白花前胡内生真菌的分离筛选及菌株bhqh-2的次级代谢产物研究
2023-10-19张世凯杨正友赵凤春
张世凯,徐 清,刘 林,杨正友,赵凤春
(山东农业大学 生命科学学院,泰安 271018)
近年来,抗生素的耐药性已经成为威胁人类健康的最严重的挑战之一[1]。同时,癌症成为非传染性疾病引起的过早死亡的主要原因之一[2]。因此,寻找新的治疗感染和癌症的药物迫在眉睫。另一方面,现代农业中化学农药的滥用会对人类生态环境产生恶劣影响,还会导致病虫害抗性等问题。从微生物的次级代谢产物中开发结构独特、活性显著的先导化合物现已成为人类寻找和开发新型农药的研究热点[3]。
在过去的几十年里,植物内生真菌因具有产生多种次生代谢物的能力而受到广泛关注[4]。其所产生的天然产物具有多种生物活性,如抗菌、抗寄生虫、抗氧化、免疫抑制剂和抗癌活性等[5-8]。白花前胡(Peucedanumpraeruptorum)是伞形科(Umbellales)前胡属(Peucedanum)的多年生草本植物[9],是我国一种传统中药材,具有散风清热、降气化痰的功效,临床上用于风热咳嗽痰多、痰热喘满、咳痰等[10]。研究表明,白花前胡中主要含有香豆素类化学成分,其类型包括简单香豆素、呋喃香豆素和吡喃香豆素,此外还含有挥发油、甾醇和有机酸等化学成分[11-12];这些成分具有多种良好的生物活性,如抗真菌、抗氧化、抗肿瘤和抗炎等[13]。
一些药用植物内生菌因长时间与宿主协同进化,可产生某些与宿主植物相似或相同的代谢物质[14]。因此,从白花前胡内生菌中有望获得具有抗菌和抗肿瘤的生物活性物质。目前,关于白花前胡内生真菌的报道较少,为进一步开发利用该菌种资源,本研究对白花前胡内生菌进行分离,对其粗提物进行抗菌和抗肿瘤活性初筛,并进一步选取一株活性较好的菌株进行次级代谢产物研究。
1 材料与方法
1.1 材料
1.1.1 植株、菌株及细胞
2020年10月在山东省泰安市岱岳区桃花峪采集新鲜健康、生长旺盛的白花前胡,植物样品采集后放入干净的聚乙烯袋中避光保存于4 ℃冰箱。
金黄色葡萄球菌(StaphylococcusaureusATCC 25923)、肠炎沙门氏菌(SalmonellaenteritidisATCC 13076)、大肠埃希氏菌(EscherichiacoliATCC 8739)和铜绿假单胞菌(PseudomonasaeruginosaATCC 27853)等4种细菌,禾谷镰刀菌(Fusariumgraminearum)、大丽轮枝菌(Verticilliumdahliae)、灰葡萄孢霉(Botrytiscinerea)和白色念珠菌(CandidaalbicansATCC 10231)等4种真菌,人肺癌细胞A549和人乳腺癌细胞MDA-MB-231两种癌细胞均为实验室保存。
1.1.2 试剂与仪器
MTT溶液。称取0.1 g MTT粉末,用20 mL磷酸盐缓冲液(PBS,10 mmol/L)溶解,0.22 μm滤膜过滤除菌,配好后放于棕色瓶中,于4 ℃冰箱避光保存。
麦芽汁液体培养基(ME)。称取20 g生麦芽,加入适量去离子水煮沸30 min,4层脱脂棉纱布过滤,滤液中添加20 g蔗糖、1 g蛋白胨,溶解后调整pH值为7.2,定容至1 L,分装到锥形瓶中,121 ℃高压蒸汽灭菌20 min。
绿豆培养基。称取绿豆20 g洗净,加入适量去离子水煮沸30 min,用4层脱脂棉纱布过滤,定容至1 L,pH自然,分装到锥形瓶中,121 ℃高压蒸汽灭菌20 min。
水琼脂。称取1.5 g琼脂粉,加去离子水定容至100 mL,转移至锥形瓶中,121 ℃高压蒸汽灭菌20 min。
半制备高效液相色谱仪FL-H050GS( Agela Phenomenex公司);多功能酶标仪CLARIO star(BMG LABTECH 公司);台式全温振荡器THZ-C-1(苏州市培英实验设备有限公司);光学显微镜SK2009U8(深圳市赛克数码科技开发有限公司);二氧化碳培养箱HF151(上海力申科学仪器有限公司)。
1.2 方法
1.2.1 内生真菌的分离
采用组织块法进行内生真菌的分离[15]:将白花前胡样品用去离子水冲洗干净,用0.05% Tween-20溶液浸泡60 s,然后用5%次氯酸钠溶液浸泡5 min,再用2.5%硫代硫酸钠溶液浸泡10 min,最后用70%乙醇浸泡3 min。将样品用无菌水冲洗3次,切成1 cm×1 cm的小块,接种在含有双抗的PDA平板上(100 μg/mL氨苄西林钠,50 μg/mL链霉素),取100 μL最后一次冲洗的无菌水涂布于PDA平板上作为对照组,28 ℃恒温培养箱培养5~7 d。待植物组织表面长出菌丝时,采取尖端菌丝挑取法,在新鲜PDA培养基上四区划线,反复分离纯化培养,直到纯化出单菌落。
1.2.2 内生真菌的发酵及粗提物的制备
将保藏的菌种于PDA固体培养基上进行活化,随后把长满菌丝的琼脂划分为1 cm×1 cm的菌块,取5块转接到100 mL ME中,28 ℃、180 r/min恒温振荡培养7 d,得到菌种发酵液。发酵液中加入等体积乙酸乙酯萃取两次,将上层萃取液合并进行旋转蒸发浓缩,得到粗提物,将粗提物称重后于-20 ℃冰箱保存备用。
1.2.3 粗提物的抑菌活性测定
使用管碟法测定粗提物对病原细菌和病原真菌的抑制作用[16],在培养皿中倒入10 mL的水琼脂,待其凝固后均匀放置4~5个牛津杯;随后将150 μL的病原菌液(细菌菌悬液或真菌孢子液)和15 mL融化后的固体培养基混合后倒入平板内(加入菌液前培养基需冷却至50 ℃左右,细菌使用LB培养基,真菌使用PDA培养基),培养基凝固后取出牛津杯。实验组每孔加入50 μL粗提物溶液(20 mg/mL,甲醇溶解);抗细菌或抗真菌阳性对照孔加入50 μL氨苄西林钠溶液(10 mg/mL)或制霉素溶液(2万单位/mL);阴性对照孔加入50 μL甲醇;37 ℃静置培养12 h(抗细菌实验)或28 ℃静置培养5~7 d(抗真菌实验);采用十字交叉法测量抑菌圈直径,观察对病原菌的抑菌效果。
菌液制备方法如下:将病原细菌于固体LB培养基上进行活化,用接种环挑取单菌落接种于5 mL液体LB培养基中,37 ℃、180 r/min恒温振荡培养12 h,制得病原细菌悬液。将病原真菌于PDA固体培养基上进行活化,取5块1 cm×1 cm的菌块,加入到100 mL绿豆培养基中,28 ℃、180 r/min恒温振荡培养5~7 d,得到病原真菌孢子液。
1.2.4 粗提物的细胞毒活性鉴定
采用MTT法测定粗提物的细胞毒活性[17]。每孔加入100 μL细胞稀释液(1×DMEM,10% FBS,4 000 cells/well),在37 ℃、5% CO2的细胞培养箱中培养20 h,每孔再添加80 μL培养基,实验组加20 μL粗提物稀释液(粗提物终浓度为100 μg/mL),阳性对照组加入20 μL盐酸阿霉素(终浓度为0.05 μg/mL),阴性对照组加入20 μL培养基;混匀后培养48 h,吸出培养液,缓慢加入200 μL PBS洗涤一次,然后每孔加入含20% MTT的培养液100 μL培养4 h,弃去培养液,每孔加入150 μL DMSO,振荡孵育10 min,测定570 nm下吸光度。另设置空白对照组,孔中只含有培养基不含细胞。

1.2.5 活性菌株鉴定
将菌种接种至PDA培养基上培养5 d,观察菌株的菌落和菌丝形态特征,使用光学显微镜,观察菌丝和分生孢子等显微形态。提取基因组DNA,送至青岛睿博兴科公司进行内转录间隔区(ITS)测序,将所得的ITS序列与GenBank网站中已知菌株的序列进行Blast分析,从中获得与菌株ITS具有相似同源性典型菌株的ITS的序列,用MEGA 7.0软件构建系统发育树。
1.2.6 活性菌株化合物分离鉴定
对菌株活性最好的一株菌进行大规模发酵,经过萃取、旋蒸浓缩得到粗提物浸膏。首先使用硅胶柱层析,以石油醚和乙酸乙酯作为洗脱剂,按照体积比石油醚∶乙酸乙酯为10∶1、4∶1、2∶1、1∶1、1∶2的比例依次进行洗脱,对粗提物进行初步分离,后续利用C18反相硅胶柱层析、Sephadex LH-20柱层析及半制备HPLC等方法对次级代谢产物进行分离纯化。将单体化合物用500 μL氘代丙酮或氘代DMSO进行溶解,转移到干净的核磁管中,测定化合物的1H NMR谱和13C NMR谱,通过对比文献确定化合物的结构。
2 结果与分析
2.1 内生真菌的分离及粗提物的制备
从新鲜健康白花前胡中分离出内生真菌7株,编号为bhqh-1~bhqh-7,菌株形态如图1所示。
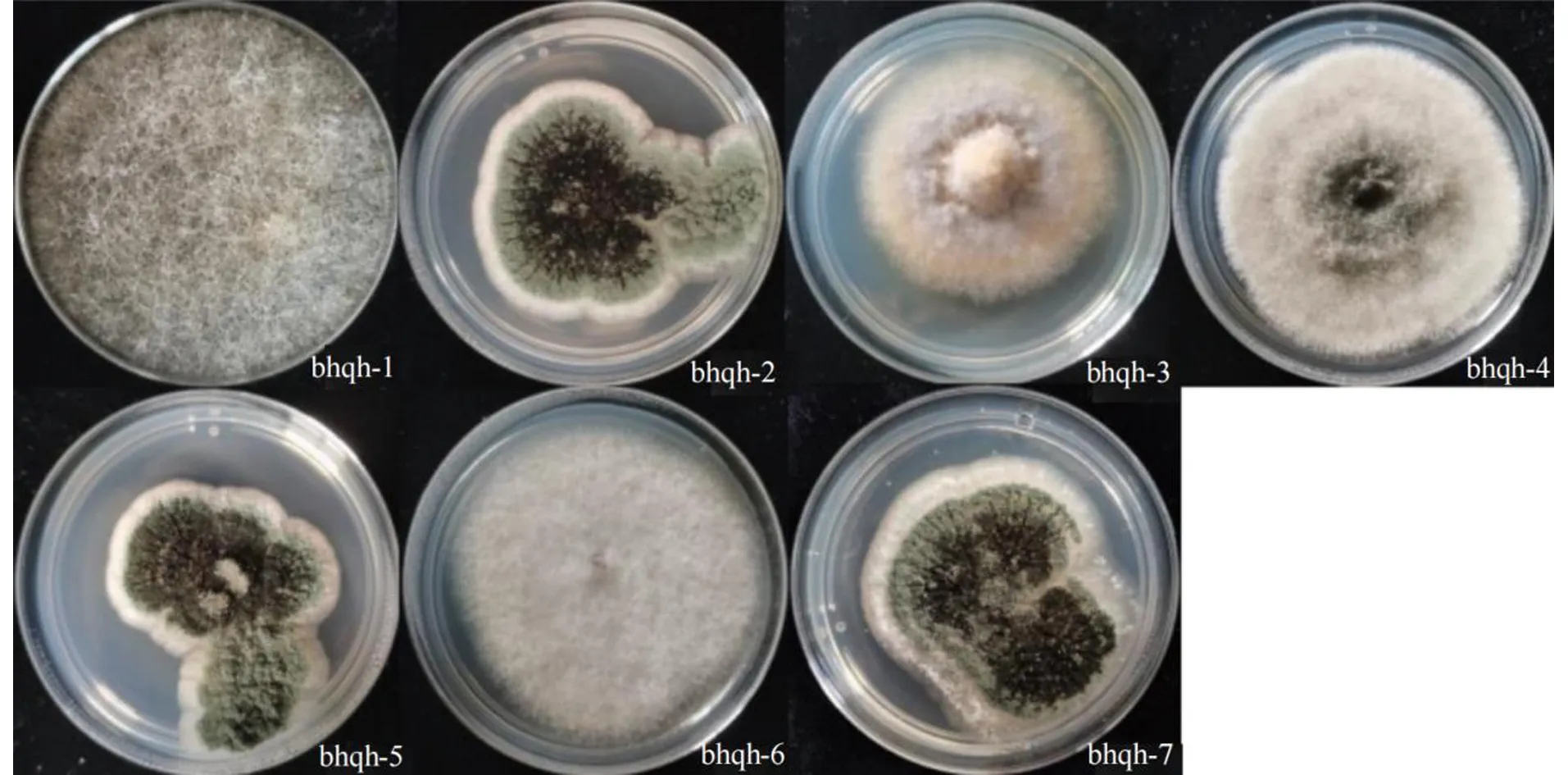
图1 7株白花前胡内生真菌菌株形态图
各菌株发酵后制备粗提物,粗提物的产量、颜色和状态如表1所示。结果表明不同菌株粗提物产量存在较大的差异。bhqh-2、5、7的菌落形态相似,其粗提物的产量也较高。其中bhqh-2的粗提物产量最高,为232.4 mg/100 mL,bhqh-7和bhqh-5次之,分别为213.8和195.2 mg/100 mL。
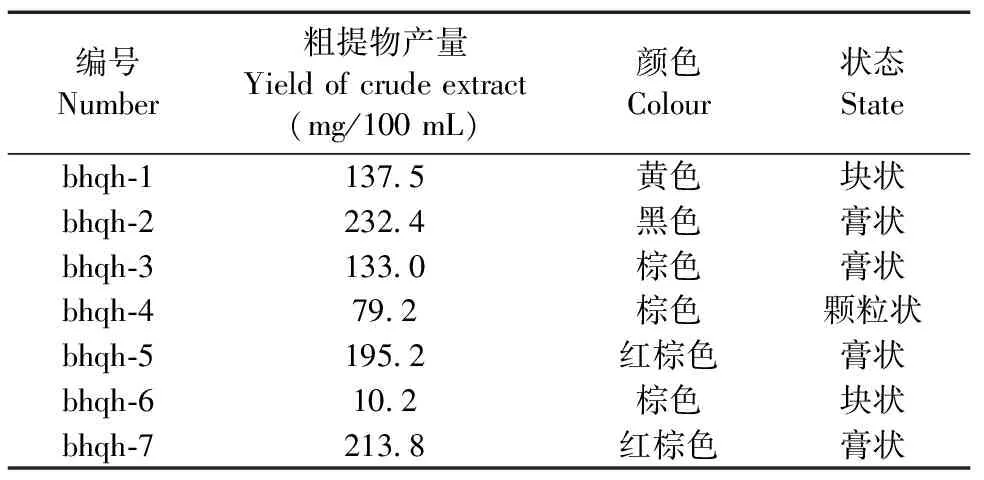
表1 7株内生真菌粗提物产量及特征
2.2 粗提物抑菌活性的测定
通过管碟法测定7株白花前胡内生真菌粗提物对病原细菌和病原真菌的抑菌活性。发酵粗提物对病原细菌的抑菌效果如表2所示,其中bhqh-1、bhqh-2、bhqh-3、bhqh-5和bhqh-7对4种细菌都有抑制效果,bhqh-2的抑菌效果最好,对病原细菌的抑菌圈直径均在30.0 mm以上。
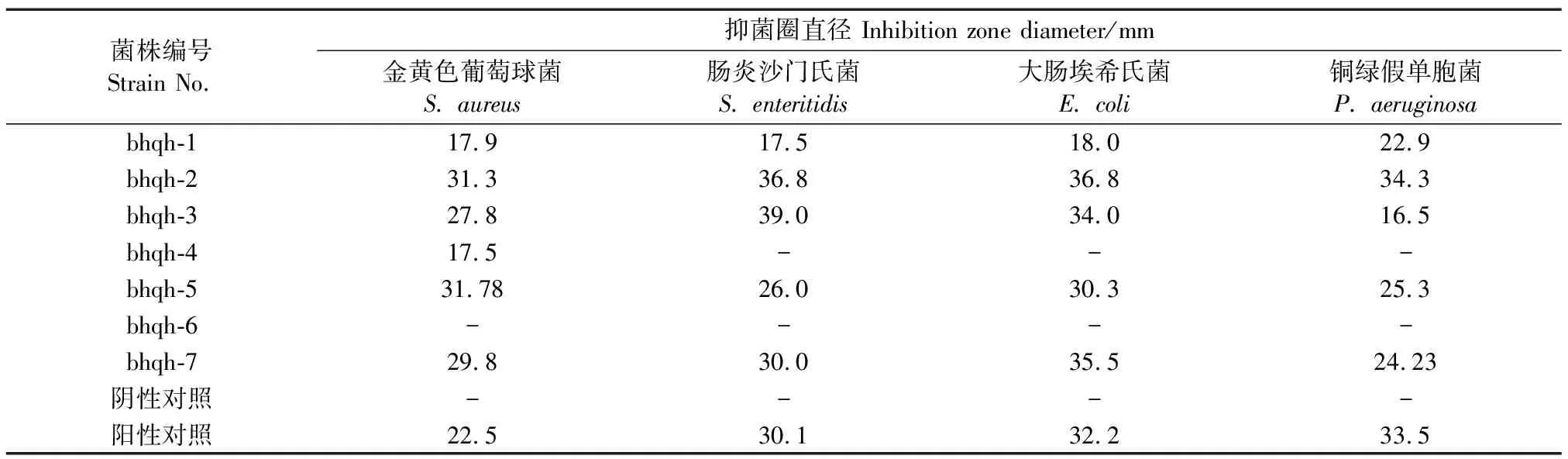
表2 7种粗提物对病原细菌的抑菌效果
发酵粗提物对病原真菌的抑菌效果如表3所示,所有内生真菌的粗提物都对1种以上的病原真菌有抑制活性。bhqh-2、bhqh-3、bhqh-5和bhqh-7这4株内生真菌的粗提物对4种病原真菌均具有抑制作用,其中bhqh-2的抑菌效果最好,特别是其对V.dahliae的抑菌圈直径为29.3 mm,与阳性对照所产生的抑菌圈直径(30.1 mm)相近。
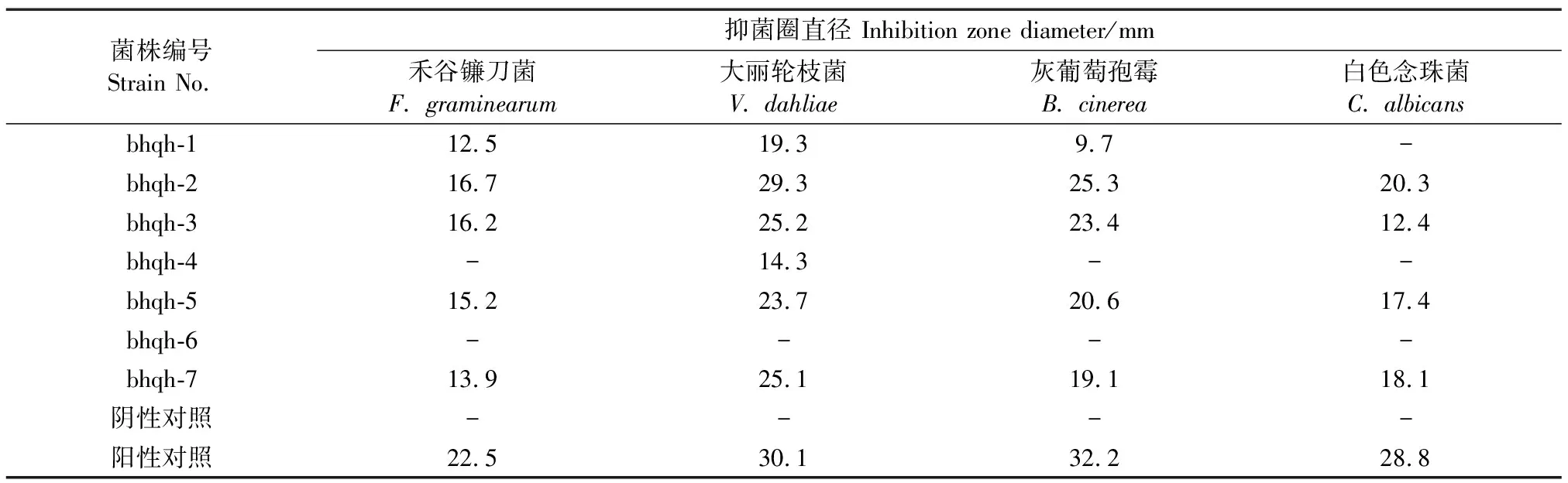
表3 7种粗提物对病原真菌的抑菌效果
2.3 粗提物细胞毒活性的测定
内生真菌的粗提物对A549和MDA-MB-231的细胞毒性结果如图2所示。菌株bhqh-2、bhqh-3、bhqh-5、bhqh-7的粗提物对A549表现出显著的抑制活性,bhqh-2、bhqh-3、bhqh-4、bhqh-5、bhqh-7的粗提物对MDA-MB-231表现出显著的抑制活性,抑制率均达到95%以上,推测其次级代谢产物中含有细胞毒活性较高的物质。
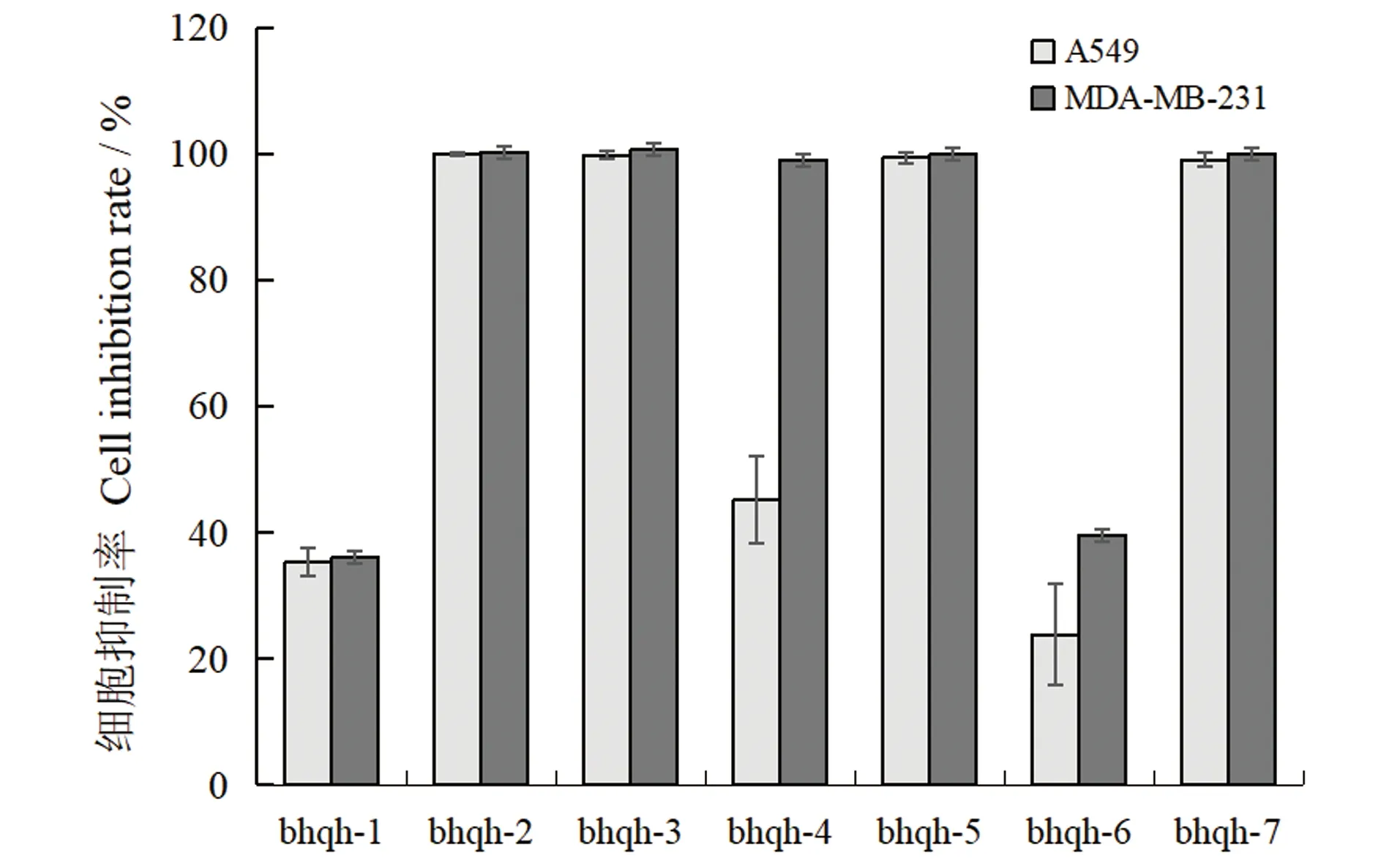
图2 粗提物对2种肿瘤细胞的抑制率
2.4 菌株bhqh-2的鉴定
内生菌粗提物抑菌活性和细胞毒活性的初筛表明,内生真菌bhqh-2活性最好,对其进行形态学和分子生物学鉴定。如图3所示,bhqh-2菌落正面从中心往四周分别呈黑色、绿色、白色,菌落形态呈放射状,菌丝较短,有孢子生成,背面菌落呈米白色,菌落中心有褶皱。显微镜下(10×40)观察,有球形的分生孢子头,分生孢子梗直径约为14.1 μm,孢子直径约为3.1 μm,初步判定为曲霉属(Aspergillus)。
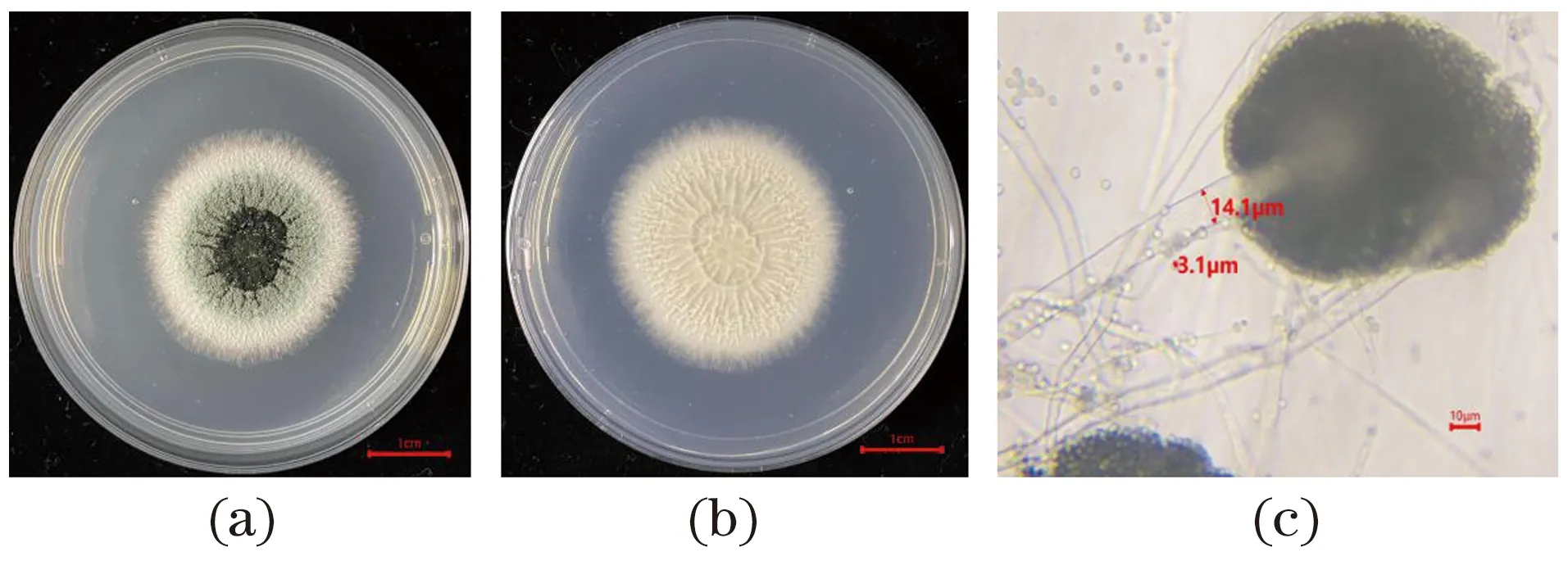
(a)正面;(b)反面;(c)显微形态。
经ITS测序获得bhqh-2菌株ITS序列(GenBank No.ON202823.1),用MEGA 7.0构建系统发育树,结果显示其与棒曲霉(Aspergillusclavatus)聚为一族(图4),因此将该菌株命名为A.clavatusbhqh-2。
2.5 化合物的分离纯化
对bhqh-2进行大规模发酵,经过萃取、旋蒸浓缩得到10 g粗提物浸膏。通过硅胶柱层析,得到Fr.1~Fr.45,通过薄层层析检测合并相似组分,获得Fr.A~Fr.I共9个组分。后续利用C18反相硅胶柱层析、Sephadex LH-20柱层析及HPLC等方法从Fr.C中分离获得化合物1~3,从Fr.D中分离获得化合物4~6。
2.6 化合物的结构鉴定
从内生菌A.clavatusbhqh-2中共获得6个化合物,其核磁数据如下所示。
化合物1:白色固体,1H NMR (400 MHz,Acetone-d6):δ7.83(s,1H),7.72(s,1H),6.79(d,J=3.0 Hz,1H),6.65(d,J=8.5 Hz,1H),6.58(dd,J=8.5,3.0 Hz,1H),4.68(s,2H),3.34 (s,1H)。13C NMR(101 MHz,Acetone-d6):δ151.88,149.57,129.89,117.28,115.81,115.65,62.46。结合文献[18]数据,化合物1的结构被确定为2,5-二羟基苯甲醇。
化合物2:白色粉末,1H NMR (400 MHz,DMSO-d6):δ6.48(q,J=2.3 Hz,1H),5.44(t,J=5.5 Hz,1H),4.30(ddd,J=18.6,5.4,2.4 Hz,1H),4.17(ddd,J=18.6,5.4,2.1 Hz,1H),3.98(d,J=4.0 Hz,1H),3.94(dd,J=3.9,2.3 Hz,1H)。13C NMR(101 MHz,DMSO-d6):δ192.21,192.07,149.77,129.62,57.30,54.15,54.03。结合文献[19]数据,化合物2的结构被确定为phyllostine。
化合物3:淡黄色油状物,1H NMR(400 MHz,Acetone-d6):δ6.52(ddq,J=5.5,3.0,1.5 Hz,1H),4.57(d,J=4.9 Hz,1H),3.76(ddd,J=3.7,2.5,1.3 Hz,1H),3.42(dd,J=3.7,1.1 Hz,1H),3.31(s,1H),1.76(t,J=1.3 Hz,3H)。13C NMR(101 MHz,Acetone-d6):δ 195.66,141.97,134.25,64.23,59.54,54.70,16.55。结合文献[20]数据,确定化合物3的结构为epiepoformin。
化合物4:淡黄色结晶状固体,1H NMR(400 MHz,Acetone-d6):δ8.30(s,1H),7.13(t,J=7.8 Hz,1H),6.87(t,J=2.0 Hz,1H),6.81(d,J=7.2 Hz,1H),6.70(dd,J=7.9,2.6 Hz,1H),4.56(d,J=3.3 Hz,2H),4.25(d,J=6.0 Hz,1H)。13C NMR(101 MHz,Acetone-d6):δ158.38,145.03,130.10,118.52,114.67,114.39,64.72。结合文献[21]数据,确定该化合物为间羟基苯甲醇。
化合物5:淡黄色固体,1H NMR(400 MHz,Acetone-d6):δ7.25(t,J=7.9 Hz,1H),6.92(ddd,J=7.6,1.6,0.9 Hz,1H),6.87~6.84(m,1H),6.80(ddd,J=8.0,2.6,0.9 Hz,1H),5.95(ddt,J=1.9,1.3,0.6 Hz,1H),5.92(dt,J=4.5,2.3 Hz,1H),5.78(s,1H),4.83(d,J=11.9 Hz,1H),4.67(d,J=11.9 Hz,1H),4.62(ddd,J=17.1,2.6,1.2 Hz,1H),4.39(ddd,J=17.1,4.5,0.7 Hz,1H)。13C NMR(101 MHz,Acetone-d6):δ 168.75,155.93,152.1,148.71,138.36,129.99,120.34,115.27,114.86,111.26,107.53,92.48,69.99,59.19。结合文献[22]数据,该化合物被确定为pintulin。
化合物6:白色晶体,1H NMR(400 MHz,Acetone-d6):δ6.10~6.01(m,3H),4.66(dd,J=17.4,2.6 Hz,1H,),4.39(dd,J=17.3,3.7 Hz,1H)。13C NMR(101 MHz,Acetone-d6):δ169.74,153.02,147.20,110.69,109.30,89.41,59.79。结合文献[23],确定该化合物为展青霉素。
3 讨论及结论
在白花前胡内生菌发酵产物活性的研究方面,马逢时等[24]从白花前胡中分离得到25株内生菌,其中5株对金黄色葡萄球菌有抑制活性,抑制效果最好的一株为青霉属。Wang等[25]对白花前胡内生菌Aspergillusudagawae进行次级代谢产物研究,获得4个具有细胞毒活性的新化合物Aspergilfuranones A-D。这些研究表明,从白花前胡内生菌中获得具有抗菌或抗肿瘤的活性化合物是可行的。本研究共获得7株白花前胡内生真菌,有6株内生真菌粗提物对至少1种病原细菌有抑制作用,所有的内生真菌粗提物对至少1种病原真菌具有抑制活性,有5株内生菌的粗提物至少对一种肿瘤细胞抑制率达到95%以上。对一株发酵产量最高,活性最好的菌株bhqh-2进行鉴定,确定其为棒曲霉菌。对其进行大规模发酵和次级代谢产物研究,获得6个已知化合物,分别为2,5-二羟基苯甲醇、phyllostine、epiepoformin、间羟基苯甲醇、pintulin和展青霉素。其中,phyllostine、epiepoformin和展青霉素曾被报道具有良好的抗菌活性[26];pintulin也被报道具有抗菌和肿瘤细胞毒活性[24]。以上表明这些化合物是该菌株具有抗菌和抗肿瘤活性的物质基础。
本研究从传统中药植物白花前胡中分离到活性良好的内生真菌,进一步获得其次级代谢产物,丰富了白花前胡内生真菌的研究,为药物先导化合物的发掘提供了菌种资源和理论基础。
