2 种乌贼冻藏期间品质及肌原纤维蛋白功能特性变化
2023-10-19贾俊琦林慧敏
贾俊琦,张 悦,林慧敏,张 宾
(浙江海洋大学食品与药学学院,浙江舟山 316022)
近年来,随着传统经济鱼类资源量的逐年衰退,头足类海产品逐渐成为主要捕捞对象,其中乌贼成为我国重要经济海产种类[1]。2021 年头足海产品类国内捕捞产量为58.55 万吨,曼氏无针乌贼(Sepiella maindroni)和金乌贼(Sepia esculenta)属于捕捞量较高的2 种乌贼[2]。曼氏无针乌贼是东海和黄海捕捞的主要头足类之一[3],营养价值较高,同时具有抗炎、降血脂和抗氧化等特性[4],年产超过7 万余吨;金乌贼主要分布于俄罗斯、日本、韩国和菲律宾海域,属于我国的经济物种,其药用价值高,营养丰富[5],近年来捕捞量约为6 万余吨[6]。2 种乌贼均属于低脂高蛋白的水产品,味道鲜美,是补充人体营养物质的理想食品来源。
乌贼隶属于软体动物门,具有抗氧化、抗炎、降血糖、预防老年化疾病等作用[7]。其富含人体必需氨基酸、不饱和脂肪酸,属于低脂高蛋白的水产品,深受广大消费者的喜爱。但在加工运输的过程中,因微生物繁殖和内源酶的活性肌肉蛋白易氧化,使其加工利用率降低。蛋白质氧化主要通过改变肌肉肌原纤维蛋白(myofibrillar protein,MP)的结构特性或加速其交联形成来促进蛋白质降解,肌原纤维蛋白功能特性的变化可以反映出水产品的劣变程度。
冻藏可抑制微生物繁殖和内源酶的活性,从而改善肌肉品质[8]。目前,国内外关于水产品冻藏的研究主要集中于冻藏期间的品质变化及改善冻藏对水产品的不良影响[9-12]。低温冷链贮藏是一种普遍的水产保鲜方法,工业生产中常以冻藏(-18 ℃)进行水产品保鲜[13]。研究表明,较低的冻藏温度可保持水产品品质,减缓水产品劣变速率[14-15]。但关于曼氏无针乌贼和金乌贼两种海产品冻藏期间肌肉的品质变化比较的研究还未见报道。因此,本文通过对比在-18 ℃贮藏条件下2 种乌贼(0~120 d)肌肉的品质和肌原纤维蛋白特性的变化情况,以期为2 种乌贼冷链贮藏过程的品质控制提供理论依据。
1 材料与方法
1.1 材料与仪器
曼氏无针乌贼(体长约17.54±1.27 cm,质量159.09±6.89 g)、金乌贼(体长约23.79±2.61 cm,质量286.6±28.77 g)各30 只,购自浙江舟山国际水产城;硼酸、马来酸、无水乙醇等 分析纯,国药集团化学试剂有限公司;总巯基、羰基、Ca2+-ATPase 活性测定试剂盒 南京建成生物工程研究所。
CR-10 型便携式色差仪 日本柯尼卡美能达公司;HD-3A 型水分活度测定仪 常州德杜精密仪器有限公司;MS-Pro 型物性测试仪 美国FTC 公司;UV751GD 型紫外-可见分光光度计 上海第三分析仪器厂;CF-16RN 高速冷冻多用途离心机 日本日立公司;T18 ULTRA-TURRAX 型高速匀浆机 德国IKA 公司;Pannoramic MIDI 型显微镜玻片扫描仪 3D HISTECH;Hitachi Regulus 8100 型电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 原料分组与取样 2 种乌贼去骨、取出内脏并摘除眼睛得到的胴体肌肉,清洗沥干后,分别装入保鲜自封袋中,再将其于-18 ℃冰箱冻藏120 d,每隔30 d 取样一次,进行各指标的测定。
1.2.2 水分含量和水分活度 水分含量参考GB 5009.3-2016《食品中水分的测定》[16]直接干燥法。采用水分活度仪测定水分活度。取约2 g 乌贼肌肉切成肉糜后,均匀平铺于样品盒中,将样品盒放入HD-3A型水分活度仪感应器中,测定乌贼肌肉的水分活度。
1.2.3 质构分析 采用TPA(texture profile analysis)模型进行测定。选取乌贼胴体中心处肌肉,测试速率为60 mm/min,样品形变百分量为30%,保持时间为3 s。采用FTC-PRO 软件从每个样品产生的力-时间曲线中,观察乌贼肌肉组织质构变化。
1.2.4 色差分析 以乌贼胴体中心处肌肉为测试点,采用色差仪(CR-10 型),测定乌贼肌肉表面的L*(亮度值)、a*(红度值)、b*(黄度值)。色差计在使用前进行校准,每一肉样平行测定5 次。按以下公式计算白度值,如下:
1.2.5 总挥发性盐基氮(total volatile basic nitrogen,TVB-N)值测定 采用GB 5009.228-2016[17]《食品中挥发性盐基氮的测定》中的自动凯氏定氮法测定TVB-N 含量。
1.2.6 肌肉肌原纤维蛋白(myofibrillar protein,MP)的理化性质测定 参考王雪松等[18]方法略作修改,取2 g 样品,加入20 mL Tris-maleate 缓冲液(pH 为7.0,20 mmol/L)后充分匀浆,4 ℃条件下8000 r/min离心15 min,弃上清液留沉淀,重复两次,最后向沉淀中加入10 mL Tris-maleate 缓冲液(pH 为7.0,20 mmol/L,含0.6 mol/L KCl),充分匀浆后置于4 ℃条件下提取1 h,然后于4 ℃条件下8000 r/min离心15 min,所得上清即为MP。MP 的总巯基含量、Ca2+-ATPase 活性、羰基含量分别使用南京建成试剂盒测定。
1.2.7 苏木精-伊红(hematoxylin-eosin,HE)染色观察分析 参考荣建华等[19]方法,选取乌贼胴体中心部位的肌肉,将样品顺纤维方向取约1 cm3的样品浸泡在多聚甲醛溶液(4%)中固定,然后脱水2 h(至70%无水乙醇中),再进行石蜡包埋(60 ℃)、切片、HE 染色、封片,显微镜玻片扫描仪观察乌贼肌肉的组织结构。
1.2.8 扫描电镜(scanning electronic microscopy,SEM)参照Song 等[20]方法,略作修改。将样品切成1 cm×1 cm×0.5 cm 的小块,用戊二醇溶液(2.5%)固定24 h,利用磷酸缓冲液(1 mol/L)漂洗;再用30%、50%、70%、80%不同梯度的乙醇各脱水一次,乙醇(100%)脱水2 次,每次10 min。通过醋酸异戊酯置换15 min,最后将切片放入二氧化碳临界点干燥器中干燥,喷金,随后用扫描电子显微镜观察其微观结构。
1.3 数据处理
采用Excel 2010 处理实验数据,通过SPSS 25.0对数据进行显著性分析(P<0.05)分析,采用 Pearson相关性分析对指标进行相关性分析,所有图用Origin 9.0 进行绘制,实验重复3 次。
2 结果与分析
2.1 2 种乌贼冻藏过程的水分含量及水分活度变化
水分含量和水分活度是影响水产品稳定性的重要指标。2 种乌贼在-18℃贮藏(0~120 d)的水分含量和水分活度的变化趋势如图1 所示。
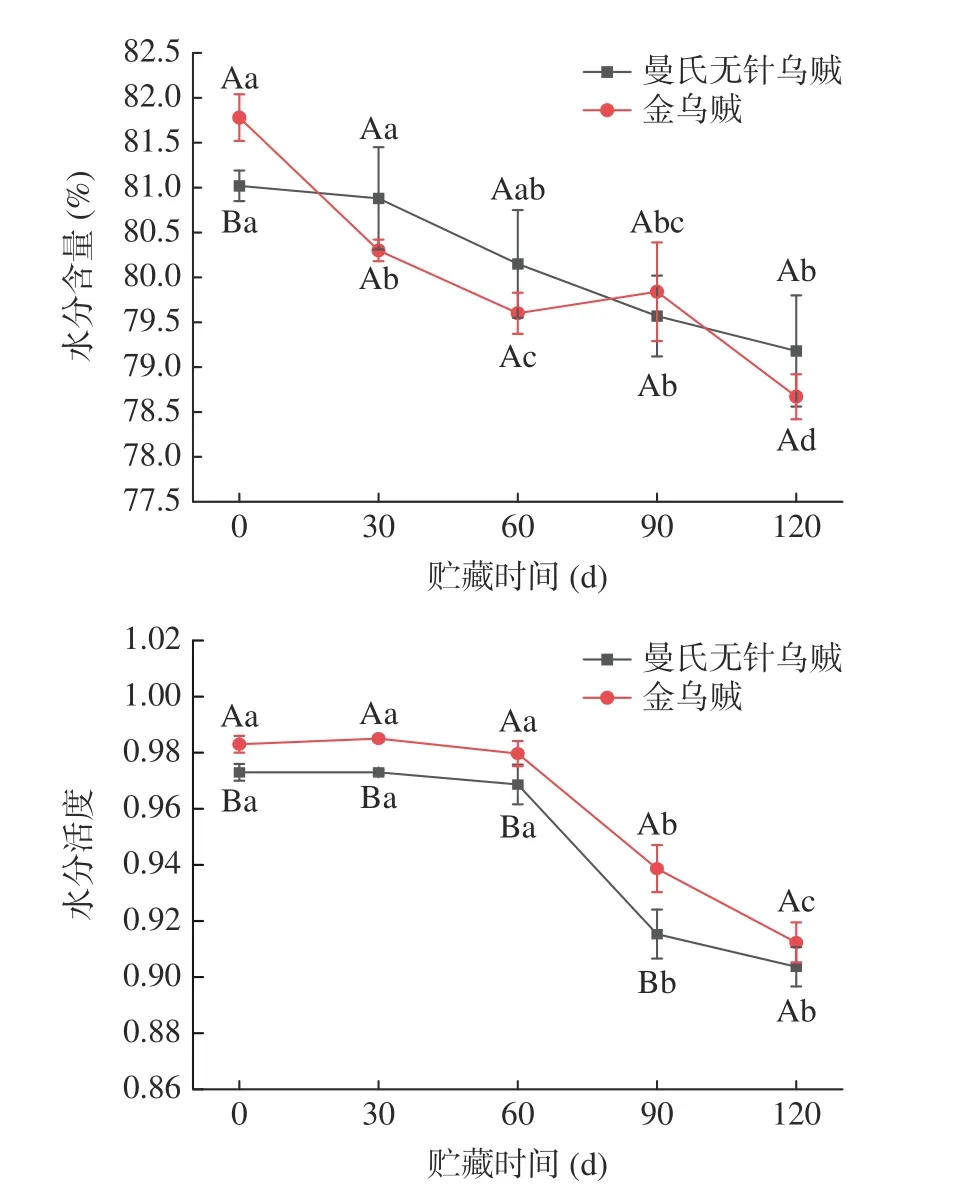
图1 2 种乌贼冻藏过程中肌肉水分含量及水分活度变化Fig.1 Changes in water content and water activity in the muscle tissues of two cuttlefish during frozen storage
由图1 可知,2 种乌贼在冷冻贮藏期间的水分含量呈总体下降趋势。其初始水分含量分别为81.02%(曼氏无针乌贼)和81.78%(金乌贼),直至冻藏120 d,分别降至79.18%和78.67%,可能由于冻藏过程中存在升华现象[21]。与曼氏无针乌贼相比,金乌贼水分含量急剧下降,可能由于冻藏过程中,金乌贼肌肉的初始水分含量显著高于曼氏无针乌贼(P<0.05),冻藏期间冰晶破坏肌肉细胞膜,金乌贼肌肉的肌纤维破坏程度较严重,导致汁液流失更多,水分含量下降速度更快。
水分活度在水产品生产、运输和加工中具有重要意义[22]。由图1 可知,2 种乌贼肌肉的水分活度分别0.963(曼氏无针乌贼)和0.983(金乌贼),直至冻藏120 d 后降至0.904 和0.912,从60 d 起,2 种乌贼水分活度下降趋势均很显著(P<0.05),可能由于水分活度下降和蛋白质变性有关。蛋白质变性取决于冰晶大小,冻藏后期大冰晶的形成可使蛋白质高度变性导致肌肉细胞脱水,细胞内的水分子迁移至细胞外后,细胞内的离子强度增加,蛋白失去保持水分的能力,因此释放出游离水[23]。2 种乌贼肌肉的水分活度下降趋势一致,但在冻藏过程中金乌贼的水分活度更高,可能由于金乌贼肌肉中的自由水流失过多,结合水流失较少[24]。
2.2 2 种乌贼冻藏过程中的质构变化
食品的质构性质决定消费者对食品的可接受程度。由图2 可知,2 种乌贼肌肉的质构特性随着贮藏时间的延长发生了不同程度变化。总体来看,随着贮藏时间延长,2 种乌贼肌肉的硬度呈下降趋势;胶粘性、咀嚼性呈先下降后回升的趋势。新鲜曼氏无针乌贼肌肉硬度低于金乌贼,冻藏120 d 后曼氏无针乌贼肌肉的硬度降低57.50%(23.46 g 降至9.97 g);金乌贼肌肉的硬度降低了71.01%(37.26 g 降至10.80 g),可能由于冻藏过程中肌肉细胞受到损伤,使肌肉蛋白质变性导致其功能特性的变化,从而改变乌贼肌肉的质构特性进而降低肌肉硬度[25],贮藏时间在(0~60 d)的范围内,2 种乌贼肌肉的硬度下降趋势显著(P<0.05),可能由于乌贼死后肌肉蛋白水解会促进肉质嫩化,残基被氧化导致蛋白酶活性受到抑制[26],冻藏后期(60~120 d)下降速率减慢并趋于稳定。由图2可知,随着贮藏时间延长,2 种乌贼肌肉的弹性变化无显著差异,这与Gokoglu 等[27]研究结果一致,冷冻后所有头足类肌肉的弹性值均没有显著变化。新鲜曼氏无针乌贼肌肉胶粘性低于金乌贼,与新鲜乌贼相比,贮藏90 d 后曼氏无针乌贼肌肉的胶粘性降低了41.17%(10.64 g 降至6.26 g);金乌贼降低了63.10%(20.68 g 降至7.63 g)。2 种乌贼肌肉胶粘性的降低,可能由于蛋白质在氧化过程中发生折叠反应,导致其三维结构破裂,使胶粘性下降。新鲜的曼氏无针乌贼的咀嚼性均低于金乌贼。随着贮藏时间的增加,2 种乌贼肌肉的咀嚼性呈先下降后回升的趋势,可能由于氧化导致蛋白质变性、发生降解,肌肉细胞间结合力减小,使肌肉组织结构崩解,导致2 种乌贼肌肉的咀嚼性下降,直至120 d 出现回升,可能是肌肉经过长时间的冻藏,蛋白氧化的程度加剧形成蛋白交联派生物,而肌肉的咀嚼性增加通常归因于蛋白质交联[27]。
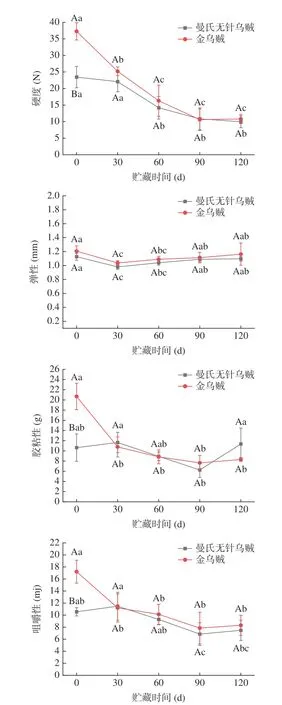
图2 2 种乌贼冻藏过程中肌肉质构变化Fig.2 Changes in the textural properties of muscle tissues of two cuttlefish during frozen storage
2.3 2 种乌贼冻藏过程中的色差变化
色差值的大小可用来判断肉质的新鲜度,对冷冻产品的外观和可接受程度有重要影响[28]。本研究中,2 种乌贼在-18 ℃储藏120 d 后颜色发生显著变化(P<0.05)。如图3 所示,随着贮藏时间延长,2 种乌贼肌肉的白度值(W)均呈下降趋势。可能由于随着冻藏时间的延长,在冻结过程中冰晶对乌贼肌肉造成一定程度损伤,水分含量迅速减少,导致肌肉表面色泽暗淡。研究表明,肌肉表面色泽变化与肌肉的保水性有关[29],在冻藏过程中曼氏无针乌贼的W 均高于金乌贼,可能由于曼氏无针乌贼的保水性较好。2 种乌贼肌肉的亮度值L*呈下降趋势,表明2 种乌贼肌肉颜色随着贮藏时间的延长而逐渐加深,可能由于冻藏后期乌贼肌肉失水过多导致肉质失去光泽[25]。随着贮藏时间延长,2 种乌贼肌肉的a*值无明显变化,b*值总体呈上升趋势,可能由于贮藏后期鱼肉在温度及酶等因素的作用下发生蛋白质变性,导致颜色发黄[30]。

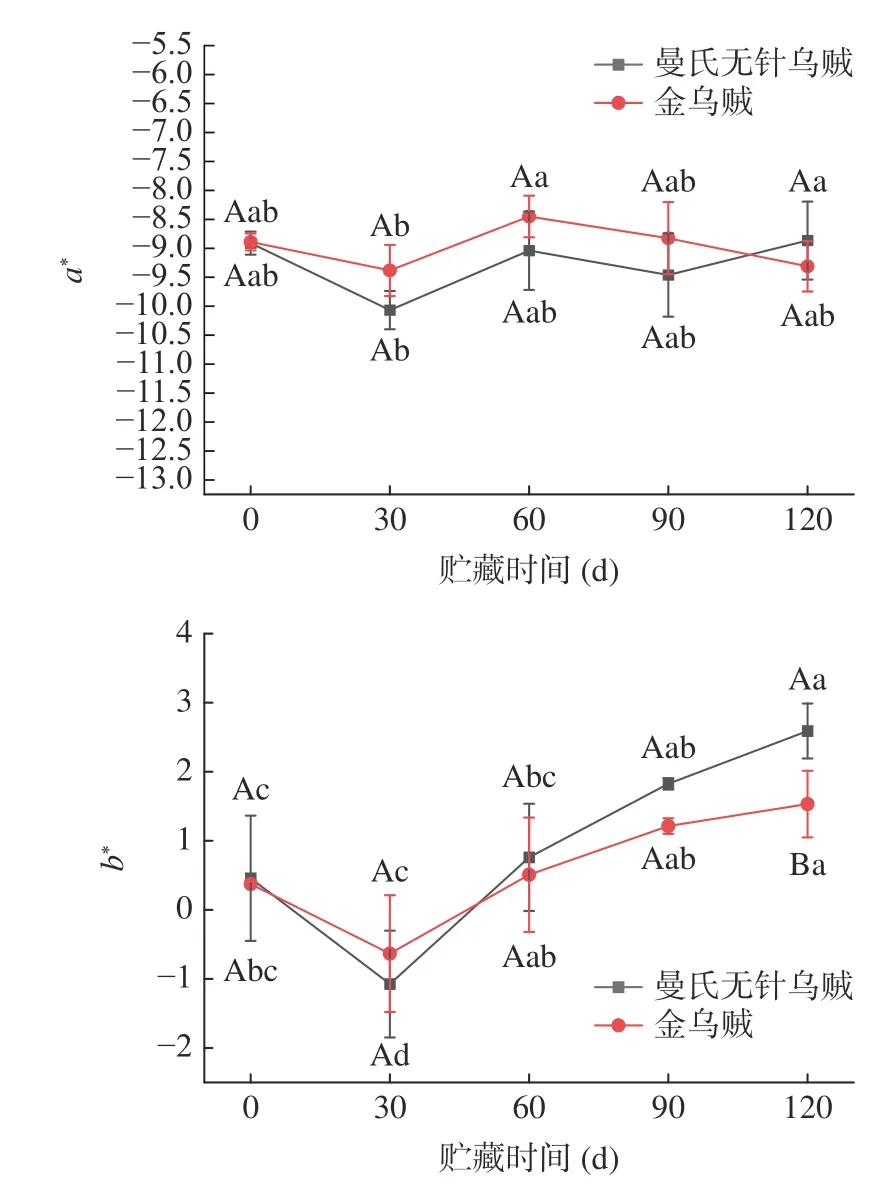
图3 2 种乌贼冻藏过程中肌肉色差变化Fig.3 Changes in the color of muscle tissues of two cuttlefish during frozen storage
2.4 2 种乌贼冻藏过程中TVB-N 含量的变化
TVB-N 反映了水产品腐败程度[31]。由图4 可知,TVB-N 含量先升高后降低。新鲜的曼氏无针乌贼和金乌贼肌肉中TVB-N 值分别为12.36 mg/100 g和10.02 mg/100 g(P>0.05),随着冻藏时间延长,2 种乌贼TVB-N 含量呈上升趋势。贮藏120 d 后,金乌贼肌肉中TVB-N 含量更高,这可能由于金乌贼肌肉水分含量更高,促进蛋白质发生分解使TVB-N 含量升高。GB 2733-2005《鲜(冻)动物性水产品卫生标准》规定头足类TVB-N≤30 mg/100 g,冻藏90 d 时达到19.00 mg/100 g(曼氏无针乌贼)和20.22 mg/100 g(金乌贼),2 种乌贼该指标相差不大。直到冻藏120 d 时曼氏无针乌贼和金乌贼TVB-N 出现下降趋势,这可能由于冻藏后期乌贼肌肉中营养物质减少,导致其中可被分解的蛋白质含量减少,进而导致分解三甲胺、二甲胺和其他含氮化合物的作用下降,因此TVB-N 含量也相应减小[32]。
2.5 2 种乌贼MP 的总巯基含量变化
MP 是肌肉组织的主要结构蛋白,约占蛋白质总量的60%~70%[33]。巯基是蛋白质中的活性基团,易受到活性氧的攻击,氧化的巯基能与其他巯基反应生成二硫键或者与氧反应生成硫基过氧自由基[34]。由图5 可知,随着贮藏时间的延长,2 种乌贼MP 的总巯基含量总体呈下降趋势,可能由于蛋白质发生氧化所致,MP 中的巯基氧化形成多肽分子间或分子内二硫键,进一步氧化成磺酸类或其他氧化产物,从而导致总巯基含量的下降[35]。冻藏120 d 后,曼氏无针乌贼和金乌贼MP 的总巯基含量分别下降了52.28%、56.12%,金乌贼下降速度高于曼氏无针乌贼。可能由于金乌贼肌原纤维蛋白变性程度更大,而巯基作为肌球蛋白中具有最高反应活性的基团,与其结构的稳定性密切相关。此外,巯基的暴露可增加蛋白质的表面疏水性,使蛋白质紧密有序的结构变得松散无序[36]。
2.6 2 种乌贼MP 的Ca2+-ATPase 含量变化
Ca2+-ATPase 活性来源于MP 中的肌球蛋白,是反映MP 的变性程度的重要指标[37,38]。肌原纤维蛋白变性是导致Ca2+-ATPase 活性下降的原因,冰晶的生长及蛋白质周围水合物层的破坏导致蛋白质变性,冻藏一段时间再经过解冻后水分子不断向外渗出,导致肌原纤维蛋白变性发生大程度的聚集[39]。如图6所示,2 种乌贼MP 的Ca2+-ATPase 活性总体呈下降趋势,经过120 d 冻藏,曼氏无针乌贼和金乌贼的分别下降了70.93%和72.00%。Ca2+-ATPase 活性的降低可能与肌球蛋白的氧化有关,肌球蛋白变性会引起Ca2+-ATPase 活性下降[40],其原因可能是球状肌球蛋白头部构象改变及蛋白质聚集[41]。金乌贼MP 的Ca2+-ATPase 变性程度更高,表明金乌贼的肌球蛋白变性的敏感性更高。

图6 2 种乌贼肌原纤维蛋白Ca2+-ATPase 活性的变化Fig.6 Changes of Ca2+-ATPase activity in myofibrillar protein of two cuttlefish
2.7 2 种乌贼MP 的羰基含量变化
羰基主要通过氨基酸侧链的直接氧化及多肽链的氧化断裂产生[42]。如图7 所示,在冻藏过程中,2 种乌贼MP 的羰基含量不断增加,可能由于冻藏过程中活性氧自由基攻击蛋白质氨基酸分子中的自由氨基或亚氨基,导致某些氨基酸残基转化成羰基衍生物[43]。研究表明,肌肉的品质、质地、风味变化的同时,活性氧自由基也能导致蛋白质肽链断裂,在断裂处产生羰基基团,导致肌肉中羰基含量不断增加[44]。此外,氧化蛋白质中分子内和分子间交联也会影响肌原纤维蛋白的功能,交联有助于形成稳定的蛋白质聚集体,大量聚集的氧化修饰会降低肌肉品质[38,45]。2 种乌贼冻藏过程中,羰基含量总体呈上升趋势,直至冻藏120 d 时,金乌贼MP 的羰基含量显著高于曼氏无针乌贼(P<0.05),可能由于金乌贼在冻藏过程中有较多的促氧化成分,形成大量的蛋白质聚集体,导致羰基含量明显增加。

图7 2 种乌贼肌原纤维蛋白的羰基含量变化Fig.7 Changes of carbonyl content in myofibrillar protein of two cuttlefish
2.8 HE 染色观察2 种乌贼冻藏过程中肌肉组织结构的变化
冻藏会导致大体积的冰晶压迫肌肉纤维使其变形导致局部组织破裂[46]。如图8 所示,HE 染色观察2 种乌贼冻藏120 d 后肌肉组织结构的变化。新鲜乌贼肌肉组织结构整体比较完整,肌纤维排列紧密,肌丝间隙较小。贮藏120 d 后,2 种乌贼肌肉呈现出不同程度的劣变,曼氏无针乌贼肌原纤维蛋白结构趋于疏松,肌丝断裂严重;金乌贼肌纤维的变化主要表现肌丝变细、间隙增大、卷曲明显,并出现变形断裂的现象。这表明冻藏120 d 后肌肉中冰晶不断增大,肌原纤维受到破坏的同时也会导致结缔组织的受损[47]。这与前面水分含量变化趋势一致,可能由于纤维间隙变大,从而使大量储存于肌肉组织间隙的自由水难以被束缚而被排出,最终导致乌贼肌肉水分含量下降,与新鲜肌肉的微观结构相比劣变受损程度加重[48]。
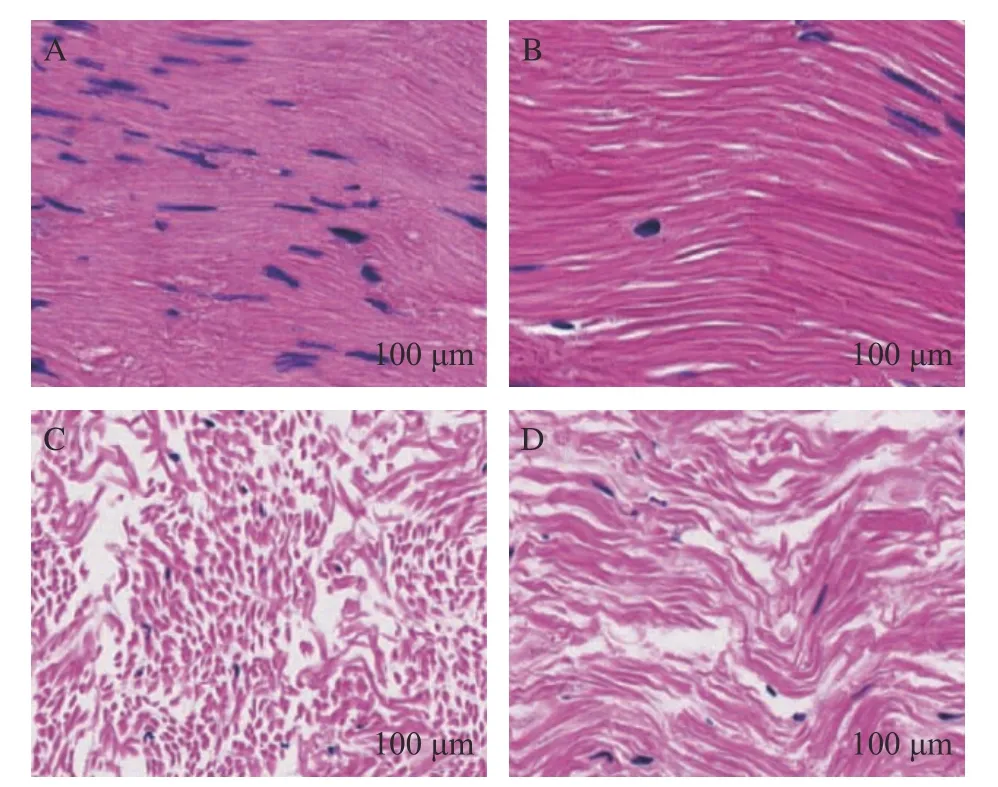
图8 HE 染色观察2 种乌贼肌肉组织结构的变化Fig.8 Changes of muscle tissue structure of two kinds of cuttlefish observed by HE staining
2.9 2 种乌贼冻藏过程中微观结构的变化
通过微观结构观察可以直接看出乌贼肌肉组织的完整性,肌纤维束的间隙大小和分布情况,可以反映肉制品的结构变化[49]。由图9 可知,新鲜的2 种乌贼,肌肉排列紧密,肌内膜整齐划一,而冻藏120 d后,曼氏无针乌贼肌肉组织间糊化成肉糜状,金乌贼肌纤维分布混乱,孔隙增大。可能因为冻藏过程中冰晶形成,导致组织结构受到大程度破坏,失水和蛋白质降解导致肌纤维收缩,更多肌纤维和肌内膜等结缔组织被降解,使蛋白质变性更严重[50]。随着贮藏时间延长,肌纤维的破坏增加了肌纤维的间隙,降低了肌肉的持水力,使肌肉中的水分流出,导致肌肉微观结构遭到严重破坏,表明贮藏时间的延长会加重肌肉组织结构的变化,而乌贼的种类不同其劣变程度也存在差异。

图9 扫描电镜观察2 种乌贼肌肉组织结构变化(500×)Fig.9 Changes in histological microstructures of muscle tissues of two cuttlefish observed by scanning electron microscope (500×)
2.10 相关性分析
为了进一步探究2 种乌贼在冻藏过程中的品质变化规律,分别对其品质指标和肌原纤维蛋白理化指标进行了相关性分析,结果如图10 所示。由图10a可知,冻藏过程中曼氏无针乌贼的水分活度、胶粘性、咀嚼性、W 值、L*值、总巯基、Ca2+-ATPase 活性、羰基和硬度均呈显著(P<0.05)相关性,羰基和水分含量、胶粘性、a*值之间均无显著相关性(P>0.05),表明曼氏无针乌贼肌肉的白度值、硬度、咀嚼性的变化与蛋白质氧化变性密切相关,原因可能是巯基氧化形成多肽分子间或分子内二硫键,破坏了蛋白质结构,使得蛋白质内部变得松散无序,导致肌肉品质变差颜色加深。总巯基和Ca2+-ATPase 活性呈正相关,冻藏期间,Ca2+-ATPase 活性的下降是由于低温破坏了肌球蛋白的完整性,说明肌球蛋白头部的巯基影响Ca2+-ATPase 活性[51]。由图10b 可知,冻藏过程中金乌贼的硬度、胶粘性、咀嚼性、W、L*、TVB-N、总巯基、Ca2+-ATPase 活性、羰基均与水分含量呈显著(P<0.05)相关性,说明金乌贼各指标受水分含量的影响较大,可能由于冻藏过程中金乌贼水分含量变化趋势更显著(P<0.05),2 种乌贼的a*值与其他指标无显著相关性(P>0.05),这主要由于冻藏期间a*值不随贮藏时间的变化而变化[52],因此,a*值的变化不是乌贼冻藏过程中品质恶化的模型指标。故冷冻曼氏无针乌贼和金乌贼可以Ca2+-ATPase 活性和总巯基等品质指标为基础进行相关性分析。
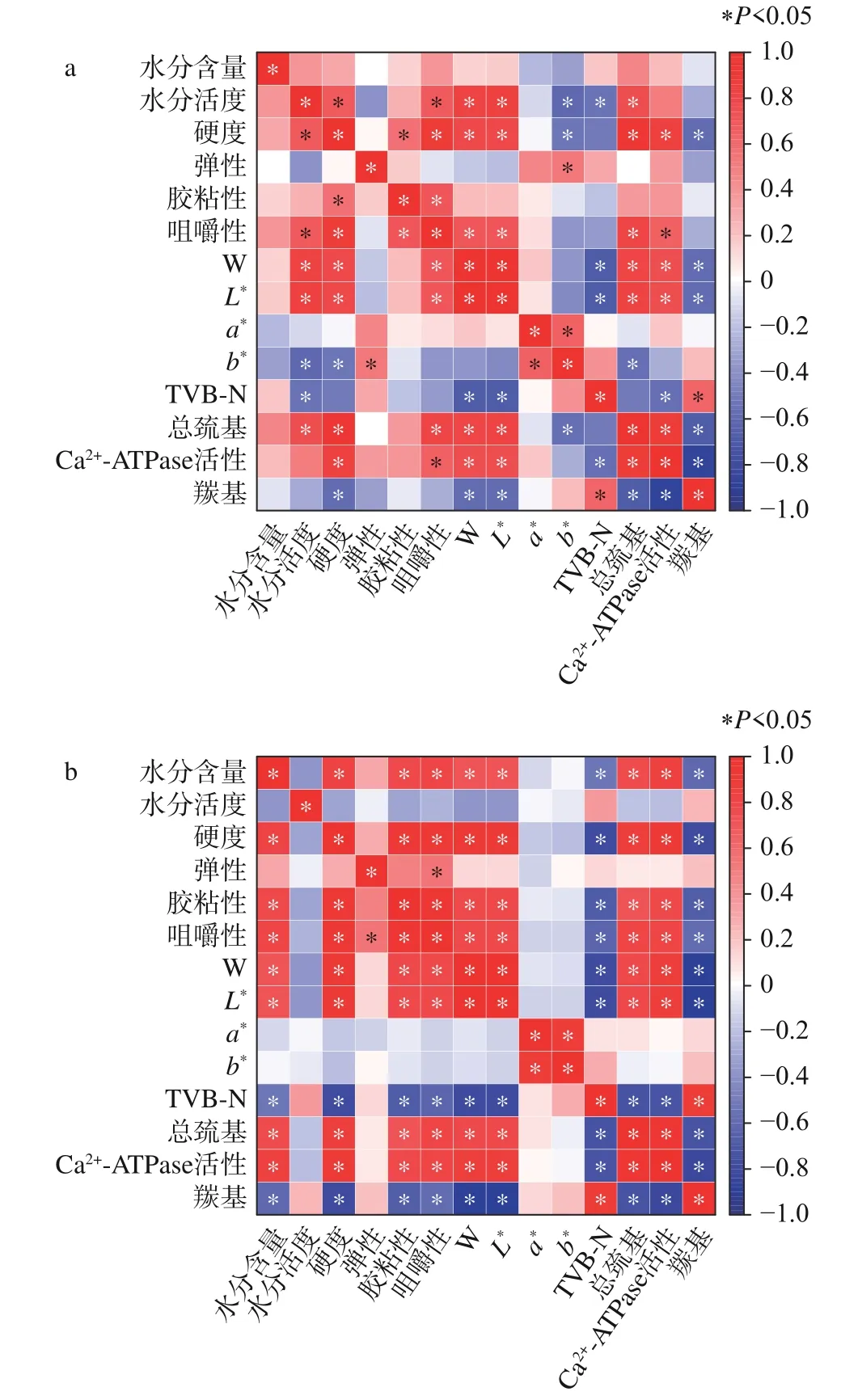
图10 2 种乌贼冻藏过程中肌肉品质指标和蛋白质理化指标的相关性分析Fig.10 Correlation analysis between muscle quality indexes and protein physiochemical indexes of two kinds of cuttlefish during frozen storage
3 结论
本文探究了2 种乌贼在-18 ℃的条件下贮藏0~120 d 的肌肉品质及肌原纤维蛋白功能特性变化。2 种乌贼肌肉水分含量、水分活度、质构特性等随贮藏时间的延长呈下降趋势。与曼氏无针乌贼相比,金乌贼肌肉的质构特性更好。从宏观角度来看,2 种乌贼在第120 d 肌肉颜色加深,变化趋势较一致。TVB-N 含量整体均呈上升趋势,新鲜金乌贼肌肉的TVB-N 含量低于曼氏无针乌贼,直至第120 d金乌贼肌肉的TVB-N 含量超过曼氏无针乌贼。与曼氏无针乌贼相比,金乌贼肌原纤维蛋白的巯基含量及Ca2+-ATPase 活性变化趋势更为显著。从微观角度来看,不同种类乌贼肌肉肌纤维状态不同,经过一段时间的冻藏后,2 种乌贼肌肉均发生劣变,但由于乌贼种类的不同,其肌肉变质的形态也不尽相同。本研究为冻藏期内乌贼的保鲜技术及品质控制研究提供参考。
