糖尿病与视网膜亚层厚度的相关分析
2023-10-18应黄芳胡卫萍倪利洋屠叔丹张子龙陶永钢徐永根
应黄芳,胡卫萍,倪利洋,屠叔丹,张子龙,陶永钢,徐永根
糖尿病与视网膜亚层厚度的相关分析
应黄芳,胡卫萍,倪利洋,屠叔丹,张子龙,陶永钢,徐永根
绍兴文理学院附属医院眼科,浙江绍兴 312000
探讨糖尿病对视网膜亚层厚度的影响。本研究为回顾性研究。收集2021年1月至12月在绍兴文理学院附属医院就诊的2 型糖尿病患者54例,分为非增殖期糖尿病性视网膜病变(non-proliferative diabetic retinopathy,NPDR)组(=27)和糖尿病无糖尿病性视网膜病变(no diabetic retinopathy,NDR)组(=27)。选取同期年龄、性别相匹配的无糖尿病者作为空白对照(Control)组(=34)。使用SD-OCT扫描并测量黄斑中心凹、鼻侧和颞侧三位点视网膜各亚层厚度。分析三组间视网膜亚层厚度差异及各因素相关性。NPDR组和NDR组的黄斑中心凹处外层视网膜厚度均较Control组偏薄(NPDR. Control,=0.001;NDR. Control,=0.038)。NPDR组颞侧内核层厚度较NDR组和Control组均偏厚(NPDR. Control,=0.025;NPDR. NDR,=0.009)。内层视网膜和外层视网膜厚度比值方面,NPDR组和NDR组在黄斑中心凹均较Control组偏大(NPDR. Control,=0.022;NDR. Control,=0.040),NPDR组在颞侧较NDR组和Control组均偏大(NPDR. NDR,=0.007;NPDR. Control,=0.020)。Logistic回归分析结果显示,糖尿病性视网膜病变是颞侧内核层厚度变化的影响因素(=0.019)。糖尿病可引起视网膜亚层厚度的改变。糖尿病性视网膜病变与视网膜内层厚度相关,是颞侧内核层厚度增加的影响因素。
光学相干断层扫描;糖尿病;糖尿病性视网膜病变;视网膜亚层
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的并发症,也是成年人可预防性盲的主要原因之一,预计到2045年全球将有1.6亿成年人患DR[1]。目前,临床上对于DR的主要诊断依据为是否出现视网膜微血管病变。然而,最近研究发现,在疾病早期,视网膜神经退行性变化可能先于视网膜微血管改变[2-5]。如何对DR进行早发现早治疗为最新的研究热点。光学相干断层扫描(optical coherence tomography,OCT)具有快速、非接触、高分辨等优势,已作为常用的视网膜检查手段,往往能够发现视网膜细微结构的异常[6]。国内外对于糖尿病患者早期外层视网膜结构变化的相关研究较少,本研究旨在通过糖尿病患者和空白对照组视网膜各亚层厚度进行比较分析,并对年龄、性别、糖尿病、胰岛素用药等因素进行回归分析,探讨糖尿病性视网膜病变视网膜亚层厚度变化规律及与各影响因素的相关性。
1 资料与方法
1.1 一般资料
收集2021年1月至12月在绍兴文理学院附属医院就诊的2型糖尿病患者54例(54眼),根据欧堡眼底照相及OCT结果分为非增殖期糖尿病性视网膜病变(non-proliferative diabetic retinopathy,NPDR)组27例(27眼)和糖尿病无糖尿病性视网膜病变(no diabetic retinopathy,NDR)组27例(27眼)。选取同期年龄、性别相匹配的左眼单眼白内障住院者34例(34眼)作为无糖尿病空白对照(Control)组。均以右眼为研究对象。诊断标准:糖尿病诊断参考2017年版《中国2型糖尿病防治指南》[7],糖尿病性视网膜病变诊断分期参考2014版《我国糖尿病视网膜病变临床诊疗指南》[8]。糖尿病组纳入标准:①符合糖尿病诊断标准;②符合糖尿病NDR、NPDR诊断标准。糖尿病组排除标准:①屈光不正<-6.00D;②屈光介质明显混浊;③有青光眼病史;④有葡萄膜炎、非糖尿病引起的视网膜、视神经疾病及临床可见的黄斑水肿、增殖性DR、黄斑前膜等;⑤有眼部外伤史及眼底手术史;⑥有高脂血症、肾病等。对照组纳入标准:①正常中老年左眼单眼白内障;②右眼屈光介质无明显混浊。对照组排除标准:①有糖尿病、高脂血症、肾病、视网膜及视神经疾病史;②有青光眼史;③屈光不正<-6.00D。NPDR组27例(27眼,男/女=12/15),年龄(62.7±11.0)岁;NDR组27例(27眼,男/女=14/13),年龄(61.3±9.0)岁;Control组34例(34眼,男/女=16/18),年龄(61.2±7.4)岁。本研究经绍兴文理学院附属医院伦理委员会审查同意[伦理审批号:2023(研)-068-01],所有患者均签署知情同意书。
1.2 方法
所有患者均通过住院病案系统,收集患者性别、年龄、体质量指数(body mass index,BMI)等。糖尿病患者额外收集患者有无DR、住院期间最高血糖、糖化血红蛋白、降糖药种类、是否使用胰岛素、糖尿病病程等。并根据以下方案进行分级。根据年龄,<51岁为中年,51~65岁为中老年,>65岁为老年。根据BMI,18.5~<24kg/m2为体质量正常,24~<28kg/m2为超重,≥28kg/m2为肥胖。根据住院期间最高血糖,<10mmol/L为1级,10~<20mmol/L为2级,≥20mmol/L为3级。根据糖化血红蛋白,<7.0%为控制好,7.0~<9.0%为控制一般,>9.0%为控制差。根据糖尿病病程,≤5年为病程短,6~15年为病程中,>15年为病程长。
采用德国海德堡OCT扫描仪(型号 Spectralis OCT)于黄斑中心凹行水平扫描。选取经过黄斑中心凹正中的水平断层OCT图像,用OCT仪器自带分析程序将视网膜分为内层视网膜6个亚层,分别为视网膜神经纤维层(nerve fiber layer,NFL)、神经节细胞层(ganglion cell layer,GCL)、内丛状层(inner plexiform layer,IPL)、内核层(inner nuclear layer,INL)、外丛状层(outer plexiform layer,OPL)、外核层(outer nuclear layer,ONL)和外层视网膜(outer retinal layer,ORL),并测量黄斑中心凹(central,C)、中心凹鼻侧1mm(nasal,N)和中心凹颞侧1mm(temporal,T)3位点视网膜各亚层厚度。
1.3 统计学方法
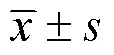
2 结果
2.1 三组患者一般资料比较
三组间的BMI比较差异有统计学意义(=9.50,<0.001)。年龄、性别比较,差异均无统计学意义(>0.05)。NPDR和NDR两组间住院期间最高血糖、糖化血红蛋白、降糖药种类、是否使用胰岛素、糖尿病病程等比较,差异均无统计学意义(>0.05),见表1。
2.2 视网膜各亚层厚度比较
三组的黄斑中心凹处ORL层厚度比较,差异有统计学意义(=6.566,=0.002),NPDR组(92.9±10.0μm)和NDR组(95.8±5.5μm)均较Control组(99.9±6.8μm)偏薄(NPDRControl,= 0.001;NDRControl,=0.038)。颞侧INL层厚度三组间差异有统计学意义(=4.088,=0.020),NPDR组(39.7±8.7μm)较NDR组(34.1±8.4μm)和Control组(35.2±6.0μm)均偏厚(NPDR. Control,= 0.025;NPDR. NDR,=0.009)。其余位点各视网膜亚层厚度,三组间比较差异均无统计学意义,见图1。
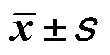
表1 三组患者一般资料比较()
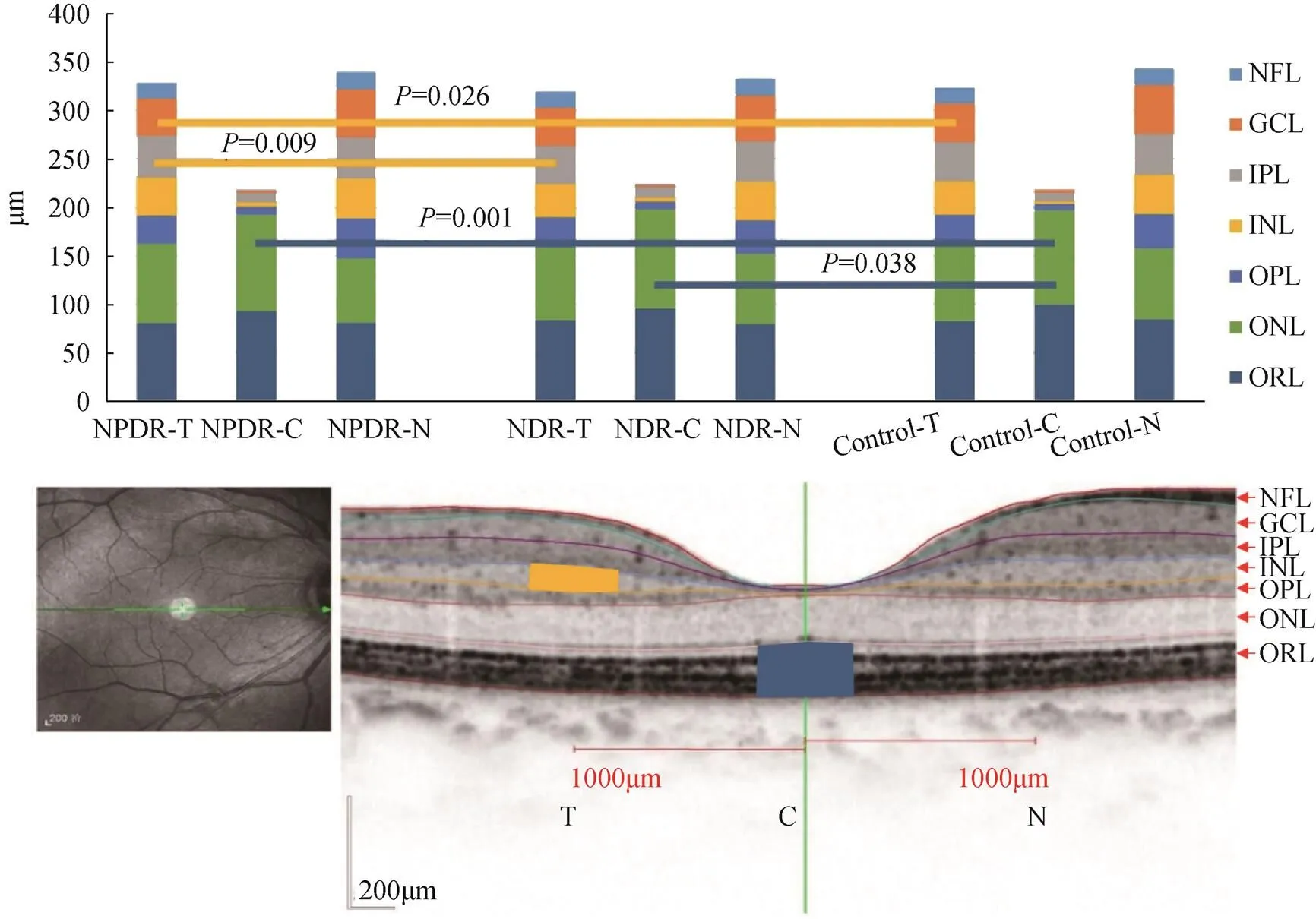
图1 各位点视网膜各亚层厚度比较
注:T为黄斑颞侧,C为黄斑中央,N为黄斑鼻侧。黄色线段表示INL层厚度组间的比较,黄色区域表示INL厚度有差异的位点。蓝色线段表示ORL层厚度组间的比较,蓝色区域表示ORL厚度有差异的位点。
内层视网膜和外层视网膜厚度比值,黄斑中心凹处三组间差异有统计学意义(=3.431,=0.037),NPDR组(1.37±0.26)和NDR组(1.35±0.33)均较Control组(1.20±0.24)偏大(NPDRControl,=0.022;NDR vs Control,=0.040)。颞侧三组间差异有统计学意义(=4.428,=0.015),NPDR组(3.08±0.35)较NDR组(2.87±0.26)和Control组(2.91±0.21)均偏大(NPDRNDR,=0.007;NPDRControl,=0.020),见表2。
2.3 各因素对视网膜亚层厚度的影响
多元logistic回归分析各因素对颞侧INL层厚度影响。DR与否对颞侧INL层厚度有影响(=0.019)。性别、年龄、BMI、患者住院期间最高血糖、糖化血红蛋白、降糖药种类、是否使用胰岛素、糖尿病病程等对颞侧INL层厚度均没有影响,见表3。
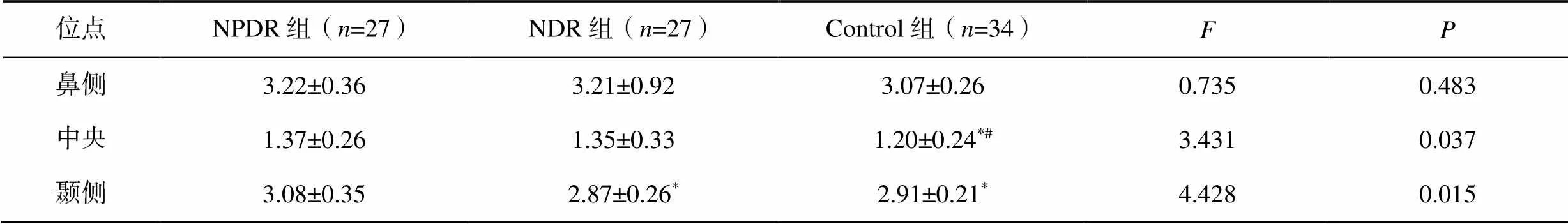
表2 各位点内层视网膜厚度与外层视网膜厚度比值比较
注:与NPDR组比较,*<0.05;与NDR组比较,#<0.05
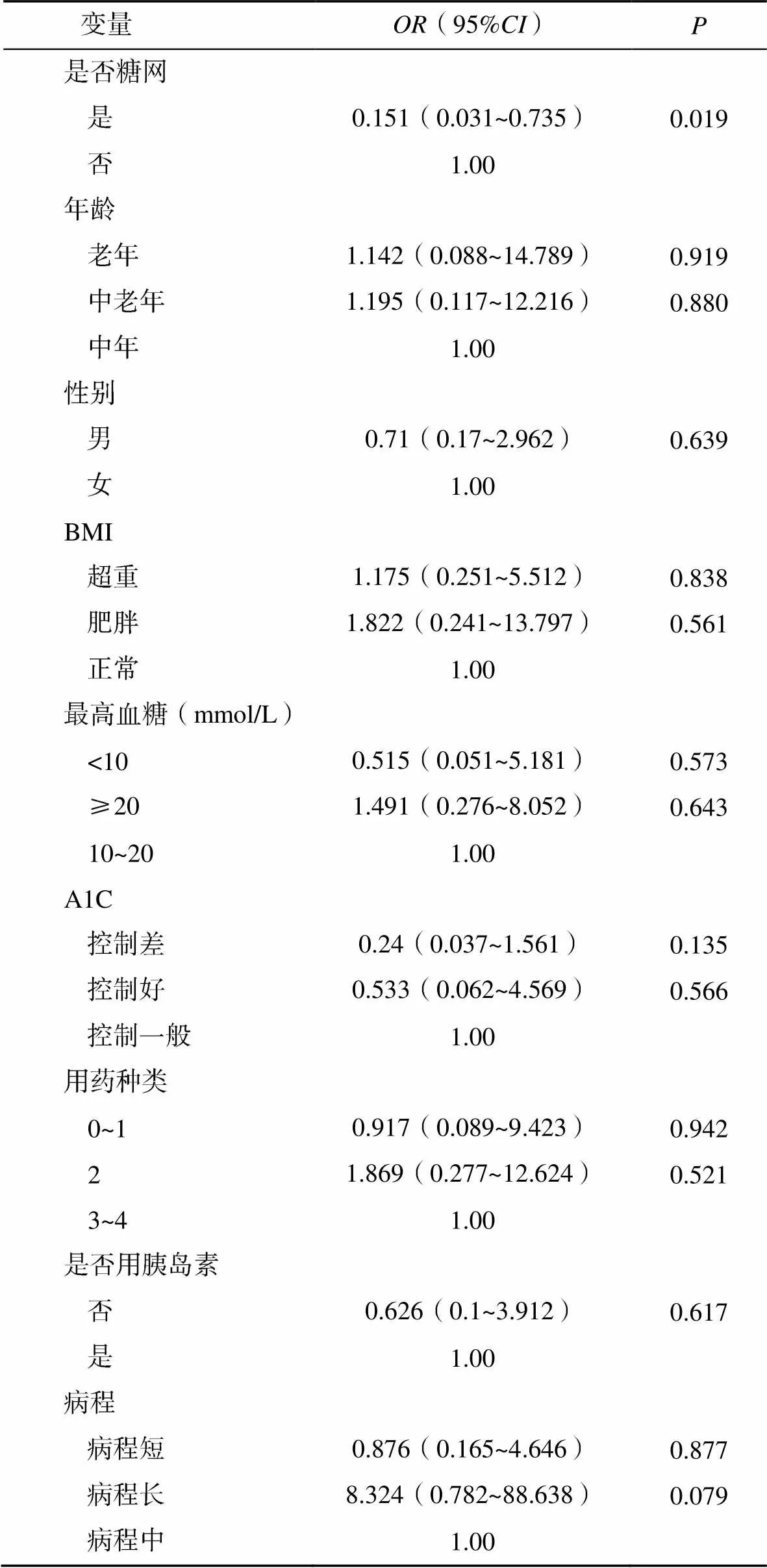
表3 黄斑颞侧内核层厚度相关因素的多元Logistic回归分析
注:上表为黄斑颞侧内核层厚度小于平均值组结果,参照组为黄斑颞侧内核层厚度≥平均值组;所有患者黄斑颞侧内核层平均值为36.9μm
3 讨论
糖尿病可引起视网膜微血管的改变,早发现早治疗对疾病控制有积极意义。OCT是目前常用的视网膜检查手段,能在发生视网膜微血管瘤前发现视网膜亚层的厚度异常。
本研究发现糖尿病者(NPDR组及NDR组)较非糖尿病者(Control组)黄斑中心凹处ORL厚度偏薄,导致其黄斑中心凹处内层视网膜厚度与外层视网膜厚度比值偏大。有DR者(NPDR组)较无DR者(Control组及NDR组)颞侧INL厚度偏厚,同样导致黄斑颞侧内层视网膜厚度与外层视网膜厚度比值偏大。其余NFL、GCL、IPL、OPL、ONL 5个亚层均未见明显异常。是否患有DR对颞侧INL层厚度有影响。
ORL层为外层视网膜,从外界膜到视网膜色素上皮层外缘,由视锥视杆细胞的内外节和色素细胞构成。黄斑中心凹处主要为视锥细胞的内外节。提示糖尿病患者早期视锥细胞受损可能。McAnany等[9-10]报道糖尿病早期尚未有DR时就有锥细胞功能障碍,与本研究结果一致。INL层为内核层,由无长突细胞、Müller细胞、双极细胞、水平细胞构成。视网膜中央动脉供应视网膜内层,到达INL层为深层毛细血管即终末毛细血管。推测血糖对视网膜微循环的影响最先累及INL层,INL因缺氧发生水肿,导致厚度增加。Huang等[11]报道认为视网膜颞侧功能更容易受损,与本研究结果一致。有学者研究了糖尿病病程、是否有糖尿病性视网膜变性、年龄、性别、糖化血红蛋白对视网膜厚度影响,发现仅是否有糖尿病性视网膜变性对内层视网膜厚度有影响[12],与本研究结果一致。
有学者通过OCT研究了糖尿病对视网膜厚度影响,结果与本研究不尽相同。吴宇霏等[13]发现糖尿病早期患者相比无糖尿病者黄斑中心区及颞侧视网膜NFL变薄,而黄斑上下方区域NFL各组间未见差异。冀向宁等[14]、李海东等[15]发现糖尿病组较非糖尿病组视盘上下方的NFL变薄,鼻颞侧未见差异。提示糖尿病患者NFL变薄在重度非增殖期及增殖期较明显,以视盘上下方的NFL为主,糖尿病早期不明显。单独的NFL厚度测量并不能很好的提示由糖尿病引起的视网膜损害,而长期的对照随访可能更能说明糖尿病对NFL的损害。本研究测量的是黄斑中心凹及中心凹附近1mm鼻侧和颞侧视网膜NFL,未在差异较明显的上下方,且本研究NPDR组均为轻中度患者。尹玉如等[16]研究发现重度非增殖期和增殖期较非糖尿病组GCL变薄,轻中度非增殖期尚无变化。张佳慧等[17]测量了NPDR或病情更重的患者黄斑GCL-IPL复合体的平均厚度及最小厚度,发现随着糖尿病眼底病情加重最小厚度逐渐变薄。本研究3组间GCL厚度差异无统计学意义,考虑可能是本研究NPDR组均为轻中度患者,且血糖控制同NDR组相近,病情较轻有关。提示在DR早期,血糖控制好的情况下,视网膜GCL变化并不显著,对早期DR临床意义不大。Van等[12]发现轻度DR者较无糖尿病者黄斑旁中心及周边IPL偏薄。差异可能源于测量位置不同。Van等[12]测量的是离黄斑中心0.5~1.5mm及1.5~3mm环形区域内的平均厚度,本研究单纯测量水平方向上中心凹鼻侧1mm和颞侧1mm的视网膜亚层厚度。
本研究仍有不足之处,首先本研究为回顾性研究,未能获取到上方及下方黄斑区视网膜亚层厚度信息,NFL在黄斑区偏薄,不能很好的显示差异。其次,本研究发现内层视网膜厚度与外层视网膜厚度比值在糖尿病患者和DR患者均偏大,但观察病例不多,需要更大样本的观察来确定其特异性及正常范围。
综上所述,糖尿病患者在未发生DR之前已有OCT可发现的差异。糖尿病对视网膜不同程度的损伤可引起视网膜亚层不一样的改变。实际应用中,不能忽略黄斑区上下方及视盘区视网膜亚层厚度的测量。NFL连续随访较单次测量更有临床意义。内层视网膜厚度与外层视网膜厚度比值可能是判定糖尿病对视网膜损害的有效指标。
[1] TEO Z L, THAM Y C, YU M, et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: systematic review and meta-analysis[J]. Ophthalmology,2021, 128(11): 1580–1591.
[2] ZHANG B, CHOU Y, ZHAO X, et al. Early detection of microvascular impairments with optical coherence tomography angiography in diabetic patients without clinical retinopathy: a meta-analysis[J]. Am J Ophthalmol,2021, 222: 226–237.
[3] CHAI Q, YAO Y, GUO C, et al. Structural and functional retinal changes in patients with type 2 diabetes without diabetic retinopathy[J]. Ann Med, 2022, 54(1): 1816–1825.
[4] PILOTTO E, TORRESIN T, LEONARDI F, et al. Retinal microvascular and neuronal changes are also present, even if differently, in adolescents with type 1 diabetes without clinical diabetic retinopathy[J]. J Clin Med, 2022, 11(14): 3982.
[5] SOHN E H, VAN DIJK H W, JIAO C, et al. Retinal neurodegeneration may precede microvascular changes characteristic of diabetic retinopathy in diabetes mellitus[J]. Proc Natl Acad Sci USA,2016, 113(19): E2655–2664.
[6] NANEGRUNGSUNK O, PATIKULSILA D, SADDA S R. Ophthalmic imaging in diabetic retinopathy: A review[J]. Clin Exp Ophthalmol, 2022, 50(9): 1082–1096.
[7] 中华医学会糖尿病学分会视网膜病变学组. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4–67.
[8] 中华医学会眼科学会眼底病学组. 我国糖尿病视网膜病变临床诊疗指南(2014年) [J]. 中华眼科杂志, 2014, 50(11): 851–865.
[9] MCANANY J J, LIU K, PARK J C. Electrophysiologicalmeasures of dysfunction in early-stage diabetic retinopathy: no correlation between cone phototransduction and oscillatory potential abnormalities[J]. Doc Ophthalmol,2020, 140(1): 31–42.
[10] MCANANY J J, PARK J C. Cone Photoreceptor dysfunction in early-stage diabetic retinopathy: association between the activation phase of cone phototransduction and the flicker electroretinogram[J]. Invest Ophthalmol Vis Sci, 2019, 60(1): 64–72.
[11] HUANG J, LI Y, CHEN Y, et al. Multifocal electroretinogram can detect the abnormal retinal change in early stage of type2 dm patients without apparent diabetic retinopathy[J]. J Diabetes Res,2021, 2021: 6644691.
[12] VAN DIJK H W, VERBRAAK F D, KOK P H, et al. Early neurodegeneration in the retina of type 2 diabetic patients[J]. Invest Ophthalmol Vis Sci,2012, 53(6): 2715–2719.
[13] 吴宇霏, 谭凡, 郑玥, 等. 2型糖尿病患者早期黄斑区视网膜亚层及脉络膜的光学相干断层扫描成像特征[J].中华眼视光学与视觉科学杂志, 2018, 20(11): 663–668.
[14] 冀向宁, 张习, 韩风梅, 等. 糖耐量异常及2型糖尿病患者早期视网膜损伤的观察[J]. 中华眼视光学与视觉科学杂志,2015, 17(3): 176–180.
[15] 李海东, 方伟, 吴素兰, 等. 糖尿病视网膜病变患眼视盘旁血流和视网膜神经纤维层厚度参数变化特征[J]. 中华眼底病杂志,2020, 36(6): 458–461.
[16] 尹玉如, 焦万珍, 赵博军. 糖尿病患者视网膜神经组织变性及微血管损伤研究[J]. 中华眼底病杂志,2022, 38(1): 27–33.
[17] 张佳慧, 陈晓隆. 2型糖尿病患者黄斑区结构改变与视力的相关性分析[J]. 中华眼底病杂志,2020, 36(5): 370–373.
Correlation between diabetes mellitus and retinal layers thickness
Department of Ophthalmology, Affiliated Hospital of Shaoxing University, Shaoxing 312000, Zhejiang, China
To investigate the possible relationship between retinal layers thickness and diabetes.A retrospective study was conducted. A total of 54 patients with type 2 diabetes admitted to the Affiliated Hospital of Shaoxing University from January to December 2021 were collected. Divided into a non-proliferative diabetic retinopathy (NPDR) group (=27), and a diabetic without retinopathy (NDR) group (=27). Non-diabetic patients matching age and gender at the same period were selected as the control group (=34). The thickness of retinal layers at the fovea, the nasal and temporal sides were measured by SD-OCT. The difference of retinal layers thickness and the correlation of each factor were analyzed.The thickness of the outer retinal layer in the macular fovea in both NPDR and NDR groups was thinner than that in the control group (NPDRControl,=0.001; NDRControl,=0.038). The thickness of the temporal inner nuclear layer in NPDR group was thicker than that in NDR group and control group (NPDRControl,=0.025; NPDRNDR,=0.009). The thickness ratio of the inner retinal layer to the outer retinal layer in the macular fovea was larger in NPDR group and NDR group than in control group(NPDRControl,=0.022; NDRControl,=0.040). The thickness ratio of the inner retinal layer to the outer retinal layer in temporal was larger in NPDR group than in NDR group and Control group (NPDRNDR,=0.007; NPDRControl,=0.020). Diabetic retinopathy status affected temporal inner nuclear layer thickness (=0.019).The retinal layers thickness in patients with type 2 diabetes was changed. Diabetic retinopathy status was related to the thickness of the temporal inner nuclear layer, which can increase the thickness of the temporal inner nuclear layer.
Optical coherence tomography; Diabetes; Diabetic retinopathy; Retinal layers
R587.2
A
10.3969/j.issn.1673-9701.2023.26.019
徐永根,电子信箱:xuyonggensx@163.com
(2023–02–23)
(2023–08–29)
