丹参多酚酸盐抑制氧化应激减轻阿霉素诱导的心脏毒性研究
2023-10-18张旼旼黄新宇戴慧
张旼旼,黄新宇,戴慧
丹参多酚酸盐抑制氧化应激减轻阿霉素诱导的心脏毒性研究
张旼旼1,黄新宇2,戴慧1
1.浙江大学医学院附属杭州市肿瘤医院放疗科,浙江杭州 310002;2.浙江大学医学院附属杭州市肿瘤医院肿瘤内科,浙江杭州 310002
探究丹参多酚酸盐(salvianolate,SAL)对阿霉素(adriamycin,ADM)诱导心脏毒性的保护作用及调控机制。采用随机数字表法将40只小鼠分为对照组、ADM组、等效剂量丹参多酚酸盐(equivalent dose of salvianolate,ESAL)组和高剂量丹参多酚酸盐(high-dose salvianolate,HSAL)组,每组10只,超声检测心脏结构和功能,测量小鼠体质量和心脏重量计算心脏体质量比,苏木精–伊红染色观察心脏组织形态,TUNEL检测法检测心脏组织凋亡,ELISA法检测小鼠血清中乳酸脱氢酶(lactate dehydrogenase,LDH)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、B型钠尿肽(B-type natriuretic peptide,BNP)、丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)的含量水平。将小鼠心肌细胞仍分为上述四组,每组均设3个重复孔,每个实验重复3次。CCK-8和流式细胞术检测心肌细胞活性和凋亡;ELISA法检测心肌细胞上清液中LDH、AST、MDA和SOD的含量。SAL可减轻ADM诱导的心肌肥厚、改善射血分数和降低心脏体质量比(<0.05),减轻心肌组织纤维化,减少组织细胞发生凋亡(<0.05);降低了ADM诱导的小鼠血清中LDH、AST、BNP和MDA水平(<0.05),升高了SOD的水平(<0.05);SAL能提高ADM抑制的心肌细胞活性(<0.05)、减少细胞凋亡(<0.05),降低了小鼠心肌细胞中LDH、AST和MDA水平(<0.05),升高了SOD的水平(<0.05)。SAL可能通过抑制氧化应激发挥对ADM诱导的心脏毒性的保护作用。
丹参多酚酸盐;阿霉素;心脏毒性
蒽环类抗肿瘤药物阿霉素(adriamycin,ADM),是临床广泛使用的细胞毒性药物之一。研究显示,如果使用剂量超出400~700mg/m2的范围,蒽环类药物会导致剂量依赖性的心脏毒性[1],因而ADM在临床使用中受到剂量限制[2]。右丙亚胺(dexrazoxane,DEX)是美国食品药品监督管理局批准临床使用的心脏保护剂,但其具有生殖毒性,且可加重化疗药物引起的骨髓抑制,长期使用可发生继发性恶性肿瘤(主要为急性髓性白血病)[3]。丹参的水溶性成分丹参多酚酸盐(salvianolate,SAL)具有减轻氧自由基损伤、提高机体抗脂质过氧化的作用,SAL能使缺血再灌注后的心肌凋亡细胞数明显减少[4]。本研究通过动物和细胞实验来研究SAL对ADM诱导的心脏毒性的保护作用。
1 材料与方法
1.1 动物与材料
选取6周龄雄性C3H/HeN小鼠40只,购自北京维通利华实验动物技术有限公司[动物许可证号:SCXK(京)2016-0011]。适应性饲养1周后开始实验。小鼠原代心肌细胞(批号:CPKP-M073)购自赛百慷(上海)生物技术有限公司。本研究经江大学医学院附属杭州市肿瘤医院动物伦理委员会批准(伦理审批号:EYOUNG-20210205-03)。
1.2 药物与试剂
阿霉素(生产单位:辉瑞制药有限公司,批准文号:国药准字H20013334,规格:10mg/瓶);苏木精–伊红染液套装、蛋白酶K、TUNEL试剂盒和DAPI均购自武汉赛维尔生物科技有限公司,CCK-8试剂盒购自上海碧云天生物技术有限公司,细胞凋亡试剂盒购自美国BD医疗器械有限公司,小鼠ELISA试剂盒购购自江苏酶免实业有限公司。
1.3 药物制备与分组
1.3.1 丹参多酚酸盐制备 丹参的风干根购自杭州市中医院中药房,通过蒸馏水将丹参干燥的根部煮沸制备,采用高效液相色谱法对丹参多酚酸盐进行含量测定,将提取物用生理盐水稀释成10mg/ml,4℃保存备用[5]。
1.3.2 动物分组与给药 40只小鼠采用随机数字表法分为对照组、ADM组、ESAL组、HSAL组,每组10只。对照组第5、12天于小鼠腹腔左侧注射生理盐水2ml,ADM组第5、12天于腹腔左侧注射ADM 7.5mg/kg,注射体积2ml,给药方式和剂量参考先前报道[6];对照组和ADM组小鼠腹腔右侧均每天注射生理盐水2ml。ESAL组和HSAL组除第5、12天于腹腔左侧注射7.5mg/kg ADM 2ml外,每天于腹腔右侧注射SAL(ESAL为15mg/kg,HSAL为30mg/kg)2ml,连续14天。
1.3.3 细胞分组与给药 细胞实验仍设置对照组、ADM组、ESAL组、HSAL组,每组均设3个重复孔,每个实验重复3次。对照组不加药物,ADM组加入ADM 20μmol/L,ESAL组和HSAL组除加入ADM 20μmol/L外,还需加入SAL(ESAL为14μmol/L,HSAL为28μmol/L),培养24h后进行后续实验。
1.3.4 心脏结构和功能检测 将小鼠腹腔注射戊巴比妥钠麻醉,备皮,采用动物超声成像系统,取5个心动周期的平均值记录数据,评价小鼠心脏结构与功能。心脏结构监测包括左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end-systolic diameter,LVESD)、室间隔舒张末室厚度(intraventricular septum end-diastolic thickness,IVSEDT)、室间隔收缩末厚度(intraventricular septum end-systolic thickness,IVSEST),左心室后壁舒张末厚度(left ventricular end-diastolic posterior wall thickness,LVEDPWT)和左心室后壁收缩末厚度(left ventricular end-diastolic posterior wall thickness,LVESPWT),这些指标均反映了心脏的肥厚程度;评价心脏功能指标包括左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fractional shortening LVFS)。
1.4 心脏体质量比
处死小鼠,取出心脏,称小鼠体质量和全心重量,计算心脏心脏体质量比[全心重量(g)/体质量(g)]。
1.5 苏木精-伊红染色
将石蜡包埋的心脏组织标本切片、脱蜡,苏木精–伊红染色,脱水封片后,显微镜下采集图像并分析(细胞核呈蓝色,细胞质呈红色)。
1.6 组织凋亡染色
心脏组织切片脱蜡、蛋白酶K修复、破膜,按TUNEL试剂盒说明书步骤,进行组织凋亡染色;使用DAPI复染细胞核,封片后于荧光显微镜下观察并采集图像(DAPI染出的细胞核在紫外的激发下呈蓝色,FITC荧光素标记阳性凋亡细胞核呈绿色);心肌组织凋亡率:分别计数400倍的高倍镜下至少5个视野内的绿色细胞数与蓝色细胞数的比率。
1.7 细胞活性检测
取小鼠原代心肌细胞,将对数生长的心肌细胞以3×104细胞/孔的密度铺于96孔板中,给药处理24h,CCK-8试剂盒评估细胞活力,使用酶标仪在450nm的波长下测量吸光度()值,计算细胞存活率,细胞活性=(实验组值–空白调零值)/(对照组值–空白调零值)×100%。
1.8 细胞凋亡检测
取对数生长期心肌细胞以1.2×106细胞/孔种植于6孔板,给药处理24h后,流式细胞仪检测细胞凋亡率。
1.9 小鼠血清和原代心肌细胞中LDH、MDA、SOD、AST、BNP含量变化
C3H/HeN小鼠取血或取小鼠原代心肌细胞,离心后取上清液,ELISA试剂盒分析小鼠血清或心肌细胞上清液中LDH、MDA、SOD、AST、BNP的含量变化。
1.10 统计学方法
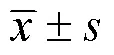
2 结果
2.1 各组小鼠心脏结构和功能比较
与对照组比较,ADM组、ESAL组和HSAL组中小鼠心脏结构指标(LVEDD、LVESD、IVSEDT、IVSEST、LVEDPWT和LVESPWT)数值均显著增加(<0.05),与ADM组比较,ESAL组和HSAL组中小鼠心肌肥厚度显著下降(<0.05)。与ADM组比较,ESAL组和HSAL组均可改善心脏射血功能(<0.05),见表1。ESAL组和HSAL组间心肌肥厚程度和心脏射血功能比较,差异均无统计学意义(>0.05),见表1。与对照组比较,各给药组中小鼠LVEF、LVFS显著降低(<0.05),见图1。
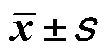
表1 各组小鼠心脏结构和功能比较(,mm,n=5)
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
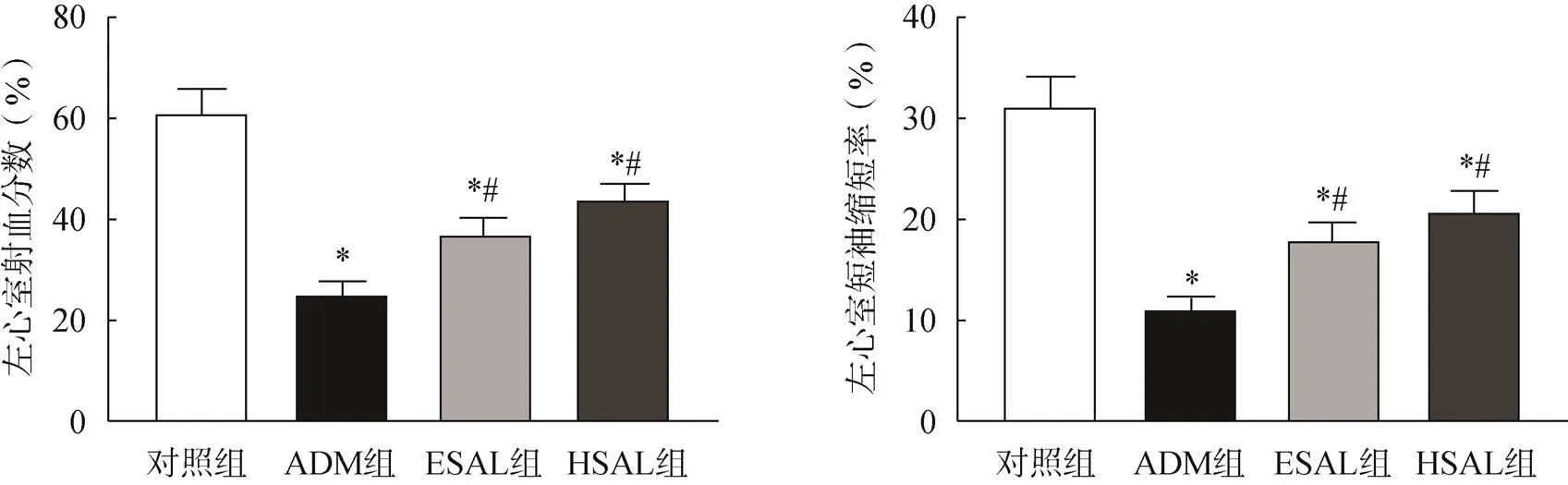
图1 各组小鼠LVEF和LVFS比较
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
2.2 小鼠心脏体质量比比较
与对照组比较,各给药组中小鼠心脏体质量比均显著性升高(<0.05),与ADM组比较,ESAL组和HSAL组均可减轻ADM诱导的心脏水肿(<0.05),但ESAL组和HSAL组比较,差异无统计学意义(>0.05),见表2。
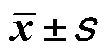
表2 各组小鼠全心重量、体质量及心脏体质量比变化情况(,n=5)
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
2.3 各组小鼠心肌组织形态变化
对照组小鼠心肌细胞核位于细胞中部,呈长椭圆形,心肌纤维排列整齐,间隙大小均等;而ADM组中心肌细胞损伤较严重,细胞肿胀变圆,心肌细胞纤维化明显,排列紊乱,间隙大小不一;与ADM组相比,ESAL组和HSAL组心肌细胞损伤均有不同程度的恢复,其中HSAL组心肌细胞肿胀程度明显减轻,心肌纤维排列部分恢复有序状态,见图2。
2.4 各组小鼠心肌组织凋亡情况比较
与对照组相比,各给药组组中TUNEL染色阳性(绿色荧光,图3A)的细胞增多,心肌组织凋亡率显著升高(图3B)(<0.05);与ADM组比较,ESAL和HSAL组均可显著减少ADM诱导的心肌组织凋亡(<0.05),ESAL和HSAL组比较,差异无统计学意义(>0.05),见图3。
2.5 各组小鼠血清中LDH、AST、BNP、MDA和SOD水平比较
与对照组比较,各给药组小鼠血清中LDH、AST、BNP和MDA的含量均显著升高(<0.05),SOD的含量均显著降低(<0.05);与ADM组比较,ESAL组和HSAL组均显著降低ADM诱导的LDH、AST、BNP和MDA的水平(<0.05),显著升高SOD水平(<0.05),ESAL组和HSAL组比较,差异无统计学意义(>0.05),见图4。
2.6 各组小数心肌细胞活性比较
与对照组比较,各给药组小鼠原代心肌细胞的存活率显著降低(<0.05);与ADM组比较,ESAL组和HSAL组中心肌细胞的细胞活性显著升高(<0.05),ESAL组和HSAL组比较,差异无统计学意义(>0.05),见图5。
2.7 各组小鼠心肌细胞凋亡情况比较
与对照组比较,各给药组心肌细胞的细胞凋亡率显著升高(<0.05);与ADM组比较,ESAL组和HSAL组中细胞凋亡率均显著降低(<0.05),ESAL组和HSAL组比较,差异无统计学意义(>0.05),见图6。
2.8 各组小鼠LDH、AST、MDA和SOD的含量比较
与对照组比较,各给药组心肌细胞上清液中LDH、AST和MDA的含量均显著升高(<0.05),SOD的含量均显著降低(<0.05);与ADM组比较,ESAL组和HSAL组中LDH、AST和MDA含量均降低(<0.05),SOD含量显著升高(<0.05),ESAL组和HSAL组间上述指标比较,差异无统计学意义(>0.05),见图7。
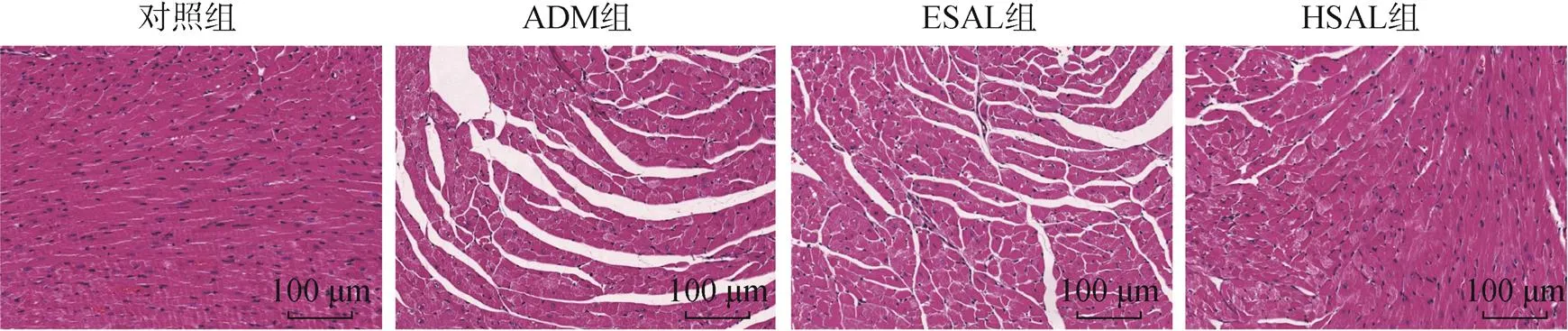
图2 小鼠心肌组织形态变化(HE染色,×200)
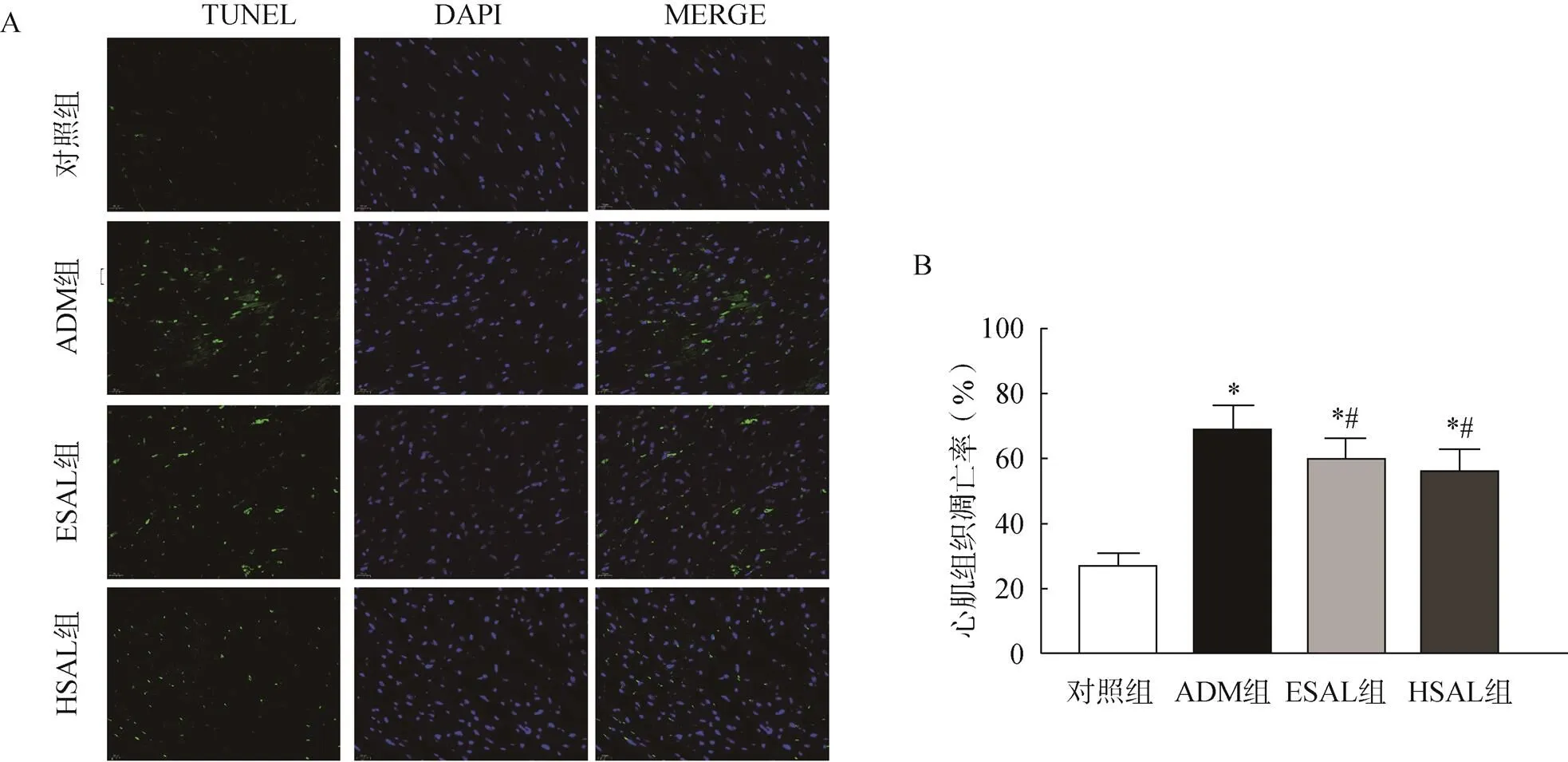
图3 各组小鼠心肌组织凋亡情况比较
A.TUNEL染色观察心肌组织凋亡(×400);B.各组小鼠心肌组织凋亡率
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
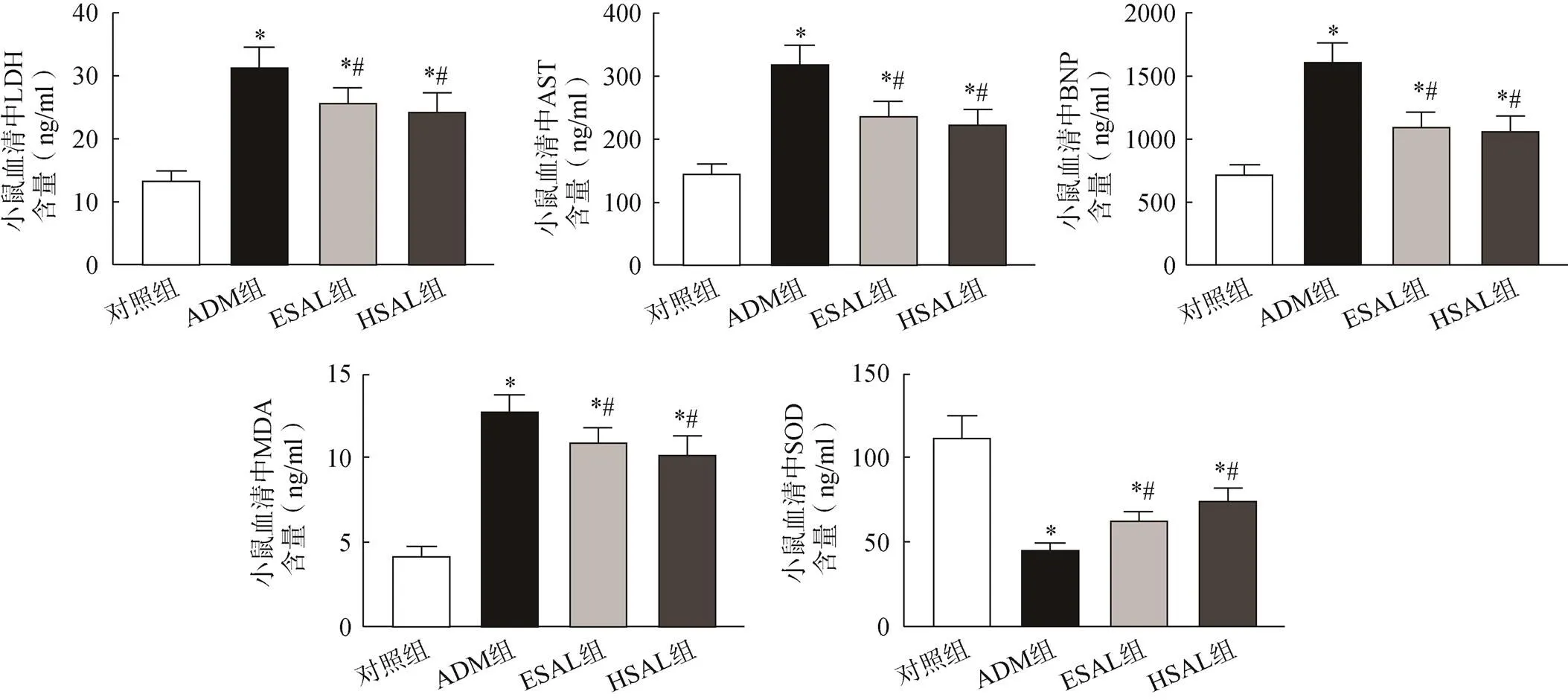
图4 各组小鼠血清中LDH、AST、BNP、MDA和SOD的水平比较
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
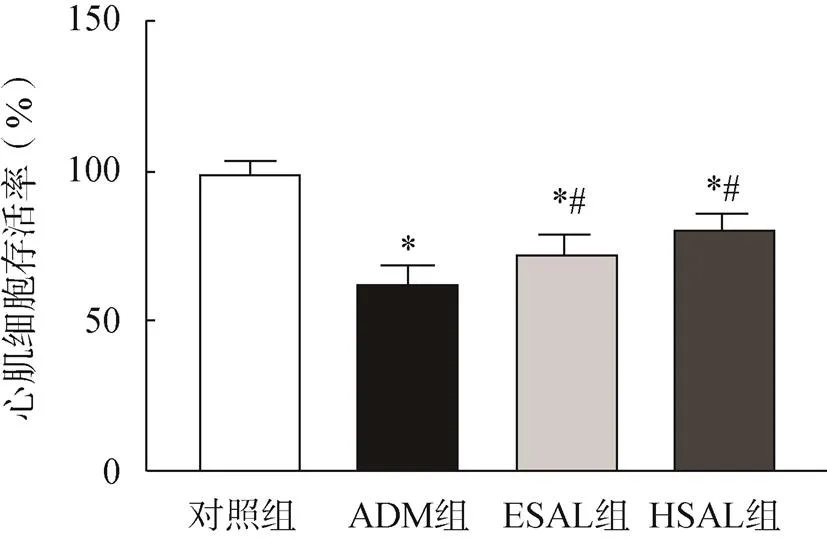
图5 CCK-8检测心肌细胞存活率
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
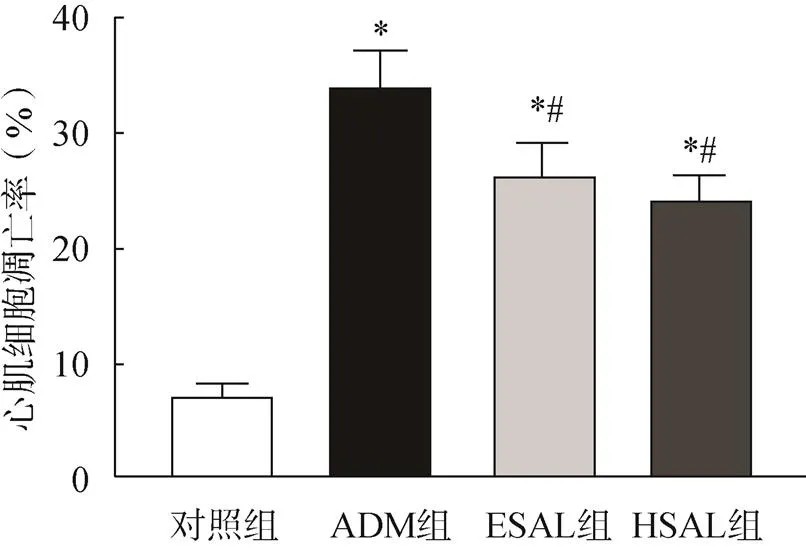
图6 流式细胞术检测心肌细胞凋亡率
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
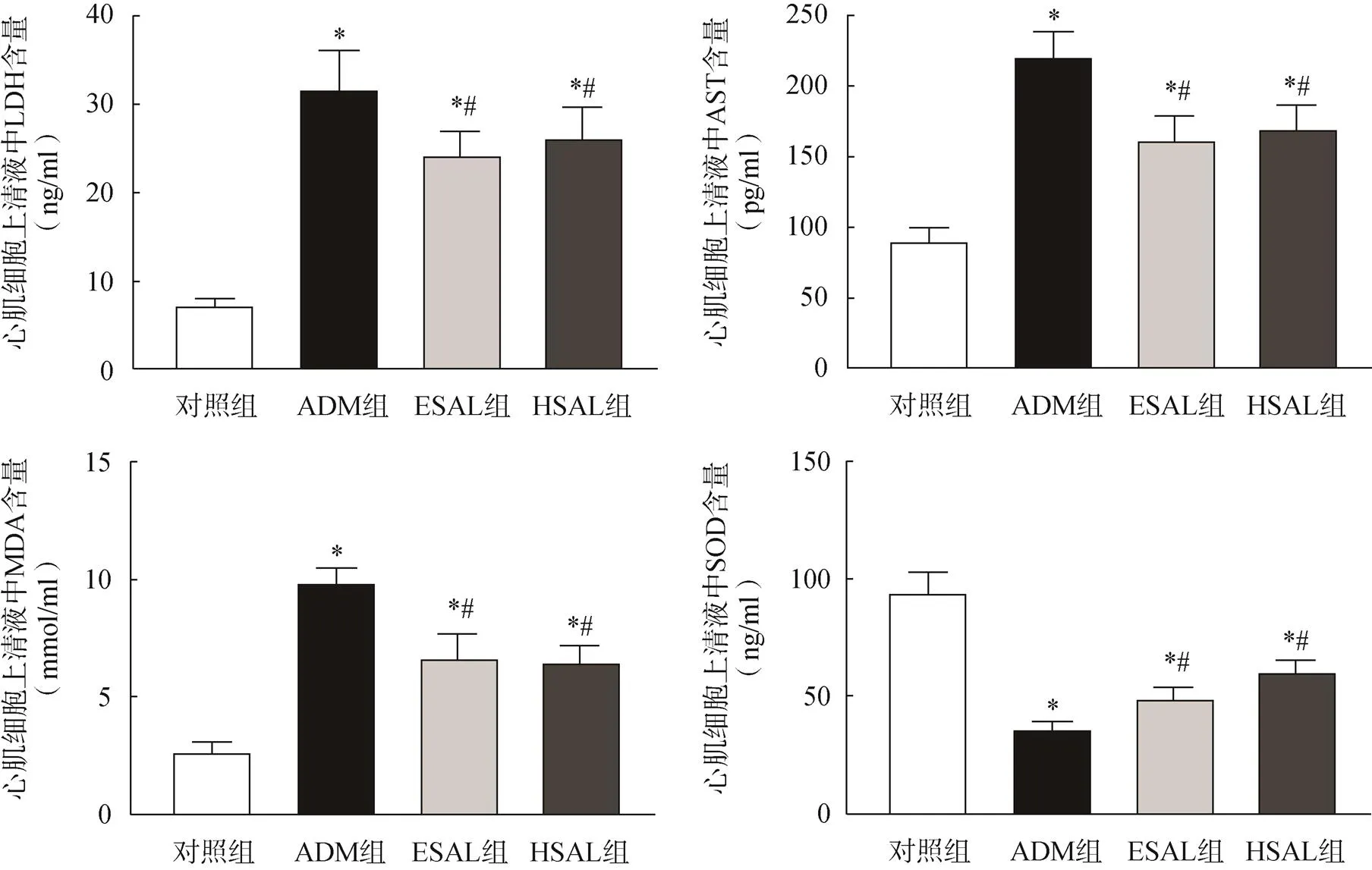
图7 各组小鼠LDH、AST、MDA和SOD水平比较
注:与对照组比较,*<0.05;与ADM组比较,#<0.05
3 讨论
ADM诱导的心脏毒性在肿瘤治疗中是极其严重的不良反应,现有多种机制来解释ADM引起的心脏毒性的发病机制,包括氧化应激、脂质过氧化等[7-8]。阿霉素诱导心肌毒性的产生已被证实与氧自由基相关,尤其是抗氧化物SOD减少、活性氧(reactive oxygen species,ROS)增多,从而触发氧化应激事件导致细胞损伤[7]。ADM可以导致细胞内外多种生化成份过氧化堆积,如脂质过氧化物MDA,MDA可损伤生物膜,使膜酶受损、活性降低,进而导致心肌细胞变性坏死[8]。此外,ADM诱导的心肌损害,会导致心脏毒性生物标志物,如LDH、AST、BNP等从受损的心肌细胞中释放,这些都可作为监测ADM 诱导心脏毒性的敏感指标[9]。尽管已经进行了广泛的研究以减少ADM诱导的心脏毒性,但尚未发现安全有效的预防措施。
丹参多酚酸盐是由中药材丹参的根提制而成,它具有镇静、抗氧化和促进血液循环等作用。丹参中主要包含脂溶性和水溶性化合物两大成分,其中,水溶性化合物主要由丹参素、原儿茶酚及SAL等组成。有研究报道,SAL具有抗氧化和清除自由基作用,可以保护细胞免受氧化应激[10]。Hung等[11]研究发现丹参水提取物对ADM介导的大鼠心肌来源的H9c2细胞的死亡具有剂量依赖性的保护作用。
本研究结果显示,SAL可减轻ADM预处理后小鼠心肌肥厚、改善心脏射血功能和减轻心脏水肿、减少心肌纤维化和心肌组织凋亡的发生,还可以减少小鼠心脏毒性指标(LDH、AST和BNP)释放。在细胞实验中,SAL增强了心肌细胞活性和抑制心肌细胞凋亡,同样可以降低心肌细胞上清液中LDH、AST水平。通过上述体外体内实验,证实SAL对ADM诱导的心脏毒性具有保护作用。本研究中还通过ELISA法检测了小鼠血清和原代心肌细胞上清液中SOD和MDA水平,结果证实SAL可以促进SOD的释放及抑制MDA的表达。
综上所述,SAL可能是通过促进抗氧化物SOD释放以减少氧化应激事件、抑制脂质过氧化物MDA产生以减轻ADM对细胞膜的损伤,进而抑制心肌细胞和心肌组织发生凋亡,从而发挥其对ADM诱导心脏毒性的保护作用的。这一结果有可能为临床安全使用ADM提供更加有效的措施。但SAL具体如何促进抗氧化剂SOD释放及抑制脂质过氧化MDA产生的机制仍不清楚,需要更进一步的研究来揭示相关的分子机制。
[1] NEBIGIL C G, DÉSAUBRY L.Updates in anthracycline- mediated cardiotoxicity[J]. Front Pharmacol, 2018, 12(9): 1262.
[2] CARVALHO C, SANTOS R X, CARDOSO S, et al. Doxorubicin: the good, the bad and the ugly effect[J]. Curr Med Chem, 2009, 16(25): 3267–3285.
[3] REICHARDT P, TABONE M D, MORA J, et al. Risk-benefit of dexrazoxane for preventing anthracycline- related cardiotoxicity: re-evaluating the European labeling[J]. Future Oncol, 2018, 14(25): 2663–2676.
[4] 赵全如,谢晓燕. 丹参的化学成分及药理作用研究进展[J]. 广东化工,2021, 48(1): 57–59.
[5] LIU K, ZHANG J W, LIU X G, et al. Correlation between macroscopic characteristics and tissue-specific chemical profiling of the root of Salvia miltiorrhiza[J]. Phytomedicine, 2018, 1(51): 104–111.
[6] YOU J S, PAN T L, LEE Y S. Protective effects of Danshen (Salvia miltiorrhiza) on adriamycin-induced cardiac and hepatic toxicity in rats[J]. Phytother Res, 2007, 21(12): 1146–1152.
[7] OCTAVIA Y, TOCCHETTI C G, GABRIELSON K L, et al.Doxorubicin-induced cardiomyopathy: from molecular mechanisms to therapeutic strategies[J]. J Mol Cell Cardiol, 2012, 52(6): 1213–1225.
[8] MENG Y Y, YUAN Y P, ZHANG X, et al. Protection against doxorubicin-induced cytotoxicity by geniposide involves AMPKα signaling pathway[J]. Oxid Med Cell Longev, 2019, 26: 7901735.
[9] YU W, QIN X, ZHANG Y, et al. Curcumin suppresses doxorubicin-induced cardiomyocyte pyroptosis via a PI3K/Akt/mTOR-dependent manner[J]. Cardiovasc Diagn Ther, 2020, 10(4): 752–769.
[10] HSU Y C, LIN Y L, CHIU Y T, et al. Antifibrotic effects of Salvia miltiorrhiza on dimethylnitrosamine- intoxicated rats[J]. J Biomed Sci, 2005, 12(1): 185–195.
[11] HUNG Y C, WANG P W, LIN T, et al. Functional redox proteomics reveal that salvia miltiorrhiza aqueous extract alleviates adriamycin-induced cardiomyopathy via inhibiting ros-dependent apoptosis[J]. Oxid Med Cell Longev, 2020, 2020: 5136934.
Study on the inhibition of oxidative stress by salvia polyphenolates to alleviate adriamycin-induced cardiotoxicity
ZHANG Minmin, HUANG Xinyu, DAI Hui
1.Department of Radiotherapy, Affiliated Hangzhou Cancer Hospital, Zhejiang University School of Medicine, Hangzhou 310002, Zhejiang, China; 2.Department of Medical Oncology, Affiliated Hangzhou Cancer Hospital, Zhejiang University School of Medicine, Hangzhou 310002, Zhejiang, China
To investigate the protective effect and regulatory mechanism of salvianolate (SAL) on adriamycin (ADM)-induced cardiotoxicity.A total of 40 mice were randomly divided into control group, ADM group, equivalent dose of salvianolate (ESAL) group, high-dose salvianolate group (HSAL) group, with 10 rats in each group. The heart structure and cardiac function were detected by ultrasound, the weight and heart weight of mice were measured to calculate the heart weight ratio, and the morphology of heart tissue was observed by HE staining, TUNEL assay to detect cardiac tissue apoptosis, ELISA method was used to detect the contents of lactate dehydrogenase (LDH), aspartate aminotransferase (AST), B-type natriuretic peptide (BNP), malondialdehyde (MDA) and superoxide dismutase (SOD) in mouse serum. The mouse primary cardiomyocytes were still divided into the above 4 groups, with each group consisting of three repeated wells, and each experiment was repeated three times. the cardiomyocyte activity and apoptosis were detected by CCK-8 and apoptosis kit; ELISA method was used to detect LDH, AST, MDA and SOD content in cardiomyocyte culture medium.SAL can reduce ADM induced myocardial hypertrophy, improve ejection fraction and reduce heart weight ratio (<0.05), reduce myocardial fibrosis, and reduce apoptosis of tissue cells (<0.05). It decreased the levels of LDH, AST, BNP and MDA in serum of mice induced by ADM (<0.05), and increased the level of SOD (<0.05). SAL can increase the activity of cardiomyocytes inhibited by ADM (<0.05), reduce apoptosis (<0.05), decreased the level of LDH, AST and MDA in mouse cardiomyocytes (<0.05), increased the level of SOD (<0.05).SAL may play a protective role on ADM induced cardiotoxicity by inhibiting oxidative stress.
Salvianolate; Adriamycin; Cardiotoxicity
R273
A
10.3969/j.issn.1673-9701.2023.26.024
杭州市农业与社会发展科研项目(20180533B64)
黄新宇,电子信箱:zhouhui3k686@163.com
(2022–11–13)
(2023–08–20)
