胃癌患者腹腔镜切除术前后G-17、CA125、PG 的变化及临床意义
2023-10-18高伟周进学冯建超
高伟,周进学,冯建超
(1.新郑华信民生医院普外二科,河南 新郑 451100;2.河南省肿瘤医院肝胆胰外科,河南 郑州 450008)
我国癌症临床统计数据显示,胃癌发病率与死亡率在各类恶性肿瘤中居于第二位,每年死亡胃癌患者高达30 万左右[1]。腹腔镜胃癌切除术具有创伤小、并发症少、恢复时间短等诸多优点,是治疗胃癌的重要手段。探索评估腹腔镜切除术清除胃癌病灶效果的敏感指标,对于指导临床治疗具有重要意义。糖类抗原125(CA125)等肿瘤标志物是恶性肿瘤诊断、治疗与预后评价的有效辅助指标[2];血清胃蛋白酶原(PG)以及胃泌素17(G17)能够准确反映胃黏膜的组织学特征,具有“血清学活检”的重要作用[3]。本研究以我院122 例胃癌患者为研究对象,分析其接受腹腔镜切除术治疗前后上述各指标的变化情况,现总结如下。
1 资料与方法
1.1 一般资料 选取2017 年1 月至2020 年12 月我院收治的胃癌患者122 例为观察组。纳入标准:(1)经胃镜、病理检查确诊为胃癌;(2)辅查肝、骨髓、肾功能正常;(3)无消化道手术史以及放疗、化疗史;(4)均行腹腔镜切除术;(5)患者及家属自愿参加研究。排除标准:(1)合并其他恶性肿瘤,或5年之内的恶性肿瘤病史;(2)合并严重心、肝、肾功能不全;(3)有激素类药物治疗史;(4)合并精神障碍性疾病。其中男83 例,女39 例,年龄47~71 岁,平均(57.92±9.74)岁;胃癌类型:黏液腺癌20 例(16.39%),印戒细胞癌74 例(60.66%),管状腺癌24 例(19.67%),其他6 例(4.92%)。另选取同期在我院体检的健康者60 例为对照组,其中男38 例,女22 例;年龄48~70 岁,平均(56.79±9.27)岁。两组性别、年龄等一般资料,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 采血方法 对照组于体检当日观察组于腹腔镜手术前1 d、术后30 d、术后90 d 采集晨起空腹静脉血5 mL。
1.2.2 实验室检测 在采集血液标本1 h 内进行检测。操作方法:3 000 r/min 离心10 min,提取血清。采用电化学发光法检测G-17、CA125 水平,仪器为罗氏Cobase601 电化学发光仪,试剂购自厦门波生生物技术公司;采用乳胶增强免疫比浊法检测PGI、PGⅡ水平,计算PGI/ PGⅡ比值(PGR),仪器为日立7180 全自动生化分析仪,试剂购自北京利德曼生化公司。检测过程严格遵循相关说明书规定。
1.2.3 随访 于术后1(m)、3 m、12 m 月对观察组所有患者进行随访,复查CT、胃镜等,评估是否复发。
1.3 统计学方法 实验数据使用SPSS 19.0 软件进行统计分析。计量资料两组间比较采用t 检验,多组间比较采用F 检验,两两比较采用LSD 检验;计数资料采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组G-17、CA125 以及PG 比较 观察组G-17、CA125、PGⅡ高于对照组,PGI、PGR 低于对照组(P<0.05),见表1。

表1 两组G-17、CA125 以及PG 比较
2.2 观察组手术前后G-17、CA125 以及PG 水平比较 观察组患者术后1 m、3 m G-17、CA125 明显低于术前,术后3 m G-17、CA125 明显低于术后1 m(P<0.05);术后1 m、3 m PGI、PGR 明显高于术前,术后3 m PGR 明显高于术后1 m(P<0.05);术后3 m PGⅡ明显低于术前(P<0.05),见表2。
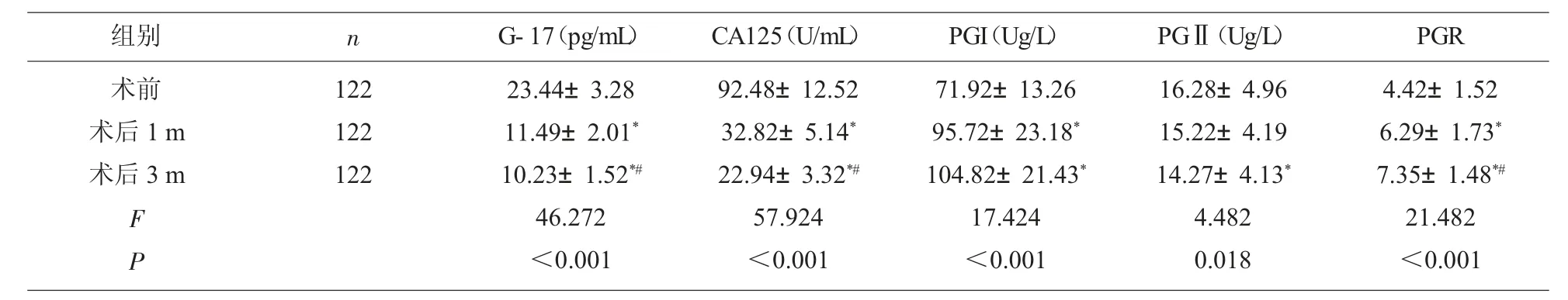
表2 观察组手术前后G-17、CA125 以及PG 水平比较
2.3 不同预后亚组G-17、CA125 以及PG 水平比较 所有患者随访12 m,其中复发患者17 例(复发亚组)、未复发患者105 例(未复发亚组)。复发亚组G-17、CA125、PGⅡ高于未复发亚组,PGI、PGR低于未复发亚组(P<0.05),见表3。

表3 不同预后亚组G-17、CA125 以及PG 水平比较
2.4 各变量对手术后复发的预测价值 ROC 曲线分析显示,G-17(AUC=0.761)、CA125(AUC=0.843)、PGI(AUC=0.741)、PGⅡ(AUC=0.732)、PGR(AUC=0.737)均是预测手术后复发的重要因素(P<0.001),见表4、图1。

图1 各变量对手术后复发的预测价值
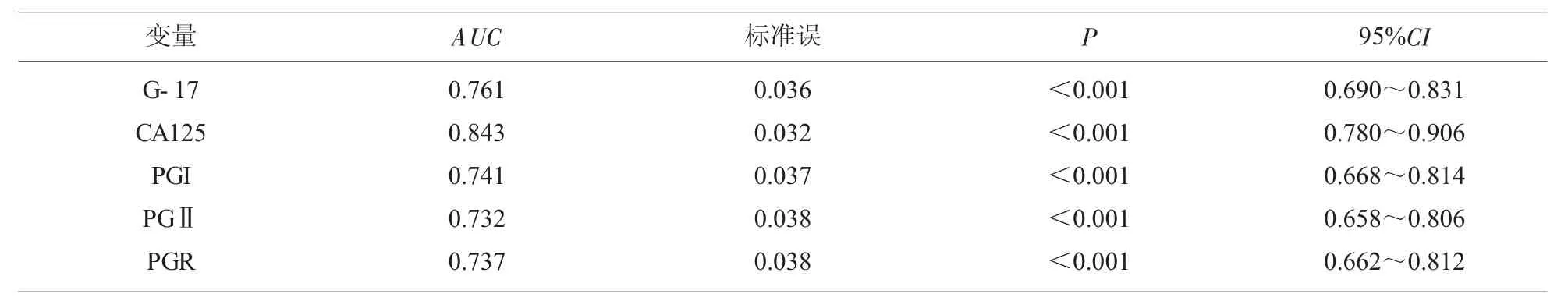
表4 各变量对手术后复发的预测价值
3 讨论
目前胃癌主要实施手术治疗,通过外科手术清除肿瘤组织以及淋巴结组织,可有效延长患者生存期。传统的开腹手术创伤大,术中肿瘤组织可能受到挤压,导致癌细胞进入血液循环,因此术后容易复发[4]。腹腔镜手术能够提供清晰视野,手术创伤小、出血少、可减少术后并发症,缩短术后恢复时间。但临床研究表明,对于术前存在淋巴结转移的患者,术后复发率仍超过50%[5]。本研究分析了胃癌患者接受腹腔镜手术治疗前后G-17、CA125、PG 的变化,以期为准确评估腹腔镜手术疗效及预后提供参考。
G-17 是胃泌素的主要结构形式,约占胃泌素的80%~90%,其主要由胃窦幽门腺G 细胞合成,起着调节壁细胞分泌胃酸、滋养上皮细胞以及刺激细胞增殖分化等重要作用[6]。近年研究发现,G-17可作为早期筛查胃部肿瘤的敏感指标[7]。Zhao 等[8]研究报道,早期胃癌患者G-17 水平异常升高。李世杰等[9]研究表明,G-17 浓度升高可促进癌细胞增殖以及转移侵袭,对于消化道肿瘤良恶性鉴别以及治疗判断具有重要的参考价值。CA125 是对多种类型恶性肿瘤具有诊断价值的重要肿瘤标志物。CA125 属于黏蛋白类物质,由于细胞基膜的屏障功能,CA125 在健康人血清中浓度极低;当组织恶变或肿瘤浸润破坏这种屏障功能时,CA125 释放进入血液中。CA125 半衰期仅为4.8 d,其检测结果能够有效反映肿瘤组织的近期变化状态,对于评估治疗效果具有重要的参考价值[10]。廖衍强等[11]报道,CA125 水平在胃癌患者中明显升高,应用于诊断胃癌的灵敏度高达91.3%。本研究结果显示,观察组治疗前G-17、CA125 水平明显高于对照组,与上述研究结论一致。
PG 由胃黏膜分泌,按照其生化与免疫特性的差异可分为PGI 和PGⅡ,前者由胃底腺合成,后者则由全胃腺以及位于近端十二指肠的Brunner腺分泌,两者均是反映胃黏膜组织学状态的重要生化指标[12]。胃黏膜萎缩时,胃底腺合成与分泌PG I 的功能下降。PG I 水平降低对胃癌发生具有良好的预示作用[13]。PGⅡ也是导致CAG 与胃癌发病的主要危险因素。董曲文等[14]研究发现,胃癌患者PGⅡ水平高于非胃癌患者,认为早期胃癌患者胃壁生理结构受损,从而导致PGⅡ大量进入血循环中。有研究报道,PGⅡ基因多态性与胃癌发病风险高度相关,编码PGⅡ基因的第100 个插入/删除位点携带短等位基因,可能诱导胃癌的发病[15]。本研究中观察组PGI 及PGR 低于对照组,PGⅡ高于对照组,与上述研究结论一致,提示PG 可作为胃癌前病变的重要临床观察指标之一。
本研究结果显示,腹腔镜手术治疗后1 m 及3 m,患者G-17、CA125 呈明显下降趋势,PGI、PGR 均上升趋势,说明腹腔镜手术实现了癌灶组织的精准切除,减轻了患者的肿瘤负荷,同时促进胃底腺细胞生理功能的恢复,使其合成PGI 明显增多。术后3 m,患者PGⅡ低于术前,考虑其原因为:手术治疗逆转了原来癌细胞对胃壁功能的破坏,GPⅡ不再从受损的胃壁大量进入血液循环,因此其水平明显下降。而术后1 m GPⅡ水平与术前无明显差异,可能是由于时间较短,胃壁功能尚未完全恢复。本研究中通过随访进一步发现,与未复发患者比较,复发患者G-17、CA125 以及PGⅡ升高,而PGI、PGR 显著降低,ROC 曲线分析显示,G-17(AUC=0.761)、CA125(AUC=0.843)、PGI(AUC=0.741)、PGⅡ(AUC=0.732)、PGR(AUC=0.737)均是预测手术后复发的重要因素,说明病情复发引起G-17、CA125 等肿瘤标志物的相应变化,同时由于癌细胞侵袭胃底腺细胞,并损害胃壁功能,引起PG相关指标的变化,此发现与董曲文等[14]研究结论一致。
综上所述,胃癌患者G-17、CA125、PGⅡ明显升高,PGI、PGR 明显降低,且经腹腔镜手术治疗后,G-17、CA125 持续下降,PGI、PGR 明显升高,联合监测上述指标,可为胃癌筛查、腹腔镜手术疗效评估及预后判断提供参考。
