顶空-气相色谱法检测卤化丁基胶塞中的挥发性化合物
2023-10-17马玉玲白青青王娅莉
班 璐,于 兰,马玉玲,白青青,张 晴,王娅莉
(微生物药物国家工程研究中心 河北省工业微生物代谢技术创新中心 石家庄市微生物药物技术创新中心 华北制药集团新药研究开发有限责任公司,河北 石家庄 052165)
卤化丁基胶塞具有吸湿率低、化学性好、气密性好和无生理毒副作用等显著特点,已成为重要的药品包装密封材料[1-2]。然而在胶塞的制造过程中必须加入多种化学助剂,因此会在胶塞本体内残存一些未被化学键合的反应剩余物,这些物质在药品的贮存过程中,不可避免地会迁移到胶塞表面,尤其是其中的可挥发性成分会迁移到药品中,极大可能被药品吸附,从而降低药效或产生毒副作用[3-4]。因此,包装材料是否合适是评价药品质量的重要指标[5-8],药品包装材料与药品相容性试验是评价包装材料最直观有效的方法。
小分子烷烃类化合物在可挥发性化合物中占比较高,成分较多,且容易发生迁移被药品吸附[9]。鉴于此,作者采用顶空-气相色谱法检测注射用阿尼芬净的卤化丁基胶塞中5种小分子烷烃类化合物(2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷),测定其在加速0月、3月、6月药品中的迁移量,为药品包装材料的相容性研究提供理论依据。
1 实验
1.1 材料、试剂与仪器
注射用阿尼芬净(规格100 mg/瓶,批号YF01010021),华北制药股份有限公司。
2-甲基戊烷(批号S4R2B-BC,98.0%),东京化成工业株式会社;3-甲基戊烷(批号G1501073,99.0%),阿拉丁试剂有限公司;正己烷(批号20141022,99.5%),天津科密欧化学试剂有限公司;甲基环戊烷(批号K5212,99.0%),山东西亚化学工业有限公司;环己烷(批号Q5MHO-AM,99.5%),梯希爱上海化成工业发展有限公司;二甲基亚砜(批号10969300833),默克。
7890A型气相色谱仪,美国安捷伦公司。
1.2 色谱条件
顶空条件:恒温炉80 ℃,样品流路90 ℃,传输线110 ℃,样品平衡时间40 min,GC循环时间50 min。
DB-624色谱柱(60 m×250 μm,1.40 μm)。柱温:起始温度60 ℃保持3 min;以5 ℃·min-1升温到80 ℃保持10 min,以15 ℃·min-1升温到240 ℃保持10 min。分流进样口温度110 ℃,分流比20∶1。FID检测器,温度250 ℃。
1.3 混合对照品溶液的制备
精密称取2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷各100 mg,置于25 mL容量瓶中,用二甲基亚砜溶解并稀释至刻度,摇匀,作为混合对照品储备液A;精密量取混合对照品储备液A 2.5 mL置于25 mL容量瓶中,用二甲基亚砜稀释至刻度,摇匀,作为混合对照品储备液B;精密量取混合对照品储备液B 1.25 mL置于10 mL容量瓶中,用二甲基亚砜稀释至刻度,摇匀,得50 μg·mL-1混合对照品储备液C;取混合对照品储备液C 0.1 mL,加入0.9 mL二甲基亚砜、1.0 mL水,置于顶空瓶中,混匀,作为混合对照品溶液。
精密量取混合对照品储备液C 2.5 mL置于5 mL容量瓶中,用二甲基亚砜稀释至刻度,摇匀,作为混合对照品储备液D;精密量取混合对照品储备液B 2.5 mL置于10 mL容量瓶中,用二甲基亚砜稀释至刻度,摇匀,作为混合对照品储备液E;精密量取混合对照品储备液C和混合对照品储备液E各2.5 mL,混匀,作为混合对照品储备液F。
1.4 线性溶液的制备
精密量取适量混合对照品储备液B,用二甲基亚砜逐级稀释成200 μg·mL-1、100 μg·mL-1、50 μg·mL-1、20 μg·mL-1、10 μg·mL-1、4 μg·mL-1、2 μg·mL-1的溶液,分别量取混合对照品储备液B及其稀释后各浓度溶液0.1 mL,加入二甲基亚砜0.9 mL、水1.0 mL,混匀,即得进样浓度(μg·mL-1)分别为20、10、5、2.5、1.0、0.5、0.2、0.1的线性溶液,按色谱条件进样分析。
1.5 供试品溶液的制备
供试品溶液的制备:取一瓶注射用阿尼芬净制剂,用30 mL超纯水溶解,精密量取1.0 mL,加入1.0 mL二甲基亚砜后置于顶空瓶中,混匀。
50%浓度水平加标供试品溶液的制备:取一瓶注射用阿尼芬净制剂,用30 mL超纯水溶解,精密量取1.0 mL,加入0.1 mL混合对照品储备液D、0.9 mL二甲基亚砜后置于顶空瓶中,混匀。
100%浓度水平加标供试品溶液的制备:取一瓶注射用阿尼芬净制剂,用30 mL超纯水溶解,精密量取1.0 mL,加入0.1 mL混合对照品储备液C、0.9 mL二甲基亚砜后置于顶空瓶中,混匀。
150%浓度水平加标供试品溶液的制备:取一瓶注射用阿尼芬净制剂,用30 mL超纯水溶解,精密量取1.0 mL,加入0.1 mL混合对照品储备液F、0.9 mL二甲基亚砜后置于顶空瓶中,混匀。
2 结果与讨论
2.1 色谱条件的优化
2.1.1 升温程序的确定
按1.3方法制备混合对照品溶液,分别在以下4种升温程序下进样分析,通过比较各成分分离度(表1),确定最优的升温程序。
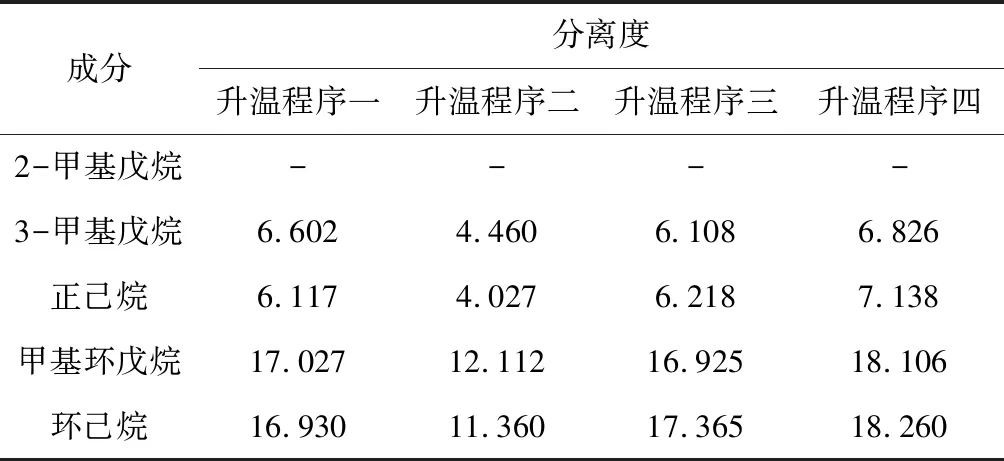
表1 不同升温程序下各成分的分离度
升温程序一:起始温度60 ℃保持3 min,以5 ℃·min-1升温到80 ℃保持10 min,以15 ℃·min-1升温到240 ℃保持10 min,运行时间37 min。
升温程序二:起始温度60 ℃保持3 min,以20 ℃·min-1升温到240 ℃保持15 min,运行时间27 min。
升温程序三:起始温度60 ℃保持5 min,以5 ℃·min-1升温到80 ℃保持10 min,以15 ℃·min-1升温到240 ℃保持10 min,运行时间40 min。
升温程序四:起始温度40 ℃保持3 min,以5 ℃·min-1升温到80 ℃保持10 min,以15 ℃·min-1升温到240 ℃保持10 min,运行时间42 min。
由表1可知,按升温程序一、三、四进样分析,各成分分离度均优于升温程序二。考虑到升温程序三、四的运行时间较长,选择升温程序一进行检测。
采用DB-624色谱柱,按升温程序一进样分析,混合对照品溶液的顶空-气相色谱如图1所示。
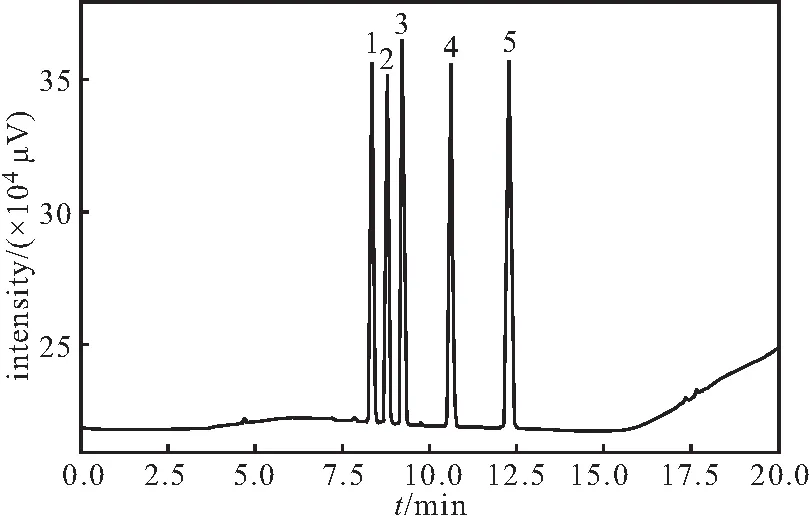
1~5:2-甲基戊烷(8.350 min)、3-甲基戊烷(8.788 min)、
由图1可知,采用DB-624色谱柱,按升温程序一进样分析,混合对照品溶液各成分分离度均大于1.5,满足分离需求。
2.1.2 顶空瓶平衡温度和平衡时间的确定
设置平衡时间为30 min,在平衡温度分别为70 ℃、75 ℃、80 ℃、85 ℃、90 ℃时,混合对照品溶液各成分顶空-气相色谱峰的峰面积随着平衡温度的升高逐渐增大,80 ℃后峰面积整体变化缓慢(图2)。因此,确定平衡温度为80 ℃。
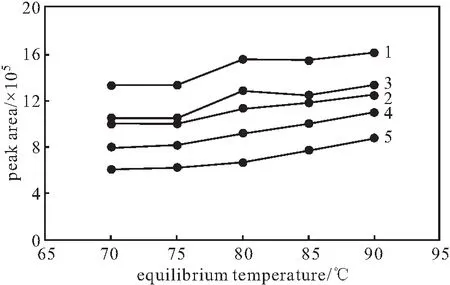
1~5:2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷
设置平衡温度为80 ℃,在平衡时间分别为20 min、30 min、40 min、50 min、60 min时,混合对照品溶液各成分顶空-气相色谱峰的峰面积随着平衡时间的延长先减小后增大再趋于稳定,40 min后峰面积变化不明显(图3)。为节省时间,确定平衡时间为40 min。

1~5:2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷
2.2 标准曲线与线性范围
取各浓度线性溶液,以峰面积(A)为纵坐标、浓度(c)为横坐标绘制各对照品溶液的标准曲线,结果如图4所示。
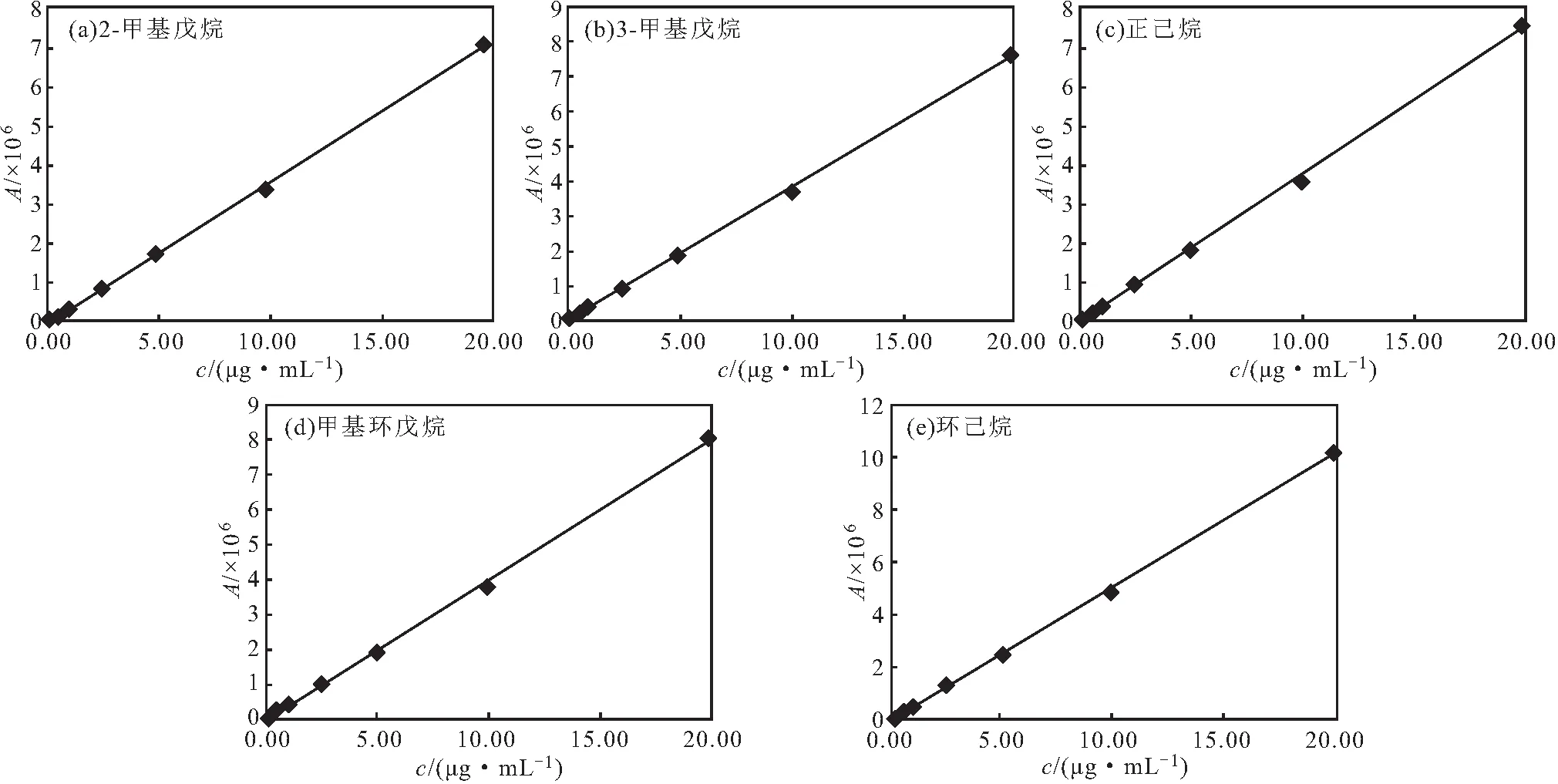
图4 各对照品溶液的标准曲线
依据标准曲线计算各对照品溶液的线性回归方程及相关系数。得到2-甲基戊烷:A=361180.8380c-50944.1155,R2=0.9985;3-甲基戊烷:A=357876.2729c-50420.6082,R2=0.9985;正己烷:A=362486.6981c-49285.6570,R2=0.9984;甲基环戊烷:A=368637.7664c-37344.3748,R2=0.9986;环己烷:A=444778.9533c-44637.6230,R2=0.9986。表明,2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷浓度在0.1~20 μg·mL-1范围内与峰面积线性关系良好。
2.3 定量限与检出限
称取2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷各100 mg,分别置于25 mL容量瓶中;再分别吸取各对照品溶液于容量瓶中,用二甲基亚砜逐级稀释,得到梯度浓度的混合对照品稀释液。精密量取各对照品稀释液0.1 mL,加入1.0 mL水、0.9 mL二甲基亚砜,置于顶空瓶中,注入气相色谱仪,调节仪器灵敏度,信噪比10∶1时为定量限,信噪比3∶1时为检出限。各对照品的定量限与检出限见表2。
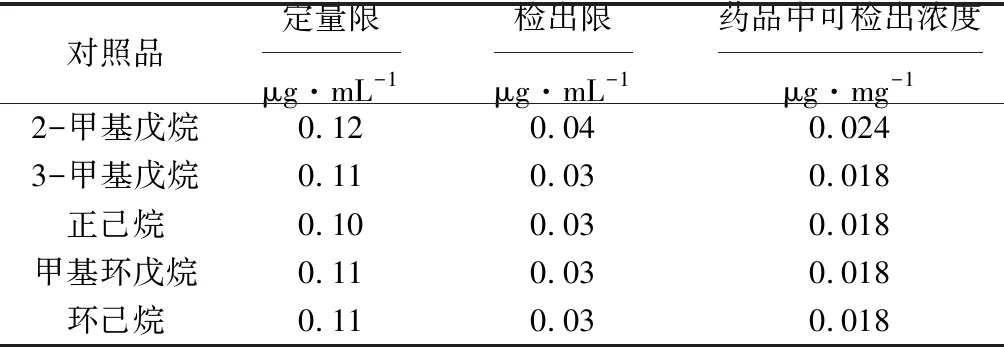
表2 各对照品的定量限与检出限
2.4 加标回收率
按1.5方法制备注射用阿尼芬净50%、100%、150%浓度水平加标供试品溶液,进样测定,计算加标回收率,结果见表3。
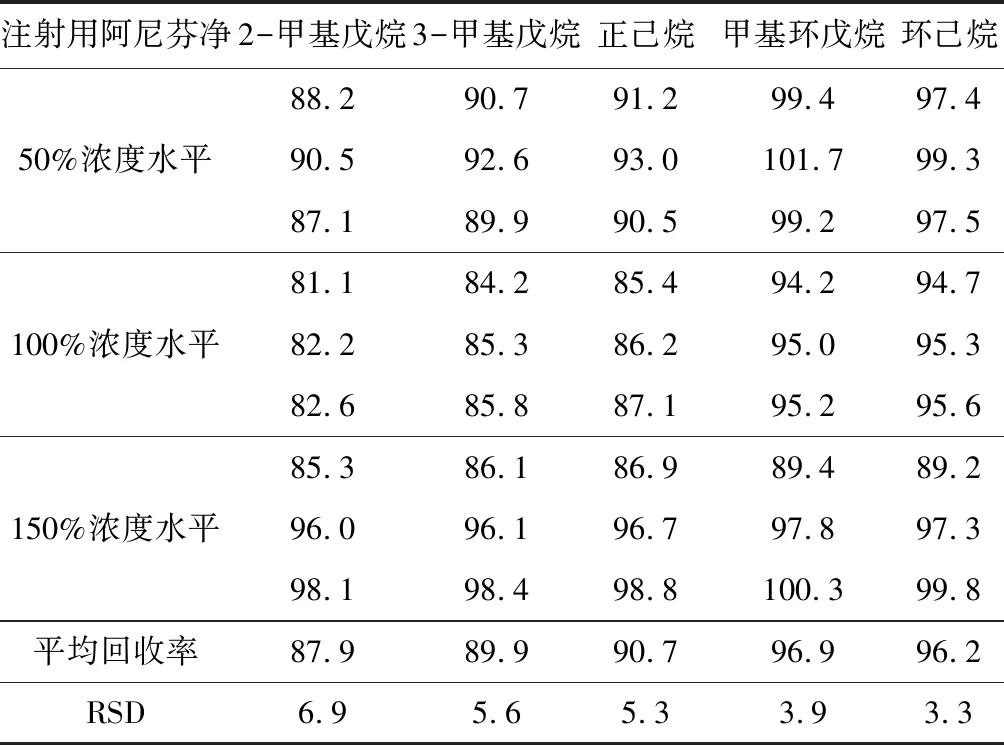
表3 供试品加标回收率(n=3)/%
由表3可知,注射用阿尼芬净50%、100%、150%浓度水平加标供试品溶液中的5种挥发性化合物的加标回收率均在81.1%~101.7%之间,RSD值均小于10%,说明该方法准确、可靠。
2.5 样品检测
在优化的色谱条件(DB-624色谱柱;起始温度60 ℃保持3 min,以5 ℃·min-1升温到80 ℃保持10 min,以15 ℃·min-1升温到240 ℃保持10 min;分流比20∶1;顶空瓶80 ℃平衡40 min)下,测定镀膜卤化丁基胶塞中的5种挥发性化合物(图5a)。另取加速条件[温度(25±2) ℃,湿度60%±10%]下0月、3月、6月注射用阿尼芬净,测定镀膜卤化丁基胶塞中的5种挥发性化合物迁移进入药液中的含量(图5b为0月注射用阿尼芬净)。结果表明,在3批注射用阿尼芬净中均未检出2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷等5种挥发性化合物,表明镀膜卤化丁基胶塞与注射用阿尼芬净的相容性良好。
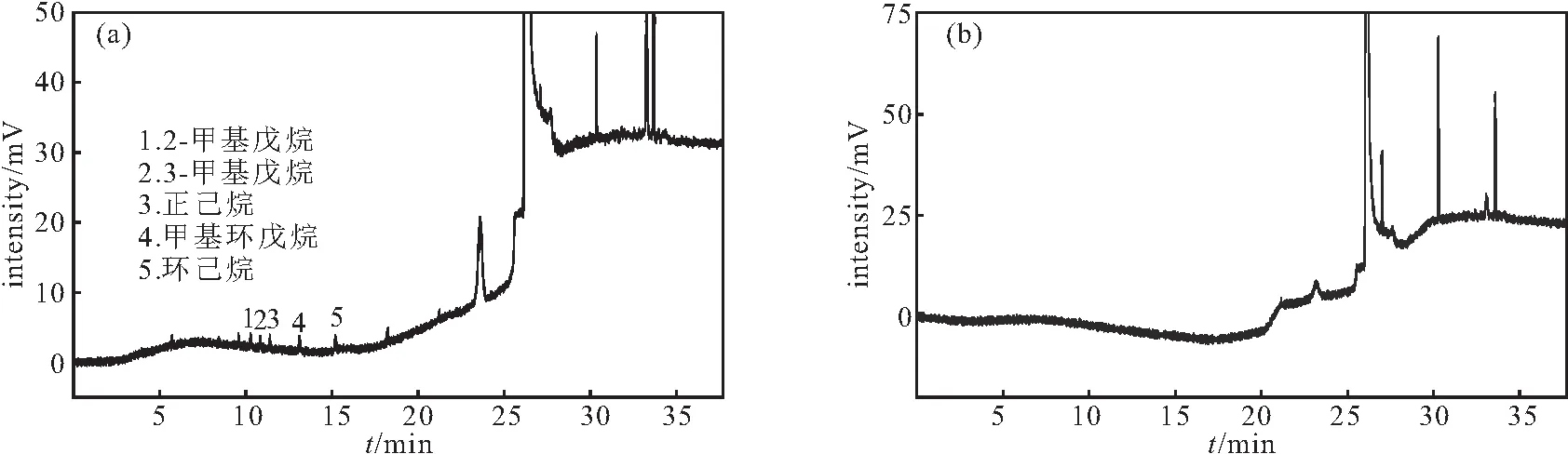
图5 胶塞中5种挥发性化合物(a)及其迁移至药液中的顶空-气相色谱(b)
2.6 安全性评估
根据ICH Q3C残留溶剂的指导原则,正己烷、环己烷的口服每日允许最大暴露量(PDE)分别为2.9 mg·d-1、38.8 mg·d-1,静脉PDE按口服PDE的10%进行计算,正己烷、环己烷的静脉PDE分别为0.29 mg·d-1、3.88 mg·d-1。
搜索“化学药品数据库”:2-甲基戊烷、3-甲基戊烷、甲基环戊烷组实验中出现的显著性差异,均没有正己烷组明显,即正己烷的毒性强于2-甲基戊烷、3-甲基戊烷、甲基环戊烷。因此,按照从严控制的原则,将正己烷在注射液中PDE作为2-甲基戊烷、3-甲基戊烷、甲基环戊烷的PDE。
注射用阿尼芬净每日最大用量为2瓶,即200 mg或60 mL,经计算药液中2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷日最大摄入量均为3.6~4.8 μg·d-1。表明,2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷等5种挥发性化合物日摄入量均远低于PDE,卤化丁基胶塞中挥发性化合物的迁移不会给药品带来风险。
3 结论
采用顶空-气相色谱法同时测定卤化丁基胶塞中2-甲基戊烷、3-甲基戊烷、正己烷、甲基环戊烷、环己烷等5种挥发性化合物,在加速0月、3月、6月的注射用阿尼芬净药液中,均未检出5种挥发性化合物,表明卤化丁基胶塞与注射用阿尼芬净的相容性良好。顶空-气相色谱法具有专属性强、重现性好、准确度高等特点,可用于包装材料与药品相容性试验中的可挥发性化合物的检测,以更好地控制药品质量。
