桦褐孔菌菌丝体多糖提取工艺优化及其降血糖能力测定
2023-10-16陈盛宇张淑梅王玉霞田缘马俊秀胡基华潘钰韩增华
陈盛宇,张淑梅,王玉霞,田缘,马俊秀,胡基华,潘钰,韩增华
(黑龙江省科学院微生物研究所,黑龙江哈尔滨 150010)
桦褐孔菌(Inonotus obliquus)又称桦树茸、桦树菇等,主要分布于北半球的寒带地区,是一种的食药用菌。桦褐孔菌富含多糖和三萜类等活性成分,大量研究表明,桦褐孔菌多糖具有抗氧化[1]、降血糖[2]、抗炎[3]、抗疲劳[4]和抗癌[5]等功效。但是野生桦褐孔菌资源日益稀少,难以满足现阶段的研究和开发。有文献表明,桦褐孔菌发酵菌丝体多糖的含量和生物活性可媲美野生桦褐孔菌[6-7]。
桦褐孔菌多糖的提取方式有溶液浸提法[8]、微波辅助提取法[9]、超声波辅助提取法[10]、高压脉冲辅助提取法[11]、闪式提取法[12]和酶提取法[13]等,微波辅助提取法、超声波辅助提取法、高压脉冲辅助提取法、闪式提取法和酶提取法等方法存在设备要求高、成本高、难以规模化提取等问题[14],酸提取和碱提取会对多糖结构造成不可逆的影响,热水浸提法具有操作简单且安全、成本低、无污染、条件温和等优势,可进行大规模提取,适用于产业化生产。目前,对于桦褐孔菌的研究主要集中在野生资源活性成分的提取和作用功效以及液体发酵培养基优化等方面[15-18],而对提取工艺和活性研究的相关报道较少。Ⅱ型糖尿病主要症状为高血糖,是小肠黏膜细胞的α-葡萄糖苷酶和α-淀粉酶催化碳水化合物水解为易吸收的单糖所引起的[19],市面上的降糖药物主要通过竞争性抑制α-葡萄糖苷酶或α-淀粉酶的活性达到降血糖的目的,但长期服用可引起不良副作用,如胃肠道不适、乳酸酸中毒、腿部或脚踝肿胀等毒副作用[20-21]。本研究采用热水浸提法提取桦褐孔菌菌丝体多糖,对其提取工艺进行优化,并对体外降血糖活性进行评价,旨在为桦褐孔菌菌丝体多糖的深入研究和综合开发提供参考。
1 材料与方法
1.1 材料与试剂
桦褐孔菌发酵菌丝体(干品):黑龙江省科学院微生物研究所药物中心。
4-硝基苯基-β-D-吡喃葡糖糖苷(4-nitrophenyl β-D-glucopyranoside,PNPG)(纯度为99%)、α-淀粉酶(14 U/mg)、阿卡波糖:上海源叶生物科技有限公司;α-葡萄糖苷酶(≥10 U/mg):美国Sigma 公司;重蒸酚、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、可溶性淀粉:北京索莱宝科技有限公司;浓硫酸:天津市科密欧化学试剂有限公司;以上试剂均为分析纯。
1.2 主要仪器设备
高速冷冻离心机(3K15):德国Sigma 公司;恒温水浴锅(PURA):优莱博技术有限公司;酶标仪(INFINITE 200 PRO):瑞士帝肯公司;冷冻干燥机(FDU-200):东京理化器械株式会社;电热恒温鼓风干燥箱(DHG-9245):苏州江东精密仪器有限公司;旋转蒸发器(RE-52):上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 多糖提取
桦褐孔菌发酵菌丝体干燥后粉碎,过120 目标准筛,精确称取适量样品,按一定液料比加入蒸馏水,置于水浴锅中加热提取,然后10 000 r/min 离心10 min,沉淀加入蒸馏水重复提取,合并后浓缩提取液,加入4倍体积的95%乙醇,4 ℃静置12 h,10 000 r/min 离心10 min,收集沉淀,无水乙醇清洗3 次,冷冻干燥即得桦褐孔菌菌丝体粗多糖。
1.3.2 多糖提取率测定
总多糖采用苯酚-硫酸法[22]测定,绘制葡萄糖标准曲线,曲线方程为y=10.448x+0.069 2,相关系数R2=0.994 8。还原糖测定采用DNS 法[23],标准曲线为y=0.729 6x+0.031 9,相关系数R2=0.997 7。精确称取干燥和过筛后菌丝体粉末1.000 g,采用1.3.1 的方法提取多糖,粗多糖样品用50 mL 容量瓶定容,分别测定总多糖和还原糖含量,以公式(1)计算多糖提取率(W,%)。
式中:C1为回归方程计算出的稀释后总多糖浓度,mg/mL;C2为回归方程计算出的稀释后还原糖浓度,mg/mL;N为稀释倍数;V为粗多糖样品复溶后体积,mL;W为桦褐孔菌菌丝体多糖提取率,%;M为称量原料的质量,g。
1.3.3 单因素试验
1.3.3.1 提取次数对多糖提取率的影响
称取1.000 g 菌丝体粉末,固定试验条件为80 ℃、液料比40 ∶1(mL/g),提取时间2 h,考察提取次数(1、2、3、4)对多糖提取率的影响,每个处理3 次重复。
1.3.3.2 提取温度对多糖提取率的影响
称取1.000 g 菌丝体粉末,固定液料比40 ∶1(mL/g)加入蒸馏水,提取时间2 h,提取3 次,考察不同提取温度(60、70、80、90、100 ℃)对多糖提取率的影响,每个处理3 次重复。
1.3.3.3 液料比对多糖提取率的影响
称取1.000 g 菌丝体粉末,按上述试验确定的最佳提取温度,固定提取时间2 h,提取3 次,考察不同液料比[20 ∶1、30 ∶1、40 ∶1、50 ∶1、60 ∶1(mL/g)]对多糖提取率的影响,每个处理重复3 次。
1.3.3.4 提取时间对多糖提取率的影响
称取1.000 g 菌丝体粉末,按上述试验确定的最佳提取温度和液料比,考察不同提取时间(1.0、1.5、2.0、2.5、3.0 h)对多糖提取率的影响,每个处理重复3 次。
1.3.4 响应面优化
在单因素的基础上,提取温度、液料比和提取时间作为考察的因素,利用Design-Expert V12.0.1 软件进行三因素三水平Box-Behnken 试验设计,优化桦褐孔菌菌丝体多糖的提取工艺。试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface tests
1.3.5 酶活性试验
1.3.5.1 多糖对α-葡萄糖苷酶抑制活性的影响
参照Ren 等[24]的方法,略作修改。多糖、阿卡波糖、α-葡萄糖苷酶和PNPG 溶液均用0.1 mol/L,pH6.8的磷酸缓冲盐溶液(phosphate buffered saline,PBS)配制,优化条件下提取的多糖浓度为1、2、4、6、8、10 mg/mL,以阿卡波糖作为阳性对照。取40 μL 的样品,加入到96 孔板中,然后加入40 μL 1 U/mL 的α-葡萄糖苷酶液混匀,于37 ℃水浴15 min,再加入20 μL的7.5 mmol/L PNPG 溶液37 ℃水浴30 min,最后加入100 μL 0.2 mol/L Na2CO3溶液结束反应,于405 nm 波长测OD 值(A0),每组3 个平行。样品对照组中,以40 μL的PBS 代替样品组酶液测其OD 值(A1);在空白组中,以40 μL 的PBS 代替样品溶液测其OD 值(A2),按照公式(2)计算α-葡萄糖苷酶抑制率(Y1,%)。
2012年,胜利油田“四化”工作开始标准化采购,并于2014年在全油田推开。实施标准化采购以来,油田物资采购模式发生积极转变,不仅质量管控更有效,采购流程更顺畅,而且采购资金降幅也更大,为油田降低成本4亿多元。油田物资标准化采购比例大幅提高,物资采购实现了从“传统采购”到“定制采购”变革。
1.3.5.2 多糖对α-淀粉酶抑制活性的影响
参照汤陈鹏等[25]、王鑫等[26]的方法,略作修改。多糖、阿卡波糖、α-淀粉酶和淀粉溶液均用0.1 mol/L,pH6.8 的PBS 配制,优化条件下提取的多糖浓度为1、2、4、6、8、10 mg/mL,以阿卡波糖作为阳性对照。向各试管中分别加入300 μL 不同质量浓度的多糖和阿卡波糖溶液及300 μL 1 U/mL 的α-淀粉酶溶液,混合均匀,于37 ℃下水浴15 min,再分别加入300 μL 质量分数1%的淀粉溶液水浴15 min,最后加入500 μL DNS 试剂显色,并立即沸水浴10 min 终止反应;加入10 mL蒸馏水稀释并混匀,于540 nm 波长处测定其吸光度A0。以等体积PBS 代替α-淀粉酶溶液,测定其吸光度A1;以等体积PBS 代替样品溶液,测定其吸光度A2,按公式(3)计算α-淀粉酶抑制率(Y2,%)。
1.4 数据分析
试验重复3 次,数据采用平均值±标准差表示,通过SPSS 17 进行统计分析,用Origin 22 进行绘图,Design-Expert V12.0.1 进行响应面设计,Graphpad prism 8.0.1 进行半抑制浓度(half maximal inhibitory concentration,IC50)的计算。
2 结果与分析
2.1 单因素试验分析
各单因素对多糖提取率的影响见图1~图4。

图1 提取次数对多糖提取率的影响Fig.1 Effect of extraction times on the yield of polysaccharides

图2 提取温度对多糖提取率的影响Fig.2 Effect of extraction temperature on the yield of polysaccharides

图3 液料比对多糖提取率的影响Fig.3 Effect of liquid-to-solid ratio on the yield of polysaccharides

图4 提取时间对多糖提取率的影响Fig.4 Effect of extraction time on the yield of polysaccharides
由图1 可知,提取次数达到第3 次时,多糖提取率为(6.70±0.43)%,多糖提取率增长趋于平缓,考虑到耗时和耗能问题,后续试验提取次数固定为3 次。
由图2 可知,提取温度在60~90 ℃时,多糖提取率与提取温度呈正相关关系。提取温度为90 ℃时,多糖提取率达到最大值,为(7.43±0.03)%,继续升高提取温度后多糖提取率略有下降,原因是高温对多糖分子结构具有降解作用,导致多糖含量减少,或高温溶解了其他水溶性物质,提高溶液的黏稠度从而阻碍多糖的溶出[27]。
由图3 可知,液料比为20 ∶1~50 ∶1(mL/g)时,多糖提取率与溶剂的加入量呈正相关关系,在50 ∶1(mL/g)时达到峰值,多糖提取率为(7.93±0.26)%。当提取溶剂较少时,多糖无法充分溶解,造成提取率较低。当溶剂增多时,加快了多糖的扩散速度,多糖不断从细胞溶出。达到峰值后再增加溶剂,导致浓缩时间延长,增加了多糖降解几率[28]。
2.2 响应面优化试验结果
响应面试验设计及结果表2,回归模型方差分析见表3。

表2 响应面试验设计及结果Table 2 Design and results of response surface test
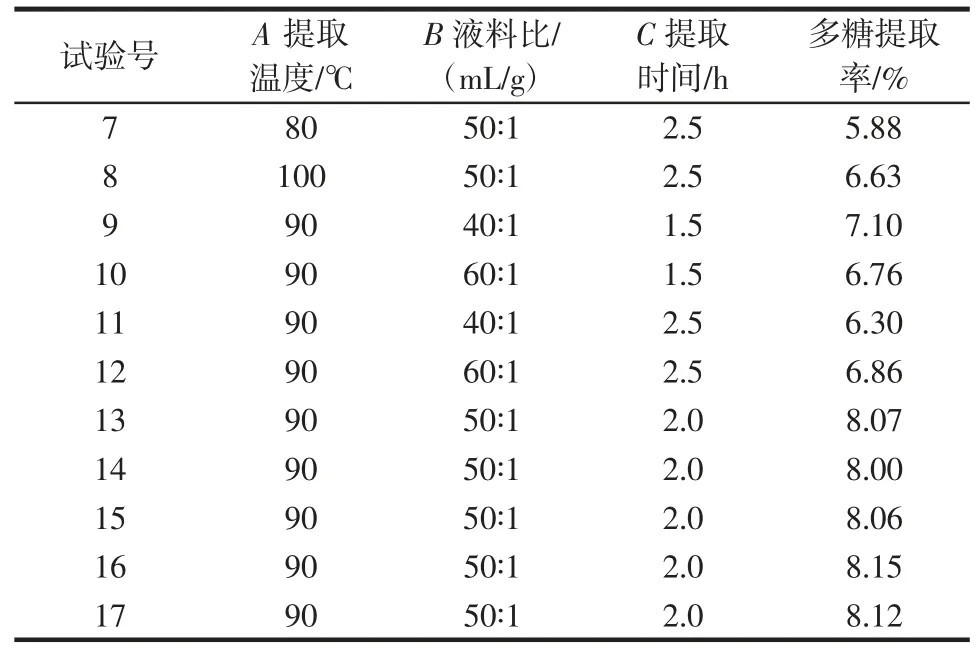
续表2 响应面试验设计及结果Continue table 2 Design and results of response surface test
根据Design-Expert V12.0.1 软件设计响应面优化试验,进行响应面二次回归拟合分析,得到回归方程:多糖提取率=8.08+0.50A+0.076B-0.24C+0.042AB-0.13AC+0.23BC-0.53A2-0.33B2-0.99C2。
由表3 可知,模型P<0.000 1,说明具有显著性;失拟项的P值是0.117 8>0.05,即不显著;线性相关系数R2=0.994 4,表明该模型与实际试验情况拟合度较好;调整决定系数R2=0.987 3 与预测决定系数R2=0.932 1的差值不大于0.2,信噪比为32.579,表明回归模型合理,具有较高的可信度和准确度,可用于桦褐孔菌菌丝体多糖提取率的预测和分析。由表3 可知,A和C影响极显著(P<0.01),B影响差异显著(P<0.05);A2,B2,C2对多糖的提取率的影响均极显著(P<0.01);AC影响显著(P<0.05),BC影响极显著(P<0.01),AB不显著;通过F值可知,各因素对提取率的影响顺序为A(提取温度)>C(提取时间)>B(液料比)。

表3 回归模型方差分析Table 3 ANOVA of the regression model
各因素交互作用的响应面见图5 和图6。
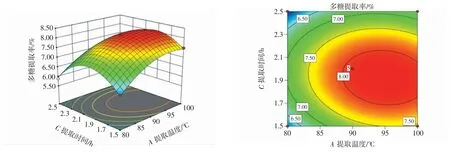
图5 提取时间与提取温度之间交互作用对多糖提取率的影响Fig.5 Effect of interaction between extraction time and extraction temperature on the yield of polysaccharides

图6 提取时间与液料比之间交互作用对多糖提取率的影响Fig.6 Effect of interaction between extraction time and liquid-to-solid ratio on the yield of polysaccharides
在各因素交互作用的3D 曲面和等高线中,曲面图的陡峭程度、等高线的线椭圆分布致密程度与显著性成正相关关系[31]。由图5 可知,提取温度与提取时间的曲面图陡峭,坡度大,等高线呈现明显的椭圆形,说明对多糖的提取率的影响较大。由图6 可知,液料比与提取时间的曲面图最陡峭,坡度大,等高线呈现明显的椭圆形,说明对多糖的提取率的影响较大。
通过Design-Expert V12.0.1 软件分析可知,提取工艺的最佳条件为提取温度97.599 ℃、液料比51.439 ∶1(mL/g)、提取时间1.903 h,提取3 次,在此条件下提取率为8.188%。结合实际情况,选择提取温度97 ℃、液料比51 ∶1(mL/g)、提取时间1.9 h、提取3 次,进行3 次平行试验,最终得到多糖提取率为(8.02±0.45)%,与预测值仅相差0.168%,说明响应面得到的结论可信度和准确度较高。
2.3 多糖对α-淀粉酶和α-葡萄糖苷酶抑制活性的影响
α-淀粉酶和α-葡萄糖酶抑制剂通过抑制糖原、淀粉等物质形成葡萄糖的过程,从而降低餐后血糖水平[32],这两种酶是调节血液中葡萄糖含量的关键因子,
因而受到了广泛的关注。阿卡波糖作为典型的α-葡萄糖抑制剂,本试验以阿卡波糖作为阳性对照。
桦褐孔菌菌丝体多糖对α-葡萄糖苷酶活性和α-淀粉酶的抑制作用分别见图7 和图8。

图7 桦褐孔菌菌丝体多糖对α-葡萄糖苷酶活性的抑制作用Fig.7 Inhibitory effect of extracted polysaccharides on αglucosidase activity by polysaccharides from mycelia of Inonotus obliquus

图8 桦褐孔菌菌丝体多糖对α-淀粉酶活性的抑制作用Fig.8 Inhibitory effect of extracted polysaccharides on αamylase activity by polysaccharides from mycelia of Inonotus obliquus
由图7 和图8 可知,热水浸提法在最优条件下提取到的桦褐孔菌菌丝体多糖对α-淀粉酶和α-葡萄糖苷酶的活性均具有抑制作用,多糖浓度与抑制率呈正相关,即剂量依赖性,说明桦褐孔菌菌丝体多糖具有降血糖活性。相比于α-淀粉酶,α-葡萄糖苷酶的抑制作用更为明显。在多糖浓度10 mg/mL 时,α-葡萄糖苷酶抑制率为(77.64±1.78)%,而此时α-淀粉酶为(39.20±1.17)%。α-淀粉酶和α-葡萄糖苷酶的半抑制浓度IC50值分别为17.20、3.07 mg/mL,对应的阿卡波糖的IC50值为0.011 26、0.001 023 mg/mL,与阿卡波糖相比,抑制效果存在一定差距。
3 讨论
通过人工栽培驯化获取桦褐孔菌子实体,目前技术尚未成熟,液体发酵是目前获取菌丝体的有效途径之一,具有周期短、可控和成本低等优势,灵芝等珍稀真菌的液体发酵研究已相当成熟[33],而桦褐孔菌液体发酵研究起步较晚、发展较慢。响应面法是一种有效获取最佳工艺参数的统计学方法,是目前获取真菌多糖最佳提取工艺的重要手段。本试验桦褐孔菌菌丝体多糖提取率的研究结果,与於雨碟等[34]、纪欣童等[35]、张瑞等[23]的研究结果存在一定的差异,可能是试验材料、条件和方法等因素的差异性所引起的。本试验通过热水浸提法提取桦褐孔菌菌丝体多糖,并对其提取工艺进行了优化。通过F值分析可知,提取温度对多糖提取率的影响最显著,其次是提取时间,最后是液料比,这与朱杰等[36]、杨娟等[37]、郝金斌等[29]提取其他多糖影响因素的大小相似,说明提取过程中,提取温度的控制尤为关键,在提高提取率的同时也要避免多糖的降解。体外酶活性试验表明,桦褐孔菌菌丝体多糖在1~10 mg/mL 浓度范围内对α-淀粉酶和α-葡萄糖苷酶均有抑制作用,呈剂量依赖性关系。桦褐孔菌菌丝体多糖作为一种具有潜力的降血糖资源,后续可进一步对其作用机制和功效作用进行深入研究,本研究为桦褐孔菌菌丝体多糖在食品、药品等领域的综合开发利用提供一定的理论参考。
4 结论
采用热水浸提法提取桦褐孔菌菌丝体多糖,以单因素试验筛选和响应面设计相结合对提取工艺进行优化,结果表明最佳提取条件为提取温度97 ℃、液料比51 ∶1(mL/g)、提取时间1.9 h、提取3 次,在此条件下提取率为(8.02±0.45)%。桦褐孔菌菌丝体多糖对α-淀粉酶和α-葡萄糖苷酶具有良好的抑制作用,IC50值分别为17.20、3.07 mg/mL,初步判断桦褐孔菌菌丝体多糖具有体外降血糖活性,为今后桦褐孔菌菌丝体多糖在食药领域的深入研究和综合开发提供参考。
