晚期食管癌PD-1/PD-L1免疫检查点抑制剂疗法的Cochrane Meta分析
2023-10-13许雨柔邹宜丰蔡宁范佳慧陈兴栋索晨
许雨柔 邹宜丰 蔡宁 范佳慧 陈兴栋 索晨△
(1复旦大学公共卫生学院流行病学系 上海 200032; 2复旦大学公共卫生安全教育部重点实验室 上海 200032;3复旦大学人类表型组研究院遗传工程国家重点实验室 上海 200438; 4复旦大学泰州健康科学研究院 泰州 225300;5复旦大学义乌研究院 义乌 322000)
食管癌(esophageal cancer,EC)是常见的消化道恶性肿瘤之一,其全球发病率具有广泛的地理差异,中国处于“食管癌带”的高发病率地区[1]。根据GOLOBOCAN估计的全球癌症发病率和死亡率,2020年食管癌的发病率为604 127例,为第八高发的恶性癌症;死亡544 076例,在癌症死亡率中排第六[2]。食管癌分为两种主要的亚型:食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC)。目前,食管癌的治疗主要包括内窥镜治疗、手术、放疗和化疗,但总体预后并不乐观[3]。近几年,随着生物免疫治疗的发展,免疫检查点抑制剂在黑色素瘤、非小细胞肺癌及肾癌等实体瘤的治疗取得了突破性进展,肿瘤的免疫治疗进入了新时代[4]。这些免疫检查点抑制剂也尝试用于食管癌,针对食管癌的免疫治疗研究初显成效[5]。目前,免疫检查点抑制剂以程序性细胞死亡蛋白-1[6](programmed death-1,PD-1/PD-L1)抑制剂和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抑制剂为主[7],但有关疗效的系统评价较少,其安全性和毒性仍存在质疑。本研究旨在评价现有PD-1/PD-L1免疫检查点抑制剂疗法对接受手术、放疗或化疗的食管癌患者的疗效和毒性,比较不同的治疗策略的疗效及安全性,为临床医师和肿瘤学研究者提供全面的循证指南,为相关的临床研究、临床治疗过程中药物选择提供参考。
资料和方法
资料选择
研究类型 随机对照试验(randomized controlled trials,RCTs),处于Ⅱ期或Ⅲ期的双臂临床试验。
研究对象 诊断为组织学或细胞学的晚期食管癌、先前接受过手术、化疗、放疗等传统治疗的成人患者。
干预类型 对照组采用常规化疗方案治疗;试验组在对照组干预措施基础上加用或直接使用免疫检查点抑制剂免疫治疗。
结局指标 主要结局指标:总体生存率(overall survival,OS);次要结局指标:无进展生存期(progression-free survival,PFS)、总体疗效评价、与免疫相关的反应、与治疗相关的不良反应(treatment-related adverse events,TRAEs)。
文献检索策略计算机检索Embase、PubMed、CENTRAL及其他来源检索库,查询食管癌免疫疗法的相关研究,主要包括免疫检查点抑制剂治疗,包括会议论文及学位论文,语种不限,检索时限为建库至2022年11月20日。检索词包括食管癌的相关词汇(esophageal neoplasms,esophageal cancer,esophageal carcinoma,esophagus cancer,esophagus carcinoma)、免疫疗法(chemical therapy,chemotherapy,chemotherapeutic,chemotherapy combined,immune therapy,immunization therapy,immunotherapy,PD-1 inhibitors,PD-L1 inhibitors)以及研究类型(clinical trials, randomized controlled trials,RCTs)。本研究在Cochrane Library的注册号:501519050617405596。
文献筛选与资料提取利用NoteExpress文献管理软件筛选文献、提取资料并进行核对,排除标准:(1)只有摘要而无正文的文献;(2)无法提供所需数据的文献;(3)书籍、信件、专家意见、病例报告、动物试验相关文献。尽量与原作者联系补充缺乏的资料,制定并填写数据提取表。提取内容包括第一作者姓名、发表日期、研究类型、研究对象年龄及性别、肿瘤分期、化疗方案、免疫细胞剂量及结局指标等信息。
文献质量评价纳入的RCTs研究参考Cochrane协作网对偏倚风险评价条目[8]的设定,独立评估每项研究的偏倚风险:使用随机数字表、计算机随机、抛硬币、洗扑克或信封、抽签、掷骰子时给1分;中心化分配、同一外观、连续编号的药物容器、不透明的信封给药给1分;采用盲法给1分;没有丢失结局数据、采用倾向性分析给1分;无选择性结局报告给1分;研究表现出没有其他偏倚来源给1分;根据每项评分得出总得分。
统计学分析采用RevMan5.4软件进行Meta分析。纳入研究结果间的异质性采用χ2检验(检验水准α=0.10)。若各研究间无统计学异质性(P>0.10,I2<50%),采用固定效应模型进行分析;若各研究间存在统计学异质性(P<0.10,I2>50%),则采用随机效应模型进行分析,或采用亚组分析与敏感性分析处理、解释其异质性来源。采用危险比(hazard ratio,HR)和95%CI评估RCTs的OS和PFS,客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)和与治疗相关的不良事件用风险比(risk ratio,RR)及其95%CI来评估。采用Stata16.0进行Egger检验、Begg检验,以评估研究的发表偏倚。
结 果
文献筛选结果初步检索相关文献329篇,其中检索数据库及检索文献数具体如下:Embase(n=108)、PubMed(n=58)、CENTRAL(n=176)以及其他检索库(n=15)。通过NoteExpress文献管理软件删重98篇,通过阅读标题摘要和关键词排除无关文献、非临床试验及已注册的protocol文献155篇,对剩余的98篇文献进行全文阅读,筛除85篇(包含27篇综述报告,7篇重复临床试验,37篇论文摘要,8篇病理讨论,以及6篇非单一干预)的文献。对符合标准的13篇文献进行深入阅读,最终纳入10篇文献[7-16],包含6 497个实验对象。纳入文献的研究主要为免疫检查点抑制剂的相关临床试验,包括帕勃利珠单抗(Pembrolizumab)、纳武单抗(Nivolumab)、卡瑞利珠单抗(Camrelizumab)、特瑞普利单抗(Toripalimab)等。具体筛选过程见图1。
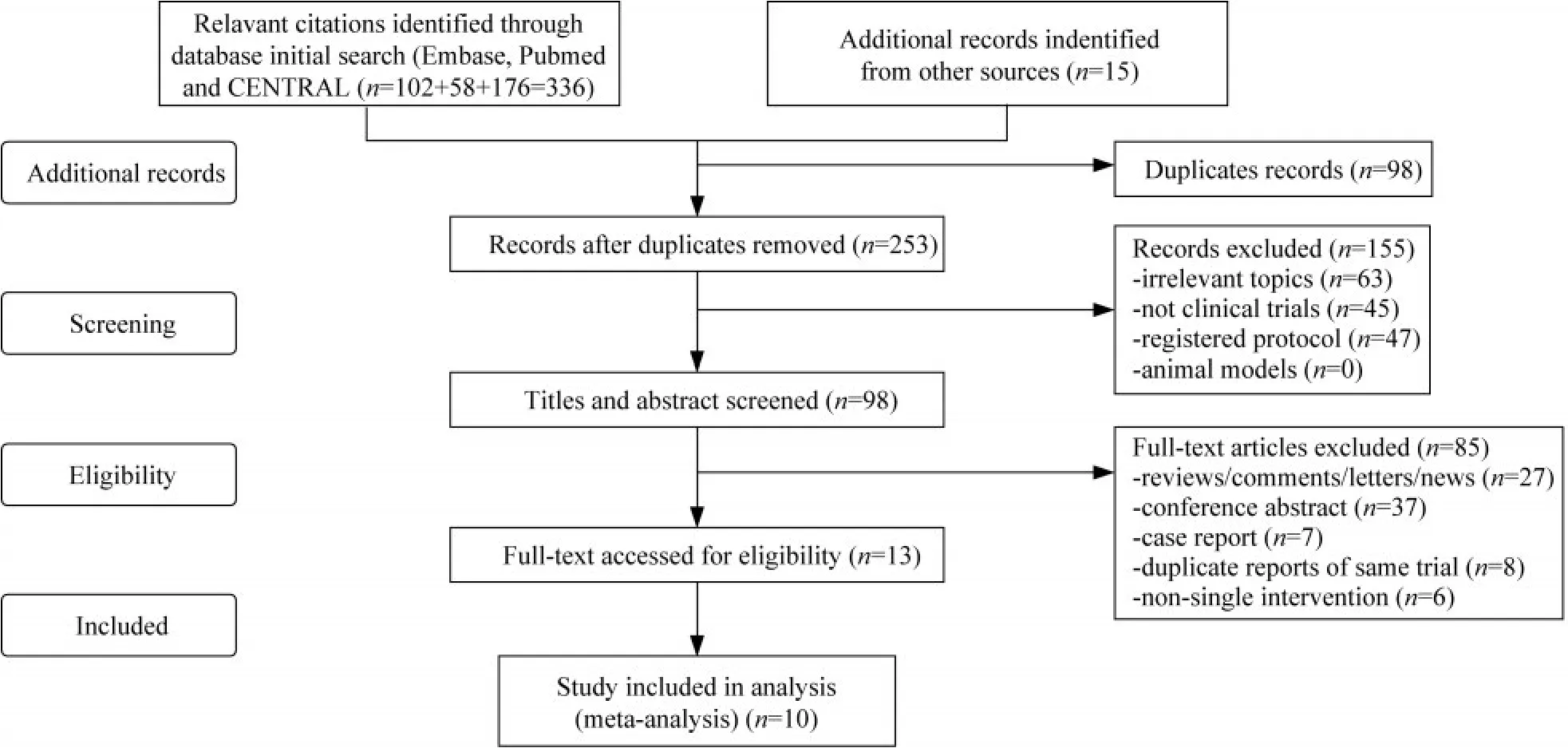
图1 纳入文献筛选流程图Fig 1 Flow chart of the study identification process
纳入文献的基本特征和风险偏倚评估结果纳入研究的基本特征见表1,10篇文献中的RCTs研究共包含受试对象6 497人。RCTs研究的风险偏倚由RevMan5.4进行评估,本次Meta分析中包含的10项研究在随机序列生成以及对受试者及研究人员的盲法使用方面均为低风险,1项研究在对结果评估的盲法使用风险较高,1项研究未报告完整的结局数据。总体来说,纳入的研究质量评估的风险偏低(图2)。
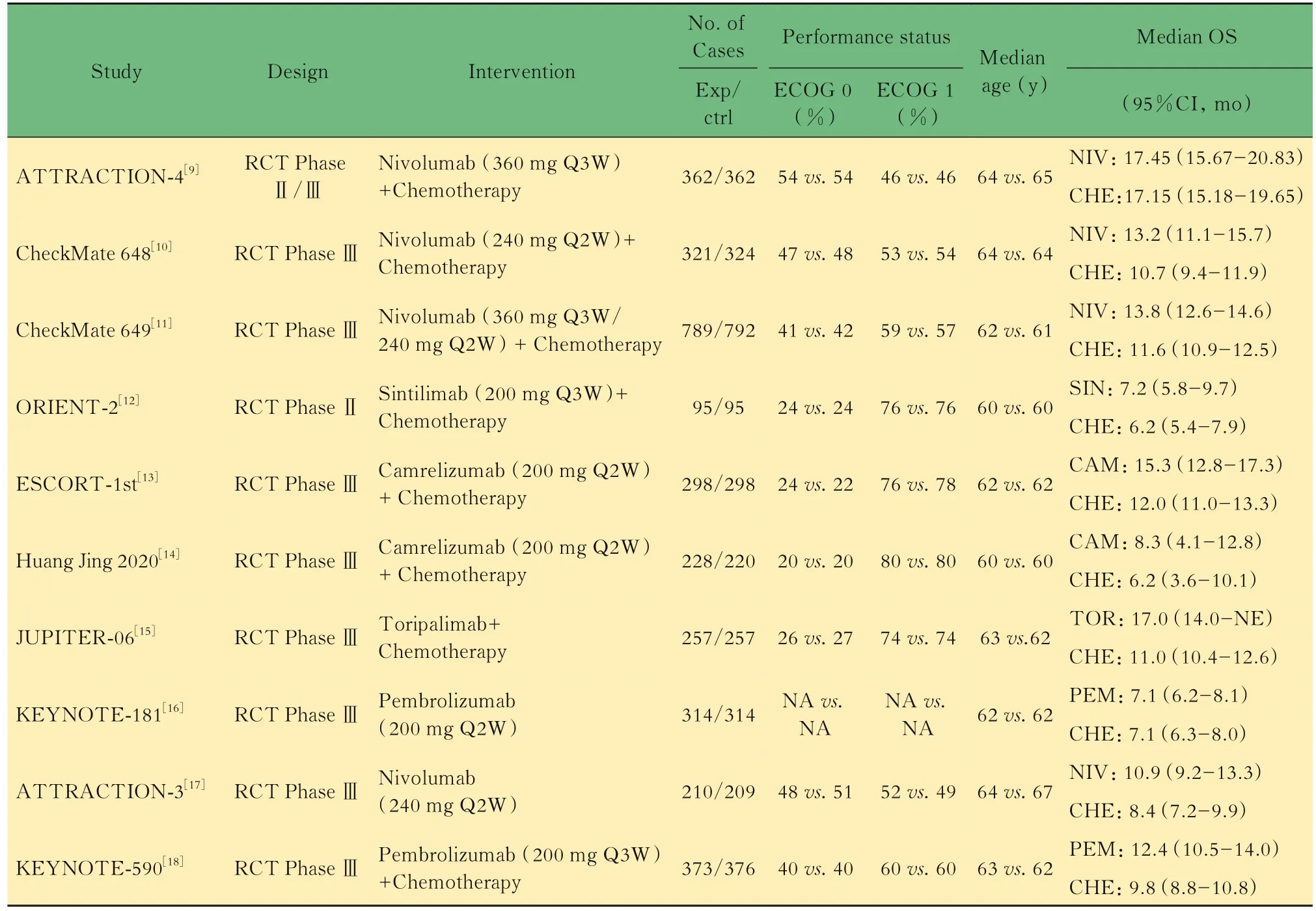
表1 纳入文献研究的一般特征Tab 1 Basic characteristics of the eligible studies
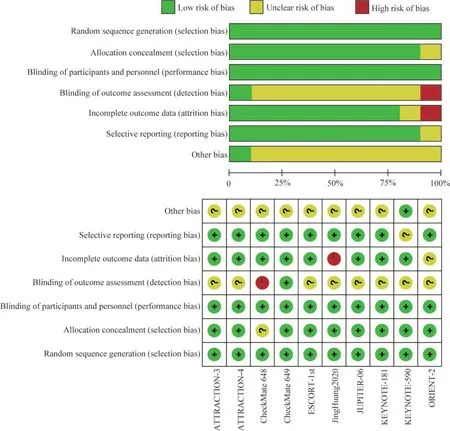
图2 由RevMan评估的纳入RCT研究的风险偏倚图Fig 2 Risk of bias graphed by RevMan to review authors' judgements about each risk of bias item presented as percentages across all included studies
Meta分析结果
总体生存率 总体生存率(overall survival,OS)的数据来自10篇文献[7-16]的研究,各研究间的OS异质性低(I2<50%),采用固定效应模型。用HR作为效应指标,Meta分析结果显示,免疫干预组的OS优于对照组,即接受PD-1/PD-L1免疫检查点抑剂处理组的患者死亡风险明显低于接受传统手术、放化疗的晚期食管癌患者,且差异有统计学意义(HR=0.75,95%CI:0.71~0.80,P<0.000 1;H:I2=48%,P=0.05)(图3)。对不同因素进行亚组分析的结果如图4所示,在性别、种族、PD-L1表达、癌症的组织学特征以及有无远处转移、有无吸烟亚组间的OS均有显著差异(P<0.05);男性、亚洲人群、有远转移、组织学特征为鳞癌以及目前吸烟的患者中,免疫疗法的OS更高;PD-L1肿瘤阳性评分(tumor proportion score,TPS)≥1%的患者OS优于TPS<1%的患者(HR:0.66vs.0.85,P组内<0.001),同样的优势在TPS≥10%及CPS≥10%亚组内也能观察到。在不同类型的免疫抑制剂疗法中,相对于传统化疗疗法,Toripalimab显示出最佳的OS优势,其次是Sintilimab和Camrelizumab,但其亚组内差异无统计学意义(P亚组=0.061)。
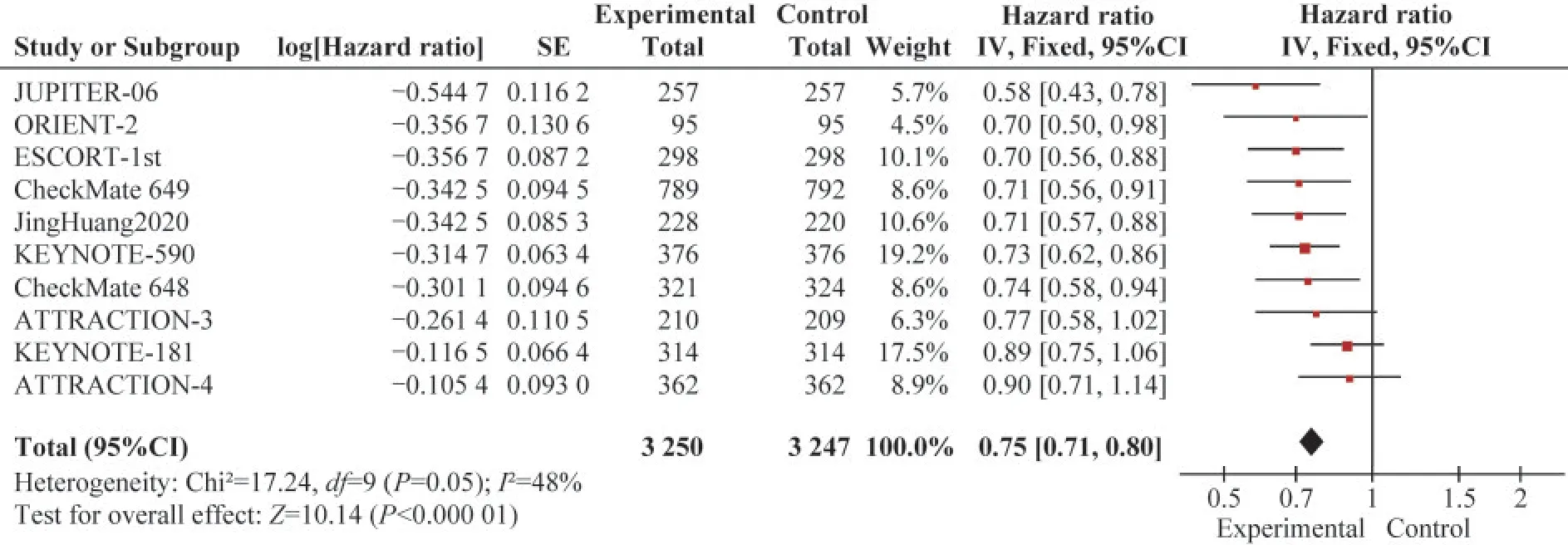
图3 总体生存率的Meta分析森林图Fig 3 Forest plot of comparison of overall survival intervention
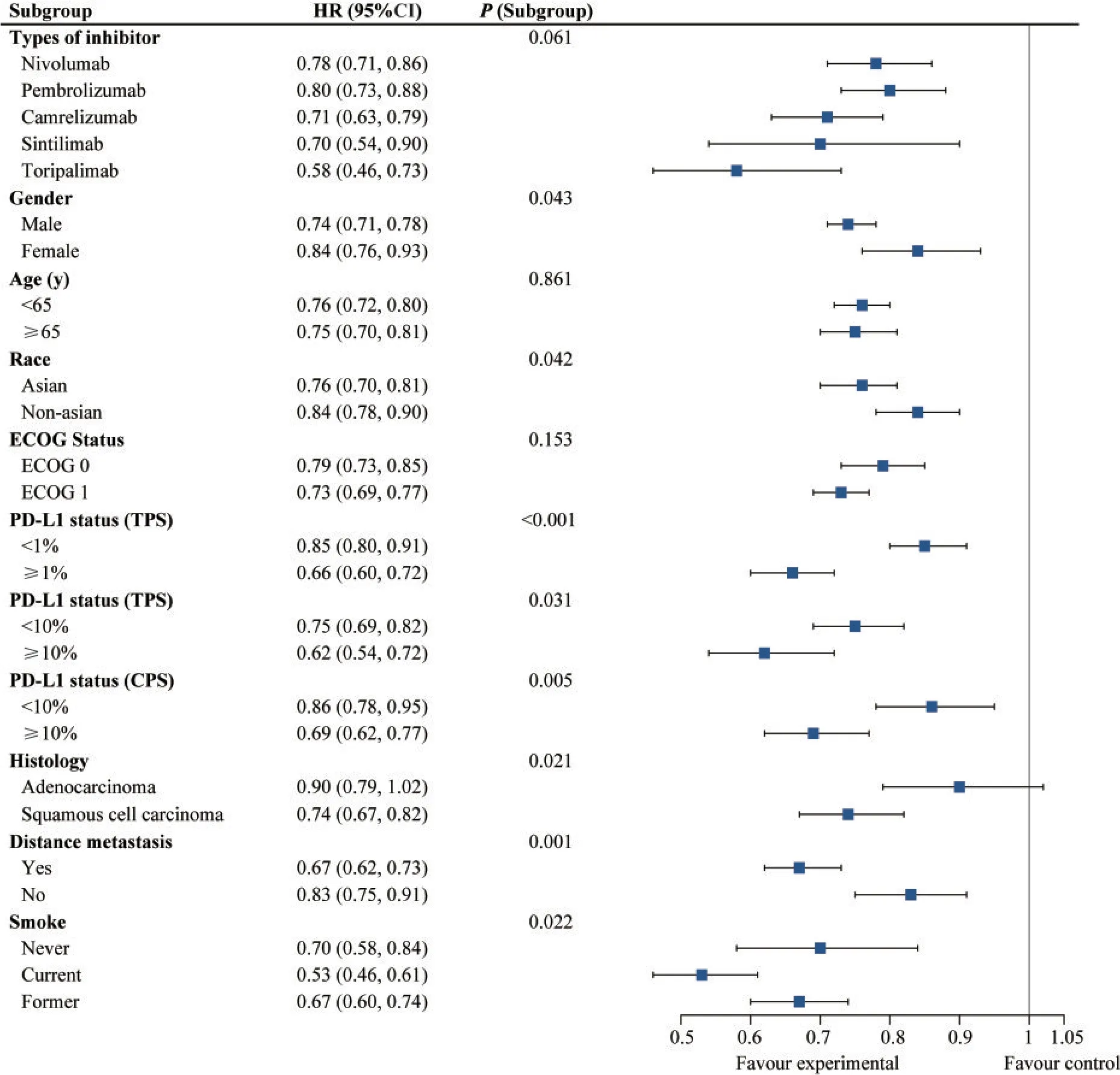
图4 总体生存率的亚组分析Fig 4 Subgroups analysis of overall survival
无进展生存期 PFS的数据来自10篇文献[7-16]的研究结果,各研究间的PFS异质性较高(I2>50%,P<0.001),因此采用随机效应模型。采用HR作为效应指标,Meta分析结果显示,免疫抑制剂治疗组的患者总体PFS显著优于对照组,说明免疫治疗组食管癌病情恶化风险低于对照组(HR=0.77,95%CI:0.66~0.90,P=0.000 8; H:I2=90%,P<0.001)(图5)。
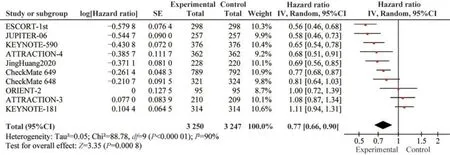
图5 无进展生存期的森林图Fig 5 Forest plot of comparison of progression-free survival intervention
总体疗效评价 总体疗效由ORR和DCR来评价,分别纳入8个研究[9,11-13,15-18]和5个研究[7,10-13]的数据。采用RR作为效应指标,Meta分析结果显示,免疫治疗组的患者ORR高于对照组,差异有统计学意义(RR=1.28,95%CI:1.16~1.40,P<0.000 1;H:I2=49%,P=0.06)(图6A),各研究间异质性较低,采用固定效应模型;免疫治疗组的患者DCR高于对照组,且纳入研究的异质性低,差异有统计学意义(RR=1.07,95%CI:1.02~1.12,P=0.003;H:I2=28%,P=0.24)(图6B)。
安全性比较 安全性分析结果如表2所示,在TRAEs比较中,对于任何级别的不良反应(RR=0.97,95%CI:0.96~0.99,P<0.001)和≥3级的不良反应(OR=0.98,95%CI:0.94~1.02,P=0.22)发生率,免疫抑制剂疗法组均低于对照组,仅前者差异有统计学意义;然而,相比于传统疗法,免疫疗法组患者发生严重不良反应(RR=1.67,95%CI:1.51~1.86,P<0.001)、因不良反应引起治疗中止(RR=1.09,95%CI:1.00~1.19,P=0.049)的可能性更高;在与不良反应相关的死亡风险中,两组差异无统计学意义。与对照组相比,免疫疗法组发生免疫相关的不良反应发生风险较高(RR=2.45,95%CI:2.16~2.78,P<0.001)。
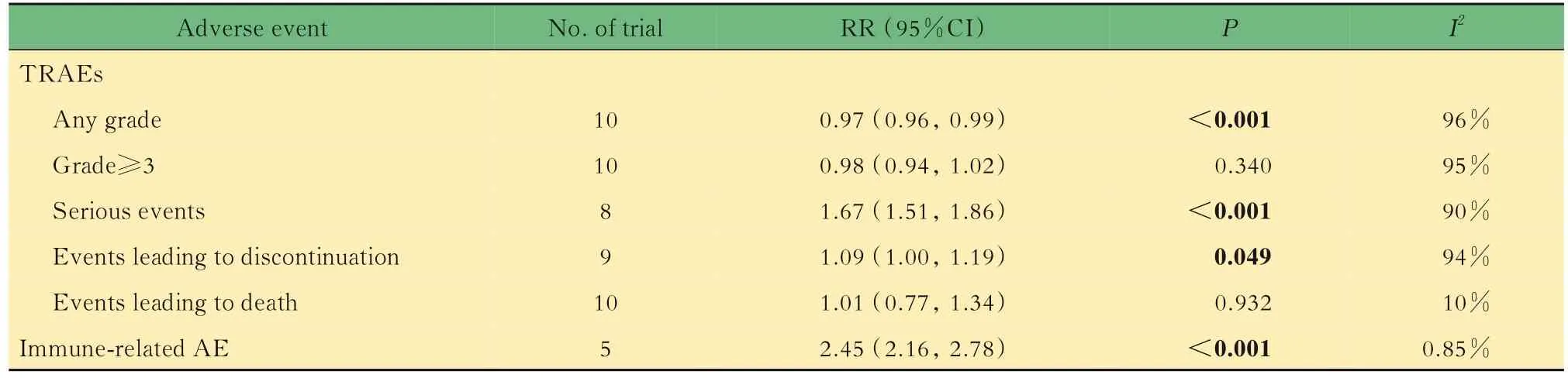
表2 与治疗及免疫相关的不良反应的Meta分析结果Tab 2 Results of Meta-analysis of treatment-related and immune-related adverse events
敏感性分析和发表偏倚分析 在总体疗效分析中,逐个剔除研究后,发现剔除Keynote-181研究后,疾病控制率的异质性(I2)从67%下降为0,提示该研究结果为敏感性来源,因此在DCR的分析中不纳入该研究的结果。总体生存分析和安全性评价中,逐个剔除研究后,结果未发生逆转且变化小,提示Meta分析结果稳健,敏感性较小。绘制报道PFS、ORR以及TRAEs的文献发表偏倚漏斗图,显示对称性欠佳,考虑与样本纳入量较少有关。进一步进行Begg检验和Egger检验,结果显示,对于OS以及PFS,Egger检验结果分别为P=0.762及P=0.013,提示PFS的分析结果受发表偏倚影响可能性较高;对于总体疗效以及安全性比较,Begg检验结果提示分析结果受发表偏倚影响的可能性较小(表3)。
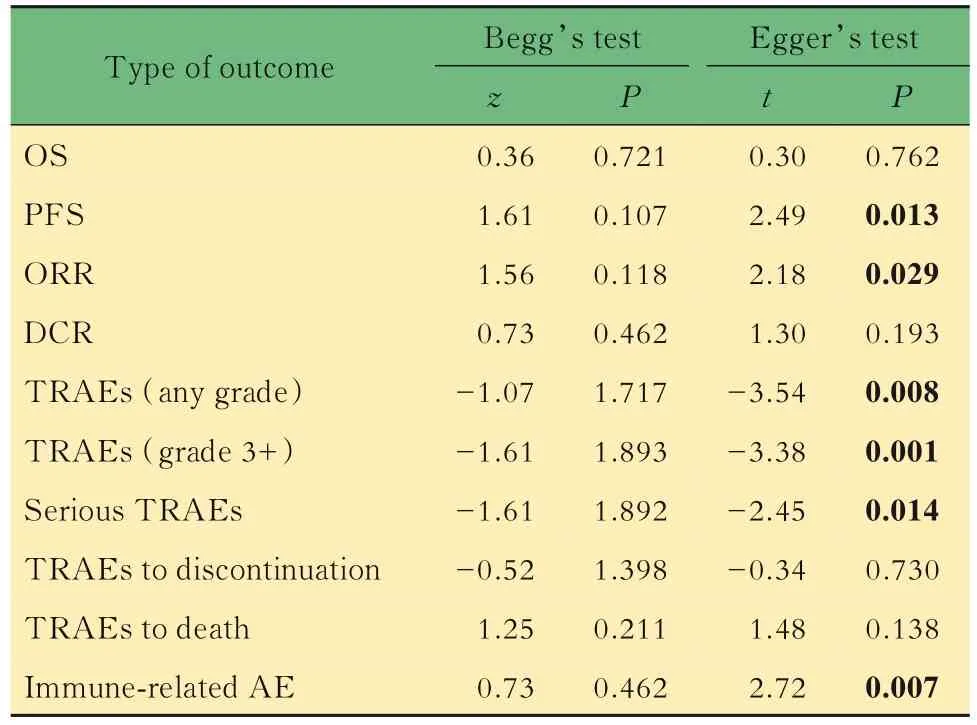
表3 Begg检验和Egger检验的P值Tab 3 P values of Begg’s and Egger's tests
讨 论
食管癌的发病因素众多,除了地域因素,还与患者年龄、性别、种族生活环境及饮食习惯有关[19]。多数患者早期无明显临床表现,部分患者首次就诊时已进展至中晚期[20]。手术、放疗和化疗是食管癌患者的常规治疗手段,但其效率不高,且有较大的毒性副反应,患者常因难以耐受痛苦而中断治疗,使得食管癌预后较差。相比而言,食管癌的免疫治疗安全性强,且疗效显著[21]。
本研究探讨的免疫检查点抑制剂是针对相应的免疫检查点研发的单抗类药物,可阻断表达免疫检查点的肿瘤细胞对免疫细胞的抑制作用[22]。纳入研究中的免疫检查点抑制剂主要包括PD-1/PDL1抑制剂,T细胞表面的PD-1与高表达在肿瘤细胞表面的PD-1配体(PD-L1或PD-L2)结合后可使PD-1通路持续激活,进而抑制T细胞对肿瘤细胞的杀伤作用,因此抑制PD-1通路可以阻断这一通路,恢复部分T细胞的功能,加强机体对肿瘤的自身免疫[23]。目前针对食管癌中PD-1/PD-L1通路开展的临床研究以PD-1抑制剂Pembrolizumab和Nivolumab为代表,近年来以国产新型PD-1单抗如Sintilimab[24]、Atezolizumab[25]等开展的临床研究也显示出了较好的疗效,可提高晚期食管癌患者的疾病控制率,改善患者的免疫功能和生活质量[26]。
尽管不同临床试验中,免疫检查点抑制剂对晚期食管癌患者的有效性和安全性有不同的结论,但本次Meta分析结果显示,通过对结果及统计量的合并,PD-1/PD-L1抑制剂的免疫检查点抑制剂疗法和/或联合放化疗,无论是一线治疗还是化疗后进展的二线治疗,均能有效提高食管癌的OS、PFS、ORR和DCR,且具有可管理的安全性。与国内外的研究相比,目前对于食管癌的免疫疗法Meta分析文献较少,在Wang等[27]的研究中,PD-1/PD-L1抑制剂疗法已显示在晚期食管/胃食管交界癌患者中具有一定的抗肿瘤疗效和可控的安全性,且PD-L1过表达且用了抑制剂的患者的ORR更高;Yang等[28]的研究也显示,以PD-1/PD-L1为靶点治疗晚期食管胃管癌患者延长了部分患者的生存期,但与单纯化疗相比,免疫疗法表现出更高的治疗毒性。本研究在一定程度上对食管鳞癌及腺癌患者免疫疗法的有效性和安全性的临床证据进行了补充和完善。
总体生存期的亚组分析结果表明,PD-1/PDL1抑制剂对总体生存期的显著改善在不同特征的患者中有差异。PD-L1的表达作为肿瘤免疫疗法的疗效生物标志物,是治疗预后及临床反应的较好预测指标[29],本研究显示,不论是根据TPS还是CPS作为亚组进行分析,PD-L1高表达的患者均表现出较高的总体生存期,与既往结果一致[5,28]。性别和年龄是已知与免疫反应疗效相关的因素[30],本研究发现男性食管癌患者接受免疫疗法后具有更高的OS,这与Fabio等[31]的研究结论相同,可能是由于性激素调节的差异,男性和女性对外来及自身抗原的免疫反应不同,且在先天性及适应性免疫反应方面表现出差异[30]。在免疫疗法的种族差异方面,本研究发现亚洲人相比于非亚洲人有更优的OS,Peng等[32]针对PD-1抑制剂的研究中也观察到了相同的结果,一种可能的解释是亚洲与非亚洲患者之间存在T细胞功能和病理特征的差异[33]。此外,肿瘤的组织学特征、有无远处转移以及患者的吸烟情况也在亚组分析中显示出差异,提示应根据不同患者的具体特征评估PD-1/PD-L1抑制剂疗法的疗效和预后。总体而言,PD-1/PD-L1抑制剂治疗的生存获益在本研究中得到进一步证实。
安全性评价中,免疫抑制剂在任何级别的TRAEs发生更少,但因治疗导致的严重不良反应、治疗中止以及与免疫相关的不良反应在免疫干预组中显示出更高的发生风险。许多研究表明,抗PD-1/抗PD-L1抗体的免疫相关不良事件是由于T细胞抑制的自我耐受性受损,不良反应一般可控,但在某些情况下也可能是致命的[34],因此在治疗过程中密切关注患者的不良反应十分重要。考虑到免疫治疗的安全性与样本量及患者个体耐受力差异等因素有关,需要纳入大样本的具体数据进行评估。通过漏斗图、Egger检验、Begg检验法对纳入文献的发表偏倚进行检测,结果表明无明显发表偏倚;敏感性分析表明,本次Meta分析的结果较为稳健。
本研究的优势在于纳入了国内外实施完善的RCTs,对晚期食管癌免疫抑制剂疗法的总体疗效及安全性进行了合并分析,并在亚组分析中考虑了患者的特征,如年龄、性别、吸烟史以及PD-L1表达等影响疗效的重要因素。本研究有一定的的局限性:(1)各研究中化疗方案不尽相同,可能会影响结果一致性;(2)仅纳入关于PD-1/PD-L1抑制剂的试验进行分析,对于免疫检查点疗法的研究结果一定程度上缺乏推广意义;(3)免疫疗法存在特定的不良反应,本研究的安全性评价中并未分析不同免疫相关反应的发生率。
本研究显示,以PD-1/PD-L1免疫检查点抑制剂为主的食管癌免疫疗法可以提高食管癌的治疗疗效和总体生存水平,显示出优于传统化疗的安全性,但可能存在一定的免疫毒性。本研究对临床实践具有一定指导意义,但纳入的研究和病例数有限,所得结论需要更进一步的临床数据及分析支持。
作者贡献声明许雨柔 论文构思和撰写,文献检索,数据整理和分析。蔡宁,邹宜丰 检索策略制定。范佳慧 文献质量筛选,论文修改。陈兴栋,索晨 可行性分析,论文指导和修订。
利益冲突声明所有作者均声明不存在利益冲突。
