重症哮喘儿童血浆脂质代谢特征与潜在生物标志物研究
2023-10-13郑红梅温亚锦韩晓冯瑞刘丽娟陈仁杰李小玲金婷婷周玉峰张晓波
郑红梅 温亚锦 韩晓 冯瑞 刘丽娟 陈仁杰 李小玲 金婷婷 周玉峰,5 张晓波△
(1国家儿童医学中心/复旦大学附属儿科医院呼吸科, 2儿科研究所 上海 201102; 3复旦大学计算机科学技术学院 上海 200433;4复旦大学公共卫生学院环境卫生学教研室 上海 200032; 5复旦大学生物医学研究院 上海 200032)
支气管哮喘是儿童最常见的慢性疾病。2010年,我国城市0~14岁儿童哮喘患病率为3.02%,近年又呈逐年上升趋势[1]。大多数儿童在吸入中低剂量的糖皮质激素后症状得到控制,但有约2.5%~5%[2-3]的重症哮喘儿童需要吸入高剂量糖皮质激素来控制症状。重症哮喘儿童虽然占比较小,但由于住院和急诊就医频率显著增加,带来了巨大的卫生资源负担。与轻中度哮喘相比,重症哮喘儿童年度医疗费用是其两倍[4-5]。因此,提高重症哮喘的诊治有利于改善哮喘的整体控制水平,降低医疗成本。
既往研究显示,外周血嗜酸性粒细胞和血清IgE浓度是预测哮喘急性加重或者高恶化风险的重要生物标志物[6-7],但对于预测重症哮喘的特异性生物标志物目前尚无统一结论。近年来,代谢组学方法在筛选与疾病发生发展相关的生物标志物研究中得到广泛应用。代谢组学旨在探究生物体内小分子代谢物成分及其在生理病理中的整体动态变化规律,强调对代谢组分的定量和定性分析[8]。既往多项工作[9-15]揭示了与哮喘发生发展显著相关的代谢物和代谢途径,前者包括腺苷、丙氨酸等,后者包括脂质代谢、三羧酸循环等,但结果并不一致。值得注意的是,近年来国外研究报道脂质代谢在儿童哮喘的控制中发挥重要作用[13]。鉴于哮喘是由基因和环境共同诱发的异质性疾病,人群的基因遗传易感性在其发生发展中发挥重要作用,所以在我国特有的与环境和饮食相适应的遗传基础上,研究重症哮喘与轻中度哮喘儿童脂质差异特征具有重要意义。
本研究采用液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)技术对重症哮喘和轻中度哮喘儿童的血浆进行非靶向脂质代谢组学检测,探索重症哮喘儿童体内脂质成分的改变,并筛选重症哮喘儿童的潜在血浆标志物,以期为重症哮喘的临床诊治提供新思路。
资料和方法
研究对象本研究数据来源于复旦大学附属儿科医院哮喘专病数据库。哮喘患者入组后即完成社会人口学和基线临床信息收集和评估,并纳入哮喘专病管理;哮喘专病库定期向哮喘儿童推送哮喘随访问卷,以评估患者的哮喘控制、药物依从性、哮喘加重等情况,并在入组后第3、6、9和12个月时安排患者进行哮喘专病门诊的随访和评估。选取2020年9月1日—2021年4月30日入组哮喘专病数据库且入组时已规范化治疗和管理1年以上,被诊断为重症哮喘的儿童。根据重症哮喘儿童性别、年龄,从哮喘专病数据库中1:1匹配轻中度哮喘儿童。最终纳入50例重症哮喘和54例轻中度哮喘儿童。本研究获得复旦大学附属儿科医院伦理委员会的批准(批准号:2018-215),患儿家属均签署知情同意书。
纳入标准 结合2020版GINA及我国儿童支气管哮喘诊治建议,本院哮喘专病门诊严格管理并诊断重症哮喘[3,16]。重症哮喘纳入标准:(1)符合我国儿童哮喘防治指南中哮喘的诊断标准;(2)排除患儿依从性不良、药物吸入技术错误,并排除诱发加重或使哮喘难以控制的因素;(3)在过去1年中需要使用第4级或第5级哮喘药物治疗以防止变成为“未控制”哮喘,或即使在上述治疗下仍表现为“未控制”哮喘。轻中度哮喘:(1)符合我国儿童哮喘防治指南中哮喘的诊断标准;(2)使用第3级或以下哮喘药物治疗能达到良好控制的哮喘。
排除标准 两组均排除以下儿童:(1)存在未控制的胃食管反流、睡眠呼吸暂停、鼻窦炎、心理疾病等共存疾病;(2)患有遗传代谢病、先天性心脏病等基础疾病;(3)无法配合完成肺通气功能和呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)检测;(4)家属拒绝提供临床信息及血液样本。
临床资料收集与样本采集在哮喘儿童接受规范化管理和治疗12个月后,哮喘专科医师根据纳入标准纳入重症哮喘儿童,收集患儿血常规、肺通气功能、FeNO、外周血嗜酸性粒细胞计数(eosinophils,EOS)等临床资料,同时采集重症哮喘儿童空腹静脉血1 mL。重症哮喘儿童纳入后,专科医师在哮喘专病数据库中根据年龄、性别,1∶1匹配轻中度哮喘儿童,并收集相同的临床信息和静脉血标本。所有血浆样本均于2 h内以3 000×g速度离心10 min,留取血浆上清液,冻存于-80 ℃冰箱,用于代谢组学分析。
试剂与仪器甲醇、乙腈、异丙醇、水等均为色谱纯,氯仿为分析纯(均购自美国Thermo Fisher公司)。高分辨质谱仪(QE plus)、高效液相色谱仪(Dionex U3000)均购自美国Thermo Fisher公司,色谱柱购自美国Waters公司ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)。
血浆代谢分子水平检测委托上海欧易生物医学科技公司检测。
脂质提取 从-80 ℃取出血浆,取100 μL上清液,加入10 μL内标(L-2-氯苯丙氨酸)和300 μL氯仿-甲醇(体积2∶1),涡旋震荡30 s,静置30 min后离心(12 000 r/min,离心半径178.6 mm,4 ℃,10 min,后续离心条件相同)。取出200 μL下层氯仿装入新的离心管。在剩余液体中加入200 μL氯仿-甲醇(体积2∶1),超声提取10 min,离心后再次取出200 μL下层氯仿,加入上一步新的离心管中,进行挥干。挥干后的残渣用200 μL异丙醇-甲醇(体积1∶1)复溶,离心后留取150 μL上清用于LC-MS分析。
LC-MS检测 柱温:55 ℃;流动相A由乙晴和水(体积6∶4,包含10 mmol/L乙酸铵)组成,流动相B由异丙醇和乙晴(体积9∶1,包含10 mmol/L乙酸铵)组成;流速为0.26 mL/min;进样5 μL。洗脱梯度:1~15 min,68%流动相A和32%流动相B;15~18 min,3%流动相A和97%流动相B;18~21 min,68%流动相A和32%流动相B。质谱参数:采集范围100~1 200m/z,电压3.8(+)/3.8(-) KV,离子源温度和脱溶剂气温为350 ℃。雾化脱溶气体为氮气。
统计学处理临床资料数据采用SPSS 25.0统计软件进行分析。正态分布的计量资料采用描述,偏态分布的计量资料采用M(Q1,Q3)描述,计数资料以率(%)描述,分别采用t检验、Mann-Whitney U检验和χ2检验进行两组组间比较。脂质组学数据采用LipidSearch对原始数据进行峰识别、峰提取、脂质鉴定等预处理。处理后通过主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLSDA)进行多元统计分析,并进行置换检验。根据变量权重值(variable importance in projection,VIP)>1,筛选组间有差异的脂质分子。选取P<0.05且VIP>1的脂质进行代谢通路富集分析。利用变异倍数(fold change,FC)>2和P<0.05筛选显著差异的特征脂质分子。通过受试者工作特征(receiver operating characteristic,ROC)曲线评估临床指标与显著差异代谢分子的预测价值。
结 果
一般资料共纳入104例研究对象:重症哮喘组50例,其中男性34例(68.0%),年龄(8.8±2.6)岁;轻中度哮喘54例,其中男性38例(70.4%),年龄(8.4±2.8)岁。两组间年龄、性别差异无统计学意义(P=0.075,0.422,表1)。
表1 重症哮喘组与轻中度哮喘组临床资料比较Tab 1 Clinical characteristics of severe asthma and mild-to-moderate asthma [n(%) or or M(Q1,Q3)]
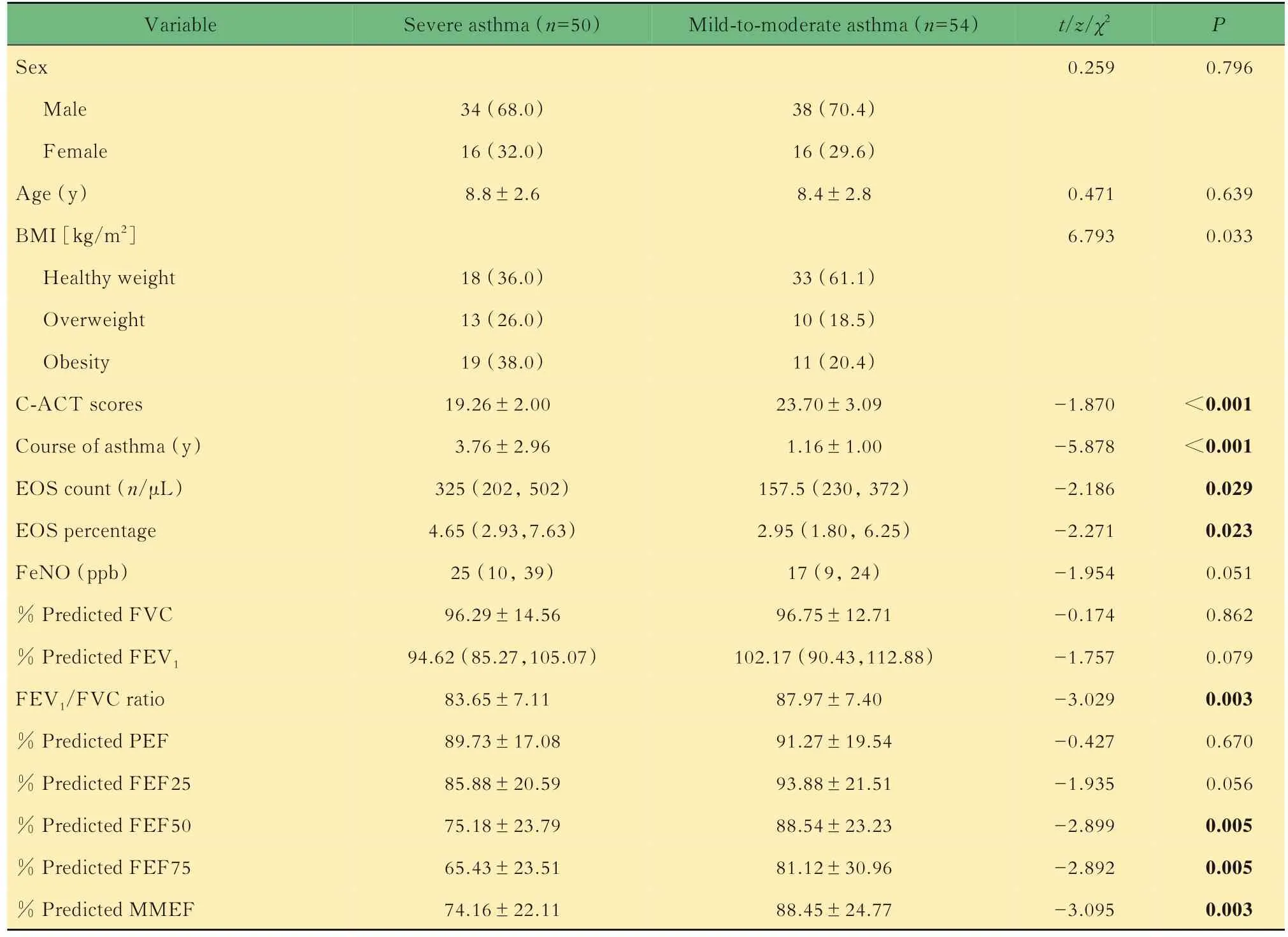
表1 重症哮喘组与轻中度哮喘组临床资料比较Tab 1 Clinical characteristics of severe asthma and mild-to-moderate asthma [n(%) or or M(Q1,Q3)]
BMI: Body mass index; compared with growth charts for children who are the same age and sex, healthy weight is a BMI between the 5th to the 85th percentile, overweight is a BMI between the 85th percentile and the 95th percentile, obesity is a BMI in the 95th percentile or above. C-ACT:Childhood asthma control test. EOS: Eosinophils; FeNO: Fractional exhaled nitric oxide; FEV1: Forced expiratory volume in 1 second; FVC:Forced vital capacity; PEF: Peak expiratory flow; FEF25: Forced expiratory flow at 25% of the pulmonary volume; FEF50: Forced expiratory flow at 50% of the pulmonary volume; FEF75: Forced expiratory flow at 75% of the pulmonary volume; MMEF: Forced expiratory flow at 25%-75% of the pulmonary volume.
Severe asthma (n=50)Mild-to-moderate asthma (n=54)Variable Sex Male Female Age (y)BMI [kg/m2]Healthy weight Overweight Obesity C-ACT scores Course of asthma (y)EOS count (n/μL)EOS percentage FeNO (ppb)% Predicted FVC% Predicted FEV1 FEV1/FVC ratio% Predicted PEF% Predicted FEF25% Predicted FEF50% Predicted FEF75% Predicted MMEF t/z/χ2 0.259 P 0.796 34 (68.0)16 (32.0)8.8±2.6 38 (70.4)16 (29.6)8.4±2.8 0.471 6.793 0.639 0.033<0.001<0.001 0.029 0.023 0.051 0.862 0.079 0.003 0.670 0.056 0.005 0.005 0.003 18 (36.0)13 (26.0)19 (38.0)19.26±2.00 3.76±2.96 325 (202, 502)4.65 (2.93,7.63)25 (10, 39)96.29±14.56 94.62 (85.27,105.07)83.65±7.11 89.73±17.08 85.88±20.59 75.18±23.79 65.43±23.51 74.16±22.11 33 (61.1)10 (18.5)11 (20.4)23.70±3.09 1.16±1.00 157.5 (230, 372)2.95 (1.80, 6.25)17 (9, 24)96.75±12.71 102.17 (90.43,112.88)87.97±7.40 91.27±19.54 93.88±21.51 88.54±23.23 81.12±30.96 88.45±24.77-1.870-5.878-2.186-2.271-1.954-0.174-1.757-3.029-0.427-1.935-2.899-2.892-3.095
重症哮喘和轻中度哮喘临床指标比较与轻中度哮喘相比,重症哮喘儿童肥胖比例更高、CACT评分更低、哮喘病程更长(P=0.033,<0.001,<0.001)。实验室检测中,重症哮喘组EOS计数、EOS百分比均高于轻中度哮喘组(P=0.029,0.023)。肺通气功能检测中,重症哮喘组FEV1/FVC、FEF50%预计值、FEF75%预计值及MMEF%预计值均低于轻中度哮喘组(P=0.003,0.005,0.005,0.003);以上差异均有统计学意义(表1)。
重症哮喘和轻中度哮喘的脂质分子差异比较脂质组学PCA图显示,重症哮喘组和轻中度哮喘组血浆分离趋势不明显(图1A),进一步采用PLS-DA模型分析,结果显示两组分离趋势明显(图1B)。在PLS-DA的基础上,通过OPLS-DA模型去除噪音,结果显示两组的分离趋势进一步明显(图1C)。对OPLS-DA模型进行置换验证(R2=0.0476,Q2=-0.489),显示OPLS-DA模型未过拟合(图1D),提示模型稳健,可成功区分两组样本。
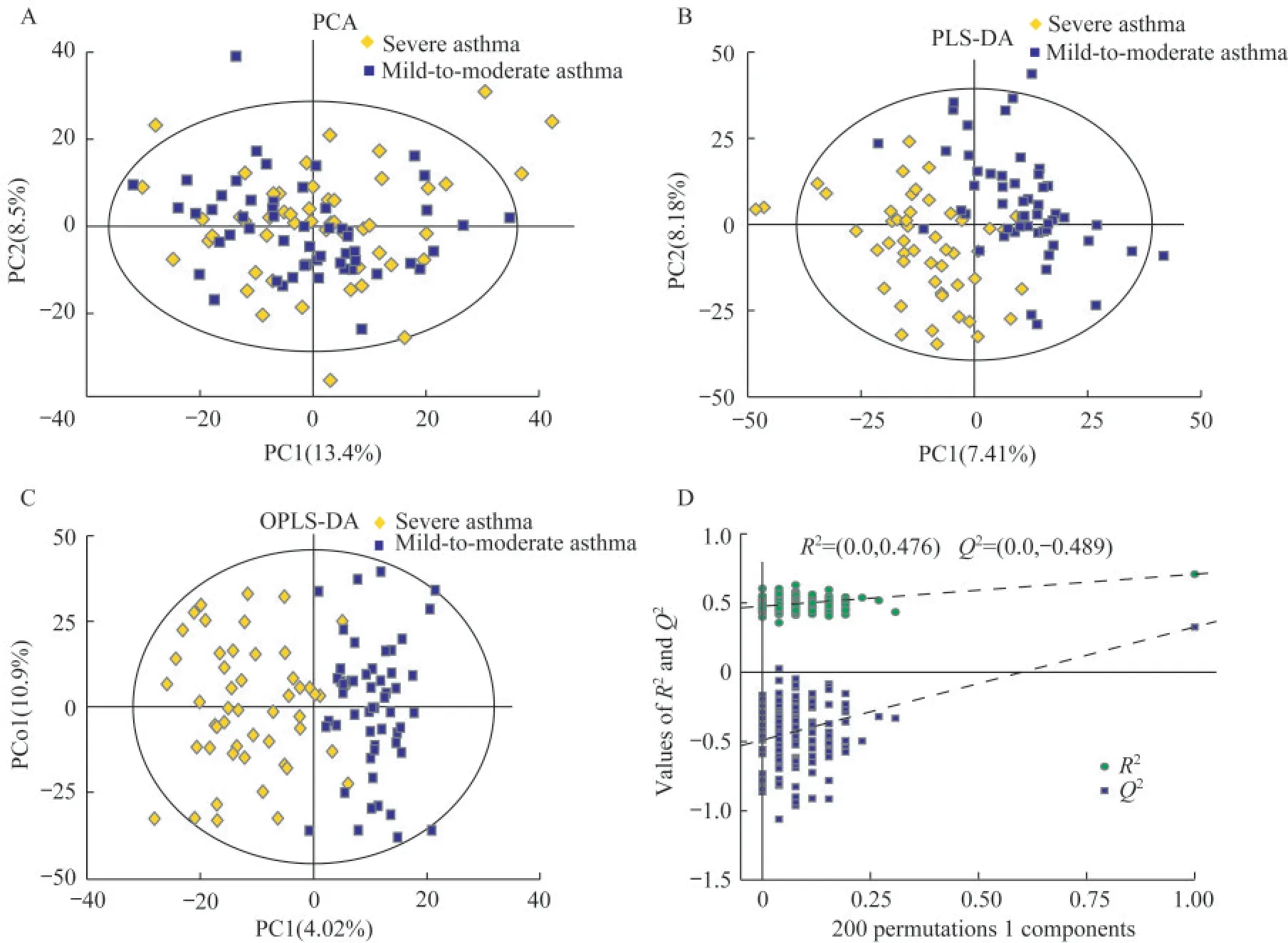
图1 重症哮喘组与轻中度哮喘组儿童脂质组学多元统计分析Fig 1 Multiple statistical analysis of plasma metabolic profiling in children with severe asthma and mild-to-moderate asthma
差异脂质分子筛选与聚类分析基于LC-MS法对全部血浆样本进行非靶向脂质检测,共筛选出1 578个差异代谢分子。以VIP>1、P<0.05作为筛选标准,得到差异脂质39个,归属于6个亚类。与轻中度哮喘相比,重症哮喘组中表达上调的29个,下调的10个。在这39种差异脂质中选取VIP>1的前20名的表达量对两组样本进行层次聚类。结果显示(图2),与轻中度哮喘组相比,重症哮喘组有8种磷脂酰胆碱(phosphatidylcholine,PC)、5种鞘磷脂(sphingomyelin,SM)、1种磷脂酰乙醇胺(phosphatidylethanolamine,PE)、1种磷脂酰丝氨酸(phosphatidylserine,PS)、1种磷脂酰肌醇(phosphatidylinositol,PI)显著性上调;3种溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)、1种磷脂酰乙醇胺显著性下调。其中,在两组间有显著差异(FC>2,P<0.05)的脂质分子为PS(40∶2)和PE(47∶10),均在重症哮喘中表达下调。
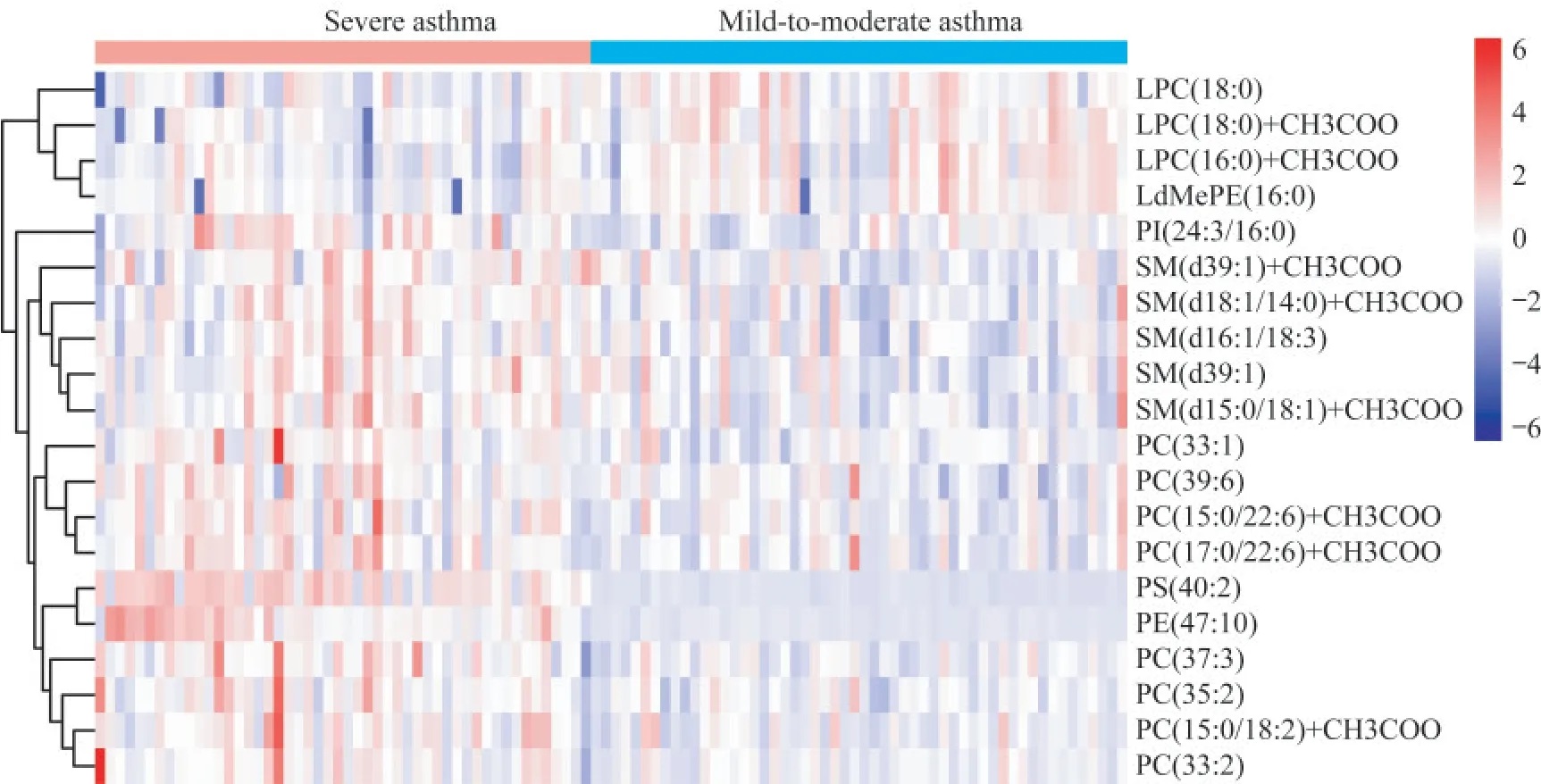
图2 重症哮喘组与轻中度哮喘组VIP前20种脂质热图比较Fig 2 The heat map of relative abundance of VIP-top 20 plasma lipid species in severe asthma group and mild-to-moderate asthma group
差异脂质分子代谢通路富集分析采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路数据库对以上20种差异脂质分子进行代谢通路富集分析,结果显示重症哮喘组中受干扰的通路有胆碱代谢、甘油磷脂代谢、逆行内源性大麻素信号、亚油酸代谢、α亚油酸代谢和花生四烯酸代谢(表2)。

表2 代谢通路富集分析结果Tab 2 Relevant metabolic pathways were analyzed by KEGG
受试者工作特征(ROC)曲线分析将两组间有统计学意义的6个差异临床指标(EOS、EOS%、FEV1/FVC、FEF50%预计值、FEF75%预计值、MMEF%预计值)作为基线,进行ROC曲线评估。并将可能具有诊断潜力的脂质分子PE(47∶10)和PS(40∶2)分别与基线进行联合ROC曲线分析。结果显示,基线、基线联合PE(47∶10)和基线联合PS(40∶2)的曲线下面积分别是0.737(95%CI:0.640~0.834)、0.928(95%CI:0.851~1.000)和0.923(95%CI:0.863~0.983)(图3)。提示临床指标联合显著差异脂质分子PE(47∶10)或PS(40∶2)后,均能提高对重症哮喘儿童的诊断准确度。
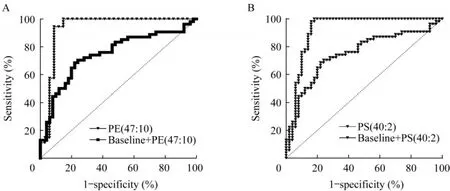
图3 PE(47∶10)和PS(40∶2)用于鉴别重症哮喘和轻中度哮喘儿童的受试者工作特征曲线分析Fig 3 Receiver operating characteristic curves analysis of lipid species PE(47∶10)and PS(40∶2) in discriminating children with severe asthma and mild-to-moderate-asthma
讨 论
研究发现不同表型的哮喘患者体内代谢模式有所区别。脂质通过炎症反应、氧化应激等参与哮喘的发展,影响哮喘的结局,越来越多地引起了人们的关注[17-19]。近来国外研究发现花生四烯酸与亚油酸代谢在儿童哮喘的控制中发挥重要作用,且可用脂质代谢预测未控制的哮喘[13]。本研究应用脂质组学技术对50例重症哮喘和54例轻中度哮喘儿童的血浆进行了检测,探讨了不同哮喘的脂质差异,发现39个主要差异脂质分子。差异的脂质成分主要为PC、SM、PE、PS、PI和LPC 6类,代谢通路富集分析显示胆碱代谢紊乱最为显著。
在本项研究中,我们分析了重症和轻中度哮喘儿童的临床指标,发现重症哮喘儿童BMI更高、病程更长。既往研究揭示肥胖显著影响儿童哮喘的药物治疗敏感性。Reyes-Angel等[20]发现超重肥胖的哮喘儿童对吸入性糖皮质激素药物治疗的反应性更差。Bapat等[21]在肥胖的哮喘小鼠体内发现,Th2细胞介导的免疫炎症反应更多地转化为Th17细胞介导的炎症类型,从而导致小鼠炎症反应加重和药物耐受。与过往研究一致,本研究中发现与轻中度哮喘儿童相比,重症哮喘儿童BMI更高,进而可能加剧了重症哮喘对激素不敏感。
重症哮喘的代谢组学研究对于早期发现代谢标志物、预测治疗反应和指导个体化靶向治疗具有重要价值[22-23],但目前重症哮喘代谢组学的相关研究较少,重症哮喘早期代谢标志物的意义尚不明确。本研究发现了不同严重程度哮喘存在血浆脂质代谢差异,并且以胆碱代谢紊乱最为显著。胆碱是一种人体必需的营养素,可转化为S-腺苷甲硫氨酸、乙酰胆碱等作为甲基供体参与神经活动。队列研究发现,哮喘患者补充胆碱6个月,可显著降低气道阻力、EOS百分比、总IgE水平,以及IL-4、IL-5、TNF-α水平[24],提示大剂量补充胆碱可以抑制哮喘患者体内炎症和氧化应激。但是,Columbo等[25]发现,老年哮喘患者在补充胆碱6周后,肺通气功能、外周血EOS百分比、总IgE水平和ACT得分无明显改变。因此,胆碱在哮喘中的作用尚需更多研究来验证。
同时,我们发现EOS、EOS%、FEV1/FVC、FEF50%预计值、FEF75%预计值、MMEF%预计值在重症和轻中度哮喘儿童间有差异,并以此为ROC曲线分析的基线。ROC曲线分析结果显示,差异脂质中变异倍数最大的PS(40∶2)和PE(47∶10)的AUC、灵敏度和特异性均高于基线,提示PE(47∶10)和PS(40∶2)可能是重症哮喘诊断的潜在生物标志物。
PE是体内含量丰富的甘油磷脂,广泛参与多种生命过程,如促进氧化磷酸化、自噬、内质网应激、促进铁沉积等[26-27]。研究发现,成人女性哮喘患者血清中PE含量高于男性哮喘患者[28];在健康成人、轻度哮喘和中度哮喘中,PE(38∶1)、PE(18∶1p/22∶6)和PE(20∶0/18∶1)的水平差异有统计学意义;与正常健康人群相比,哮喘患者体内PE水平显著升高,且PE表达水平与哮喘的严重程度、IgE水平呈正相关[29];同样,动物实验中发现气道阻力明显上升的小鼠支气管肺泡灌洗液中PE水平显著升高,提示PE与气道阻力正相关[30]。值得注意的是,研究揭示吸烟、感染等哮喘危险因素可降低GPX4活性,从而通过增加脂质过氧化导致磷脂氧体的结构和功能平衡改变,导致上皮细胞功能障碍甚至铁死亡[31],而PE作为细胞膜的主要成分,其解离程度与细胞发生铁死亡的比例正相关[27]。因此,这在一定程度上提示PE与哮喘的发生密切相关,但PE(47∶10)与重症哮喘的关联机制仍需进一步探讨。
PS可以由PE在磷脂酰乙醇胺丝氨酸转移酶的作用下生成,并在生物酶生成和激活过程中扮演关键角色[32-33]。研究发现,PS是唯一与T细胞免疫球蛋白和黏蛋白域(T cell immunoglobulin domain and mucin domain,TIM)受体结合的非蛋白分子[34]。而TIM是哮喘和过敏的重要易感基因,优先表达于Th2细胞,并作为有效共刺激分子激活T细胞。进一步在小鼠实验中发现,TIM高表达与Th2细胞比例、气道炎症程度和气道高反应性正相关[35],同时Goth等[36]发现PS特异性地促进了蛋白质抗原诱导的大鼠肥大细胞释放组胺,从而诱导气道平滑肌痉挛。因此,我们猜测PS(40∶2)可能通过与TIM结合,促进肥大细胞释放组胺和Th2型炎症发生,从而导致重症哮喘,然而这需要进一步体内外研究进行论证。
本研究初步探究了国内重症哮喘和轻中度哮喘儿童血浆脂质代谢差异,发现相关差异表达脂质分子。本研究也具有一定的局限性:首先,重症哮喘组与轻中度哮喘组儿童治疗用药存在不同,尤其吸入糖皮质激素剂量及疗程不同可能在一定程度上影响代谢组学。虽然既往Picado等[37]、Sparreman等[17]的研究提示激素治疗本身对患者血浆脂类代谢、蛋白组学可能影响较小,但相关研究不多且尚无明确结论。其次,单次代谢组学检测提供的是静态的代谢分子丰度信息,而哮喘是一个慢性炎症性疾病,机体代谢处于动态变化中,并受饮食模式等多种因素的影响,因此无法完全展示重症哮喘儿童体内代谢情况。此外,本研究仅探究了重症哮喘儿童的差异代谢分子,尚未对发现的差异代谢分子进行靶向验证。因此,需要在本研究的基础上进行前瞻性研究,通过进一步扩大样本量、靶向代谢检测等深入探讨代谢分子在重症哮喘发生发展中的作用。
综上所述,本研究通过脂质组学检测,初步探究了国内重症哮喘和轻中度哮喘儿童血浆脂质代谢差异。通过代谢通路富集分析发现差异脂质分子主要集中在胆碱代谢通路,并将变异倍数最大的PE(47∶10)和PS(40∶2)与临床指标联合分析,可提高对重症哮喘的诊断。在后续的研究中,可通过扩大样本量、联合多组学等进行更深入地探索重症哮喘的发病机制,为重症哮喘的诊断和治疗提供新的思路。
作者贡献声明郑红梅 实验设计与研究,数据分析和论文撰写。温亚锦 实验研究,数据分析,论文撰写。韩晓 实验设计,论文修订。冯瑞研究咨询,数据分析。刘丽娟 数据分析,论文修订。陈仁杰 数据分析。李小玲,金婷婷 文献调研与整理。周玉峰 研究设计,可行性分析。张晓波 研究设计,监督指导,论文修订。
利益冲突声明所有作者均声明不存在利益冲突。
