多房棘球蚴囊液对沉默DDIT4后小鼠肝细胞生物学功能的影响※
2023-10-12尹凤娇陈佳昕仁增卓嘎冶赓搏庞明泉樊海宁曹得萍王海久王志鑫
尹凤娇,徐 凯,陈佳昕,仁增卓嘎,乜 茹,冶赓搏,庞明泉,樊海宁,曹得萍,王海久*,王志鑫
(1.青海大学附属医院 肝胆胰外科,西宁 810001;2.青海省包虫病研究重点实验室,西宁 810001;3.桂林医学院基础医学院 基础医学教研室,桂林 541199)
DNA损伤诱导转录因子4(DNA damage-inducible transcript 4,DDIT4)是一种与代谢、免疫等相关的蛋白,在损伤等应激条件下高表达。在前列腺癌、卵巢癌等众多恶性肿瘤的表达中有显著性差异,且在抗肿瘤治疗中起着“保护伞”作用[1-3]。肝多房棘球蚴病病灶边界不清楚,囊液持续外渗,刺激周围肝细胞,导致正常肝细胞损伤。徐凯[4]等研究发现,正常小鼠肝细胞经多房棘球蚴囊液(HCF)干预后,细胞活性明显受到抑制,且DDIT4在凋亡、自噬相关蛋白中高表达。本研究观测HCF对沉默DDIT4后小鼠肝细胞生物学功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验细胞系
正常小鼠肝细胞株(AML-12)购自中国科学院上海生命科学研究所,保存于青海大学附属医院中心实验室。
1.1.2 小鼠
BALB/c小鼠购自南京市江宁区青龙山动物繁殖场,动物合格证号:No.201930977。
1.1.3 主要试剂和仪器
RIPA裂解液、0.25%胰蛋白酶消化液(不含EDTA)、嘌呤霉素(puromycin)均购自北京索莱宝科技有限公司,DMEM/F12培养基购自武汉普诺赛生命科技有限公司,CCK-8试剂盒、BCA蛋白浓度测定试剂盒、BCA蛋白定量试剂盒购自美国Thermo公司,DDIT4一抗、Beclin-1一抗购自美国Abcam公司,Caspase-3一抗、LC3A/B一抗购自美国Cell Signaling Technology公司,β-actin抗体、HRP山羊抗兔二抗购自武汉爱博泰克生物科技有限公司,RNA Simple总RNA提取试剂盒、逆转录试剂盒购自天根生化科技有限公司,DDIT4引物、18S引物购自华大基因公司,LV-Ddit4-RNAi、阴性对照病毒购自吉凯基因公司。生物倒置显微镜系统购自日本OLYMPUS公司,荧光化学发光成像系统购自美国GE公司,酶标仪购自德国Tecan公司,电泳仪购自BIO RAD公司,PCR基因扩增仪购自美国ABI公司,普通高速离心机购自Sigma公司,Cytation5细胞成像微孔板检测系统购自美国BioTek公司,实时荧光PCR仪购自Roche公司,透射电子显微镜购自HITACHI公司。
1.2 方法
1.2.1 囊液收集及处理
将造模小鼠采用颈椎脱臼法处死,以无菌方式打开腹腔并小心分离多房棘球蚴囊泡(用PBS反复多次清洗),并将囊泡放至20 mL无菌注射器内,以挤压方式分离囊液并离心(3200 r/min,7 min),用滤器(0.22 μm)过滤离心囊液后分装,并存于-80℃冰箱备用。
1.2.2 慢病毒LV-Ddit4-RNAi转染
小鼠肝细胞按规定密度(4×104个/mL)接种于六孔板中。24 h后当细胞覆盖率为20%~30%时进行慢病毒转染。根据《慢病毒使用操作手册》要求,每组细胞分别加入LV-Ddit4-RNAi 1、LV-Ddit4-RNAi 2、LV-Ddit4-RNAi 3和LV-Ddit4-NC病毒,以及相应的转染增强液置培养箱(37℃,5% CO2)培养。用嘌呤霉素筛选稳定细胞株,并进行RT-qPCR及Western Blot鉴定,检测各组DDIT4基因mRNA和蛋白表达量,并确定合适的慢病毒进行转染。
1.2.3 小鼠肝细胞DDIT4蛋白的表达量检测
分别收集经HCF作用后的LV-Ddit4-RNAi 1、LV-Ddit4-RNAi 2、LV-Ddit4-RNAi 3和LV-Ddit4-NC细胞,细胞用含有PMSF蛋白酶抑制剂的Ripa缓冲液做冰上裂解(30 min)、离心(4℃,12 000 r/min,10 min)后取上清液后用5×蛋白上样缓冲液稀释并水浴(95℃,10 min),通过BCA蛋白定量试剂盒测定蛋白样品浓度。取30 μg总蛋白进行SDS-PAGE电泳。结束后转移至0.2 μm PVDF膜上,用5%脱脂奶粉封闭(室温,1 h)。将膜与DDIT4(1:1000)、β-actin(1:1500)一抗一同孵育(4 ℃,过夜)。第二天对稀释(1:5 000)的用HRP标记的二抗进行孵育(室温,1 h)。使用增强型ECL化学发光系统进行印记检测(以β-actin为内参)。使用Image J软件对蛋白条带进行灰度分析。
1.2.4 小鼠肝细胞DDIT4的表达量检测
直接提取细胞总RNA,将适量的RNA逆转录成cDNA,采用RT-qPCR法检测4组DDIT4的mRNA表达量,筛选慢病毒。将4个样品用DDIT4基因和内参基因引物扩增,见表1。每个反应重复3次。采用20 μL体系建立扩增体系。采用两步法PCR反应程序进行实验。PCR结果分析由ABI Q5 PCR仪完成。

表1 DDIT4、18S引物序列
1.2.5 HCF对沉默DDIT4后小鼠肝细胞形态学影响
收集转染后的小鼠肝细胞接种于6孔板(3×105个/孔),24 h后更换培养基并加入浓度为0.0、0.4、0.8 mg/mL的HCF,分别与细胞培养48 h。
1.2.6 HCF对沉默后小鼠肝细胞活性的影响
收集转染后的小鼠肝细胞接种于96孔板(1×104个/孔),24 h后更换培养基并加入浓度为0.0、0.4、0.8 mg/mL的HCF,处理48 h后,每孔加入CCK-8试剂孵育。
1.2.7 凋亡自噬相关蛋白水平检测
同1.2.3所示方法。
1.2.8 细胞内超微结构观察
收集转染后的小鼠肝细胞,在培养皿(35 mm)接种细胞(1×106个/皿),24 h后更换培养基,并加入不同浓度的HCF培养48 h。从EP管中收获培养48 h的细胞,用PBS洗涤2次;用2.5%戊二醛固定(过夜)后以1%锇酸固定(避光,室温)2 h,再用不同浓度梯度(30%、50%、70%、80%、95%、100%)乙醇进行脱水,然后浸透、包埋、聚合、切片、拍照,在电镜下观察细胞内超微结构。
1.2.9 统计学处理
2 结果
2.1 慢病毒转染效率
2.1.1 细胞慢病毒转染情况
使用Image J软件检测荧光细胞所占全视野细胞的百分比达80%以上,可用于后续实验。如图1。

A为明场镜下图(×100);B为同一视野荧光图(×100),绿色荧光表明慢病毒已成功转染细胞
2.1.2 经HCF作用后的慢病毒转染小鼠肝细胞的DDIT4蛋白表达量
经HCF作用后慢病毒转染小鼠肝细胞的DDIT4蛋白表达水平检测结果显示,LV-Ddit4-RNAi 1、LV-Ddit4-RNAi 2、LV-Ddit4-RNAi 3组分别与LV-Ddit4-NC组比较,前三组DDIT4蛋白含量显著下降,LV-Ddit4-RNAi 3组尤为显著(P<0.01),见图2、表2。因此最终选用LV-Ddit4-RNAi 3组细胞做后续实验。

图2 小鼠肝细胞DDIT4蛋白表达图
表2 小鼠肝细胞DDIT4蛋白表达结果
2.1.3 经HCF作用后慢病毒转染小鼠肝细胞的DDIT4基因表达量
经HCF作用后慢病毒转染小鼠肝细胞的DDIT4基因表达水平检测结果显示,LV-Ddit4-RNAi 1、LV-Ddit4-RNAi 2、LV-Ddit4-RNAi 3组分别与LV-Ddit4-NC组比较,前三组DDIT4基因表达水平均显著下降,LV-Ddit4-RNAi 3组尤为显著(P<0.01),见表3。

表3 小鼠肝细胞DDIT4的表达结果
2.2 HCF对沉默后AML-12细胞形态的影响
与HCF共培养48 h后,con组LV-Ddit4-NC和LV-Ddit4-RNAi组细胞形态多呈椭圆形或者圆形,细胞生长密度正常,贴壁良好,连接成岛状;而LV-Ddit4-RNAi组分别经过0.4、0.8 mg/mL HCF处理后细胞数及状态明显好于LV-Ddit4-NC 0.4、0.8 mg/mL组,多数细胞形态较正常,且贴壁状态良好,可见少部分细胞漂浮于培养基中,见图3。
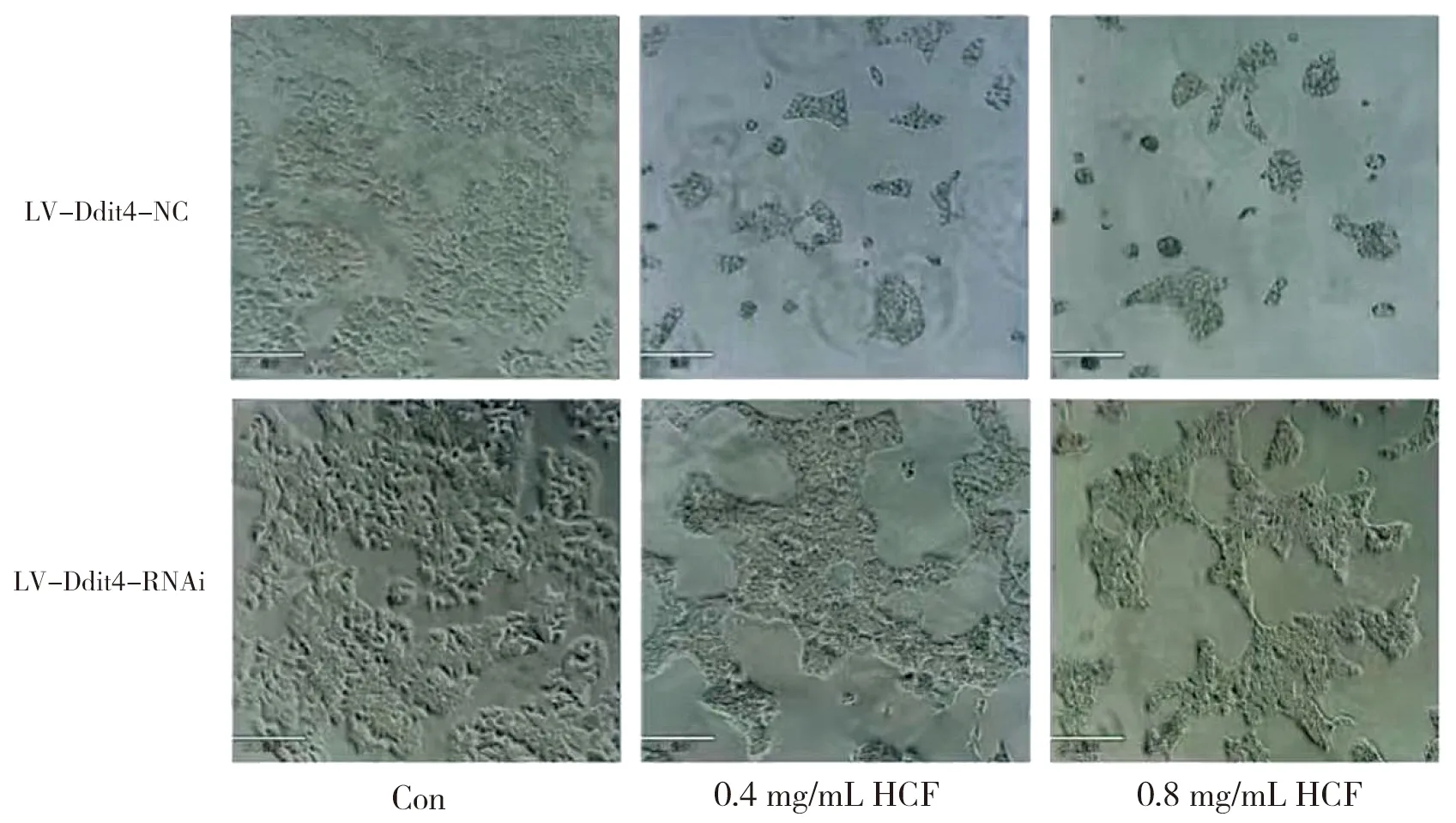
图3 48 h后各组细胞形态镜下图(×100)
2.3 AML-12细胞活力
与LV-Ddit4-NC 0.4、0.8 mg/mL组细胞比较,LV-Ddit4-RNAi 0.4、0.8 mg/mL组细胞OD值明显上升,增殖率也随之增加(P<0.01);与HCF共培养48 h后,沉默DDIT4组细胞形态接近正常AML-12细胞形态,多呈椭圆形或者圆形,且细胞生长密度较LV-Ddit4-NC组明显为高。见表4。

表4 HCF对各组AML-12细胞活力的影响
2.4 凋亡自噬相关蛋白水平
与LV-Ddit4-NC con组比较,LV-Ddit4-NC 0.4、0.8mg/mL HCF组Beclin-1、LC3-II、Caspase-3蛋白表达显著升高(P<0.01);与LV-Ddit4-RNAi con组比较,LV-Ddit4-RNAi 0.4 mg/mL HCF组的Beclin-1表达具有统计学意义(P<0.05),LV-Ddit4-RNAi 0.8 mg/mL HCF组的Beclin-1表达具有统计学意义(P<0.01);与LV-Ddit4-RNAi con组相比,LV-Ddit4-RNAi 0.8 mg/mL HCF组的Caspase-3表达具有统计学意义(P<0.05);与LV-Ddit4-NC 0.4、0.8 mg/mL HCF组比较,LV-Ddit4-RNAi 0.4、0.8 mg/mL HCF组的LC3-II表达具有统计学意义 (P<0.05),Beclin-1、Caspase-3蛋白表达具有统计学意义(P<0.01)。与LV-Ddit4-RNAi con组比较,LV-Ddit4-RNAi 0.4、0.8 mg/mL组的LC3-II表达无统计学意义(P>0.05)。见图4、表5。
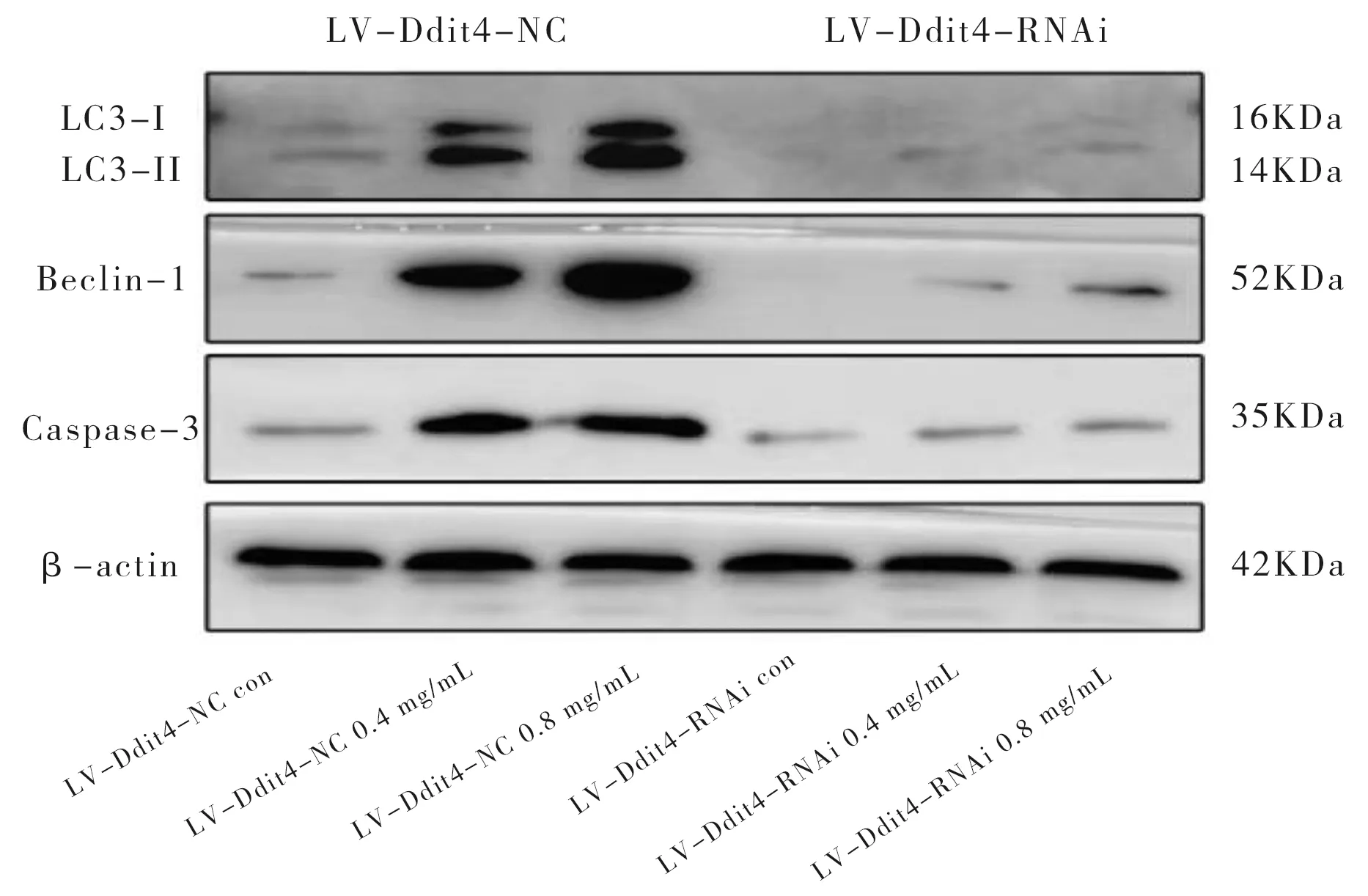
图4 Caspase-3、Beclin-1、LC3蛋白水平表达图
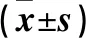
表5 凋亡自噬相关蛋白水平
2.5 细胞内超微结构
LV-Ddit-4-NC和LV-Ddit4-RNAi组的透射电镜图显示,胞质未见明显损伤,线粒体基质较均匀,粗面内质网未见明显扩张,自噬水平低,见图5a-d;LV-Ddit4-RNAi 0.4、0.8 mg/mL组细胞损伤较轻,胞质内存在较多脂滴,自噬数量增多,见图5e-h;LV-Ddit4-NC 0.4、0.8 mg/mL组细胞损伤最严重,粗面内质网严重扩张,胞质内存在大量脂滴,可见大量自噬结构,见图5i-l。

图5 各组AML-12细胞超微结构图
3 讨论
DDIT4是位于染色体10(10q22.1)上,由232个氨基酸组成的一种蛋白质。有研究表明,DDIT4能发挥广泛的细胞及生物学功能[5-6]。DNA损伤转录诱导在多种细胞中出现,正常情况下DDIT4均呈低表达,且半衰期短,很难被检测出来[7]。
在寄生虫感染中,由于虫体寄生诱发了宿主细胞的内质网应激反应并启动未折叠蛋白反应。多种应激条件下,自噬水平会显著上升[8]。
Hou等[9]研究发现,沉默DDIT4后可减轻LPS诱导人脐静脉内皮细胞凋亡现象。Su等[10]研究得出,降低DDIT4表达水平可减轻蛛网膜下腔出血患者脑脊液中代谢产物所引起的原代皮层神经元凋亡。DDIT4也可密切参与对细胞自噬的调控作用[11-12]。本课题组前期研究发现[4],HCF对正常小鼠肝细胞有损伤作用。国内外众多研究发现,DDIT4可能与细胞凋亡、细胞自噬密切相关,故本研究筛选LV-Ddit4-RNAi 3做相关实验。
本研究观测HCF对沉默DDIT4后小鼠肝细胞生物学功能的影响发现:1.AML-12细胞增殖;2.AML-12细胞凋亡、自噬数量减少。
