放血疗法促高原慢性低氧下雄性大鼠红细胞衰亡的实验研究※
2023-10-12王顺娟刘文婧李润乐
冯 琳,王顺娟,刘文婧,李润乐,汤 锋
(1.青海大学高原医学研究中心,西宁 810001;2.青海省人民医院,西宁 810007;3.青海省藏医院,西宁 810007;4.青海大学基础医学部,西宁 810016;5.青海省高原医学应用与基础研究重点实验室,西宁 810001)
本课题组前期研究发现,在慢性低氧环境下红细胞生成增加、衰亡减少。此研究结果在国际学界首次报道,并引发广泛关注[1]。据此推测放血疗法可促高原慢性低氧下雄性大鼠红细胞衰亡。本课题就此开展相关研究。
1 材料与方法
1.1 材料
1.1.1 动物及分组
SD雄性大鼠购自重庆腾鑫生物西安分公司[生产许可证号:SCXK(浙)2019-0002],200 g/只。分为对照组(Control)、低氧组(Hypoxia)和放血组(Phlebotomy)。
本研究通过青海大学医学院伦理委员会审查。
1.1.2 主要试剂和仪器
Annexin V-FITC、Retic-Count和高速分选流式细胞仪购自BD公司,中型低压氧舱购自贵州哈雷空天环境工程有限公司,全自动血液体液分析仪购自希森美康公司。
1.2 实验方法
1.2.1 慢性低氧下红细胞增多雄性大鼠模型建立
Control置青海大学医学院高原医学研究中心动物房28 d,Hypoxia和Phlebotomy置医学院低压氧舱28 d,Phlebotomy分别于第7、14、21 d经尾静脉放血500 μL。
1.2.2 血细胞分析
Phlebotomy于第7、14、21 d用EDTA抗凝管采血500 μL,检测红细胞(Red blood cell count,RBC)数目、血红蛋白(Hemoglobin,HGB)含量、血细胞容积(Hematocrit,HCT)、血小板(Platelet,PLT)数量等指标。并于第28 d取三组雄性大鼠全血进行上述项目检测。
1.2.3 红细胞渗透脆性实验
配置梯度浓度生理盐水1号(6.8 g/L NaCl)、2号(6.4 g/L NaCl)……12号(2.4 g/L NaCl)和13号生理盐水(0.9%)及14号尿素(1.9%)、15号去离子水。流式管中按序号各添加500 μL溶液,管中滴入一滴全血(约50 μL),静置30 min观察血液渗透脆性并记录。
1.2.4 红细胞衰亡检测
全血离心(800 r/min)10 min,取血浆冻存。制备1×bufferr[Annexin V-FITC(BD)]溶液,每管取1×106个红细胞,用1×PBS缓冲液清洗两次。每管取1×106个红细胞添加5 μL FITC试剂,在室温下避光孵育20 min,添加1×bufferr[Annexin V-FITC(BD)]溶液至终体积500 μL,过滤膜后使用流式细胞仪检测红细胞衰亡水平。
1.2.5 网织红细胞检测
全血离心(800 r/min)10 min,取血浆冻存。每管取5 μL红细胞添加1 mL Retic-CountTM染色剂,在室温下避光孵育30 min。离心(800 r/min)5 min弃上清,加入1 mL 1×PBS缓冲液,清洗两次,最后添加1×PBS缓冲液至终体积500 μL,过滤膜后使用流式细胞仪检测网织红细胞(Reticulocyte,Ret)。
1.3 统计学方法
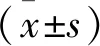
2 结果
2.1 放血对血细胞的影响
Hypoxia雄性大鼠置于模拟海拔5 000 m的低压氧舱饲养4 w时从尾静脉采血,进行血常规检测,结果见表1。Hypoxia红细胞数量和血红蛋白含量显著增加,Phlebotomy相比于Control虽有增加,但明显低于Hypoxia。同样,Hypoxia红细胞比容显著高于Control和Phlebotomy。Control血小板数量显著高于Hypoxia和Phlebotomy,同时Phlebotomy相比于Hypoxia明显增加。
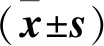
Table 1 Blood Cell Count Analysis
2.2 放血对红细胞渗透脆性的影响
红细胞起始溶血浓度为(5.2~4.4)g/L NaCl溶液,至低渗溶液中完全破裂,结果见图1。低氧促使红细胞在高于5.2 g/L浓度的NaCl溶液中破裂,红细胞渗透脆性增加。Phlebotomy和Control溶血水平基本一致。Phlebotomy、Control红细胞在NaCl溶液中起始溶血的浓度为5.2 g/L,Hypoxia红细胞在NaCl溶液中起始溶血的浓度为6.0 g/L。结果见表2。
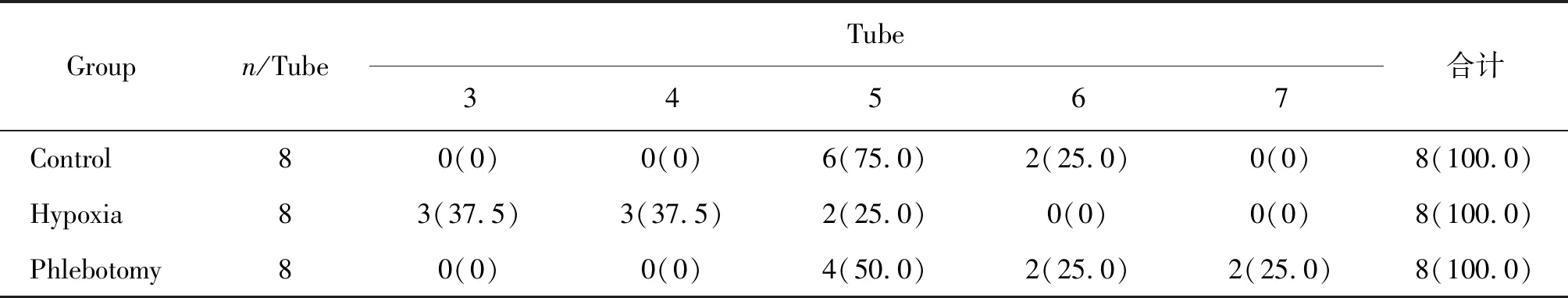
Table 2 Hemolysis of different tube numbers in each group(%)
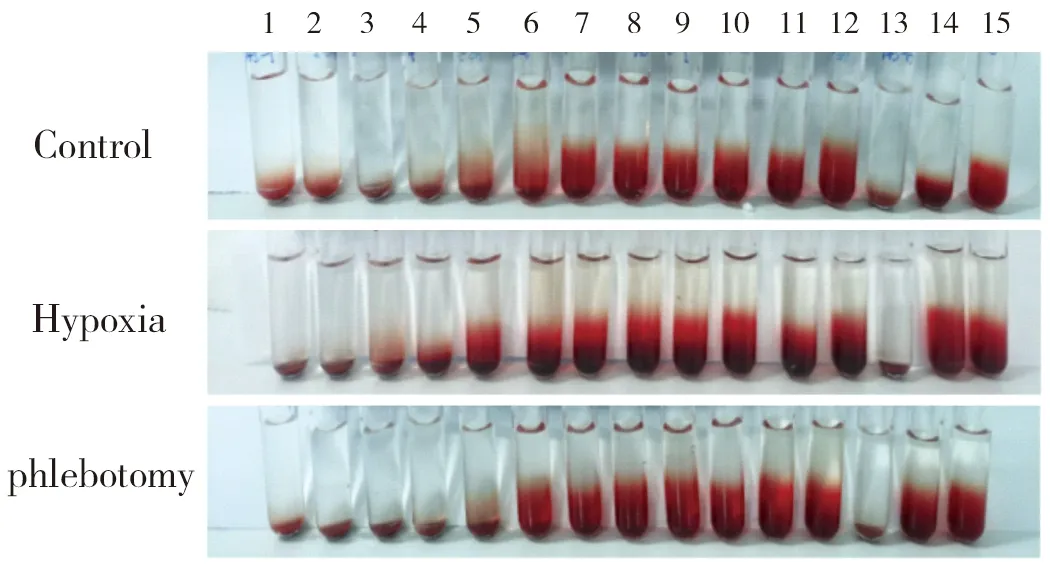
Figure 1 Hypoxia increases the osmotic fragility of erythrocytes,which can be relieved by phlebotomy
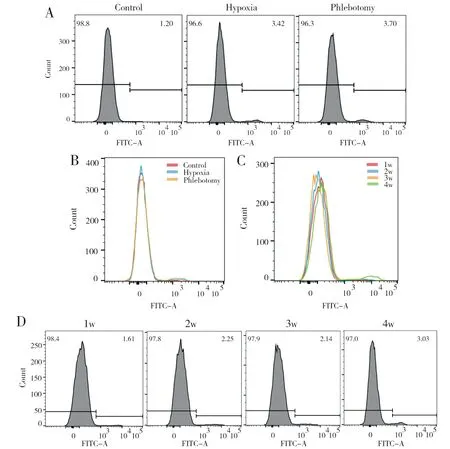
2.3 放血对红细胞衰亡的影响
Hypoxia雄性大鼠红细胞衰亡减少。表3显示,低氧可以抑制红细胞衰亡,经过放血治疗,Phlebotomy红细胞衰亡数量较Hypoxia显著增加。流式结果显示红细胞衰亡:Hypoxia(0.07±0.01)与Phlebotomy(0.10±0.02)相比,P=0.001;Control(0.10±0.01)与Hypoxia(0.07±0.01)相比,P=0.001。
Table 3 Eryptosis was analyzed in different groups by flow cytometry
图2显示,放血可以促进红细胞在低氧下的衰亡;图3显示,当红细胞数量逐渐趋于正常状态时,红细胞衰亡数量逐渐减少。结果见表4,2 w(0.20±0.01)与3 w(0.15±0.02)相比,P=0.001;3 w(0.15±0.02)与4 w(0.09±0.02)相比,P=0.001。
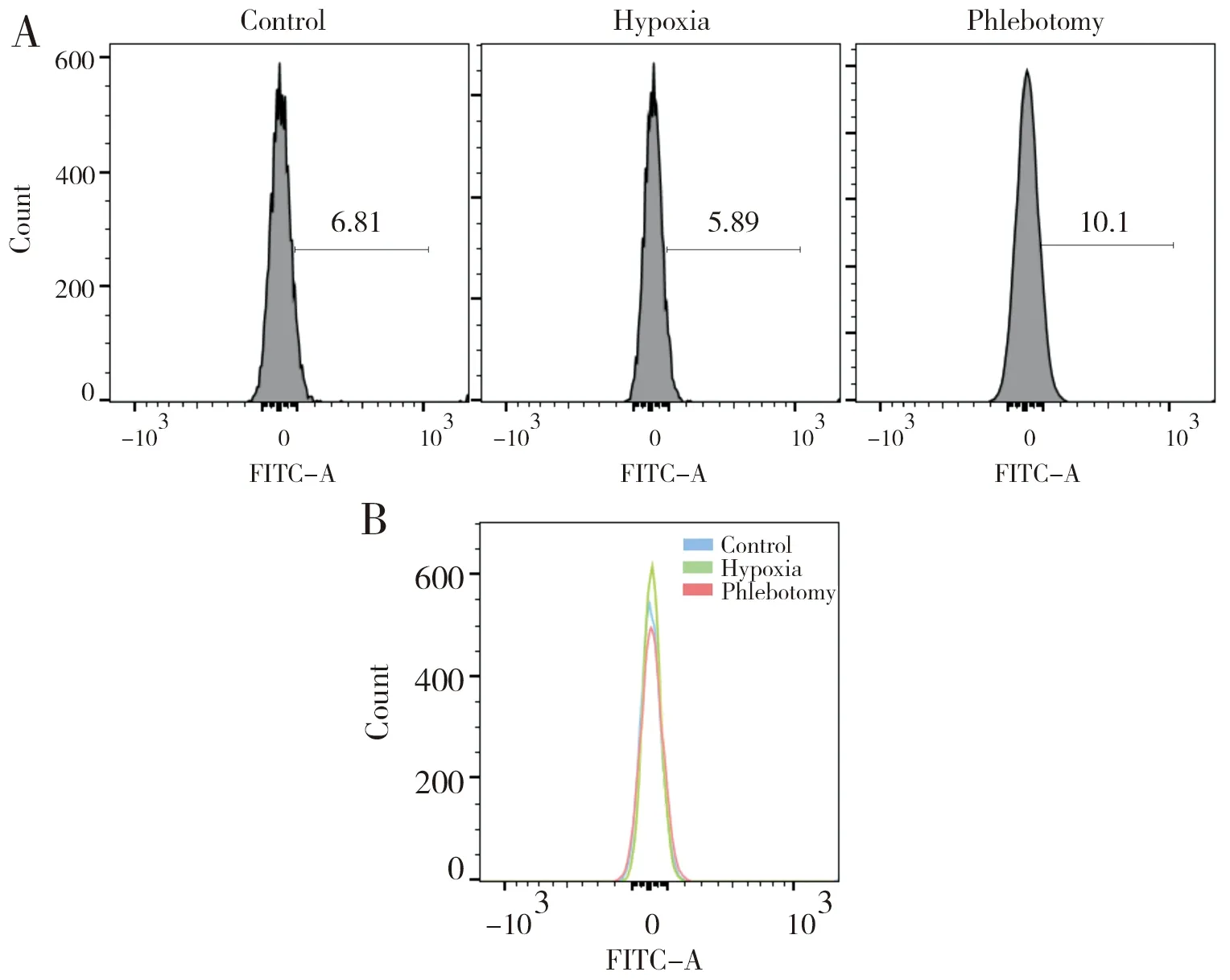
(A)and(B)Rat erythrocytes binding Annexin V-FITC after phlebotomy in three group
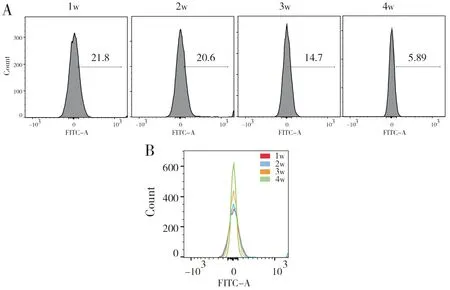
(A)and(B)Rat erythrocytes binding Annexin V-FITC after phlebotomy during the first week to the fourth week
Table 4 Dynamic results of eryptosis by flow cytometry
2.4 放血对网织红细胞的影响
图4、表5显示,网织红细胞数量增加则新生红细胞增加,随之成熟红细胞的数量增加,低氧和放血疗法均可以刺激网织红细胞增加,Hypoxia(0.04±0.01)与Phlebotomy(0.05±0.02)相比,组间差异无统计学意义。然而网织红细胞Phlebotomy动态数据结果如图4、表6,放血后网织红细胞的增加始终维持在固定范围,不会持续增加,1 w( 0.04±0.03)、2 w(0.05±0.04)、3 w(0.04±0.02)、4 w(0.06±0.03)组间差异无统计学意义。
(A)and(B)is reticulocyte in Different groups at the same time.(C)and(D)is Dynamic analysis of reticulocyte
Table 5 Reticulocyte in different groups by flow cytometry
3 讨论
放血疗法虽被应用于相关疾病治疗[2],但目前针对其作用机制并无明确说明。本研究基于前期研究基础,提出放血疗法可改善低氧对红细胞衰亡的抑制作用。
红细胞在长期慢性低氧环境下由代偿性增加逐渐转变为过度增加,课题组前期研究发现慢性低氧促进新生红细胞增加、抑制成熟红细胞衰亡。同时新生红细胞增加,红细胞数量和血红蛋白含量不断增加,红细胞比容增加,血液粘稠致血流速度缓慢,加重机体微循环障碍及其他症状[3]。而放血使红细胞数量减少、红细胞比容降低、血液黏滞度下降,从而改善机体微循环障碍。
在红细胞的生命周期里,红细胞需要不断经受血流的高压冲击,经过微小血管时不断被挤压,此过程中的红细胞需要具有高度的变形性和结构的完整性。慢性低氧延缓红细胞程序性死亡致衰老的红细胞增加,数量增加致细胞结构不规则、红细胞脆性增加、抵抗力减弱,在血流的冲击和微血管的挤压下,细胞的结构受到破坏,可塑性降低[4]。本研究结果显示,经放血干预后,红细胞变形能力增强、脆性降低,功能恢复、抵抗力增加,在运输过程中不易被破坏,更易通过微小血管完成物质交换。
虽然放血可以促进红细胞衰亡,但适当的放血并不会持续增加红细胞的衰亡。针对放血疗法,不论是治疗高原红细胞增多症、真性红细胞增多症或其他疾病均效果明显[5,6],放血排出的不止是成熟红细胞,同时还包括各个阶段的未成熟红细胞,机体感应到未成熟红细胞减少,会自发生产红细胞,红细胞会代偿性增加。网织红细胞是晚幼红细胞脱核后的未成熟红细胞,最终发展成成熟红细胞,是衡量骨髓造血功能和新生红细胞的重要指标[7]。本研究结果显示,虽然Hypoxia和Phlebotomy网织红细胞均有增加,但放血导致的红细胞增加不同于低氧引起的红细胞增加,低氧造成的红细胞增加是一种长期、慢性的恶性循环,最终导致红细胞越来越多。而放血组动态数据显示,网织红细胞的增加始终保持在一个范围内,各组间差异无统计学意义。
综上所述,放血疗法可促进高原慢性低氧下雄性大鼠红细胞的衰亡,降低慢性低氧对雄性大鼠红细胞衰亡的抑制作用。同时放血不会持续刺激雄性大鼠红细胞衰亡,也不会持续刺激雄性大鼠网织红细胞增加。
