氢离子通过mTOR 通路抑制CD8+T 细胞功能*
2023-10-11马丽黄玲朱栋炜南京中医药大学附属南京医院南京市第二医院检验科南京0003江苏大学医学院免疫学教研室江苏镇江03
马丽,黄玲,朱栋炜(.南京中医药大学附属南京医院&南京市第二医院检验科,南京 0003;.江苏大学医学院免疫学教研室,江苏镇江 03)
由免疫细胞介导的适应性免疫反应在肿瘤的发生、发展中扮演着极为重要的角色[1]。其中CD8+T 细胞作为主要的效应细胞,是适应性免疫系统的关键组成部分,在识别和清除受感染或恶性转化的细胞及抗肿瘤过程中具有重要的作用[2-3]。研究表明,以酸性、缺氧为特征的肿瘤微环境(tumor microenvironment,TME)是T 细胞增殖、分化、浸润和功能发挥的关键障碍[4-6]。本研究拟通过改变培养基的pH 值,探究TME 中主导酸性环境的氢离子(H+)对CD8+T 细胞的增殖及效应功能的影响,旨在阐明酸性TME 抑制T 细胞抗肿瘤免疫的原因。同时探究H+对CD8+T 细胞中哺乳动物雷帕霉素(Rapamycin)靶蛋白(mammalian target of rapamycin,mTOR)信号通路的影响,揭示了酸性TME 抑制CD8+T 细胞抗肿瘤免疫的分子机制。
1 材料与方法
1.1 主要试剂和仪器 人外周血单个核细胞(PBMC)购自上海澳赛尔斯生物公司,细胞培养基RMPI-1640(南京福麦斯生物技术公司),青霉素-链霉素、胰蛋白酶(上海碧云天生物科技公司),非必需氨基酸、L-丙氨酰-L-谷氨酰胺、丙酮氨酸、HEPES 缓冲液、β-巯基乙醇、Page Ruler Protein Ladder 预染蛋白质marker、RIPA 细胞裂解液、蛋白酶抑制剂、胎牛血清(美国赛默飞公司),PeproTech重组人IL-2、β-actin 单克隆抗体(美国派普泰克公司),RNA 提取试剂盒、逆转录试剂盒、qRT-PCR 试剂盒(美国普洛麦格生物技术公司),PCR 引物合成(美国金唯智生物科技公司),SDS 凝胶配制试剂盒(北京索莱宝科技公司),PVDF 膜(美国默克密理博公司),兔抗人p-AKT(Ser473)抗体、兔抗人AKT 抗体、兔抗人p-S6(Ser240/244)抗体、兔抗人S6 抗体、CD8 免疫磁珠(美国CST 公司),流式抗体FITC anti-Human-CD8、PE-TNF-α、APC-IFN-γ 及激活抗体Human anti-CD3 和Human anti-CD28(北京Biolegend 公司)。LSR Fortessa 分析型流式细胞仪(美国BD 医疗器械公司),Roche LC480 实时荧光定量PCR 仪(瑞士罗氏公司),164-5052HC 高流电泳仪(美国伯乐公司),FE28pH 酸度计(美国梅特勒托利多公司),Countess ⅡAutomated Cell Counter细胞计数仪、NanoDrop One 微量核酸检测仪(美国赛默飞公司)。
1.2 方法
1.2.1 CD8+T 细胞的分选 取上述PBMC,加入500 μL 分选缓冲液混匀,再加入200 μL CD8 免疫磁珠,混匀后4 ℃避光反应30 min,预冷PBS 洗涤后,1 300 r/min 离心5 min,弃上清,用500 μL PBS重悬细胞并过柱。PBS 洗涤分选柱,将分选柱移出磁场,收集洗液即为CD8+T 细胞。使用FACS 缓冲液(含2% BSA 的PBS)配制FITC anti-Human CD8(1 ∶300稀释)染液,冰上染色30 min,用FACS 缓冲液洗涤细胞,收集纯度为89%~92%的CD8+T 细胞用于后续试验。
1.2.2 细胞培养与传代 使用含10%FBS、1%抗生素(青霉素-链霉素)、1%非必需氨基酸、1% L-丙氨酰-L-谷氨酰胺、1 mmol/L 丙酮氨酸、0.1 mol/L HEPES 缓冲液、50 μmol/L β-巯基乙醇的培养基培养CD8+T 细胞,同时加入重组人IL-2(100 U/mL)。将细胞置于37 ℃、5%CO2恒温培养箱中,细胞培养至对数生长期时进行常规换液、传代。采用0.1 mol/L HEPES 缓冲液进行缓冲,培养过程中每24 h 更换1 次培养基,并进行以下分组。对照组:pH 值为7.2~7.4;pH 6.7 组:在对照组培养基中加入浓度为2 mol/L HCl,经pH 酸度计将培养基的pH 值调为6.7;pH 6.5 组:对照组培养基中加入浓度为2 mol/L HCl,经pH 酸度计将培养基的pH 值调为6.5;对照+雷帕霉素(Rapamycin)组:CD8+T 细胞在对照组培养基中培养3 d 后加入Rapamycin(20 nmol/L),继续将细胞培养至第10 天用于后续试验;pH 6.5+Rapamycin 组:CD8+T 细胞在pH 6.5 的培养基中培养3 d 后加入Rapamycin(20 nmol/L),继续将细胞培养至第10 天用于后续试验。
1.2.3 细胞计数 CD8+T 细胞经Human anti-CD3和Human anti-CD28 以1.5 μg/mL 的剂量刺激3 d,以2×105个/孔的细胞数量重新接种至48 孔细胞培养板中(每孔培养基体积为500 μL),分别置于对照、pH 6.7 和pH 6.5 的培养基中培养,每24 h 更换1 次培养基,并且每3 d(第3、6、9、12、15 天)用细胞计数仪进行细胞计数,根据细胞数量绘制细胞增殖曲线,计算细胞增殖能力。
1.2.4 流式细胞术检测细胞因子TNF-α 和IFN-γ的表达 CD8+T 细胞经Human anti-CD3 和Human anti-CD28(1.5 μg/mL)共同刺激3 d 后进行转板,在对照、pH 6.5 和pH 6.7 的培养基中继续培养7 d,并且每24 h 更换一次培养基。在培养第10 天时,收集细胞用新鲜的培养基重悬后加入PMA/离子霉素(PMA:50 ng/mL,离子霉素:5 μg/mL),置于96 孔板中刺激6 h 后离心收集细胞,进行流式染色。实验分为对照组、pH 6.7 组和pH 6.5 组,每组设3 个复孔,设置同型对照管。用FACS 缓冲液(含2%BSA 的PBS)配制活/死染料(1 ∶1 000 稀释)和FITC anti-Human-CD8(1 ∶300 稀释),室温避光染色30 min。FACS 缓冲液洗涤细胞后,用4%多聚甲醛冰上固定30 min。再次FACS 缓冲液洗涤,用破膜液(Permeabilization buffer)配制细胞因子抗体PE-TNF-α(1 ∶300 稀释)和APC-IFN-γ(1 ∶300 稀释),室温避光染色30 min,FACS 缓冲液洗涤后用流式细胞仪进行检测,结果用Flow Jo 8.1 软件进行数据分析。
1.2.5 qRT-PCR 检测细胞因子TNF-α和IFN-γmRNA 的表达 采用苯酚-氯仿抽提法,按照Trizol试剂说明书提取CD8+T 细胞总RNA,提取的RNA置于-80 ℃保存,按照NanoDrop One 微量核酸检测仪说明书对提取的RNA 测定浓度及纯度。取吸光度(A260nm/A280nm)值为1.8~2.0 的RNA 样本,按照逆转录试剂盒说明书将提取的RNA 逆转录为cDNA,样本置于-20 ℃保存。所有引物均用DNAMAN软件设计,并由金唯智公司合成,引物退火温度均为60 ℃。TNF-α上游引物序列:5'-CACG CTCTTCTGCCTGCT-3',下游引物序列:5'-GCTTGTC ACTCGGGGTTC-3';IFN-γ上游引物序列:5'-CTAA TTATTCGGTAACTGACTTG-3',下游引物序列:5'-ACAGTTCAGCCATCACTTGGA-3';ACTB上游引物序列:5'-CATGTACGTTGCTATCCAGGC-3',下游引物序列:5'-CTCCTTAATGTCACGCACGAT-3'。根据SYBR Green qPCR Mixture 试剂说明书配制PCR 反应体系,总体积为20 μL,包括:2×SYBR Green Master Mix 10 μL,cDNA 1 μL,10 μmol/L 上、下游引物各0.5 μL,DEPC 水8 μL。PCR 循环参数:95 ℃5 min;95 ℃30 s,60 ℃30 s,72 ℃40 s,共35 个循环。根据熔解曲线计算循环阈值(Ct)。所有样本均重复3 次,Ct 值取均值。以ACTB作为内参基因,TNF-α和IFN-γmRNA 的 相对表达水平以2-ΔΔCt法计算,公式:ΔΔCt =[(样本Ct目的基因-样本Ct管家基因)-(对照组Ct目的基因-对照组Ct管家基因)]。
1.2.6 Western bolt 检测mTOR 信号通路相关蛋白 CD8+T 细胞经 Human anti-CD3 和 Human anti-CD28(1.5 μg/mL)共同刺激3 d 后,在对照、pH 6.7 和pH 6.5 的培养基中继续培养7 d,收集细胞并加入RIPA 蛋白裂解液进行裂解,用BCA 试剂盒测定蛋白质浓度。将裂解后的蛋白质上清液加入适量上样缓冲液,高温变性后进行SDS-PAGE 电泳(浓缩胶电压80 V,分离胶电压120 V),将电泳分离的蛋白质转移至PVDF 膜(250 mA 转膜2 h),用100 g/L 脱脂奶粉封闭2 h 后分别加入兔抗人p-AKT(Ser473)抗体(1 ∶1 000 稀释)、兔抗人AKT抗体(1 ∶2 000 稀释)、兔抗人p-S6(Ser240/244)抗体(1 ∶1 000 稀释)、兔抗人S6 抗体(1 ∶2 000 稀释),鼠抗人β-actin 单克隆抗体(1 ∶5 000 稀释),4 ℃过夜,TBST 洗脱3 次,每次10 min,加入羊抗兔和羊抗鼠IgG 二抗(1 ∶5 000 稀释),室温2 h 后TBST 再次洗脱3 次,每次10 min,使用扫描成像仪进行扫描成像,以β-actin 作为内参,Image J 软件分析结果。
1.3 统计学分析 采用GraphPad Prism 7.0 软件进行统计学分析和作图。所有试验均独立重复3次,计量数据采用表示,两组均值比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 细胞计数仪检测不同pH 分组中CD8+T 细胞的增殖能力 随着CD8+T 细胞培养天数的增加,在pH 6.7 和pH 6.5 组中CD8+T 细胞的增殖速度较对照组明显缓慢,且pH 6.5 组增殖速度亦低于pH 6.7 组。见表1、图1。
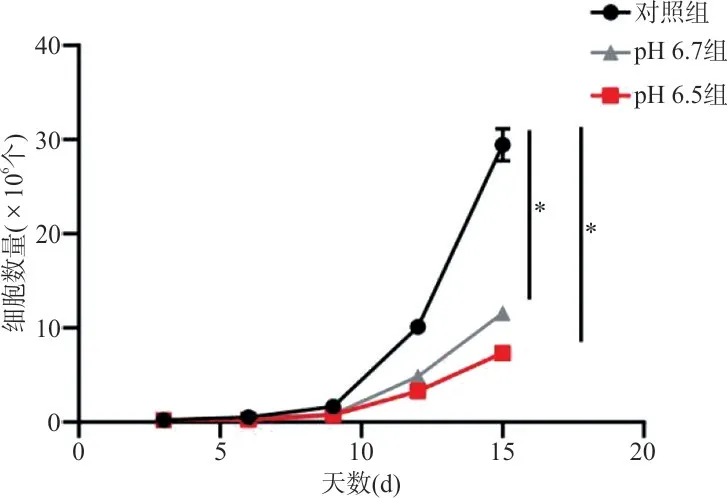
图1 不同pH 分组中CD8+T 细胞的生长曲线
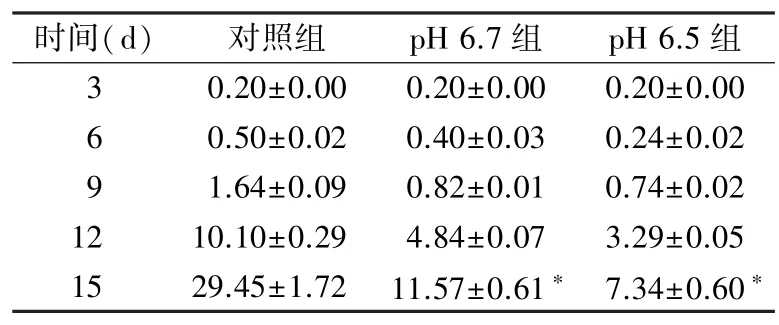
表1 不同pH 分组中CD8+T 细胞数量(×106 个)
2.2 流式细胞仪检测不同pH 分组CD8+T 细胞中细胞因子的表达 与对照组相比,pH 6.7 组中TNF-α+CD8+T 细胞的百分比(%)(25.60±2.69 vs 60.70±2.26,t=15.97,P<0.000 1)显著降低,IFN-γ+CD8+T 细胞的百分比(%)(14.60±1.70 vs 34.35±2.62,t=8.99,P=0.000 3)亦显著降低。与pH 6.7组相比,pH 6.5 组中TNF-α+CD8+T 细胞的百分比(%)(10.95±2.34 vs 25.60±2.69,t=6.67,P=0.001 6)显著降低,IFN-γ+CD8+T 细胞的百分比(%)(4.76±1.20 vs 14.60±1.70,t=4.48,P=0.012 5)亦显著降低。见图2。
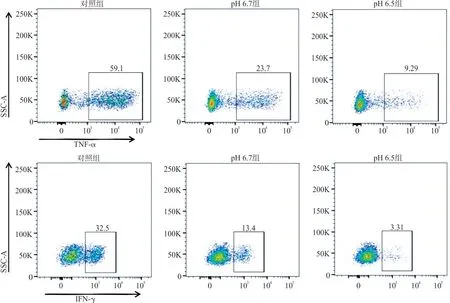
图2 不同pH 分组中CD8+T 细胞中TNF-α 和IFN-γ 的表达
2.3 qRT-PCR 检测不同pH 分组CD8+T 细胞中细胞因子的mRNA 水平 与对照组相比,pH 6.7 组TNF-αmRNA 的相对表达量(0.883±0.029 vs 1.035±0.018,t=4.516,P=0.002 1)显著降低,IFN-γmRNA的相对表达量(0.704±0.068 vs 0.888±0.062,t=5.450,P=0.000 4)亦显著降低;与pH 6.7 组相比,pH 6.5 组TNF-αmRNA 的相对表达量(0.671±0.016 vs 0.883±0.029,t=6.295,P=0.000 1)显著降低,IFN-γmRNA 的相对表达量(0.580±0.020 vs 0.704±0.068,t=3.688,P=0.009 3)亦显著降低。
2.4 Western blot 检测不同pH 分组中CD8+T 细胞AKT 蛋白和S6 蛋白的磷酸化水平 与对照组相比,pH 6.7 组中AKT 蛋白的表达水平差异无统计学意义(0.982±0.125 vs 1.010±0.078,t=0.623 9,P=0.898 7),AKT 蛋白在Ser473 位点的磷酸化水平(0.629±0.053 vs 1.055±0.045,t=9.326,P<0.000 1)显著降低。与对照组相比,pH 6.7 组中S6 蛋白的水平差异无统计学意义(1.030±0.109 vs 0.985±0.137,t=0.982 2,P=0.768 9),S6 蛋白在Ser240/244 位点的磷酸化水平(0.745±0.023 vs 0.991±0.037,t=5.391,P<0.000 1)显著降低。与pH 6.7组相比,pH 6.5 组中AKT 蛋白的表达水平差异无统计学意义(1.009±0.099 vs 0.982±0.125,t=0.584,P=0.910 6),AKT 蛋白在Ser473 位点的磷酸化水平(0.121±0.007 vs 0.629±0.053,t=11.12,P<0.000 1)显著降低,S6 蛋白的表达水平(1.125±0.075 vs 1.030±0.109,t=4.042,P=0.022 8)明显增加,S6 蛋白在Ser240/244 位点的磷酸化水平(0.246±0.026 vs 0.745±0.023,t=10.92,P<0.000 1)显著降低。见图3。
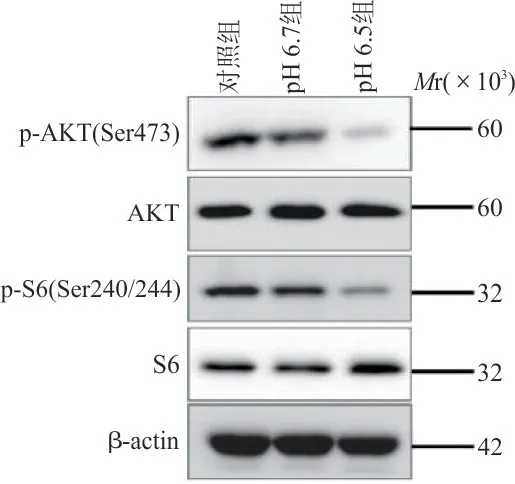
图3 不同pH 分组CD8+T 细胞中AKT 蛋白和S6 蛋白的磷酸化水平
2.5 流式细胞术检测经Rapamycin 作用后不同pH组中S6 蛋白磷酸化以及TNF-α 和IFN-γ 的表达水平 与对照组相比,对照+Rapamycin 组中S6 蛋白的磷酸化水平显著降低,pH 6.5 组中S6 蛋白的磷酸化水平亦显著降低;与pH 6.5 组相比,pH 6.5+Rapamycin 组中S6 蛋白的磷酸化水平显著降低,见图4A。与对照组相比,对照+Rapamycin 组中TNF-α+IFN-γ+CD8+T细胞的百分比(%)(35.10±2.69 vs 54.65±2.19,t=14.22,P<0.000 1)显著降低,pH 6.5 组中TNF-α+IFN-γ+CD8+T 细胞的百分比(%)(16.70±1.98 vs 54.65±2.19,t=27.61,P<0.000 1)显著降低;与pH 6.5 组相比,pH 6.5+Rapamycin组中TNF-α+IFN-γ+CD8+T 细胞的百分比(%)(0.51±0.38 vs 16.70±1.98,t=11.78,P<0.000 1)显著降低,见图4B。
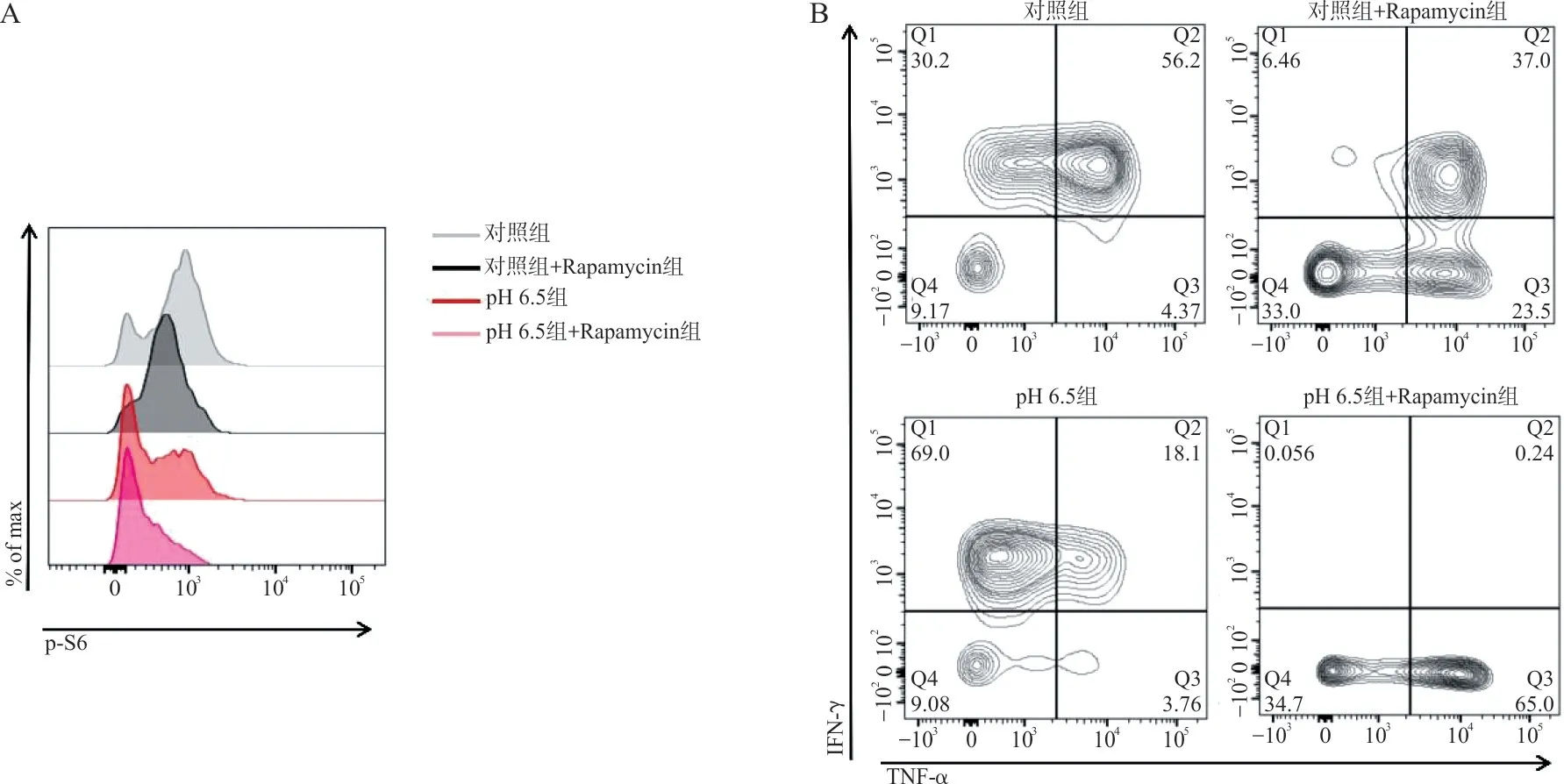
图4 抑制mTOR 后H+对CD8+T 细胞功能的影响
3 讨论
实体瘤常常伴有酸性TME,对T 细胞、NK 细胞的抗肿瘤免疫具有抑制作用[7]。有学者发现,乳酸对细胞毒性T 细胞(cytotoxic T lymphocyte,CTL)的增殖表现出较强的抑制作用,而恢复pH 后CTL 恢复至原来的状态,且单独的乳酸盐对CTL 的增殖没有影响[8]。体外实验也证实,将黑色素瘤患者的肿瘤浸润T 细胞置于pH 6.5 的酸性环境中,T 细胞反应性下降,IL-2 等细胞因子分泌受损[9]。由于活化的T 细胞内pH 值的变化会被T 细胞自身及时缓冲,因此酸性TME 对T 细胞的影响主要通过细胞外pH 值的变化而起作用。本研究利用不同H+浓度的培养基来模拟酸性TME,发现H+对CD8+T 细胞的增殖能力有明显的抑制作用,并且随着培养基的pH 值降低,抑制作用越强。此外,H+在mRNA和蛋白质水平上抑制CD8+T 细胞中TNF-α 和IFN-γ的表达水平,证实了H+对CD8+T 细胞的功能具有抑制作用。
mTOR 是一种重要的细胞能量代谢信号通路,能够整合来自细胞内外的营养物质及各种生长因子,参与调节T 细胞增殖与分化[10]。那么H+对T细胞功能的抑制作用是否与mTOR 信号通路有关呢?本研究发现H+抑制CD8+T 细胞中mTOR 信号通路的上游蛋白AKT 在Ser473 位点以及下游蛋白S6 在Ser240/244 位点的磷酸化,证实H+对T 细胞功能的抑制作用与mTOR 信号通路有关,且H+对mTOR 信号通路具有抑制作用。那么,H+能否通过mTOR 信号通路来抑制CD8+T 细胞的功能?笔者利用Rapamycin 对mTOR 信号通路进行了抑制,发现当H+和Rapamycin 共同作用时,与Rapamycin 或H+单独作用相比,CD8+T 细胞中TNF-α 和IFN-γ的表达量以及mTOR 下游蛋白S6 在Ser240/244 位点的磷酸化程度进一步降低,表明H+能够通过mTOR 信号通路抑制CD8+T 细胞的功能。
本课题组前期的研究已证实酸性TME 对T 细胞的功能具有抑制作用,本研究进一步探讨了TME中主导酸性环境的H+抑制T 细胞功能的机制,但未进行更深入的机制探究。此外,H+通过mTOR 信号通路调控何种对T 细胞功能起抑制作用的基因尚缺乏相关的实验进一步证实。在后续研究中,笔者将对于H+通过mTOR 信号通路下游靶基因影响T 细胞功能进一步进行相关探究,旨在为靶向酸性TME 的干预策略治疗肿瘤提供实验依据。
