广东惠州地区体检人群乙醛脱氢酶2 基因多态性分析
2023-10-11邓韵婷车玉传黄海勇陈嘉明吴显劲惠州市中心人民医院检验中心广东惠州516001
邓韵婷,车玉传,黄海勇,陈嘉明,吴显劲(惠州市中心人民医院检验中心,广东惠州 516001)
人线粒体乙醛脱氢酶2(acetaldehyde dehydrogenase 2,ALDH2)由ALDH2基因编码,该基因位于12 号染色体(12q24.2)上,由13 个外显子组成。ALDH2基因存在单核苷酸多态性(single nucleotide polymorphism,SNP)位点,其中以rs671 位点最为重要,出现在第12 外显子中,即1510 G>A 突变(ALDH2*2),使酶的第504 位氨基酸由谷氨酸(Glu)变为赖氨酸(Lys),导致蛋白质空间结构改变,从而影响酶的活性[1]。ALDH2基因型包括野生型GG(ALDH2*1/*1),其具有正常的酶催化活性;杂合突变型GA(ALDH2*1/*2),其只有约10%~45%的酶催化活性;纯合突变型AA(ALDH2*2/*2),其催化活性仅为1%~5%[2]。ALDH2 是酒精代谢过程中的关键酶,在体内酒精主要在肝脏代谢,先经过乙醇脱氢酶途径产生有毒产物乙醛,乙醛则由乙醛脱氢酶转化为无毒乙酸,最终代谢为水和二氧化碳,从而达到解毒作用[3]。ALDH2 对于体内氧化应激诱导的脂质衍生醛产物(如4-羟基壬烯酸等)的去除也发挥了重要作用,保护组织和细胞免受氧化损伤[4]。ALDH2基因rs671 位点突变导致的酶活性的减弱或丧失,使体内乙醛不能有效快速的转化,尤其在摄入酒精状态下,乙醛在体内蓄积,引发酒精性相关的肝脏疾病[3]。此外,ALDH2rs671 基因多态性与心血管疾病[4]、糖尿病[5]、癌症[6]、神经变性病[7]等的发生或发展具有一定联系。ALDH2同时还具有酯酶的活性,是催化硝酸甘油类药物在体内转化为一氧化氮,从而发挥药效的重要酶[8]。ALDH2rs671 基因多态性也影响个体使用硝酸甘油的药效。本研究通过检测惠州地区体检人群ALDH2rs671 基因型,分析惠州地区ALDH2基因多态性分布情况,以期为酒精危害防治、硝酸甘油的使用药效判断以及对疾病的发病风险评估提供数据参考。
1 资料与方法
1.1 研究对象 回顾性分析2021 年7 月至2022年10 月在惠州市中心人民医院进行ALDH2基因多态性检测且无血缘关系的体检健康人群样本2 057例,年龄16~83 岁,中位年龄47 岁。
1.2 试剂与仪器ALDH2基因突变检测试剂盒(PCR-荧光探针法,北京乐普诊断科技股份有限公司),7500 荧光定量PCR 仪(美国ABI 公司)。
1.3 方法 采集各受检者就诊时的EDTA-K2抗凝血1 mL,按照试剂盒说明书配制并分装ALDH2-G和ALDH2-A 反应液,加入1 μL 全血DNA 模板,按以下条件进行PCR 扩增:95 ℃5 min;98 ℃10 s,60 ℃40 s(检测荧光信号),45 个循环。根据样本在ALDH2-G 管和ALDH2-A 管扩增曲线的Ct 差值,定义ALDH2分型。试剂的分型设计基于SNP 位点设计的特异性引物,即3'端最后1 个碱基为野生型碱基或突变型碱基。野生型引物在野生型样本中与靶标完全匹配,其扩增效率高(Ct 值小),而突变型引物与野生型样本在3'端存在1 个碱基的差异,导致其在野生型样本中的扩增失败或扩增效率低(Ct 值大);反之,在纯合突变型样本中,则突变型引物的扩增效率高于野生型引物,即突变型引物扩增的Ct 值小于野生型引物的Ct 值;若样本的靶标是杂合型,则野生型引物和突变型引物的扩增效率相当,即两者的Ct 值接近。通过扩增效率差值判断纯合或杂合,其中野生型GG:CtA-CtG>5;杂合突变型GA:|CtG-CtA|<3;纯合突变型AA:CtGCtA>5。
1.4 统计学分析 使用SPSS 25.0 软件进行统计学分析,计数资料以率(%)表示。基因型频率Hardy-Weinberg遗传平衡分析采用χ2检验,不同年龄组ALDH2基因型分布采用Kruskal-WallisH检验,并将惠州地区ALDH2基因型分布频率分别与文献报道的其他国家及地区的ALDH2基因型分布频率进行比较,两地区间基因多态性频率分布的差异比较采用2×2 列表的χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1ALDH2G1510A 基因分型结果 本研究样本检出的ALDH2基因型共有3 种,分别为野生型GG:ALDH2*1/*1;杂合突变型GA:ALDH2*1/*2;纯合突变型AA:ALDH2*2/*2。
2.2 体检人群ALDH2G1510A 基因分型结果和Hardy-Weinberg 遗传平衡分析 2 057 例体检人群样本ALDH2rs671 基因型结果见表1,基因型GG频率为58.48%,GA 频率为35.88%,AA 频率为5.64%;ALDH2G 等位基因和A 等位基因的频率分别为76.42%和23.58%。对基因型检测数据进行Hardy-Weinberg 遗传平衡分析,差异无统计学意义(χ2=0.025,P=0.988),本次检测结果符合Hardy-Weinberg 遗传平衡,样本具有区域群体代表性。
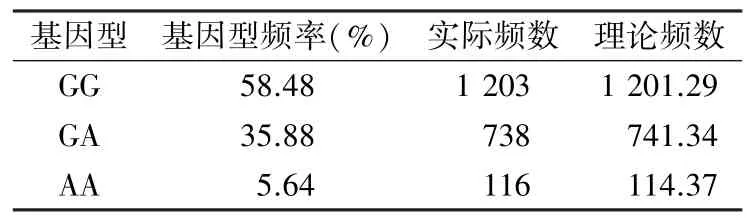
表1 Hardy-Weinberg 遗传平衡检验
2.3 本地区不同年龄组体检人群ALDH2rs671 基因型分布情况 本次研究以每10 岁分为1 个年龄组,30 岁及以下和60 岁及以上各单独分为1 个年龄组,将研究人群分为5 个年龄组,不同年龄组基因型分布进行Kruskal-WallisH检验,其差异无统计学意义(P=0.488),结果见表2。
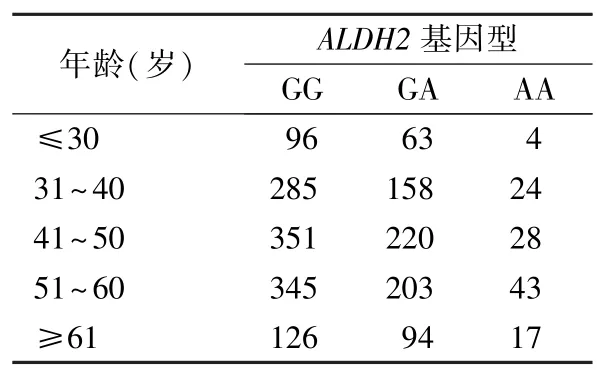
表2 惠州地区不同年龄组人群ALDH2 rs671 基因型分布情况(n)
2.4 本地区与我国其他地区及邻国ALDH2rs671基因型分布情况的比较 本地区与江苏、湖南省比较,ALDH2基因型分布差异无统计学意义(P>0.05),但与北京、四川、山东和山西等省市比较差异有统计学意义(P<0.05),此外,与日本、韩国、泰国等国家比较差异亦有统计学意义(P<0.05),结果见表3。

表3 惠州与我国其他地区及邻国ALDH2 rs671 基因型分布情况比较(n)
3 讨论
ALDH2 主要存在于肝脏、肾、心、肺、脑和其他组织细胞的线粒体中。肝脏是酒精代谢的主要器官,而ALDH2 是酒精代谢过程中的关键酶,负责酒精代谢过程中产生的有毒产物乙醛的转化。就酒精摄入而言,纯合型基因ALDH2*2/*2 患者ALDH2 活性缺失,不能代谢乙醛,而杂合型基因ALDH2*1/*2代谢乙醛能力急剧降低(损失>90%活性)[16]。携带*2 等位基因人群饮酒后血乙醛浓度达峰时间较携带*1 等位基因的人群提前,且饮酒后1~6 h血乙醛浓度高于携带*1 等位基因的人群[17]。醛分子非常活泼且不稳定,能与细胞组分迅速反应,产生无生理功能的醛加合物[16],形成的醛加合物不断累积,引起细胞功能障碍,从而引起各种疾病发生。对于携带*2 等位基因人群,由于乙醛在细胞中过度积累,会产生脸红反应、潮红伴有头痛、出汗、心动过速、心悸、恶心,之后出现嗜睡等各种不适[16],尤其是纯合携带者,所以纯合携带者反而不容易酗酒,成为1 个保护因素。但对于携带突变基因的个体若长期保持喝酒行为,乙醛在肝细胞大量蓄积,乙醛及其衍生加合物引发肝细胞损伤,引起肝脏炎症、纤维化、脂肪变性、肝硬化等酒精性相关的肝脏疾病甚至肝癌[3,16]。携带突变基因加上饮酒因素还可使上呼吸道/消化道(包括口腔、口咽、下咽、喉和食管)、胃部、结直肠等部位患癌风险增加[6]。因此,对于携带*2 突变的个体应限制饮酒,尤其纯合突变个体更应远离酒精。
ALDH2基因多态性的检测对于心血管疾病的治疗也有重要意义。硝酸甘油(甘油三硝酸酯,GTN)是治疗急性心绞痛和慢性心力衰竭时最常用的药物。舌下含服硝酸甘油是大众医学科普中为人熟知的“心痛救命药”。ALDH2 同时具有硝酸酯酶活性,是负责体内GTN 生物转化为一氧化氮(NO)的酶,从而引发cGMP 介导的血管舒张而起效。当ALDH2 酶活性下降或者受抑制时,不能产生足够浓度的NO 达到保护心脏的作用[8]。对于携带*2 突变个体,由于酯酶活性的急剧下降,舌下含服硝酸甘油很可能失效,从而延误治疗的时间。因此,对于有心绞痛病史的患者应进行ALDH2基因多态性的筛查,突变携带者避免使用硝酸酯类药物。ALDH2 对于机体应激状态下产生的内生醛(如4-羟基壬烯醛和丙二醛等)的清除也发挥重要作用,可避免后续的氧化损伤。有研究发现在急性心肌梗死(acute myocardial infarction,AMI)发生时缺血再灌注(I/R)过程中形成大量的醛可导致有害的级联反应,损害心功能并引起心律失常。及时使用ALDH2 激活剂(如Alda-1)可以极大地提高ALDH2的活性,激活的ALDH2 可以去除更多有毒的醛,并通过不同的信号通路产生心脏保护作用,这对ALDH2*2 携带者特别重要[4,18]。有心血管疾病的人群进行ALDH2基因多态性检测,可指导硝酸甘油的个体化用药,避免药物使用无效,并且在发生心梗等心血管事件时可指导临床的治疗。Jiang 等[19]通过多中心病例对照分析,发现即使在不饮酒的中国人群中,ALDH2变异也与AMI 的风险相关,提示ALDH2变异可能是AMI 的独立危险因素。Nannelli 等[20]概述了ALDH2 在维持内皮细胞功能上的重要作用,证实其活性改变与氧化应激和衰老相关,并参与衰老相关的动脉粥样硬化和神经退行性疾病的发展,ALDH2rs671 可能成为这些疾病预防或治疗的靶点。
ALDH2基因多态性存在种族差异和地域差异。白种人和非洲人群突变携带率很低,主要为亚洲黄种人群携带,在世界范围内ALDH2基因多态性突变主要集中在东亚(如中国、日本、韩国等),大约40%的东亚人口携带,约占世界人口的8%。研究表明ALDH2*2 突变体可追溯到我国中原地区的汉族祖先,在随后的几千年里随着人群南迁并在东亚地区继续传播[21]。在我国不同民族间携带率也存在差异,汉族是携带突变的主要人群,蒙古族或维吾尔族发生率较低[21]。不同地区间的汉族人群ALDH2基因突变携带率也有差异[7-10],东南部的闽南和粤东地区的汉族(客家人和闽南人)携带率最高[21]。携带率整体呈现南高北低的趋势,南方地区*2 等位基因携带率高于北方[22],东南部的频率最高,并从东南部开始频率呈放射状逐渐下降[21]。本研究中惠州地区携带率高于北京、山东、山西等北方地区,差异有统计学意义,而与江苏、湖南等南方地区的差异无统计学意义,但与四川比较存在差异,符合南方地区*2 等位基因携带率高于北方地区的趋势,但南方地区不同省份间还是存在差异,东南部携带率比西南部高。其机制可能与气候、环境、社会文化等因素相关[23]。惠州地区携带率与邻国日本、韩国、泰国等也存在差异,日本携带率更高,韩国的携带率较低,泰国的携带率更低,这种差异可能与种族起源、遗传漂移和地理环境分布有关[23]。惠州地区处在客家文化、广府文化和潮汕文化的交汇地带,各种文化的交流促使人口的流动,也可能形成本地区特有的基因遗传多态性分布。本研究提供了惠州地区体检人群ALDH2*2等位基因流行率的报告,为研究本地区的ALDH2基因遗传多态性分布提供必要的数据。惠州地区杂合突变型(GA)和纯合突变型(AA)个体占总研究群体的41.52%,有着较高的突变携带率,在本地区进行个体ALDH2基因多态性的筛查,找出突变携带者以便进行必要的健康指导,具有非常重要的意义。
本文为回顾性研究,选取的是进行ALDH2基因多态性检测的体检人群,研究对象年龄段集中在30 至60 岁间,将该人群分为5 个年龄组,结果显示每一年龄组间ALDH2基因型多态性分布没有明显差异。本研究收集的2 057 例基因型检测数据符合Hardy-Weinberg 遗传平衡,说明本样本具有区域群体代表性。但本研究只进行了人群中ALDH2基因多态性的分布特点分析,后续将深入研究不同基因型别人群具体的体检检测指标的差异,探讨ALDH2基因多态性对于人群基础健康水平是否有影响。
