基于UPLC/LTQ Orbitrap Velos MS 的创伤性脑损伤代谢组学分析*
2023-10-11周惠惠程桂青田璐周愿李洪春徐州医科大学医学技术学院江苏徐州22004徐州医科大学附属医院检验科江苏徐州22002
周惠惠,程桂青,田璐,周愿,李洪春,2(.徐州医科大学医学技术学院,江苏徐州 22004;2.徐州医科大学附属医院检验科,江苏徐州 22002)
创伤性脑损伤(traumatic brain injury,TBI)是由外力作用而导致的脑部损伤,具有较高的死亡率和致残率,是严重威胁人类健康的公共卫生问题之一[1]。格拉斯哥昏迷评分(glasgow coma scale,GCS)等认知测试具有快速、低成本、无创、易于应用的特点,但由于受检查者的主观判断影响,通常只作为TBI 的筛查方法[2-3]。颅脑创伤患者脑监测技术中国专家共识[4]指出,强烈推荐影像学检查作为首选辅助检查,推荐脑生物学标志物检测,如胶质纤维酸性蛋白和泛素羧基末端水解酶L1 用于识别轻度TBI 患者[5]。但影像学技术费用昂贵,且使许多患者暴露于不必要的电离辐射,增加急诊科的负担[6],故而开发新的血清生物学标志物有助于提高临床决策规则的作用。本研究旨在利用非靶向和靶向代谢组学方法探索新的TBI 潜在生物学标志物,用于辅助早期诊断、判断病情及预后,并加深对TBI 代谢改变的认识,以期寻找治疗靶点。
1 材料和方法
1.1 研究对象 选取徐州医科大学附属医院2022年8 月至12 月就诊的TBI 患者(TBI 组)和体检健康者(健康人对照组)各40 例进行非靶向分析筛选和靶向分析验证。TBI 患者GCS 评分在入院12 h内根据睁眼反应、语言反应和运动反应3 个方面进行评估,分为重型(3~8 分,n=19),中型(9~12 分,n=13)和轻型(13~15 分,n=8);格拉斯哥预后评分(glasgow outcome scale,GOS)在患者伤后6 个月进行评估,分为预后不良组(1~3 分,n=27)和预后良好组(4~5 分,n=13)。收集所有受试者的一般信息和实验室检测指标等临床资料。本研究经徐州医科大学附属医院伦理委员会批准(XYFY2022-KL373-02),所有受试者均知情同意。
1.2 仪器与试剂 Acquity 高效液相色谱仪(美国Waters 公司),LTQ Orbitrap Velos 高分辨质谱仪(美国赛默飞世尔科技公司),5430R 离心机(德国Eppendorf 公司)。色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm);流动相中A 相:水(含0.1%甲酸+2%乙腈),B 相:乙腈(含0.1%甲酸+2%水);柱温:45 ℃;流速:0.2 mL/min;流动相梯度体系:0 min,5% B;0~15 min,5%~95% B;15~15.2 min,95%~5% B;15.2~20 min,5% B。乙腈、甲醇(美国赛默飞世尔科技公司)。
1.3 样本制备 规范采集TBI 患者创伤12 h 内及6 个月后的空腹静脉血标本,4 ℃、3 000 r/min 离心10 min,移取100 μL 上清液置于1.5 mL 离心管中,加入300 μL 蛋白质沉淀剂(甲醇∶乙腈体积比=2 ∶1)涡旋震荡1 min,4 ℃、13 000 r/min 离心10 min,取上清液300 μL 置于离心浓缩仪中干燥,加入100 μL 乙腈∶水(体积比=1∶1)复溶,13 000 r/min 离心10 min,取上清加入进样小瓶,用于质谱检测。
1.4 质谱检测 超高效液相色谱-线性离子阱/静电场轨道阱组合式高分辨质谱(UPLC/LTQ Orbitrap Velos MS)步骤:进样量为5 μL,载气为氮气,流速恒定为0.2 mL/min,柱温为45 ℃。MS 设置:DDA 模式,电喷雾毛细管电压(正离子为2.5 kv;负离子为1.5 kv),毛细管温度为320 ℃,扫描范围为70~1 000 m/z,锥孔电压为25 V,锥空气流速为50 L/h,最大进样时间为100 ms,动态排除为50 s,MS 分辨率为30 000,MS2 分辨率为17 500。
1.5 数据处理及统计学分析 采用MS-DIAL 5.0软件对原始光谱进行数据预处理获得峰强度矩阵,将数据导入SIMCA 14.1 软件进行多元变量统计分析,包括主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),交叉验证采用R2X、R2Y、Q2等参数评价OPLS-DA模型质量,通过200 次置换检验评价模型拟合程度。设置单变量统计分析t检验中P<0.05 和倍数变化(fold change,FC)>2 或<0.5,OPLS-DA 变量投影重要度(variable influence on projection,VIP)>1,作为差异代谢物筛选条件。用MetaboAnalyst 5.0软件将差异代谢物导入京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行差异代谢物富集通路分析和分层聚类。采用SPSS 26.0 软件进行统计分析,符合正态分布的计量资料以均数±标准差()表示,不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,计数资料以n和%表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;相关性分析采用Pearson 相关分析,以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组受试者一般临床特征和生化指标分析TBI 组血清天冬氨酸氨基转移酶和葡萄糖水平显著高于健康人对照组,前清蛋白、总蛋白、清蛋白、球蛋白、肌酐、尿酸、半胱氨酸蛋白酶抑制剂C、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇水平显著低于健康人对照组,差异均有统计学意义(P<0.05)。两组受试者年龄、丙氨酸氨基转移酶、尿素和三酰甘油之间的差异无统计学意义。见表1。
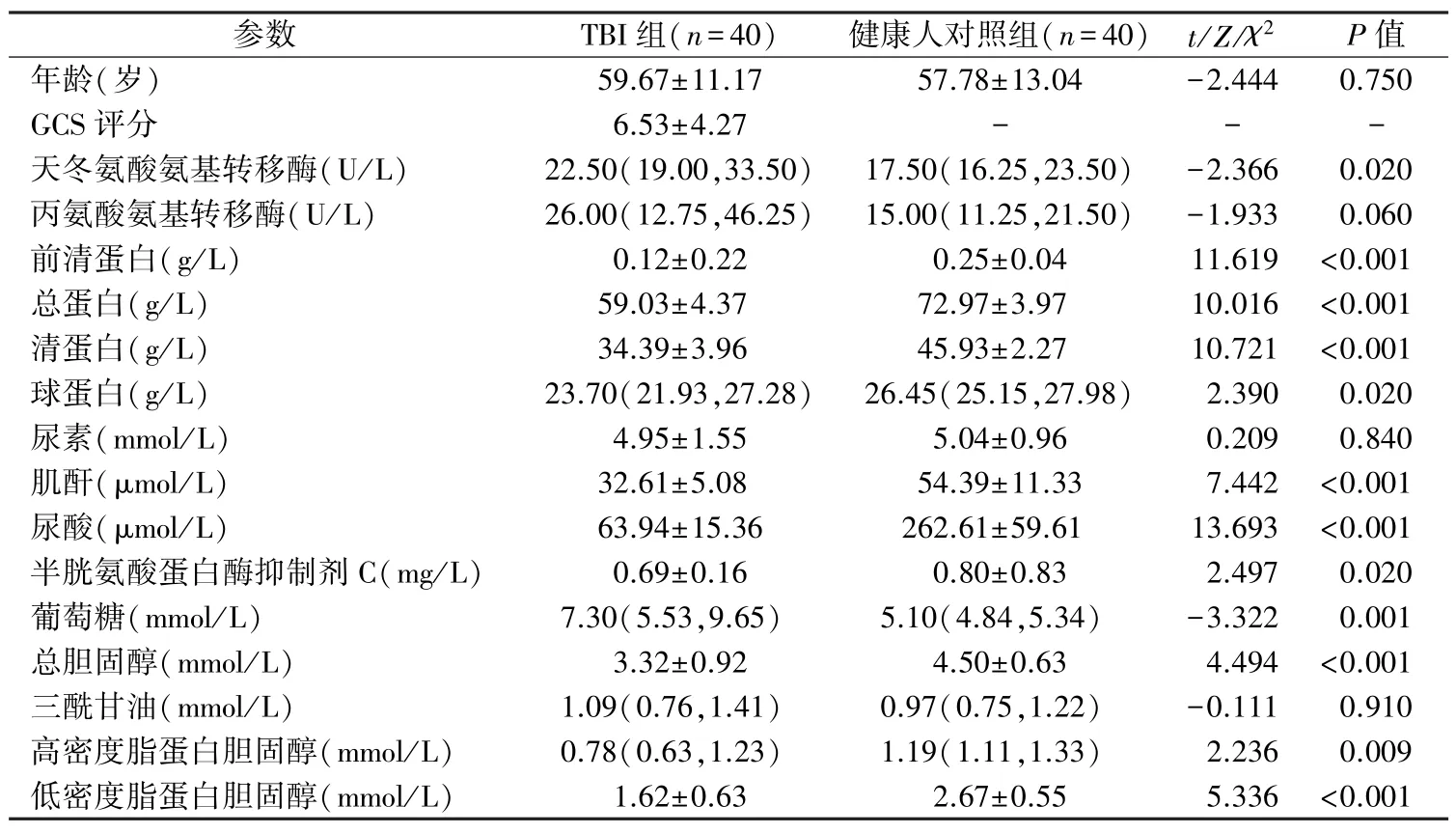
表1 TBI 组和健康人对照组一般临床特征和生化指标
2.2 两组代谢模式对比结果 根据峰强度进行PCA 和OPLS-DA 分析。PCA 分析显示(图1A、1B)两组样本代谢物存在显著差异,阳离子模式R2X(cum)和Q2分别为0.831 和0.621;阴离子模式R2X(cum)和Q2分别为0.971 和0.996。OPLS-DA分析显示组间存在显著差异(图1C、1D),阳离子模式R2X(cum)=0.808,R2Y(cum)=0.942,Q2=0.754;阴离子模式R2X(cum)=0.939,R2Y(cum)=0.936,Q2=0.874。200 次置换试验(图1E、F)阳离子模式R2Y和Q2分别为0.203 和-0.479,阴离子模式R2Y和Q2分别为0.319 和-0.364。火山图用于反映血清中差异代谢物的总体分布情况,见图2。
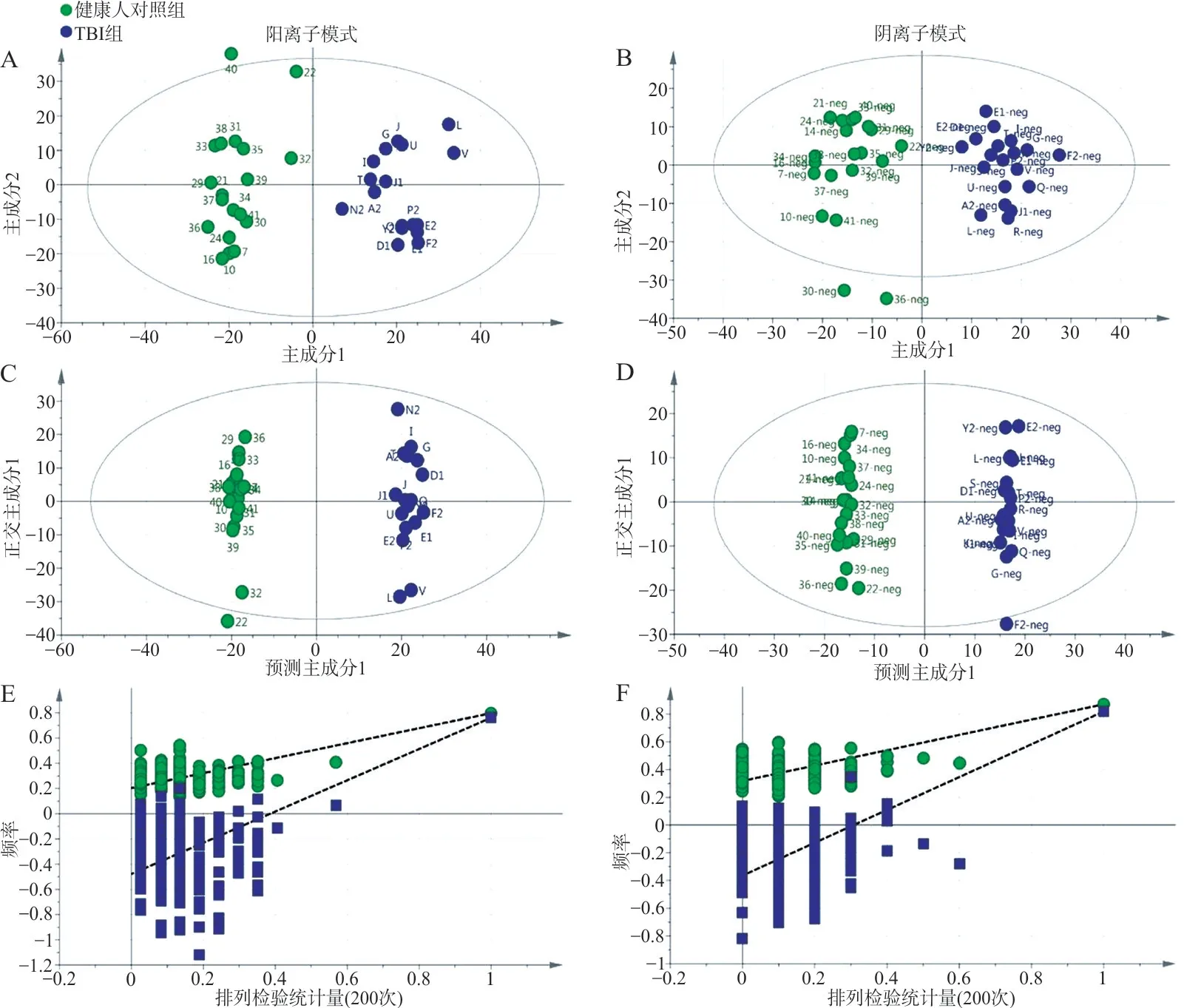
图1 TBI 组与健康人对照组代谢谱
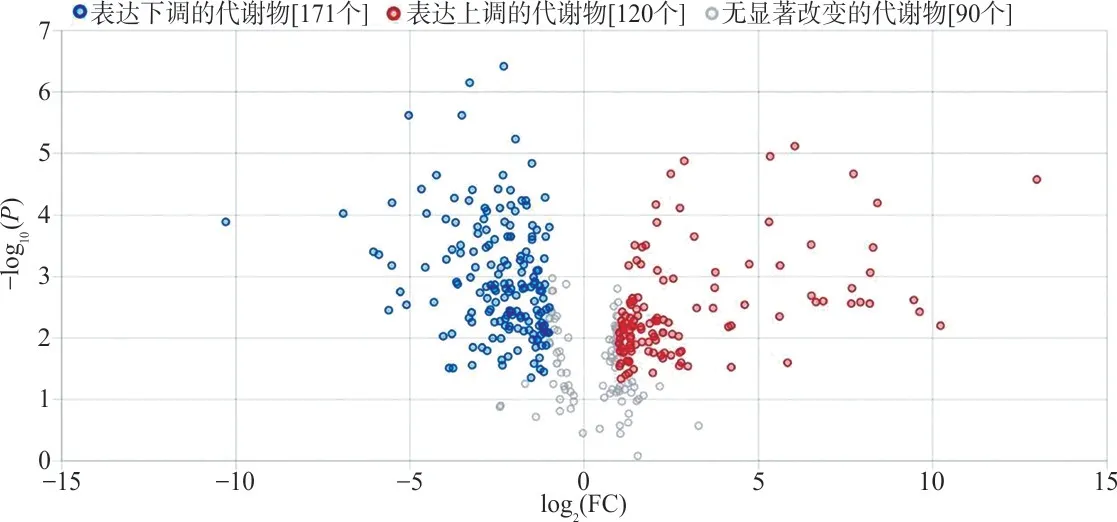
图2 TBI 组与健康人对照组差异代谢物火山图
2.3 TBI 患者差异代谢物的筛选结果 根据VIP>1、P<0.05、FC>2 或<0.5 筛选出74 个差异代谢物,选择丰度变化最大的前50 个差异代谢物绘制热图,观察代谢物的全局表达量和聚类关系。见图3。

图3 TBI 组与健康人对照组差异代谢物热图
2.4 TBI 患者差异代谢物KEGG 富集通路分析结果表明,与健康人对照组相比,TBI 组存在6 个显著代谢富集通路,分别为:(1)不饱和脂肪酸生物合成;(2)氨酰基-tRNA 生物合成;(3)精氨酸生物合成;(4)丙氨酸、天冬氨酸和谷氨酸代谢;(5)柠檬酸循环(TCA 循环);(6)苯丙氨酸、酪氨酸和色氨酸生物合成。见图4。
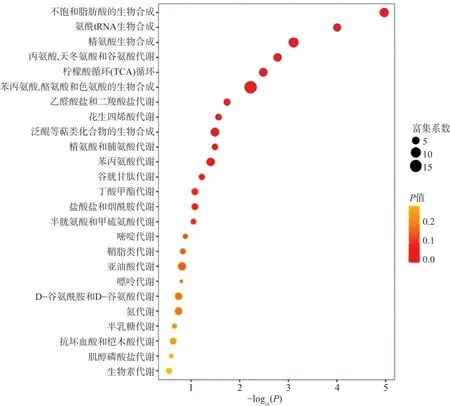
图4 TBI 组与健康人对照组代谢富集通路分析
2.5 TBI 患者候选生物学标志物的筛选和验证将74 个差异代谢物绘制ROC 曲线,根据AUCROC>0.7 筛选出14 个候选生物学标志物,再对所有血清样本进行靶向定量分析,最终明确谷氨酸、乳酸、尿酸和肌酐与非靶向代谢结果一致。见表2。
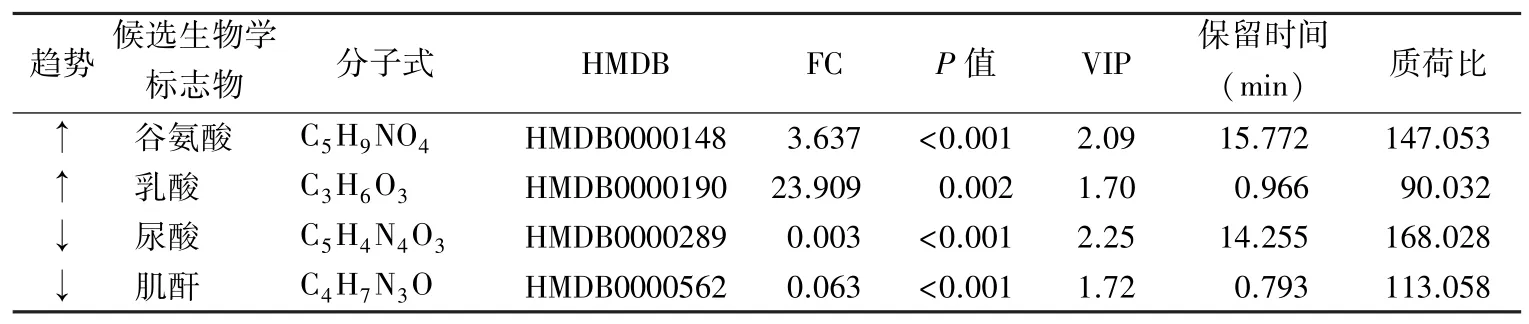
表2 TBI 组和健康人对照组候选生物学标志物筛选结果
2.6 不同严重程度TBI 组与健康人对照组差异代谢物水平比较 TBI 组不同严重程度的血清谷氨酸和乳酸水平均显著高于健康人对照组,尿酸和肌酐水平均显著低于健康人对照组,差异有统计学意义(P<0.05);随着TBI 病情加重,患者血清谷氨酸和乳酸浓度逐渐升高,尿酸和肌酐浓度逐渐降低,差异有统计学意义(P<0.05)。见表3。
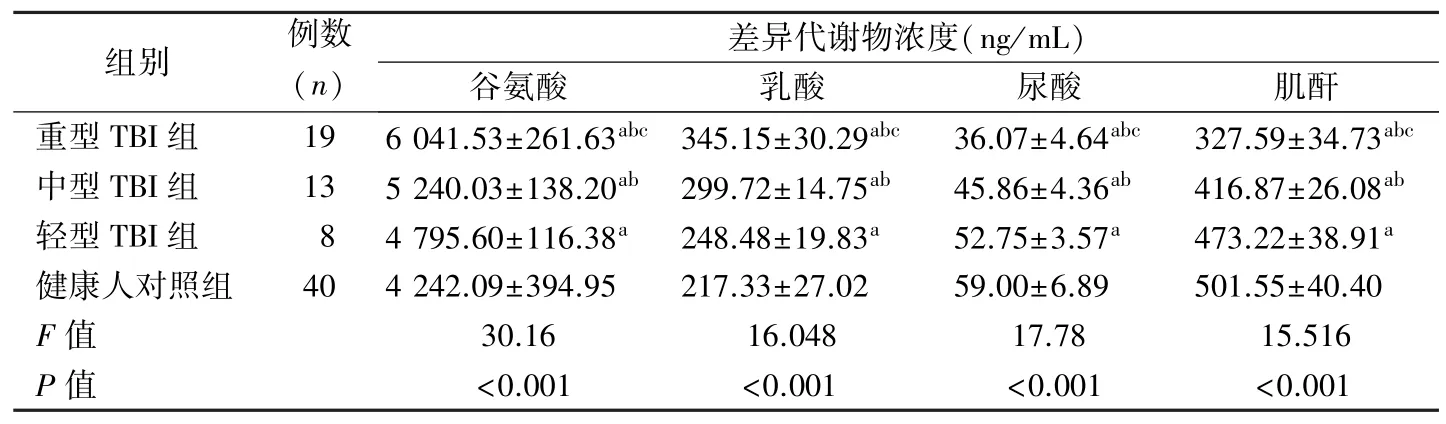
表3 不同严重程度TBI 组与健康人对照组差异代谢物水平比较
2.7 预后良好组与预后不良组差异代谢物水平比较 预后不良组血清谷氨酸和乳酸浓度高于预后良好组,尿酸和肌酐浓度低于预后良好组(P<0.05)。见表4。
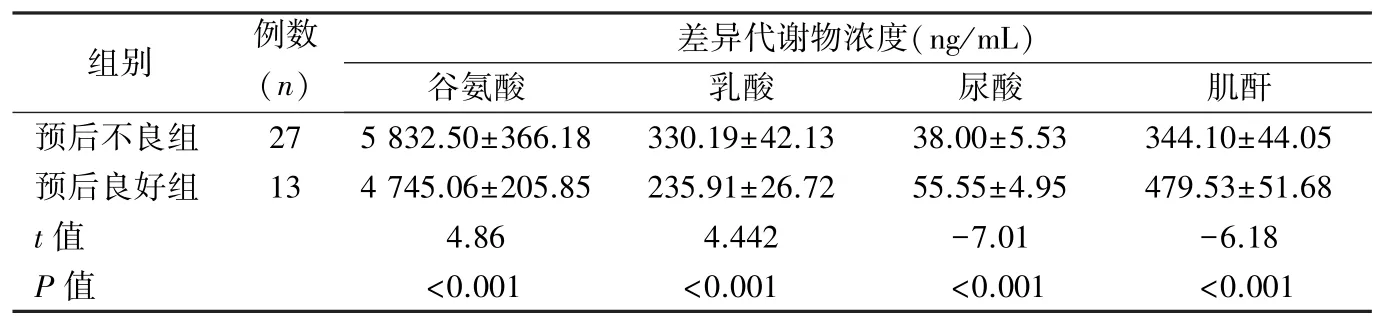
表4 TBI 患者预后良好组与预后不良组差异代谢物水平比较
2.8 相关性分析结果 40 例TBI 患者Pearson 相关性分析结果见表5。其中谷氨酸和乳酸水平与入院12 h 的GCS 评分和伤后6 个月的GOS 评分呈负相关,而尿酸和肌酐与其呈正相关(P<0.05)。
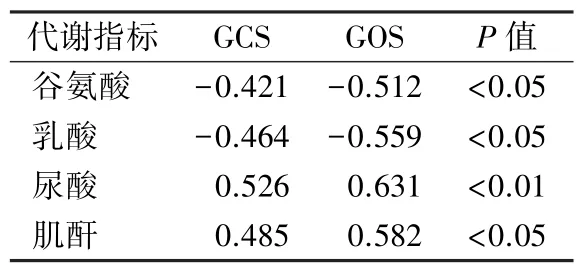
表5 TBI 患者Pearson 相关性分析(r)
2.9 影响预后不良的ROC 曲线分析 谷氨酸、乳酸、尿酸、肌酐单项和四者联合的代谢物组AUCROC分别为0.691、0.732、0.688,0.677 和0.818,联合检测提高了预测TBI 预后不良的敏感性(76.9%)和特异性(81.5%)。见表6。
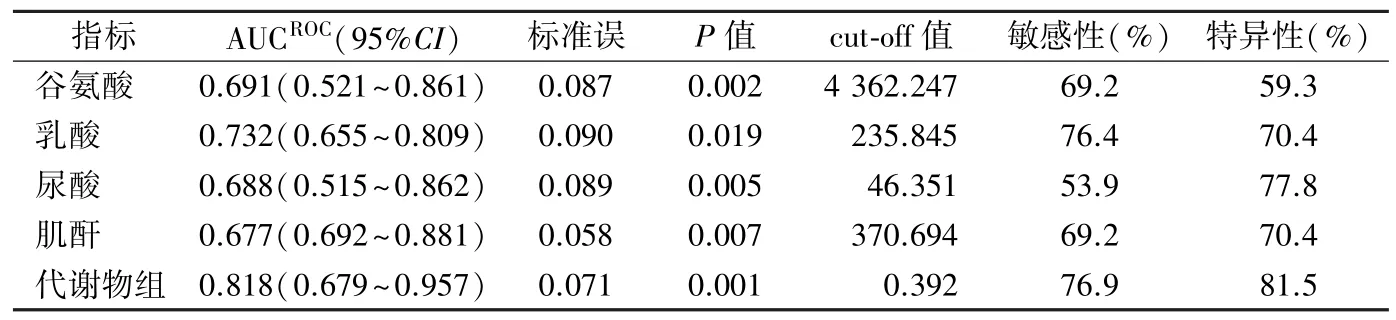
表6 谷氨酸、乳酸、尿酸和肌酐预测预后不良的ROC 曲线模型参数
3 讨论
TBI 机制复杂多样,与神经退行性疾病的关系尚未阐明,不同严重程度的TBI 也需要不同的治疗策略。目前TBI 的检测主要依赖于影像学,但存在早期漏检的问题。本研究以血清样本为研究对象,探讨了TBI 患者代谢谱的差异,结果证实谷氨酸、乳酸、尿酸、肌酐为可靠的差异代谢物,不饱和脂肪酸的生物合成是TBI 受影响最大的代谢富集通路,并将代谢物与病情严重程度和预后联系起来。笔者选择了40 例TBI 患者,将其按照入院12 h GCS评分和伤后6 个月GOS 评分进行分组,结果发现这4 种差异代谢物在不同严重程度和预后的患者之间也存在差异,四者联合预测预后的AUCROC为0.818,敏感性和特异性分别为76.9%和81.5%。
谷氨酸和乳酸是糖类代谢的重要中间产物。TBI 后脑组织损伤中断大脑有氧氧化过程,导致机体代偿性生成谷氨酸和乳酸。谷氨酸与草酰乙酸转氨基生成α-酮戊二酸,维持三羧酸循环能量供应[7],并转化为谷氨酰胺进入神经元,参与神经传递[8];另一方面,谷氨酸作为中枢神经系统兴奋性神经递质,在突触大量释放后激活相应的N-甲基-D-天冬氨酸受体和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体,介导钙流入神经元调控蛋白的信号转导和磷酸化/去磷酸化,导致线粒体功能障碍和神经元凋亡[9-10];同时钙促进活性氧自由基(reactive oxygen species,ROS)的产生激活了磷脂酶A2 介导的炎症反应[11]。有文献报道大量谷氨酸的兴奋性毒性是导致进行性神经功能衰退的重要因素[12];另有研究表明,外源性乳酸可能成为脑损伤和神经退行性疾病的潜在治疗干预手段[13-14]。本研究中TBI 患者谷氨酸和乳酸升高,且随着病情加重逐渐增加,谷氨酸的神经毒性可能继发一系列神经退行性改变,乳酸对抗脑损伤引起的脑水肿、脑细胞死亡和神经代谢异常,故而在创伤早期提高血清乳酸水平可能缓解早期脑水肿症状,预防损伤进一步发生。
尿酸和肌酐是人体内的抗氧化剂,具有对抗氧化应激保护神经,激活神经干细胞增殖,参与神经损伤修复的作用[15]。He 等[16]发现TBI 患者和脑肿瘤手术患者血清尿酸水平均下降,且下降水平与GCS 评分相关;还有研究表明,帕金森患者血清尿酸水平随着疾病的进展而下降[17];Zheng 等[18]发现血清尿酸和肌酐联合其他预后因素可帮助预测男性TBI 患者的预后;此外,另有研究证实血清肌酐水平与全因痴呆相关[17]。上述研究与本研究结果相一致,TBI 患者血清尿酸和肌酐水平低于健康人对照组,且病情越严重,尿酸和肌酐水平越低,与入院12 h GCS 评分和伤后6 个月GOS 评分呈正相关,生化结果也一致显示尿酸水平降低,因此联合测定肌酐和尿酸水平对创伤后评价肾脏功能、疾病严重程度及预防并发症具有重要意义。曹朝梁[19]研究认为TBI 后血尿酸升高且随着严重程度增加,尿酸水平越高,患者预后越差。与本研究结果相反,但具体原因有待收集更多样本进一步验证。
本研究存在以下不足之处:首先,TBI 的诊断是基于临床症状和影像技术,可能会遗漏低能损伤患者;其次,脑脊液是反映血脑屏障破坏最理想样本,由于是有创操作,本实验仅收集血清样本进行代谢组学分析,后续将扩大样本量并收集多元化样本进行比较。
