1 298 例耐甲氧西林金黄色葡萄球菌医院感染分布情况及易感因素分析
2023-10-10段德令罗爱武龚娅邱丽莉肖佳玉
段德令,罗爱武,龚娅,邱丽莉,肖佳玉
医院感染是全球医院面临的重要问题,抗生素的滥用导致大量耐药性微生物产生,耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus, MRSA)在1961 年被英国首次报道,其通过基因突变、获得外源性基因等方式适应了持续增长的抗生素选择压力。MRSA 对青霉素、耐酶青霉素(甲氧西林、氟氯西林)耐药,对大环内酯类、氨基糖苷类药物也会产生多重耐药,已成为医院感染的重要原因[1-2]。近年来MRSA 感染率呈逐年递增趋势,其特点为感染部位多、流行范围广、多重耐药性、难以处理等[3]。为阻断MRSA 在医院内的传播,本研究对2018 年1 月至2022 年7 月于南部战区总医院接受诊疗患者的细菌培养阳性标本进行回顾性分析,重点调查MRSA 医院感染的分布情况,并分析MRSA 院内感染的易感因素,为医院MRSA 针对性防治提供数据参考,现报道如下。
1 资料与方法
1.1 菌株来源 选取2018 年1 月至2022 年7 月在南部战区总医院住院治疗的31 672 例患者细菌培养阳性标本,包含病灶组织、分泌物(伤口及眼等)、尿液、痰液、导管及导管血等,剔除同一位患者相同位置重复分离检出的菌株。根据是否存在MRSA 感染,将31 672 例患者分为MRSA 感染组(n=1 298)与非MRSA 感染组(n=30 374)。
1.2 方法 使用全自动微生物鉴定及药敏分析系统(法国生物梅里埃公司,型号:VITEK-2Compact型)筛选阳性标本。分析2018-2022 年各年份的细菌检出率,分析MRSA 的来源分布、感染部位分布。MRSA、耐万古霉素金黄色葡萄球菌(vancomycin resistant S.aureus, VRSA)感染判断依据为《医院感染诊断标准(试行)》[4]。收集患者年龄、性别、住院时间、侵入性操作等资料,分析MRSA 易感因素。
1.3 统计学处理 以软件SPSS 22.0 进行统计分析,采用 Shapiro-Wiktest 检验评估计量资料的正态性,正态分布的计量资料以±s表示,比较组间连续变量采用t检验或方差分析,偏态分布的计量资料以M(P25,P75)表示,采用Wilcoxon 秩和检验,计数资料以百分比(%)表示,采用χ2检验或Fisher确切概率法。单因素中存在统计学意义的指标进行多因素Logistic 回归差异分析。自变量赋值情况为年龄:<70 岁=1、≥70 岁=1;合并≥2 种基础疾病:是=1、否=0;侵入性操作≥2 种:≥3 种=3、2 种=2、1 种=1;气管切开或插管:是=1、否=0。因变量赋值为MRSA 感染:是=1,否=0。P<0.05 表示差异有统计学意义。
2 结果
2.1 2018-2022 年31 672 例患者MRSA 阳性检出情况 31 672 例患者中共检出MRSA 阳性1 298 例,检出率4.10%,其中有4 例患者检出VRSA。其中男性1 049 例(80.82%),女性249 例(19.18%);年龄1 d~102 岁[(65.84 ± 6.59)岁]。
2.2 2018-2022 年各年份MRSA 阳性患者占比 2018-2022 年1 298 例患者MRSA 阳性检出者各年份分别为216 例、310 例、231 例、290 例、251 例,MRSA 阳性占比分别为16.64%、23.88%、17.80%、22.34%、19.33%。
2.3 MRSA 的来源分布 2018-2022 年1 298 例患者MRSA 阳性检出的主要来源标本为痰(703 例,占比54.16%),其后依次为分泌物(134 例,占比10.32%)、中段尿(125 例,占比9.63%)、静脉血(102 例,占比7.86%)、伤口分泌物(68 例,占比5.24%)、组织(38 例,占比2.93%)。见表1。
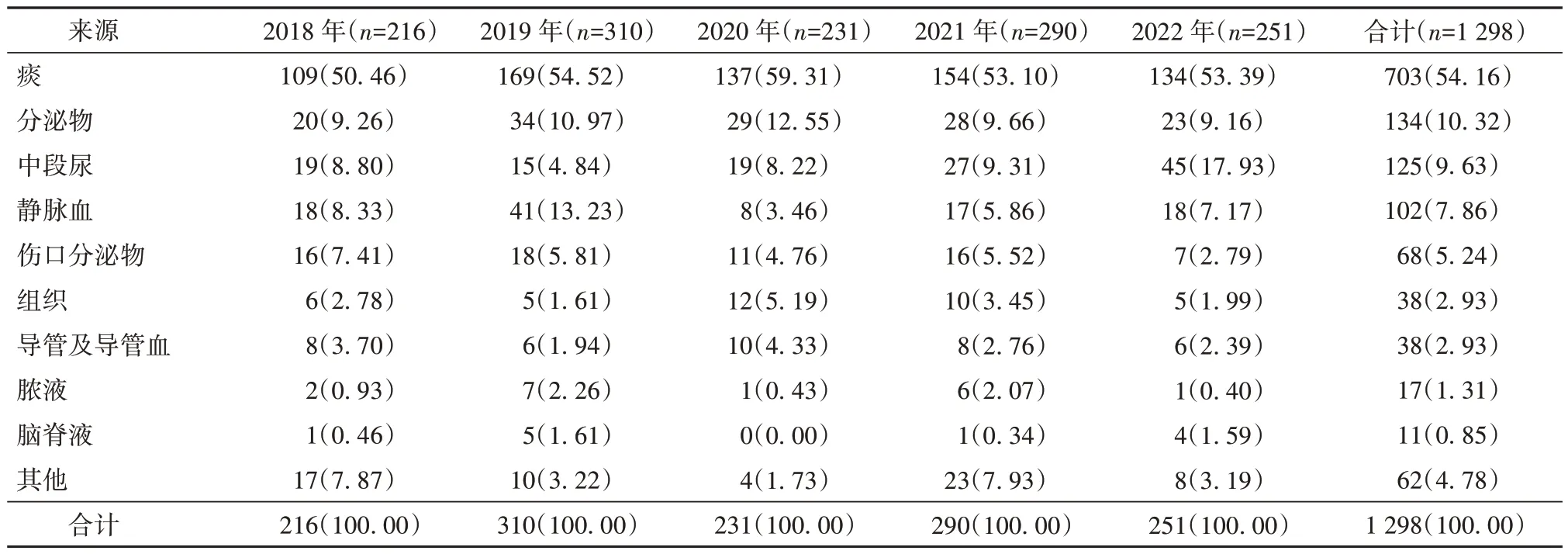
表1 2018-2022 年患者MRSA 的来源分布[例(%)]
2.4 MRSA 易感因素单因素分析 MRSA 医院感染易感因素的单因素分析结果为年龄、长期住院、合并≥2 种基础疾病、手术治疗、侵入性操作、气管插管或切开、口服免疫抑制剂、口服激素类药物、抗肿瘤化疗及放疗。见表2。
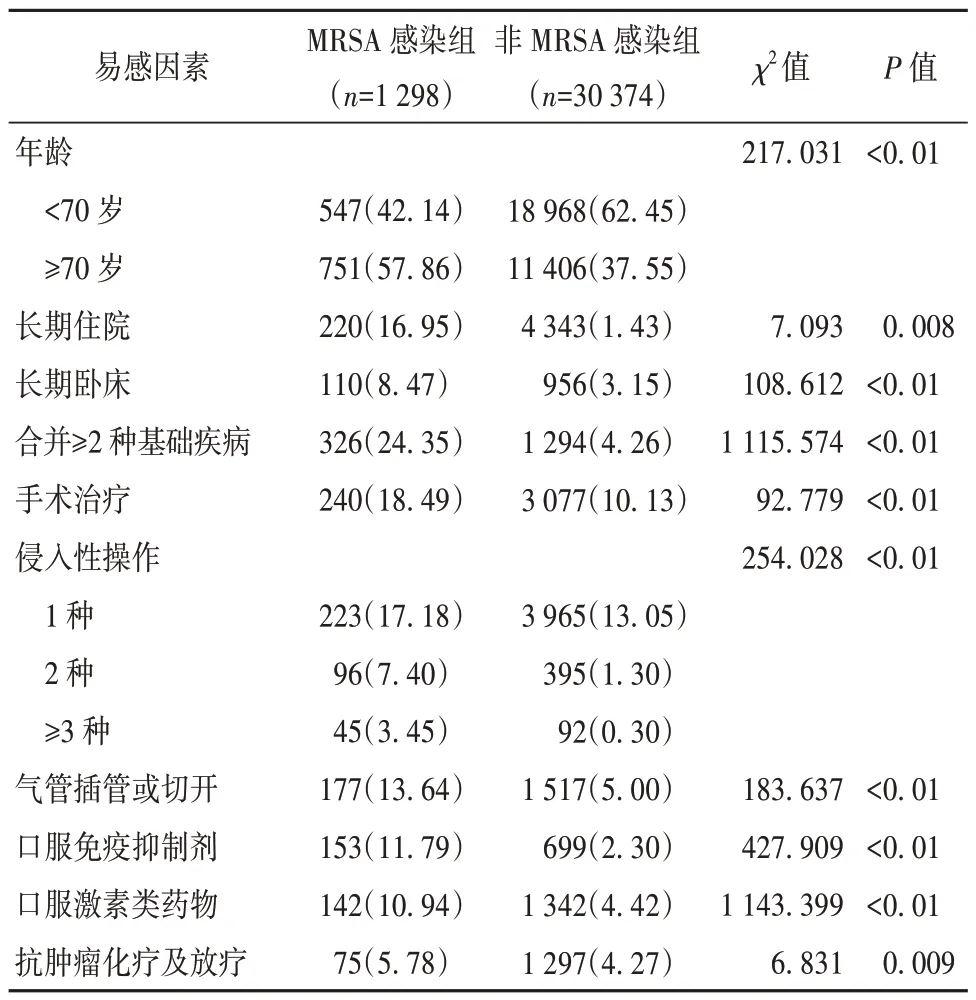
表2 MRSA 易感因素单因素分析[例(%)]
2.5 MRSA 易感因素多因素logistic 回归分析 将单因素分析中有统计学意义的指标进行赋值并进行多因素logistic 回归分析,发现MRSA 医院感染易感因素的多因素为高龄、合并≥2 种基础疾病、侵入性操作≥2 种、气管切开或插管。见表3。
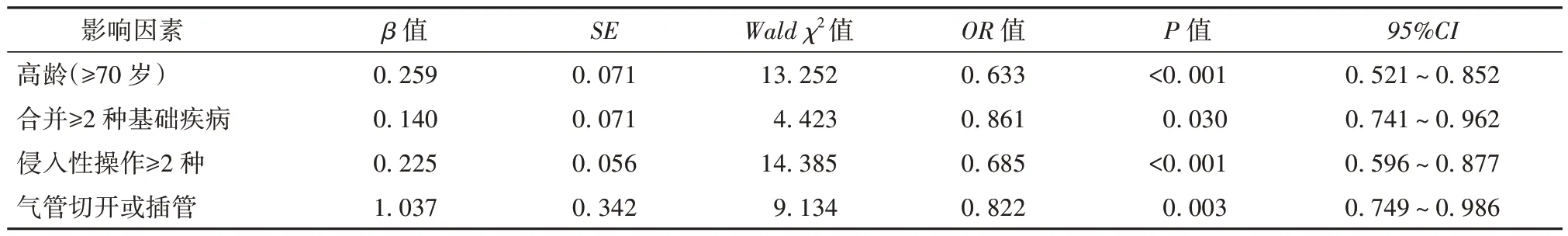
表3 MRSA 易感因素多因素Logistic 回归分析
3 讨论
金黄色葡萄球菌是目前医院感染和社区感染的常见病原菌。MRSA 对包括β-内酰胺类抗生素在内的多种抗生素耐药,具有很强的致病性,甚至可引起死亡[5]。MRSA 因其高致病性和多重耐药性对人类健康造成巨大威胁,已引起全世界广泛重视。
MRSA 感染一旦发生,会增加患者痛苦,延长住院时间,增加医疗支出,因此除积极治疗外,应重在预防[6]。本次研究重点分析MRSA 感染的分布情况,分析发现2018-2022 年MRSA 阳性占比分别为16.64%、23.88%、17.80%、22.34%、19.33%,且1 298 例患者MRSA 阳性检出的主要来源为痰,其次为分泌物和中段尿,上述结果与Chen 等[7]研究结果相似。这表明当患者存在下呼吸道感染时,需加强防控,定期监测痰液中菌株情况。分泌物来源于深部切口、皮肤感染、软组织感染等,而中段尿主要因泌尿道插管导致感染。结果提示临床医护人员应加强对下呼吸道、创面伤口及有创操作的MRSA感染危险因素识别和预防控制,严格执行相关诊疗操作规范,做好手卫生、环境物表清洁消毒、无菌技术操作、诊疗物品专人专用(共用的用后及时消毒)等,减少MRSA 医源性传播[8-9]。
MRSA 自被发现以来,致病能力以及耐药性使其成为临床上具有挑战性的难题,MRSA 的感染率不断上升,感染范围不断扩大,感染的程度越来越严重[10]。MRSA 感染的治疗目前仍以药物为主,但其对抗菌药物的多重耐药导致临床治疗困难重重,其临床感染率和危害性已经引起全球医学界的高度重视,常把其形象地称为“超级细菌”[11]。为降低院内MRSA 感染率,需加强防控,重点分析易感因素,本次研究分析发现,MRSA 医院感染易感因素为高龄、合并≥2 种基础疾病、侵入性操作≥2 种、气管切开或插管,与周晓红等[12]研究结果相似。患者年龄≥70 岁,自身机能退化,免疫力下降;合并多种基础疾病,机体处于高代谢的负氮平衡状态,免疫能力低下,抗感染能力相对较弱;多种侵入性操作使患者体内正常菌群发生变化,破坏人体的天然免疫力,加速MRSA 的产生和传播[13]。为使抗菌药物应用和医院感染防控更具针对性,提高MRSA 清除率,减少MRSA 感染源,应加强MRSA 耐药性主动监测和分子流行病学检测,指导临床针对不同感染类型、部位及程度的MRSA 病例进行个体化的经验性用药以及根据药敏试验结果进行个体化治疗[14]。院内需加强个人卫生的培训及监督,做到以下几点:(1)加强对重点科室,如重症监护室、外科等患者的监测,加强医院感染控制科与检验科之间的沟通,及时发现病例。(2)严格进行标准防护,加强手卫生。(3)对医院内的所有员工,进行MRSA 预防的培训。(4)合理应用抗菌药物,减少预防性应用,注重感染性疾病的综合治疗,如营养支持、免疫增强剂应用等;尽可能使用窄谱抗生素,减少多种抗生素的联用。(5)加快患者周转,缩减住院时间。(6)尽量减少不必要的侵入性操作,操作后要评价,及时停止侵入措施[15]。MRSA 的防治不是立竿见影的,而是一个缓慢进步的过程,加强目标及重点科室的监测,从源头抓起,严格落实消毒隔离措施,做到早发现、早隔离、早治疗。
综上所述,对医院内MRSA 分布情况进行监测与分析,可及早发现MRSA 易感人群以及易感因素,并对易感因素加强防控,对指导医院做好MRSA等多重耐药菌感染的防控工作有重要且积极的意义。
