肿瘤相关碳水化合物抗原的适配体研究*
2023-10-10袁宝银臧明玺
李 薇 陈 静 张 旭 袁宝银 臧明玺
(郑州大学基础医学院,郑州 450001)
细胞表面丰富的碳水化合物除了构成能源和结构要素外,还蕴含着大量的生物信息。异常的聚糖表达已被发现参与涉及癌症的许多基本生物过程,与肿瘤的发展和转移密切相关[1-2]。聚糖的特征结构既可作为有价值的生物标志物用于疾病诊断,也可以作为治疗靶点用于药物研发[3-7]。开发具有高亲和力和高特异性识别的聚糖特异性识别制剂,是与碳水化合物相关的基础研究以及临床相关的诊断和治疗应用的核心。
不受直接遗传控制的聚糖生物合成和巨大的结构复杂性长期以来阻碍了该领域的进一步进展[3-4]。尽管目前基于抗体和凝集素靶向聚糖的方法在肿瘤的临床诊断和预后中取得了很大进展,但这两种方法都存在着一些局限性,例如抗体的生产仍然是一个复杂且昂贵的过程[8-9],凝集素固有的低亲和力和特异性阻碍了其检测性能[10-11]。适配体是功能性的单链DNA或RNA寡核苷酸,能够与小分子、蛋白质以及整个细胞等一系列目标物种特异性结合[12-14],有望用于解决上述问题。近年来,适配体在碳水化合物的识别中越来越受到关注,但相关的文献综述仍然停留在十几年前[15],与肿瘤生物标志物有关的描述也在五年前被报道[16]。本文将就肿瘤相关碳水化合物抗原的核酸适配体的最新进展进行综述和评论。
1 癌症中的糖基化
细胞中存在着丰富的含有共价连接聚糖的复合生物大分子,统称为糖复合体[17]。这些复合糖类包括糖蛋白、蛋白聚糖和糖脂等多种类型,广泛分布于细胞表面、细胞内分泌颗粒,以及构成细胞外基质成分。糖蛋白分子中的聚糖含量和组成因蛋白质不同而异,有的可高达20%,通过多种方式影响蛋白质的结构和功能。蛋白聚糖以聚糖含量为主,由糖胺聚糖共价连接于不同的核心蛋白质形成,是构成细胞间基质的重要成分。糖脂则由聚糖和脂质组成,是细胞膜脂的主要成分。此外,体内还存在蛋白质、糖与脂质三位一体的复合物,即通过糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)连接到细胞膜上的GPI锚定蛋白。这些聚糖结构中蕴含大量的生物信息,参与许多具有生理和病理意义的生物学功能,包括细胞间的识别和黏附、宿主与病原体的相互作用、受精和胚胎发育、神经系统发育、激素调节、肿瘤转移调节、免疫监视和促进炎症反应等[18-19]。
与正常细胞相比,肿瘤细胞通常表现出异常水平和结构的聚糖形式,其改变主要归因于糖基转移酶和糖苷酶的过表达或下调[20-21]。Hakomori和Kannagi[22]首先提出了与肿瘤相关的碳水化合物改变的两种主要机制,即所谓的不完全合成和新合成过程。不完全的合成过程通常在癌症的早期阶段发生,是上皮细胞中表达的复杂聚糖正常合成受损的结果,导致了截短结构的生物合成,如黏蛋白型肿瘤抗原的O-聚糖截短,表达在胃肠癌和乳腺癌。相反,新合成通常在癌症的晚期阶段观察到,是添加的某些糖类决定簇,如糖脂和糖蛋白中唾液酸化路易斯抗原的出现、不同的岩藻糖基化,以及唾液酸化的末端结构等。这些异常的聚糖合成被认为是癌症的标志,并随着肿瘤侵袭性的发展变得更加明显。
糖基化的改变影响着癌症进展中的关键生物过程,包括肿瘤转移、血管生成、癌细胞代谢和免疫逃逸等[23-27]。恶性肿瘤发展的部分特征在于肿瘤细胞克服细胞间黏附和获得侵袭周围组织的能力,唾液酸化增加可通过局部负电荷间的静电排斥促进肿瘤肿块的分离,E钙黏蛋白上异常的N-聚糖中则可以稳定黏附连接,便于后期肿瘤成灶。肿瘤细胞上唾液酸化的路易斯抗原可通过与选择素的相互作用促进肿瘤细胞与血管内皮细胞的黏附,从而介导癌转移和侵袭。在肿瘤细胞迁移的过程中,整联蛋白是N-聚糖的载体,是细胞外基质中信号的重要受体。血管内皮细胞生长因子受体(VEGFR)的异常糖基化调节其与半乳糖凝集素的相互作用,并与肿瘤血管生成有关。此外,癌细胞中增加的β-N-乙酰葡糖胺的单糖基(O-GlcNAc)修饰可以充当“营养传感器”,调节代谢以响应于变化的营养状况。肿瘤特异性聚糖和免疫细胞上凝集素的相互作用参与调节肿瘤的微环境,导致癌细胞对免疫系统抗性的出现。例如,癌细胞表面聚糖的改变可以调节唾液酸结合免疫球蛋白型凝集素siglec-7介导的自然杀伤细胞的细胞毒性,并有助于逃避免疫等。这些糖基化的改变伴随着肿瘤细胞行为的变化,在整个癌症发展和进展中都是活跃的参与者。
由于糖基化的改变与肿瘤的恶性发展密切相关,异常聚糖结构可以作为生物标志物,是肿瘤诊断、药物治疗以及生物医学成像的潜在靶标[28-29]。已发现一些典型的聚糖表位在肿瘤细胞上独特表达,这些修饰的碳水化合物表位被定义为肿瘤相关碳水化合物抗原(tumor-associated carbohydrate antigens,TACAs)[30]。简单的 TACAs如终端聚糖表位包括唾液酸、多聚唾液酸、唾液酸化路易斯抗原和Globo H,某些含唾液酸的糖鞘脂GM1a、GM2、GM3、GD2、GD3,以及 O-聚糖截短形式sTn、TF和Tn等。此外,一些肿瘤相关蛋白的N-糖基化复杂聚糖、血清糖类抗原也在近年来受到越来越多的关注。发展针对这些聚糖的靶向制剂不仅有助于癌症临床诊断和治疗方法的开发,也将是肿瘤学相关基础研究中的有效工具。
2 聚糖识别的挑战和天然受体
与核酸和蛋白质合成不同,聚糖的生物合成并没有模板的指导,而是依靠细胞中一系列酶的表达和活性水平,特异性和有序性地组装成聚糖结构。尽管组成聚糖的单糖种类和数量有限,但由于不同单糖的性质和连接顺序、链的可能分支以及糖苷键的位置和构象,聚糖结构具有显著的复杂性和多样性。此外,聚糖可以通过一系列的单糖修饰进一步多样化,包括甲基化、硫酸化、乙酰化和磷酸化等[10]。因此,聚糖识别受体的开发存在独特的挑战性,且需要多种策略来实现对生物医学相关聚糖及其衍生物的选择性识别。
疾病特异性聚糖特征的鉴定和表征是开发新型诊断标志物的第一个关键步骤,通过各种方法例如色谱和毛细管电泳分离和检测从糖复合体中释放的荧光标记聚糖,并结合质谱技术进行更详细的糖组学和糖蛋白组学分析[31-32]。然而,一旦鉴定了潜在的聚糖标志物,则需要高灵敏度的分析方法以便用于临床实践,因此高亲和力和特异性的生物识别元件十分重要。
一些TACAs是极好的肿瘤生物标志物,长期以来一直通过使用凝集素和单克隆抗体来检测。凝集素作为碳水化合物的天然结合蛋白,广泛存在于进化树的所有分支中,从微生物到真菌、动植物的所有生物体中都有被发现。虽然在大多数情况下,当凝集素组装成低聚结构时可以显示出较高的亲和力,但其表面的浅凹槽结合口袋决定了它们对单糖和相似聚糖末端结构的选择性不足[10,33]。使用凝集素进行聚糖识别的主要优势在于低成本的粗样品检测,凝集素微阵列技术可实现复杂样品的高通量分析。此外,单克隆抗体是临床应用中癌症诊断和治疗中最有效的生物制剂类别之一。然而聚糖对抗体的产生提出了严峻的挑战,TACAs的不良免疫原性、糖基序列的相似性,以及用于产生抗体的标准宿主生物中固有表达的多种复杂聚糖都限制了相应抗体的开发[8-9]。尽管已有一些抗聚糖抗体被批准或正在临床试验中用于治疗癌症,例如GD2、GD3、路易斯抗原Y的抗体等[8],总体来说碳水化合物结合单克隆抗体的开发在数量和质量上都严重落后于抗蛋白质/肽单克隆抗体。
3 TACAs识别相关核酸适配体的发展
适配体是一类能与目标分子特异性结合的单链DNA/RNA寡核苷酸序列,这些序列能够折叠成稳定的三级结构,对有机小分子、金属离子、蛋白质、碳水化合物、细胞和病毒等表现出亲合性的功能。作为一类亲和配体,适配体显示媲美传统抗体的结合性能,同时还具有分子质量小、稳定性好、合成容易、修饰方便等特点,因此在生物医学研究等领域极具吸引力[34-37]。
适配体通常通过指数富集的配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)筛选获得[38-39]。将核酸文库与靶标分子孵育,经过多轮迭代筛选循环后,通过序列测定和固相合成制备得到最终特异性识别靶分子的适配体。经过多年的发展,SELEX已经研究和开发了一系列方法[40-43],并在提高序列性能或探索筛选机制方面显示出独特的优势。SELEX方法在文库设计、靶标类型、载体材料、筛选平台等方面的改进,使得适配体的筛选技术更加高效和准确。后SELEX的适配体优化策略,如剪裁、化学修饰和诱变,可进一步改善适配体的结合亲和力、靶向特异性、结构刚性、热稳定性和核酸酶抗性。随着计算领域的发展,人工智能算法也正在影响着SELEX。基于机器学习和生物信息学工具可以设计出与小分子或蛋白质结合的适配体,将成为克服传统SELEX工艺在时间、成本和可行性方面的关键[44]。
由于其良好的特性,例如高稳定性、生产简单、低廉的成本和生物相容性,适配体可以作为凝集素或抗体的替代品,用于TACAs的检测和靶向识别。尽管糖和寡核苷酸之间的非共价结合的相互作用有限,因为糖类分子的结构中几乎没有带电基团和芳香环部分,限制了疏水位点和氢键的相互作用。目前已有相当多的工作描述了TACAs的各种适配体,并具有μmol/L~nmol/L水平的亲和力。本文将这些TACAs识别适配体进行归纳和整理,依据SELEX程序中的靶标来源,分为3类来进行综述:a.糖类分子作为靶标;b.蛋白质聚糖表位作为靶标;c.血清糖类抗原作为靶标。
3.1 糖类分子作为靶标
唾液酸、聚唾液酸(poly-SA)、唾液酸化的路易斯抗原,以及某些神经节苷脂是相对简单且具代表性的TACAs,它们大多可以从商业化途径获得。直接以这些糖类分子作为靶标,即可筛选获得相应的适配体。图1为常见的TACAs结构,表1为代表性的TACAs适配体。通过SELEX方法的改进和后SELEX的适配体优化,适配体的平衡解离常数(KD)可达到nmol/L水平,在生物技术、诊断和治疗中显示出了巨大的潜力。
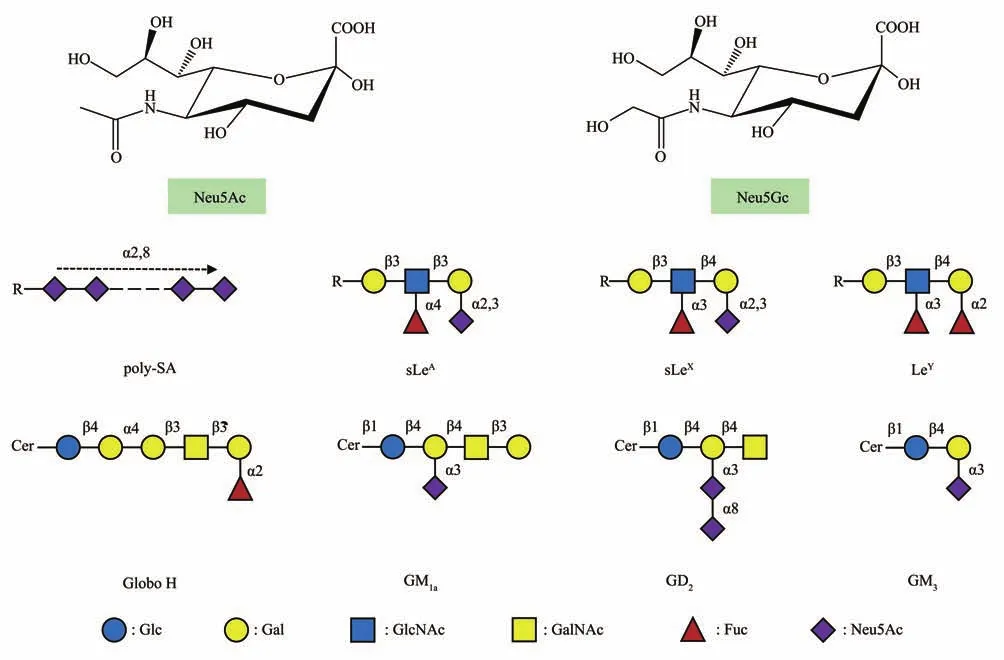
Fig.1 Structures of TACAs图1 TACAs结构
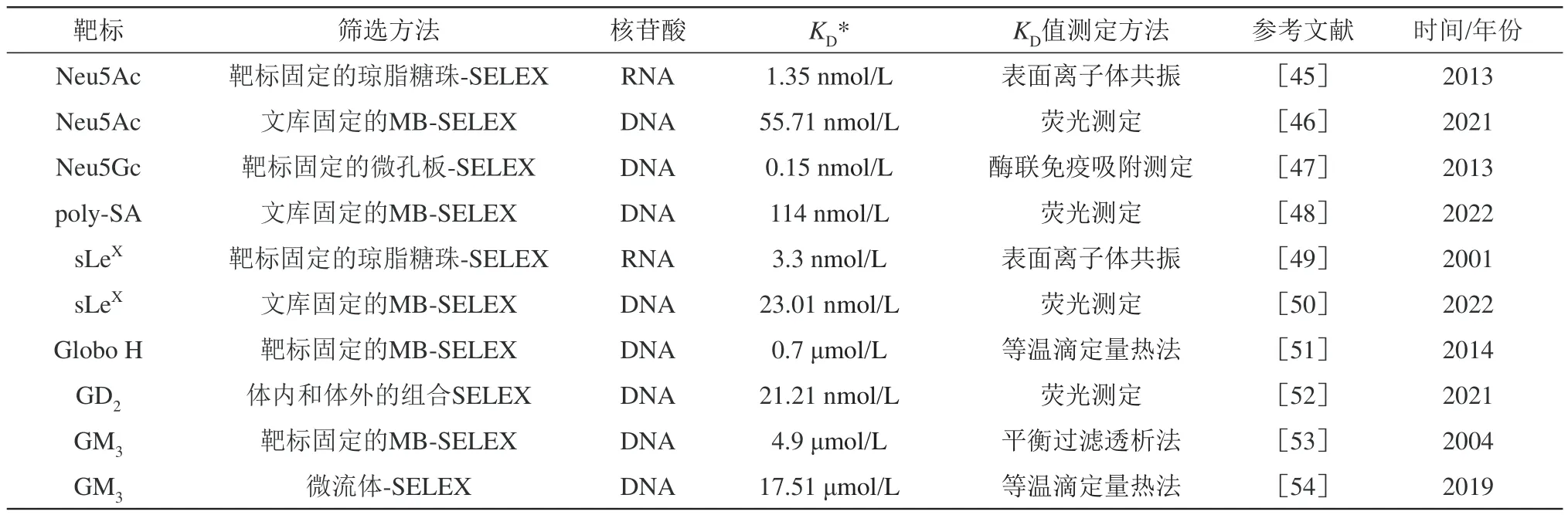
Table 1 Representative TACA-binding aptamers表1 代表性的TACAs适配体
3.1.1 唾液酸
唾液酸(SA)是九碳糖神经氨酸(Neu)酰化衍生物的总称,广泛分布于自然界中[55]。唾液酸是哺乳动物细胞表面聚糖的关键单糖构建块,在人类中最常见的形式是N-乙酰神经氨酸(Neu5Ac)。癌细胞中唾液酸转移酶活性的增加导致细胞表面糖复合体的异常唾液酸化,有助于肿瘤细胞增殖、转移、免疫逃避和耐药性。另一个重要的唾液酸成员是N-乙醇酰神经氨酸(Neu5Gc),它虽然不存在于健康人的组织中,但可以表达在一些内脏癌中,如肝癌、胃癌和结直肠癌等。因此,对唾液酸的测定为评估细胞的正常和病理过程提供了机会。
唾液酸是天然阴离子单糖,核酸分子上大量的带负电荷磷酸基团可能会影响寡核苷酸文库向唾液酸分子的富集。为了筛选对Neu5Ac具有高亲和力的适配体,Cho等[45]使用酶学方法以有序的方向将Neu5Ac固定在表面上(图2a)。因为Neu5Ac具有5个羟基官能团和1个羧基官能团,常规的化学偶联方式导致多个官能团以随机取向固定在支持物表面。他们利用α-2,3-唾液酸转移酶催化Neu5Ac从胞苷5'-单磷酸唾液酸(CMP-Neu5Ac)转移到固体支持物表面,指导了Neu5Ac的定向固定化。作者认为,与随机固定化Neu5Ac的方式相比,位点特异性固定化有助于文库向Neu5Ac特定表位的富集和识别。筛选获得的RNA适配体具有明显的高亲和力(KD=1.35 nmol/L),是对应的凝集素(SNA)的约1/60。进一步,他们将该适配体的核心结合域与具有自切割活性的核酶偶联,设计了适配体酶传感器。在Neu5Ac存在下,适配体通过构象变化改变酶的催化活性,进而影响底物荧光信号的释放。适配体酶传感器可以有效地识别Neu5Ac单体及其偶联聚糖(唾液酸乳糖、CMP-Neu5Ac和poly-SA),而对非唾液酸糖(麦芽糖、葡萄糖和蔗糖)基本没有响应。然而,最近的另一项研究工作中对Neu5Ac不同官能团固定化的适配体筛选结果,似乎并不完全支持以上观点。一项比较研究[46]使用了3种不同的基于磁珠(MB)的SELEX方法来筛选Neu5Ac特异性DNA适配体(图2b)。两种方法属于靶标固定化的SELEX,由于靶标Neu5Ac同时具有羟基和羧基,通过不同的官能团将其固定在MB上,以研究官能团对适配体筛选的影响。另一种方法属于DNA文库固定化的SELEX,将单链DNA文库固定在MB上,而Neu5Ac在筛选过程中保持自然构象以竞争性地从MB上置换适配体序列。结果表明,偶联到MB上的官能团的差异对筛选效率没有明显的影响,而DNA文库固定化的SELEX在富集具有高亲和力的序列方面表现出更高的效率。最优适配体ap3-1经截短优化后亲和力(KD=55.71 nmol/L)进一步增加,构建的Neu5Ac荧光生物传感器可以轻松区分Neu5Ac与其他唾液酸单糖(Neu5Gc、3-脱氧-D-甘油-D-半乳壬酮糖、葡萄糖、蔗糖和麦芽糖),选择性性能优于先前报道的Neu5Ac的RNA适配体。另一个唾液酸成员Neu5Gc特异性的DNA适配体序列也被开发[47]。通过将Neu5Gc羧基官能团固定化的方式,体外筛选获得的适配体N8具有最高结合常数值为6.68×109L/mol,但缺乏相应的选择性表征数据。基于该适配体建立的免疫层析试纸生物传感器可用于肿瘤患者组织中的Neu5Gc的视觉检测,是一种简单、快速、灵敏的床旁检测替代技术[56]。
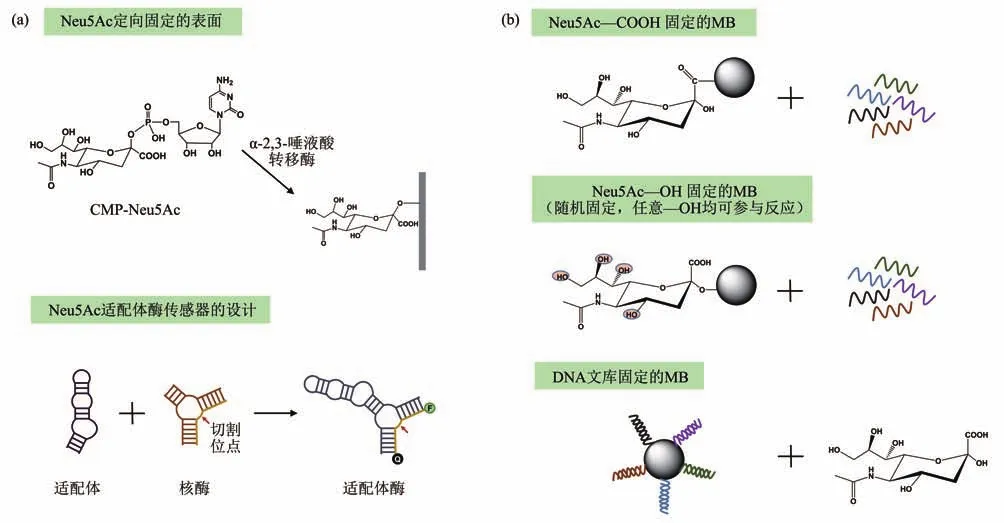
Fig.2 Different SELEX strategy for SA aptamers图2 针对SA适配体的不同的SELEX策略
3.1.2 聚唾液酸(poly-SA)
poly-SA是由2个及以上唾液酸残基(Neu5Ac)形成的线性均一多聚糖链,聚合长度通常在8~400之间[57]。poly-SA主要附着在神经细胞黏附因子(neural cell adhesion molecule,NCAM)上,在调节细胞间黏附、细胞迁移、神经发育和重塑过程中发挥关键作用。正常成人组织中的NCAM缺乏poly-SA表达,但在一些肿瘤组织,如成神经细胞瘤、肾母细胞瘤、乳腺癌、非小细胞肺癌和小细胞肺癌中存在poly-SA的再表达[58]。因其带有大量负电荷且具有亲水性,poly-SA能减弱细胞间的黏附作用及细胞与基质间的相互作用,从而促进癌细胞的分离、浸润和远端转移,以及肿瘤向脑部转移的倾向。
最近的一项工作中,Chen等[48]以三聚唾液酸(tripolysialic acid,TPSA)为靶标筛选了poly-SA特异性适配体。采用DNA文库固定化的MBSELEX技术,获得的核酸适配体不仅能特异性识别Neu5Ac,还能识别含有α-2,8-糖苷键的poly-SA。最优适配体Apt3具有最高的亲和力(KD=114.0 nmol/L)和中等特异性,它能够将TPSA与其他种类的糖类(蔗糖、乳糖、麦芽糖和葡萄糖)区分开来,但也表现出与Neu5Ac和CMP-Neu5Ac的结合能力。以该适配体作为识别元件,他们构建了一种基于荧光共振能量转移的新型荧光生物传感器应用于人血清样品中poly-SA的超灵敏检测,具有检测范围宽、检测限低、抗干扰性好等特点。
3.1.3 唾液酸化的路易斯抗原
唾液酸化的路易斯抗原是一种表达在肿瘤组织细胞表面糖脂和糖蛋白上的一组碳水化合物结构,主要表达在粒细胞和某些肿瘤细胞表面,如结肠癌、肺癌、乳腺癌等[59]。它是内皮细胞选择素蛋白的配体,介导肿瘤细胞与血管内皮细胞间的黏附作用,引起肿瘤的转移和扩散[60]。
最早在2001年报道[49]的唾液酸化的路易斯抗原X(sialyl Lewis X,sLeX)特异性RNA适配体通过靶标固定化的SELEX技术获得,显示出与市售抗体相当甚至更好的结合能力,具有极低的解离常数(KD=3.3 nmol/L)。尽管该适配体与sLeX的结合亲和力是乳糖的100倍,但对其他路易斯抗原(sLeA、LeX、LeA)的选择性不明显,结合亲和力仅高出5~10倍。RNA适配体对表达sLeX的HL60细胞与E选择素和P选择素的黏附具有抑制作用,这表明其有潜力用作抗炎治疗的细胞黏附抑制剂。直到近期才有另一项工作利用文库DNA固定化的MB-SELEX技术筛选了sLeX特异性的DNA适配体[50]。最优适配体的KD为 23.01 nmol/L,但对sLeX组成单元(LeX、Neu5Ac和半乳糖)也有较高的结合力,选择性只有2~3倍。sLeA也被命名为碳水化合物抗原19-9(CA19-9)[61],在结肠癌和胰腺癌患者的血清中被发现,并在临床中被用作胰腺癌和其他胃肠道肿瘤的血清生物标志物,用于判断预后、术后监测和监测临床对治疗的反应。已被报道的一个针对CA19-9的适配体[62]具有很高的亲和力(KD=20.05 nmol/L),但并没有进行选择性测试。此外,LeY抗原也被发现过表达于大多数腺上皮来源的肿瘤细胞表面,且与肿瘤的生长、浸润、转移密切相关[63]。LeY被认为是一个重要的肿瘤相关糖抗原,临床试验中已有抗LeY单克隆抗体被开发[64],但目前尚无相应的适配体被报道。
3.1.4 鞘糖脂(GSL)
GSL是以神经酰胺(Cer)为母体,通过糖苷键与聚糖共价连接而形成的复合脂[65]。GSL是细胞膜脂的普遍成分,在分子信号传导、细胞黏附和运动中发挥重要作用,使得大多数亚型不适合作为癌症治疗的靶标。然而,与肿瘤相关的GSL包括Globo H,以及含有唾液酸的鞘糖脂,可以通过控制细胞黏附、运动和生长、上皮-间质转化、转移以及耐药性来影响癌症的进展[66]。
最常见的Globo系列的癌症相关GSL抗原是Globo H神经酰胺,Globo H残基参与常见肿瘤内的免疫抑制和血管生成[67]。它在几种癌症中过表达,包括乳腺癌、胃癌、肺癌、卵巢癌、子宫内膜癌、胰腺癌和前列腺癌等。Wang等[51]使用一种新的逐步序列构建SELEX方法来开发能够识别Globo H的DNA适配体(图3a),即在SELEX程序中逐步延伸DNA文库序列的长度,以确保所有可能的序列都参与筛选过程。对于第一个SELEX程序,合成含有15个碱基随机区域的寡核苷酸文库用于体外筛选。经过7轮体外筛选,对产物克隆和测序,并选择与Globo H具有最高亲和力的特异性适配体用于序列构建。通过在5'端和3'端将适配体的长度各延长7个碱基随机区域,以生成新的DNA文库用于第二个SELEX程序。在执行第二个SELEX程序后,同样在最优适配体的两端各延长7个碱基随机区域以生成新的DNA文库用于第三个SELEX程序。通过第三个SELEX程序获得的命名为241163的适配体结合亲和力(0.7 μmol/L)比第一个SELEX程序的名为24的适配体(23 μmol/L)好30倍,表明DNA适配体与Globo H的结合力增强。DNA适配体241163能够区分与Globo H具有显著结构差异的聚糖(乳糖和甘露四糖),但对Globo H类似物(甘露九糖、Globo四糖和Globo五糖)有相似的结合亲和力。将该适配体与有机染料偶联可作为一种有效、准确的分子标记探针,用于在纳米尺度上的Globo H直接观察[68]。结合超分辨率显微镜,可视化了Globo H在癌细胞膜上的详细分布和空间聚类,为进一步理解癌症中碳水化合物的空间结构和功能之间的关系提供了依据。
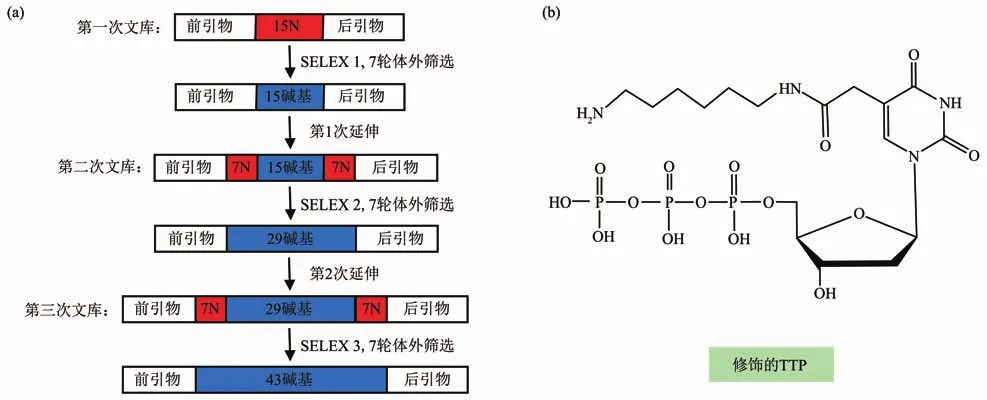
Fig.3 Different SELEX strategy for GSL aptamers图3 针对GSL适配体的不同SELEX策略
糖基部分含有唾液酸的鞘糖脂,常称为神经节苷脂[69-70]。神经节苷脂分布于神经系统中,其头部复杂的碳水化合物参与细胞间相互识别,因此在细胞生长、分化,甚至癌变时具有重要作用。神经节苷脂可根据含唾液酸的多少以及与神经酰胺相连的糖链顺序命名,M、D、T分别表示含1、2、3个唾液酸,下标1、2、3表示与神经酰胺(Cer)相连的糖链顺序(图1)。目前与临床抗肿瘤治疗效用最相关的是二唾液酸神经节苷脂GD2[71-72]。它在正常组织中的表达水平较低,而在大多数神经母细胞瘤(NB)、黑色素瘤和视网膜母细胞瘤以及几种尤因氏肉瘤中大量表达。它可诱导酪氨酸磷酸化,激活多种激酶途径,导致癌细胞增殖、迁移和侵袭能力增强。Zhang等[52]使用体内和体外的组合SELEX方法成功筛选了GD2的DNA适配体DB99,对GD2具有高亲和力(KD=21.21 nmol/L)。该适配体不仅可以区分GD2阳性和阴性细胞,而且可将GD2与对照神经节苷脂(GM1a、GD3和GM2)区分开。基于此GD2适配体,他们构建了一种多功能、可生物降解的纳米药物靶向递送系统,用于靶向转运阿霉素(Dox)和小干扰RNA(siRNA)药物,在肿瘤细胞和小鼠模型中表现出有希望的抗癌应用和生物安全性。同年,该课题组也报道了另一个体内SELEX方法获得的GD2的DNA适配体DB67[73],同样展现出对GD2阳性细胞的特异性结合,但没有给出具体的KD值。适配体DB67介导的pH敏感药物递送系统,能够靶向GD2阳性的肿瘤细胞并释放Dox药物,延长小鼠存活期并抑制肿瘤生长,显示出增强的抗NB肿瘤治疗效果。此外,其他类型的神经节苷脂,如GD3、GM2、GM3和岩藻糖基GM1也被报道和恶性肿瘤相关联[70],但相应的适配体鲜有开发。一个关于神经节苷脂GM3的DNA适配体在2004年被报道。为了获得具有高亲和力的适配体,Masud等[53]采用靶标固定的MB-SELEX程序从阳离子修饰的DNA文库中筛选唾液酸乳糖结合适配体。修饰的DNA文库是通过对称和随后的不对称PCR制备的,使用在C5位置带有末端氨基的胸苷三磷酸(TTP)衍生物(图3b)和其他三个天然核苷酸,以及KOD Dash DNA聚合酶,所得DNA文库中除前引物区域外所有胸苷残基均被修饰的胸苷替换。获得的适配体由于胸苷上带正电荷的氨基修饰,增加了对带负电荷的唾液酸乳糖的结合(KD为μmol/L级),但没有进行选择性测试。另一个被报道的GM3适配体[54]是利用微流体装置快速筛选获得的,结合亲和力为17.51 μmol/L。由于该适配体尚未进行结构上的优化,较低的亲和力是可以理解的。
3.2 蛋白质聚糖表位作为靶标
表位特异性SELEX是针对聚糖区域有效筛选适配体的另一种可能性。在这种类型SELEX程序中(图4a),靶标分子为工程化的糖基化肽或糖基化蛋白,且通常需要引入相应的非糖基化变体作为阴性靶标来进行反向筛选,以引导靶向聚糖部位的序列富集。该方法的最大优势在对于一些难以化学合成和商业化获取的复杂结构聚糖,特别是N-连接聚糖的适配体筛选工作中的可行性。此外,某些N/O-糖基化位点处的核心肽序列也是抗原决定簇,因此筛选获得的适配体可同时具有对肽和糖两个区域的双重识别。
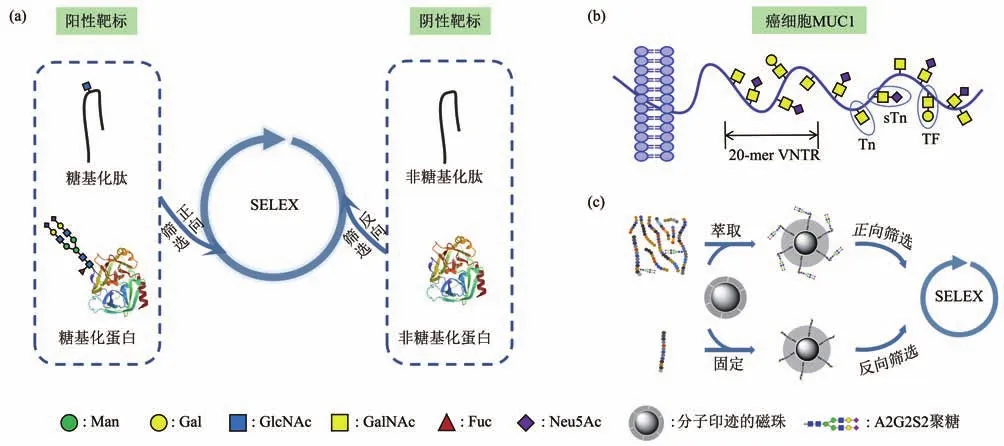
Fig.4 SELEX strategy for targeting glycan epitope of proteins图4 蛋白质聚糖表位作为靶标的SELEX策略
3.2.1 黏蛋白型O-糖基化
MUC1(CD227)是黏蛋白家族(mucins)的一员,一种I型跨膜糖蛋白[75]。正常细胞中,MUC1胞外区结构为一个大的、高度糖基化的N端结构域,而在肿瘤中,虽然其蛋白质核心的糖基化位点与正常MUC1相同,但碳水化合物侧链明显要短得多,且以唾液酰基为末端(图4b)。简单的黏蛋白型O-糖基化抗原,如Tn抗原(CD175)、TF抗原(CD176)和唾液酸Tn抗原(sTn,CD175s),是抗肿瘤治疗的非常有吸引力的靶点,因为它们在大多数胃癌、结直肠癌、卵巢癌、乳腺癌和胰腺癌中高度表达,而在健康组织中未检测到[76]。
MUC1的胞外多肽骨架含有空间结构稳定一致的可变数目重复序列(variable number of tandem repeats,VNTR),该区域富含O-糖基化位点。肿瘤细胞上MUC1糖链的改变,导致该区域的核心肽抗原表位和糖抗原表位暴露出来,从而具有免疫原性。一项适配体筛选工作以5个MUC1串联重复序列的O-糖基化形式MUC1-5TR-GalNAc(Tn抗原)作为靶标,获得了短的单链DNA适配体[77]。最佳的适配体5TRG2对Tn抗原的亲和力达到KD为18.6 nmol/L,且可以很容易地区分含有或不含有GalNAc残基的肽靶标。电泳迁移率位移测定显示出5TRG2对单独的肽(5TR)和糖(GalNAc)这两个区域也有一定程度的结合。合成DNA适配体可以用作递送载体,将光动力治疗剂等前药货物特异性地输送到上皮癌细胞,光激活以产生破坏性的单线态氧而诱导细胞死亡。
3.2.2 蛋白质N-糖基化
一些肿瘤相关蛋白质的N-糖基化在近年来受到越来越多的关注,尽管其确切的糖基化模式和糖型变化尚未完全明了,已有少数研究者发展了靶向这些特征聚糖结构的适配体。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度保守的外分泌型糖蛋白,可与肝素结合且选择性诱导血管内皮细胞增殖[78]。VEGF在肿瘤组织中的高水平表达与多种肿瘤的发生和预后不良有关,如肺癌、肝癌、大肠癌、卵巢肿瘤和神经系统肿瘤等。抗血管形成是抑制肿瘤的扩散和转移的研究方向,因此VEGF已成为药物开发的重要靶点。VEGF的N-糖基化肽片段是肝素结合域的暴露部分,靶向结合该表位的DNA适配体已被成功开发[79]。由于在SELEX策略中包括了糖基化VEGF肽靶标的正向筛选和非糖基化变体的反向筛选,最好的核酸适配体能够区分仅因单个糖基化位点而不同的肽变体,且对糖基化VEGF肽的亲和力(KD=2.5 μmol/L)是非糖基化变体的52倍。然而这项研究并未显示核酸适配体识别天然VEGF的可行性,后续也没有在细胞和体内应用的研究进展。
前列腺特异性抗原(prostate specific antigen,PSA)是由前列腺上皮细胞产生的分泌蛋白,具有极高的组织器官特异性。PSA在正常人血清中含量极微,是诊断和预测前列腺癌的金标准。已有研究表明,在肿瘤发生过程中,PSA的聚糖结构会发生细微变化,检测这些特异性糖基化变化可能为临床应用提供新的视角[80]。Díaz-Fernández等[81]首次开发了靶向PSA聚糖结构域的DNA适配体。通过在SELEX 程序中引入非糖基化的PSA蛋白进行反向筛选,可将序列引导至聚糖部分。获得的适配体虽然能够区分人PSA和非糖基化蛋白,但对具有相似聚糖结构的蛋白质没有区分能力。为了实现核酸适配体的更精细靶向,作者引入了更严格的反向筛选步骤,使用PhoSL凝集素阻断序列对蛋白核心岩藻糖的结合[82]。通过利用这种方法,新开发的适配体PSAG-1可以识别蛋白质最内层的糖残基和糖基化位点周围的肽区域。结合对适配体的结构预测和截断研究,证实了适配体PSAG-1不仅具有高亲和力(KD为72 nmol/L),而且能够将人PSA与具有非常相似的聚糖结构蛋白(如中性粒细胞明胶酶相关脂质运载蛋白(NGAL)和甲胎蛋白(AFP))区分开来。在电化学传感器中使用糖靶向PSA适配体和抗PSA适配体(显示仅与PSA的蛋白质区域结合)构建三明治夹心结构,可用于定量检测血清中的人PSA。
还有一些有趣的工作,巧妙地利用非肿瘤肽或蛋白作为聚糖支架,筛选了靶向某些肿瘤相关的复杂聚糖结构的适配体。Li等[74]以转铁蛋白作为糖链来源,其胰蛋白酶解产物中的特定糖肽为阳性靶标,引入人工合成的非糖肽用于反向筛选,成功获得了对一个双触角双半乳糖基二唾液酸化N-聚糖结构A2G2S2结合的适配体(图4c)。由于在SELEX程序中使用分子印迹的磁珠作为糖肽靶标固定和分离的基底材料,该方法避免了繁琐的聚糖制备过程,并使天然复杂聚糖的构象易于暴露。基于A2G2S2聚糖在肝癌患者中上调的表达量,作者验证了该适配体在肝癌细胞靶向成像中的应用。最近,该课题组[83]又提出了一种基于分子印迹磁珠的消减SELEX策略,获得了高甘露糖聚糖的适配体。该策略选取糖蛋白核糖核酸酶B和非糖蛋白核糖核酸酶A作为交替的筛选靶标,两种蛋白质除了一个高甘露糖基化位点外具有相同的三级结构。筛选获得的高甘露糖聚糖的适配体不仅具有对乳腺癌细胞和正常乳腺细胞的区分能力,而且展示了对病毒抗原蛋白的有效识别和阻断能力。尽管这两个工作中适配体对聚糖的亲和力(μmol/L水平)和选择性并不突出,但为开发其他有价值的复杂聚糖的适配体提供了一种新思路。
3.3 血清糖类抗原作为靶标
一些最常见的临床上用于癌症诊断和恶性进展监测,以及疾病复发的预后生物标记物,是肿瘤相关血清糖类抗原[84-86]。它们是肿瘤细胞分泌的一系列糖蛋白类物质,已被证明具有异常的癌症相关糖基化。如表2所示,这些糖类抗原大多因对应的单克隆抗体识别而命名,如碳水化合物抗原CA125、CA153、CA724、CA199等。糖类抗原对于恶性肿瘤的敏感性尤为高,依据其数值能够相对特异性地提示肿瘤在人体内的生长部位,并判断患者的病情严重程度。尽管已有多种基于抗体的商业检测试剂盒可用,识别这些糖类抗原的新型适配体的开发仍然具有重要价值,例如在成本和批量检测上的优势。以这些血清糖类抗原作为靶标,已有相应的适配体被筛选出来[62,87-89]。除此之外,常见的血清肿瘤标志物如癌胚抗原(CEA)、碱性磷酸酶(ALP)也都是糖蛋白,以其筛选获得的适配体具有对蛋白质和聚糖的混合识别[89-90]。适配体通常展现出很高的亲和力(KD值大多在nmol/L水平),可方便地用于生物传感器的构建和高灵敏度的疾病标志物检测[91-92]。

Table 2 Common clinical serum CA biomarkers and their aptamers表2 临床应用中常见的血清糖类标志物及其适配体开发
对癌症早期诊断的特异性和敏感性的更高需求,促使人们基于对某些血清蛋白质的特定糖型的检测来寻找新的生物标记物用于癌前期的诊断。典型的实例是AFP,一种用于检测肝脏疾病的血清学生物标志物。虽然AFP是用于肝癌(HCC)诊断的广泛验证的糖蛋白,但血清AFP水平不能区分HCC和良性肝病。与慢性肝病相比,HCC患者的岩藻糖基化指数显著提高,因此提出了另一种基于AFP的糖基化形式(AFP-L3组分)的肿瘤标记物,已被FDA批准用于肝硬化阶段早期HCC的血清检测[93]。然而目前,AFP-L3的检测主要依赖于其对凝集素的反应性[94-95],尚无相应的适配体被开发。
4 总结与展望
自1990年代核酸适配体首次报道以来,适配体的发现和应用有了巨大的增长,但只有少数具有足够的亲和力、特异性和稳定性的适配体可实际应用,可用于聚糖识别的适配体更加有限。本综述主要总结和讨论了癌症中特征性的糖基化改变,以及肿瘤相关碳水化合物抗原核酸适配体的开发进展。据统计,已报道的TACAs识别适配体只有十多余种,适配体的亲和力在微摩尔到纳摩尔水平不等。研究最多的TACAs是一些简单和代表性的聚糖结构,如唾液酸、poly-SA、sLeX、GD2等。这些糖类分子易于合成纯化和从商业化途径获得,可直接作为SELEX程序中的靶标分子,筛选获得的适配体显示出在生物传感、靶向成像、药物递送和治疗等领域中的应用潜力。表位特异性SELEX为聚糖适配体的开发提供了另一种可能性,它以工程化的糖蛋白或糖肽作为靶标,通过正反向的筛选程序将文库序列强制引导至聚糖及其周围区域。该策略使得一些复杂结构聚糖,特别是N-连接多天线聚糖的适配体筛选具有可行性,因为这些糖链的化学合成和获取过程耗时、费力且产量低。尽管该方法目前还不够成熟,如受到糖蛋白不均一糖型的限制,但为开发其他复杂聚糖形式的TACAs适配体提供了一种新思路。此外,临床上用于肿瘤诊断和检测的血清糖类抗原,如CA724、CA153、CA125、CA199适配体也有被报道,相对有限的数量可能是因为这些血清糖类抗原本身已经具有成熟的抗体。然而,相对于抗体,适配体仍然是一股新兴的力量,需要进一步的发展以确保持续进步。因此,迫切需要高性能的聚糖识别适配体来促进基于适配体的科学研究和转化应用。
虽然针对TACAs识别适配体的研究已经取得了较大进展,但仍然存在许多的应用挑战和改进空间。在临床转化方面仍需更多努力,将核酸适配体在癌症诊断和治疗中的应用提升到一个新的程度。目前,有数十到数百种适配体正在进行临床试验或临床前研究,它们识别的生物标志物绝大多数都是糖蛋白。但值得注意的是,这些针对糖蛋白生物标志物的适配体大都是在没有指向靶标特定区域的情况下筛选获得的,糖基化是否参与适配体的结合也并没有完全表征[96-97],且获批用于临床治疗的适配体药物仍然只有一种pegaptanib。
在未来的工作中需要在以下方面继续努力。一方面,高性能的聚糖识别适配体的开发仍然是一大难点。集中于建立寡核苷酸与聚糖之间亲和作用的研究已经显示了长足的进步,通过SELEX变体策略获得的最优适配体的亲和力可达到nmol/L水平。然而聚糖结合实体需要能够区分微小变化的单糖连接方式和分支异构体,如何增强适配体对特定TACAs靶标的选择性似乎是更大的挑战。另一方面,TACAs适配体在实际生物学环境中的应用尚且不足。基于高效色谱和质谱的深度分析已使我们能够测定各种临床样品中靶蛋白上的癌症特异性糖型,以建立新的糖型特异性癌症生物标志物,这些标志物将是适配体开发的新靶标。但大多数直接从SELEX分离出的适配体未能达到实际应用的标准,后SELEX策略对于提高适配体的质量具有重要作用。在这种情况下,需要在制定有针对性的后SELEX策略中做出努力,结合截断、突变、修饰等传统方法和新兴的计算机辅助方法(例如人工智能和分子模拟技术等)建立基于其构效关系的适配体指导数据库,以获得高质量的治疗性适配体。随着SELEX技术的不断提高,相信将有更多新型的TACAs适配体被开发,特异性也将进一步提高,核酸适配体将成为临床实践中具有巨大价值的工具。