VASN核酸适配体与端粒酶逆转录酶脱氧核酶偶联物的生物学功能研究*
2023-10-10马斐越刘雪梅台福敏邵宁生郑晓飞
马斐越 李 慧 刘雪梅 台福敏 邵宁生 高 波 * 郑晓飞 *
(1)军事科学院军事医学研究院辐射医学研究所,北京市放射生物学重点实验室,北京 100850;2)军事科学院军事医学研究院军事认知与脑科学研究所,北京 100850)
脱氧核酶(DNAzyme,Dz)是具有催化活性的单链DNA,对DNA和RNA等分子具有高效催化活性和结构识别能力[1]。近年来,基于脱氧核酶的应用研究取得巨大进展,脱氧核酶可设计为生物传感器、DNA或RNA裂解和连接酶、磷酸化和去磷酸化酶等功能分子用作多种治疗和诊断工具。其中10-23型脱氧核酶由一个催化中心和两个靶基因结合臂组成,通过结合臂和靶基因mRNA的互补配对,催化特定部位的切割反应,进而抑制基因的转录或表达,具有基因沉默功能[2]。作为抗病毒、抗肿瘤等多种疾病治疗的潜在分子,脱氧核酶具有结构稳定、易于制备、免疫原性更低等优点。但由于其具有负电荷和亲水性,不易通过细胞膜进入细胞,导致其催化切割效率严重降低,限制了在临床治疗方面的应用。因此,需要建立提高脱氧核酶递送的新技术方法。
适配体(aptamer)作为一种新型靶向分子在药物分子递送中的应用越来越广泛,适配体由一段单链寡核苷酸(DNA或RNA)序列组成,通过链内互补碱基间的配对以及静电、氢键作用与靶分子紧密结合,具有极高的靶分子亲和力和识别能力[3]。已有研究证实,适配体与具有基因沉默作用的 siRNA(small interfering RNA,siRNA)、shRNA(short interfering RNA,shRNA)及miRNA(microRNA,miRNA)偶联,在细胞中发挥作用[4-6]。适配体与G-四链体脱氧核酶偶联也可以作为生物传感器用于多种分子的检测,比如ATP[7]、干扰素[8]、凝血酶[9]等。有研究将细胞膜核仁素适配体NCL-APT(nucleolin-aptamer,NCL-APT)和靶向生存素脱氧核酶Sur_Dz(survivin DNAzyme,Sur_Dz)偶联,证明该偶联物对癌细胞具有靶向杀伤作用[10]。也有研究报道了一种被封闭的、刺激响应的适配体/脱氧核糖核酸酶索烃纳米结构,索烃纳米结构中的适配体片段与肿瘤细胞表面过度表达的MUC1蛋白结合,可以促进靶向递送纳米结构到细胞内,以实现高度特异性的基因沉默[11]。可以看出,选择靶向细胞膜蛋白质特异、高效的适配体与脱氧核酶偶联,通过适配体的跨膜递送作用,有助于解决脱氧核酶不易进入细胞的问题。
VASN蛋白(vasorin)是一种典型的I型膜蛋白,在肝癌细胞中高表达,而在正常肝细胞中低表达,可以作为一种新的肝癌生物标志物[12]。我们前期利用指数富集的配基系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术筛选得到VASN蛋白的特异核酸适配体V4-2,并发现其具有跨细胞膜递送的潜能,因此V4-2序列可作为候选递送介质[13]。
端粒酶在多种肿瘤组织中高表达,直接抑制端粒酶的逆转录活性是治疗癌症的有效手段[14]。在端粒酶的几种组分中,端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)仅在肿瘤细胞中表达,是肿瘤细胞的特异性靶点[15]。我们前期研究发现,10-23型脱氧核酶能够靶向降解hTERT mRNA,显著降低人肺腺癌细胞A549端粒酶活性[16]。因此本研究将核酸适配体V4-2与端粒酶10-23型脱氧核酶Dz连接,即脱氧核酶Dz的5'端与V4-2的3'端连接形成偶联物V4-2-Dz,检测分析该偶联物的切割活性和结合肝癌细胞的特异性,并验证其对肝癌细胞的影响,以期为脱氧核酶的递送及应用提供新的思路。
1 材料与方法
1.1 材料
人肝癌细胞HepG2和人正常肝细胞L02由本实验室保存;DMEM高糖培养基购于Gibco公司;胎牛血清(fetal bovine serum)购于PAN-biotech公司;注射用青霉素和注射用硫酸链霉素购于华北制药股份有限公司;PCR酶购于TOYOBO公司;T7体外转录试剂盒、qPCR酶购于ThermoFisher公司;RNA提取试剂Trizol购于Sigma公司;反转录试剂盒购于Genstar公司;琼脂糖胶回试剂盒购于Promega公司;StarStain Red核酸染料购于Genstar公司;MTT检测试剂盒购自北仁化学科技(北京)有限公司。PCR引物、Dz、V4-2、V4-2-Dz、5'端标记荧光素(FAM)的Dz、V4-2、V4-2-Dz合成均由上海生工生物工程有限公司完成,序列信息如表1所示。

Table 1 DNAzyme,aptamer and primer sequences
1.2 方法
1.2.1 细胞培养
HepG2和L02细胞培养于含有10%胎牛血清、1×105U/L青霉素和链霉素的DMEM高糖培养基中,置于37℃、5% CO2细胞培养箱中培养,用胰蛋白酶消化传代。选择处于对数生长期的细胞进行实验。
1.2.2 体外转录合成端粒酶催化亚基hTERT RNA片段
按Trizol法提取HepG2细胞总RNA,将其反转录为cDNA,以脱氧核酶Dz的切割位点为中心,设计hTERT上下游PCR引物hTERT F1和hTERT R1,上游引物5'端连接T7启动子序列,经PCR扩增合成hTERT DNA片段,回收扩增产物。以此PCR产物为模板,利用T7体外转录试剂盒进行体外转录,纯化回收RNA,获得端粒酶催化亚基hTERT RNA片段。
1.2.3 分析脱氧核酶和偶联物对底物RNA的体外切割
将上述体外转录得到的hTERT RNA与脱氧核酶Dz、偶联物V4-2-Dz孵育进行底物切割实验。取 5 μl 100 nmol/L Dz或 V4-2-Dz、5 μl 10 μmol/L hTERT RNA与10 μl 2×切割缓冲液(50 mmol/L Tris-HCl pH7.5、10 mmol/L MgCl2、150 mmol/L NaCl、0.01% SDS)混匀,37℃分别温浴 10、30、60、120、180 min,终止反应后采用6%变性聚丙烯酰胺凝胶电泳分离切割产物,核酸染料染色观察Dz、V4-2-Dz对hTERT RNA的切割作用。采用Image J软件分析条带灰度值,切割百分比=(实验组底物条带灰度值/对照组底物条带灰度值)×100%。
1.2.4 流式细胞术检测脱氧核酶与细胞结合
将FAM标记的Dz、V4-2、V4-2-Dz溶解于DEPC水中,加入孵育缓冲液(1×PBS,1 mmol/L MgCl2,1 g/L ytRNA),终浓度为 5 μmol/L,再与HepG2细胞或L02细胞于37℃孵育60 min,2 000 r/min 离心,弃上清,加入 350 μl 1×PBS-1 mmol/L MgCl2重悬细胞,流式细胞术检测细胞荧光强度值,利用Flowjo软件分析其与细胞的结合情况。
1.2.5 激光共聚焦检测脱氧核酶与细胞的结合
将FAM标记的Dz、V4-2、V4-2-Dz溶解于DEPC水中,加入孵育缓冲液(1×PBS,1 mmol/L MgCl2,1 g/L ytRNA),终浓度为 5 μmol/L,与接种在共聚焦小皿中的HepG2细胞于37℃共同孵育60 min,吸弃上清后,用1×PBS-1 mmol/L MgCl2清洗2次后,加入100 μl 1×PBS-1 mmol/L MgCl2,共聚焦显微镜下观察细胞。
1.2.6 实时荧光定量PCR(real time quantitative PCR,RT-qPCR)检测mRNA水平变化
将HepG2细胞按2.5×104细胞/孔接种于48孔板,待细胞融合至70%左右,在无脂质体无血清条件下转染脱氧核酶,终浓度为5 μmol/L,6 h后加入10%血清的DMEM培养基中继续培养,转染48 h后收集细胞,提取各孔细胞RNA,进行RNA逆转录和RT-qPCR,β-actin作为内参比较细胞中hTERT基因的表达。用2-△△Ct方法分析mRNA相对表达量。
1.2.7 MTT方法检测细胞增殖
将HepG2细胞按照8×103细胞/孔接种于96孔板,在无血清条件下分别将终浓度为12.5 μmol/L的Dz、V4-2、V4-2-Dz与细胞共同孵育,6 h后加入1%血清的DMEM培养基中继续培养,分别于18、36、54、72 h加入MTT检测,在波长450 nm读吸光度(A)值。
1.2.8 数据分析
实验数据采用GraphPad Prism 8.0软件分析,两组数据比较采用t检验,多组数据比较采用Oneway ANOVA检验,以P<0.05认为差异具有统计学意义。
2 结果
2.1 VASN核酸适配体与端粒酶逆转录酶脱氧核酶偶联物(V4-2-Dz)二级结构预测
利用Mfold网站分析V4-2和连接hTERT脱氧核酶偶联物V4-2-Dz序列的二级结构[17],条件设置为:温度37℃,Na+浓度150 mmol/L,Mg2+浓度1 mmol/L。图1a显示V4-2主要的结构为茎-环结构,图1b为V4-2-Dz的结构,其中1~80 bp为V4-2序列,81~113为Dz序列,V4-2序列的结构与图1a一致,表明连接脱氧核酶后没有影响V4-2的结构。V4-2和V4-2-Dz的吉布斯自由能∆G分别为-3.75 kJ/mol、-4.51 kJ/mol,说明其结构均较为稳定。
2.2 Dz和V4-2-Dz对底物RNA的体外切割活性
体外合成hTERT RNA片段后,将终浓度为25 nmol/L的Dz和V4-2-Dz与终浓度为2.5 μmol/L的hTERT RNA孵育不同时间,检测V4-2-Dz的底物切割活性。随着反应时间的增加,Dz和V4-2-Dz对底物的切割量逐渐升高,与Dz相比,V4-2-Dz的切割效率有所降低,但仍具有较强的切割活性(图2)。
2.3 V4-2-Dz与肝癌细胞结合
由于VASN在肝癌细胞中高表达,在正常肝细胞中低表达。因此,VASN的适配体V4-2能够与肝癌细胞发生特异结合。将Dz、V4-2、V4-2-Dz序列的5'端标记FAM荧光,与肝癌细胞HepG2、正常肝细胞L02细胞孵育,通过流式细胞术和激光共聚焦检测连接Dz后V4-2-Dz是否与肝癌细胞特异性结合。
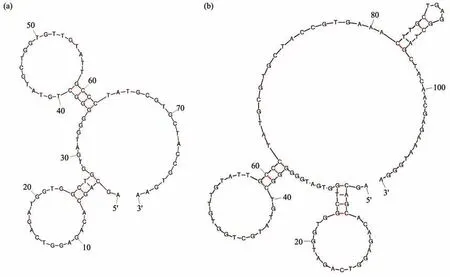
Fig.1 Mfold predicts the secondary structure of V4-2 and V4-2-Dz
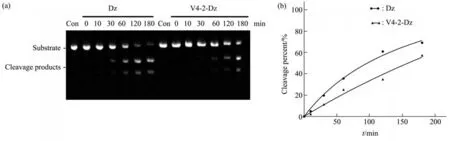
Fig.2 hTERT RNA was cleaved by Dz and V4-2-Dz in vitro
流式细胞术结果如图3所示,HepG2细胞与FAM标记的V4-2、V4-2-Dz孵育后与对照组(control,Con)相比,荧光强度峰值均发生偏移,但是与Dz孵育后未发生偏移(图3a),L02与三条核苷酸序列孵育后峰值均未发生偏移(图3b),说明V4-2能够结合HepG2,并且V4-2-Dz与V4-2比较,结合能力未发生改变。
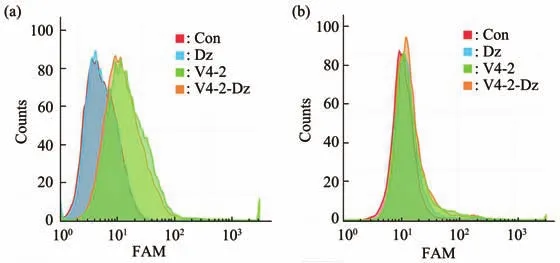
Fig.3 Binding activity of V4-2-Dz to hepatocellular carcinoma cells detected by flow cytometry
激光共聚焦检测结果如图4所示,HepG2细胞与FAM标记的V4-2、V4-2-Dz孵育后与Con、Dz组相比,观察到明显的荧光强度,说明V4-2能够结合HepG2细胞,并且V4-2-Dz与V4-2比较,结合能力未发生明显变化。

Fig.4 Binding activity of V4-2-Dz to hepatocellular carcinoma cells detected by laser confocal
2.4 V4-2-Dz降低端粒酶催化亚基mRNA表达水平
在未加脂质体的条件下,向HepG2细胞培养液中加入不同浓度的V4-2-Dz共孵育,检测其对hTERT mRNA表达的影响。随着V4-2-Dz浓度的增加,HepG2细胞中hTERT mRNA的表达逐渐降低(图5a)。在分别加入相同浓度的Dz、V4-2-Dz以及V4-2的HepG2细胞中,与Con相比,加入Dz和V4-2-Dz对hTERT mRNA水平都具有降低效果,但V4-2-Dz的效果更为显著,差异具有统计学意义(P<0.05)(图5b),说明连接V4-2后可以增强Dz的工作能力。

Fig.5 The level of hTERT mRNA expression in HepG2 cells after incubation with V4-2-Dz
2.5 V4-2-Dz抑制HepG2细胞增殖
将Dz、V4-2、V4-2-Dz分别加入HepG2细胞培养液中,检测其对HepG2细胞增殖的影响。与Con相比,V4-2-Dz抑制细胞增殖的能力有显著性差异(P<0.01)(图6)。
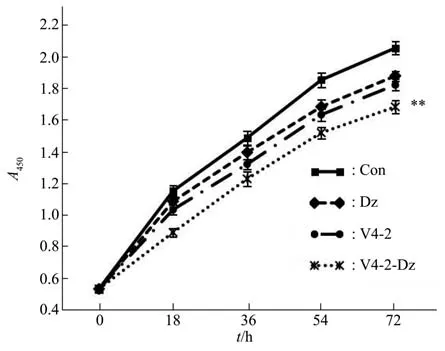
Fig.6 Detection of HepG2 cell proliferation after incubation with Dz,V4-2 and V4-2-Dz
3 讨论
本研究将VASN蛋白的核酸适配体V4-2与靶向hTERT mRNA的脱氧核酶Dz连接,通过Mfold预测的二级结构表明,在V4-2-Dz偶联物中对V4-2的结构没有产生明显的影响,对Dz左结合臂可能存在碱基互补配对情况,但仍然以独立形式存在。尽管二级结构预测存在一定不准确性,二级结构预测结果间接证明V4-2-Dz仍然具有适配体和脱氧核酶的功能结构。通过检测V4-2-Dz的体外切割活性发现,V4-2-Dz仍具有较强的切割活性但与Dz相比活性有所降低,可能由于左端结合臂过长形成空间位阻造成的。流式细胞术和激光共聚焦实验结果均显示V4-2-Dz与肝癌细胞HepG2结合的特异性未发生明显改变,表明Dz并未减弱V4-2对细胞结合的能力,说明V4-2具有稳定的功能结构。因此,将其转染细胞后,可靶向降解hTERT mRNA并抑制细胞增殖。
目前开发递送脱氧核酶的方法主要分为两种,一种是通过纳米颗粒将脱氧核酶递送至细胞,比如胶体金纳米粒子、壳聚糖纳米粒子等[18-19],另一种则是利用阳离子分子,例如阳离子聚合物、脂质体等[20-21],与负电荷的脱氧核酶通过静电相互作用结合,通过膜融合进入细胞。但是这些方法仍存在较大缺陷,比如各种材料制备较为繁琐,并且在高浓度下具有细胞毒性。适配体可以作为有效的递送介质使各种类型的寡核苷酸在细胞中发挥作用,为脱氧核酶与适配体的结合提供了良好的基础。上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是一种I型跨膜糖蛋白,在多种上皮来源肿瘤细胞中高表达[22],将靶向EpCAM的适配体与靶向Polo样激酶1(polo-like kinase 1,PLK1)的siRNA共价连接,其选择性进入表达EpCAM的乳腺癌细胞,并使PLK1表达降低[23]。受体酪氨酸激酶(AXL areceptor tyrosine kinase,AXL)同样在多种癌症细胞中高表达,将AXL的适配体GL21.T与抑癌基因miR-148b连接,特异抑制小鼠AXL阳性肿瘤生长[24]。适配体作为靶向分子在药物分子递送中的研究日益受到重视。
本研究为肝癌的治疗和脱氧核酶的有效递送提供了一种可行方案。VASN蛋白的适配体V4-2能够作为一种递送介质与各种具有沉默作用的寡核苷酸(DNazyme、siRNA、ASO、miRNA等)连接,靶向肝癌细胞发挥作用。靶向hTERT的脱氧核酶Dz同样能够和其他癌细胞特异膜蛋白的核酸适配体连接,靶向各种类型的癌细胞发挥作用,为癌症的临床治疗提供了基础。另外,适配体与脱氧核酶的连接方向可能影响脱氧核酶的活性[25],后续可检测在脱氧核酶的3'或5'端连接适配体后是否切割活性是否一致,也可在适配体与脱氧核酶的连接位点加入接头序列,即若干个不同碱基,确保适配体与脱氧核酶的功能结构不受影响。基于适配体和脱氧核酶偶联物方法未来仍存在优化空间。
4 结论
VASN蛋白的核酸适配体与端粒酶逆转录酶催化亚基的脱氧核酶偶联物V4-2-Dz具有靶向肝癌细胞递送和脱氧核酶底物切割活性,基于细胞靶向和穿膜递送的适配体V4-2与脱氧核酶的偶联物可作为一种新型生物制剂用于肿瘤药物研究。