电化学适配体传感器用于乳酸快速检测的研究*
2023-10-10黄江健杨人香姜苏珊何雅琪陈权薪苏会岚
马 怡 黄江健 杨人香 姜苏珊 何雅琪 陈权薪 苏会岚
(成都医学院公共卫生学院,成都 610500)
乳酸是食品工业中细菌污染监测[1]、发酵和环境监测[2]中的常用指标,也是生物医学诊断中反映人体生理病理状态的重要物质[3]。传统的乳酸检测方法如分光光度法[4]、比色法[5]等步骤繁琐、灵敏度低、成本高。电化学生物传感器是基于电化学分析方法发展的一种新型检测技术,通过将生物分子之间的特异性识别作用的反应信号转化成电信号,来实现对靶物质的定性或定量检测,具有样品处理简单、分析效率高、选择性好、成本低、操作简便等特点[6]。目前,基于酶电极的乳酸传感器因其检测快速且灵敏度高被广泛报道[7-8],主要应用L-乳酸氧化酶(L-LOD)和L-乳酸脱氢酶(L-LDH)的两种生物酶作为生物识别原件进行构建[9]。由于该类方法分析性能受酶活性、氧或NAD+浓度等因素影响[10],因此,迫切需要灵敏、简便和选择性高的新方法来实现L-乳酸的快速检测。
适配体是一类单链DNA或RNA寡核苷酸,被称为“化学抗体”,具有易于合成和修饰、热稳定性、低成本、缺乏免疫原性和毒性等独特优点,可以高亲和力地特异性结合各种靶标[11],是开发生物传感器非常有潜力的识别探针。与酶不同,适配体仅靠结合进行目标识别,不依懒于氧或NAD+等其他反应物[12]。乳酸是一种低表位分子,其适配体筛选较困难[13]。Huang等[14]通过文库固定化选择方法获得了10条L-乳酸的适配体序列,其中适配体链Lac201响应最灵敏,且基于Lac201所设计的荧光传感器的检测范围最广,可以涵盖乳酸1~23 mmol/L的生理全范围。三螺旋分子开关(triple-helix molecular switch,THMS)是一种非常规的核酸结构,通常由1个具有双臂片段的目标特异性DNA序列和1个被困在双臂片段之间被称为信号转导探针的DNA序列(STP)构成,通常基于靶标结合破坏其三螺旋结构的机理实现检测,作为一种核酸识别探针被广泛应用[15]。脱氧核酶(DNAzymes)是一种人工合成的功能核酸,由底物链和催化链组成,在金属离子的辅助下完成催化剪切,在电化学分析方法中常与其他信号放大策略联用实现信号放大,提高分析灵敏度[16]。其中有RNA剪切活性的Pb2+特异DNAzyme是目前研究最为充分的一类DNAzyme[17]。
本研究开发了一种超灵敏、低成本的新型电化学适配体传感器用于L-乳酸的快速检测,在最优实验条件下研究了该传感器的分析性能,为L-乳酸的检测提供新策略。
1 材料与方法
1.1 试剂与仪器
L-乳酸钠购于阿拉丁生化科技股份有限公司,1-己硫醇(HT)、半胱氨酸、葡萄糖、抗坏血酸等购于美国Sigma公司,氯金酸、磷酸盐缓冲液(PBS,pH=7.4)和 Tris-盐酸缓冲液(Tris-HCl,pH=8.0)、铁氰化钾、亚铁氰化钾、硝酸铅、氯钯酸等购于成都市科龙化工试剂厂。氮掺杂多壁碳纳米管购于江苏先丰纳米材料科技有限公司。核酸序列由生工生物工程(上海)股份有限公司合成,序列信息见表1。
CHI 660E电化学工作站(含三电极系统,上海辰华)、玻碳电极(d=4 mm)、超声波清洗机(宁波新芝生物)、BSA124S 电子天平(上海舜宇恒平)、金属浴(赛默飞)、干燥箱(天津泰斯特)、离心机(蜀科)、透射电镜(赛默飞)、恒温磁力搅拌器(上海司乐)、UV2355型紫外可见分光光度计。
1.2 溶液配制
所有核酸干粉离心后用Tris-HCI(10 mmol/L,pH=8.0)缓沖溶液进行溶解和稀释。亚甲蓝修饰核酸(MB-DNA)溶液采用TCEP(10 mmol/L)预处理30~60 min,以减少硫醇-硫醇(SH-SH)键。L-乳酸钠用超纯水稀释,得不同浓度(1、3、5、7、9、11、13、15、17、20 mmol/L)溶液。
1.3 制备复合纳米材料Au/Pd-N-MWCNTs
将12.0 mg N-MWCNTs分散到新制的多巴胺溶液(50 ml,1.0 mmol/L)中,置于碳酸盐/碳酸氢盐缓冲液(10 mmol/L,pH=8.5)中搅拌12 h,多巴胺在N-MWCNTs表面自聚合,离心洗涤得到多巴胺-N-MWCNTs复合物。
采用溶胶法预先合成金钯纳米颗粒的溶胶溶液。按比例加入1%氯钯酸和1%氯金酸水溶液作为溶胶前驱体,以聚醚酰亚胺(PEI,0.1 g/L)作为保护剂,搅拌30 min。在连续搅拌中向上述溶液加入还原剂NaBH4(0.1 mol/L),当混合溶液变为黑色时表明金钯纳米离子溶胶成功合成。
随后加入上述多巴胺-N-MWCNTs复合物粉末于金钯纳米粒子溶胶中混合搅拌16 h,直至上层清液转为透明无色。用去离子水进行多次过滤、洗涤以去除氯离子,置于60℃的烘箱中干燥12 h,装管保存,使用前称取1.5 mg溶解在3 ml的去离子水中,超声0.5 h得到相对稳定的黑色悬浮液。
1.4 合成THMS
THMS组装包括两部分:Lac 201链由L-乳酸的原始适配体序列和2个扩展序列组成,DNAzyme链包含1个Pb2+依赖的DNAzyme序列。为了形成三螺旋结构,将相同浓度(2 μmol/L)的Lac 201链和DNAzyme链等量地混合在结合缓冲液Tris-HCI(pH=8.0)中,在95°C加热5 min,然后冷却至室温2 h,4℃冰箱保存。
1.5 电化学适配体传感器的构建
将玻碳电极经抛光与超声洗涤预处理后烘干。采用循环伏安法(CV,电压范围-0.2~+0.8 V,扫描速率100 mV/s),在5 mmol/L Fe(CN)63-/4-溶液中进行电化学扫描,直到获得稳定的循环伏安图。随后滴涂10 μl Au/Pd-N-MWCNTs混合溶液在电极上,烘干后在-0.2 V的恒电位控制下,30 s内电沉积AuNPs,得到复合纳米材料修饰的电极。将8 μl MB-DNA(4 μmol/L)滴加到修饰后的电极表面,置于4°C冰箱孵育3 h。经超纯水洗涤烘干后,滴加6 μl HT溶液(1 mol/L)孵育30 min以封闭非特异性吸附位点。用Tris-HCl缓冲液洗涤后,将所得电极干燥,4°C避光保存。
1.6 检测
采用传统的三电极系统(饱和甘汞电极为参比电极、铂丝电极为辅助电极、修饰的玻碳电极GCE作为工作电极),电化学信号采用差分脉冲伏安法(DPV)获得,从-0.6 V~-0.1V。将10 μl 20 mmol/L L-乳酸与90 μl THMS溶液在结合缓冲液Tris(10 mmol/L,pH=8.0)中孵育30 min。然后,将10 μl上述孵育溶液和2 μl Pb2+加入到电极表面,37°C下孵育60 min。用PBS(pH=7.4)缓冲液洗涤后,进行电化学测量,峰电流(I)与L-乳酸的浓度相关,通过标准曲线法可测得样品中L-乳酸的浓度。
1.7 实验条件优化
优化信号链MB-DNA浓度、DNAzyme剪切时间和Pb2+浓度三个实验条件。固定其他实验条件,测试在20 mmol/L L-乳酸孵育前后,不同MB-DNA(1、2、3、4、5、6 μmol/L)浓度下的DPV响应,获得MB-DNA浓度与峰电流的关系曲线。测试不同DNAzyme剪切孵育时间(0、20、40、60、90、120 min)和Pb2+浓度(1、2、3、4、5、6 μmol/L)的DPV响应,并绘制孵育时间与峰电流的关系曲线。
1.8 性能研究
在最佳实验条件下,采用DPV检测不同浓度L-乳酸(1、3、5、7、9、11、13、15、17、20 mmol/L)的电信号响应值(I),以乳酸浓度的对数为横坐标,峰电流为纵坐标绘制标准曲线。在相同条件下,测试了该传感器的重现性、稳定性和特异性。在实际样本中分别加入高中低3种浓度的L-乳酸,根据标准曲线计算添加样本的浓度,计算得到加标回收率。
2 结果与讨论
2.1 适配体传感器的检测原理
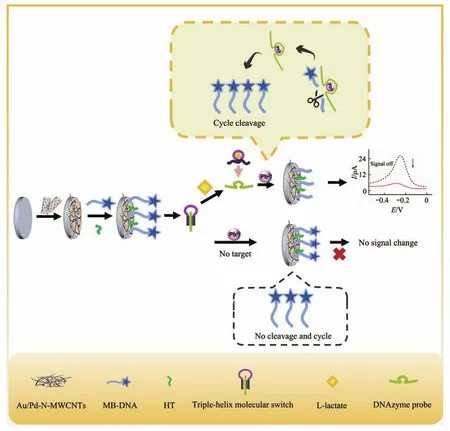
Fig.1 Schematic of the electrochemical aptasensor for detection of L-lactate based on THMS-triggered DNAzyme cleavage mechanisms
图1为基于THMS触发DNAzyme循环剪切策略检测L-乳酸的电化学适配体传感器制备示意图。首先,在预处理后的玻碳电极上修饰Au/Pd-NMWCNTs,修饰有巯基的MB-DNA链通过Au-S共价键连接到电极上,然后采用HT封闭非特异性位点。当L-乳酸存在时,与THMS结构中的Lac 201链特异性结合,释放DNAzyme链。DNAzyme链被激活,进一步与电极上的MB-DNA探针特异性识别,在Pb2+的催化下剪切MB-DNA,导致MB从电极表面脱落。当一条MB-DNA链剪切完成时,与DNAzyme链的结合力变弱,使DNAzyme被释放,再与另一MB-DNA结合,形成循环剪切过程,致使电极表面MB-DNA大量脱落,显著降低电信号。电信号降低的程度与L-乳酸的浓度相关,从而实现对其的超灵敏检测。
2.2 电极表征
采用循环伏安法(CV)对电极修饰过程进行表征(图2)。由于Au/Pd-N-MWCNTs的强导电性,电极峰电流(曲线b)升高。当MB-DNA固载到电极表面后,阻碍电子传递,峰电流降低(曲线c)。HT的固载进一步阻碍电子传递,峰电流再次降低(曲线d)。在DNAzyme的剪切效应下,MB-DNA裂解从电极表面分离,峰电流升高(曲线e),验证了修饰电极的成功制备。
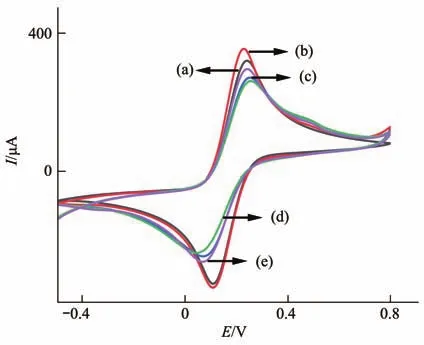
Fig.2 Cyclic voltammetry curves of the modified electrode at 5 mmol/L [Fe(CN)6]3-/4-
2.3 材料表征
多壁碳纳米管(MWCNTs)是典型的一维纳米材料,它的比表面积大、具有空腔结构和独特的电化学性质,常用于负载其他材料,从而获得特殊性能的复合物材料[18]。氮掺杂将会进一步改善MWCNTs表面的电荷分布,提高其反应活性。同时,双金属具有良好的协同催化作用,在检测过程中能显示出更高的电流响应和稳定性。因此,本研究合成金钯-掺氮多壁碳纳米管纳米复合材料,以提高玻碳电极的导电性能,加快电子转移,增强电化学活性物质的氧化峰电流。
为了验证上述纳米复合材料的成功合成,采用能谱面扫(EDS mapping)、X射线衍射(XRD)与X射线光电子能谱分析(XPS)对材料进行了表征(图3)。EDS mapping结果显示,该复合材料中含有C、N、Pd、Au四种元素,且图中Pd、Au粒子沿N-MWCNTs均匀分布,表明了这两种金属粒子成功掺杂(图3a)。由于Pd、Au为Fm-3m cubic结构,故XRD结果区分不明显(图3b)。文献对比可见[19],Au/Pd-N-MWCNTs的(002)晶面对应的衍射峰显示碳纳米管结构。(111)、(200)、(220)晶面对应的衍射峰显示碳纳米管表面的纳米颗粒结晶良好。图3c为XPS全谱分析结果,图3d~g分别代表C 1s、N 1s、Pd 3d、Au 4f四种元素的分谱,其中Au 4f的特征峰为84.1 eV,说明Au在合成后的纳米复合材料中具有良好的金属态结构,Pd 3d XPS谱由两个双态组成,表明同时存在两个化学态(Pd、PdO)。结果表明,金属态的Au和Pd均为该反应的活性组分,与周依雪[20]的研究一致。以上结果表明,Au/Pd-N-MWCNTs纳米复合材料成功合成。
采用透射电子显微镜(TEM)对制备的纳米复合材料Au/Pd-N-MWCNTs进行了形貌表征(图4a),可以看到多巴胺处理后的N-MWCNTs,较为均匀地分散在水溶液中,纳米颗粒均匀地修饰在N-MWCNTs上。为了进一步证明该复合材料的导电性能,用Au/Pd-N-MWCNTs与纳米金分别修饰玻碳电极,孵育MB-DNA后进行信号检测,发现Au/Pd-N-MWCNTs修饰的玻碳电极峰电流值为26.35 μA,较沉积金修饰的玻碳电极峰电流值高11.26 μA(图4b),说明表面Au/Pd-N-MWCNTs能显著提高电极表面的电子传输性能,有望提高传感器的检测性能。
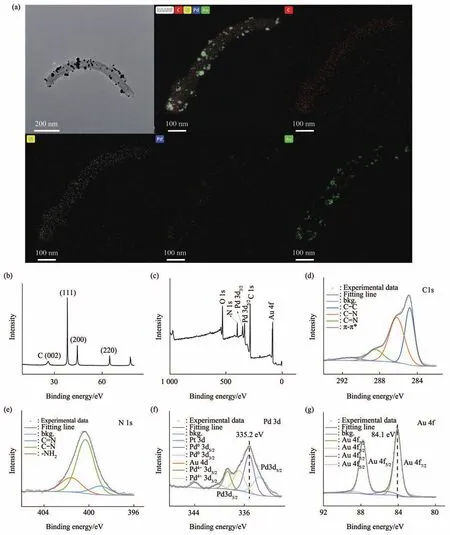
Fig.3 Characterization of the nanomaterials
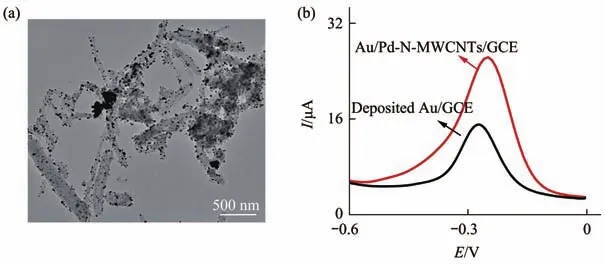
Fig.4 Electrochemical performance analysis of nanomaterials
2.4 实验条件优化
对MB-DNA浓度、Pb2+浓度和DNAzyme剪切孵育时间3个实验条件进行优化。首先研究不同浓度MB-DNA与适配体传感器孵育前后的DPV信号差异(图5a)。随着MB-DNA浓度的升高峰电流逐渐升高,当信号链MB-DNA的浓度4 μmol/L时信号最大,且不随浓度的增大而变化,说明此时MBDNA的结合已达到饱和。此外,DNAzyme的剪切需要Pb2+作为辅助因子,且Pb2+浓度对DNAzyme的剪切活性产生影响。因此,固定其他实验条件,加入不同浓度的Pb2+时电化学响应结果如图5b所示,Pb2+的浓度为4 μmol/L时信号趋于稳定。DNAzyme链的剪切孵育时间在60 min后信号没有明显的变化,表明裂解反应在60 min内完成(图5c)。综上,选择 4 μmol/L MB-DNA、4 μmol/L Pb2+和60 min孵育时间为作为最优实验条件。
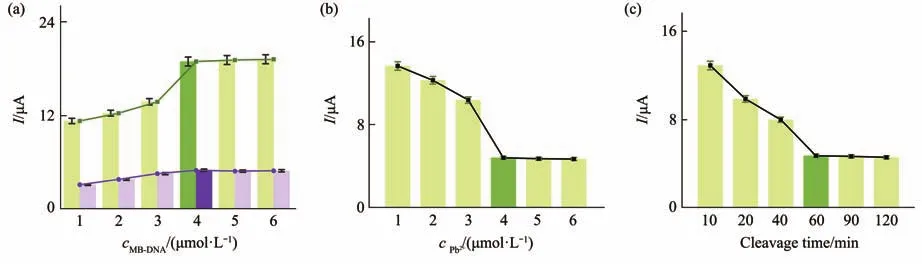
Fig.5 Optimization of experimental conditions
2.5 L-乳酸的电化学测定
在最优实验条件下,测定了不同浓度(1~20 mmol/L)L-乳酸的DPV响应曲线(图6)。图中显示,峰电流(I)随着L-乳酸浓度的增加而降低,且I与相应加入L-乳酸的浓度的对数与呈良好的线性关系,线性回归方程为I=-17.03lgctarget+27.127,R2=0.997 5,检测限为0.51 mmol/L(S/N=3),较王洋洋等[21]报道的汗液乳酸传感器(检测限小于5 mmol/L)和Huang等[14]报道的乳酸荧光生物传感器(检测限为0.55 mmol/L)的检测限更低,可见基于THMS触发DNAzyme循环剪切策略能够实现L-乳酸的超灵敏检测,其检测范围也能有效地覆盖血液中L-乳酸的生理浓度范围[22]。

Fig.6 Electrochemical determination of L-lactate
2.6 传感器的性能研究
接着同样在最优实验条件下对上述适配体传感器的重现性、稳定性和选择性进行了研究(图7)。首先,同时制备了10适配体传感器检测相同浓度的L-乳酸(20 mmol/L)(图7a),RSD为2.80%,说明该传感器具有良好的重现性。研究测试了传感器的稳定性,即将制备的适配体传感器避光存放在4℃冰箱中,在第1、7、14、21天进行电化学测试(图7c)。信号在21 d内下降了9.6%,RSD为4.56%,可见该传感器稳定性良好。同时,本研究选择了坏血酸、半胱氨酸、葡萄糖、谷胱甘肽4种小分子物质来测试传感器的特异性,将上述4种小分子分别与90 μl THMS溶液在结合缓冲液Tris孵育30 min,并用制备好的适配体传感器分别进行检测(图7b)。抗坏血酸、半胱氨酸、葡萄糖、谷胱甘肽并不能触发THMS开关诱导的信号机制,响应信号均无明显变化。而只有在L-乳酸单独存在或与其他4种小分子物质混合存在的情况下,才可以触发信号机制运转,产生明显的响应信号,相同浓度的L-乳酸和其混合溶液的响应强度无明显差异,证实该传感器对L-乳酸具有较高的特异性。
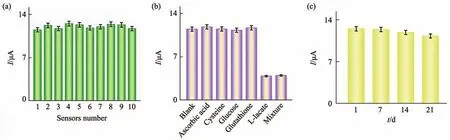
Fig.7 Analytical performance
2.7 实际样本L-乳酸的检测
为了对本适配体传感器的实际应用性能进行评估,在最优条件下采用标准加入法对所制备的适配体传感器在血清中的L-乳酸检测进行研究。血清样本用Tris缓冲液稀释10倍后,加入不同浓度的L-乳酸,测定加标回收率。加标回收率=(加标试样测定值-试样测定值)÷加标量×100%,结果见表2。该适配体传感器的加标回收率为105.60%~110.80%,相对标准偏差为2.35%~4.56%,表明所构建的电化学适配体传感器可用于血清中L-乳酸检测。
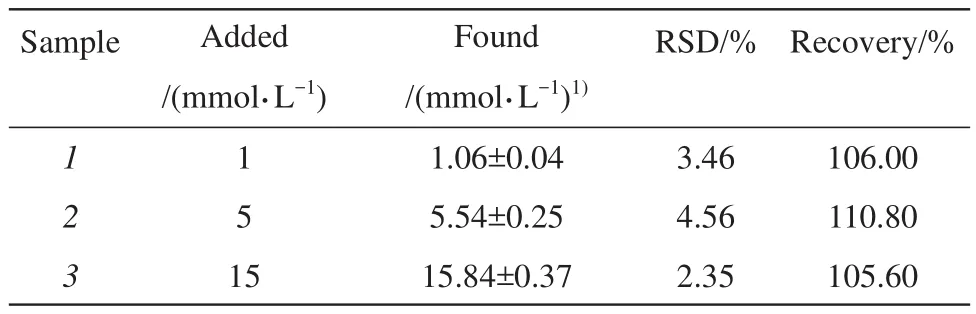
Table 2 Determination of L-lacate spiked recovery rate using an aptasensor
采用分光光度法同时检测了样品,并运用t检验对两种方法的测定值进行统计分析(表3)。结果表明,两种方法测定结果无显著差异(P>0.05)。本研究所构建的传感器对样品的测定结果与分光光度法具有很好的一致性。
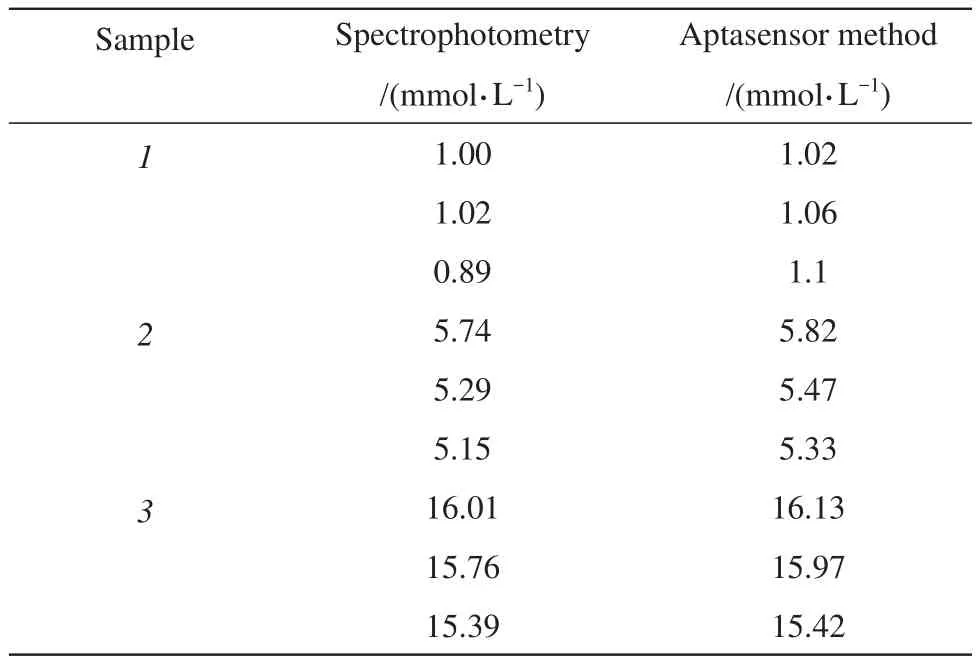
Table 3 Results of the determination of L-lactate in real serum by different methods
3 结论
乳酸检测在生物医学诊断、食品工业和环境监测等领域具有重要意义。本研究基于金钯-掺氮多壁碳纳米管纳米复合材料(Au/Pd-N-MWCNTs)构建了THMS触发的DNAzyme循环放大的电化学适配体传感器,有效提升了玻碳电极的导电性,且DNAzyme可以循环剪切MB-DNA,增强响应信号,为L-乳酸的快速检测提供了新方法。该传感策略易于设计,只需替换THMS中的适配体序列,就可以实现对不同目标的检测。该技术具有操作简单、特异性高、低成本等优势,有较宽的检测范围和较低的检测限,可望应用于L-乳酸实际样本检测工作中。但仍具有整体检测时间较长、传感器的寿命比较短和需要使用污染环境的Pb2+等局限性,希望能在后续的研究中进行改进优化。