糖尿病阴证大鼠创面模型的制备
2023-10-09周佳俞陈丽康瀚云丁雅容王巍袁忠行雷嘉欣周忠志
周佳俞,陈丽,康瀚云,丁雅容,王巍,袁忠行,雷嘉欣,周忠志
(1. 湖南中医药大学,湖南 长沙 410208; 2. 湖南中医药大学第一附属医院,湖南 长沙 410007)
糖尿病及其并发症已成为严重影响人类健康的全球性公共卫生问题之一,国际糖尿病联盟(IDF)统计显示,截至2021年我国糖尿病患者超过1.4亿人,其中糖尿病创面发病率高达20%[1],给家庭和社会带来了沉重负担。糖尿病创面多发展为慢性难愈性创面,患者患病日久、体弱纳差、创面色泽晦暗、生长迟缓、迁延难愈,中医辨证为“阴证”范畴[2]。为了进一步探究糖尿病创面的病因病机与治疗方法,建立稳定的高质量动物模型是当务之急。目前制备糖尿病、阴证等动物模型的方法多样[3-4],但仍然存在造模方法不统一、模型不稳定、可重复性不高等问题。本实验针对糖尿病创面特点并结合前期研究基础建立糖尿病阴证创面动物模型,从动物体征、创面病理改变等角度进行评价,意在对相关模型的建立提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
SPF 级雄性SD 大鼠(湖南中医药大学实验动物中心),36 只,体质量180~200 g。饲养条件:温度22 ℃左右,相对湿度40%~60%,每12 h 光照、黑暗交替,独立通风系统(IVC),3 只一笼。实验动物质量合格证号:1107272011007366;实验动物生产许可证号:SYXK(湘)2019-0004;实验单位使用许可证号:SYXK(湘)2019-0009;本研究已通过湖南中医药大学实验动物伦理审查委员会审批,批准号:LL2020071401。
1.1.2 主要试剂
高脂乳剂组成:精制猪油(产品标志号:GB/T8937);6-正丙基-2-硫代尿嘧啶(上海源叶生物科技有限公司,货号:530643);胆酸钠(上海源叶生物科技有限公司,货号:S30219);胆固醇(北京索莱宝生物科技有限公司,货号:C8280);吐温-80(北京索莱宝生物科技有限公司,货号:T8360);1,2-丙二醇(北京索莱宝生物科技有限公司,货号:YZ-190001)。SPF 级大小鼠维持饲料(华阜康公司,货号:1022);链脲佐菌素(streptozotocin,STZ)(北京索莱宝生物科技有限公司,货号:S8050);0.1%柠檬酸钠缓冲液(北京索莱宝生物科技有限公司,货号:C1013);戊巴比妥钠(西格玛奥德里奇贸易有限公司,货号:11715);氢化可的松(上海源叶生物科技有限公司,货号:B61935);苏木素、伊红、返蓝液(塞维尔生物科技有限公司)。
1.1.3 主要仪器
微单相机[索尼(中国)有限公司];切片机、显微镜(徕卡公司);数字切片扫描系统(3DHISTECH 公司);YK-8 生物组织摊烤片机(湖北耀楚医疗器械科技有限公司)。
1.2 分组与模型建立
36 只SD 大鼠,随机分为正常创面组、糖尿病创面组和糖尿病阴证创面组。适应性喂养后给予充足饮食,除正常创面组外,其余两组大鼠连续14 d灌胃高脂乳2 mL/d[5],选择一次性腹腔注射50 mg/kg STZ-柠檬酸钠混合液,同期正常创面组大鼠灌胃饮用水、腹腔注射生理盐水。尾静脉采血测定大鼠血糖值,若血糖值连续3 d ≥ 16.7 mmol/L,并糖耐量试验阳性,则认为糖尿病造模成功。
糖尿病阴证创面组大鼠按2 mL/kg剂量,连续7 d左右腿交替肌内注射氢化可的松注射液,其余组注射等量生理盐水。若大鼠创面渗液清稀、肉色灰暗,表现出喜静懒动、纳差便溏、体质量减低等阴证症状,则认为糖尿病阴证造模成功。造模成功后第1 天各组大鼠麻醉后备皮、消毒,然后在背部裸区距正中线1.5 cm处,手术构建全层皮肤缺损创面,术后置于电热毯保温,若术后及时恢复活动,3 d未出现死亡,则认为创面造模成功。
1.3 观察指标
1.3.1 一般情况
以3 d 为周期测量并记录每只大鼠体质量、饮食、饮水、随机血糖。
1.3.2 糖耐量检测
口服糖耐量(OGTT)试验:随机选取每组大鼠各10 只,禁食不禁水过夜,然后给予50%葡萄糖溶液(2 g/kg)灌胃,分别于灌胃后0、30、60、120 min 测量大鼠尾静脉血血糖值。
1.3.3 创面愈合情况
肉眼观察各组大鼠的创面颜色、创面形状、肿胀程度、渗液量、皮肤收缩情况。在造模后、第7、14 天放置标尺于创面相机拍照,并使用Image J 图像分析软件获取创面面积数据,计算愈合面积所占百分比(A)。
A(%) = (造模前创面面积-造模后创面面积)/造模后创面面积 × 100%
1.3.4 病理形态观察
处死后取材皮肤组织、胰腺检测。脱水、包埋、切片、脱蜡、HE 染色、中性树脂封片,使用3DHISTECH SlideViewer系统阅片并拍摄图片。
1.3.5 脏器指数
大鼠取材时选取肾、脾、肾上腺、胸腺,称湿重,用取材时体质量计算器官体质量分数并进行统计学处理。
1.4 统计学方法
使用SPSS 26.0 软件进行统计学处理。计量资料以均数 ± 标准差(±s)表示,运用ANOVA单因素方差分析方法。P< 0.05为差异具有统计学意义。
2 结果
2.1 大鼠成模率、死亡率统计
动物饲养与灌胃期间,大鼠健康活泼,状态良好,糖尿病造模后血糖不达标大鼠1 只,阴证造模后饲养后期,因虚弱死亡大鼠1 只,均予剔除数据。糖尿病创面组与糖尿病阴证创面组造模成功率均为91.7%。结果见表1。
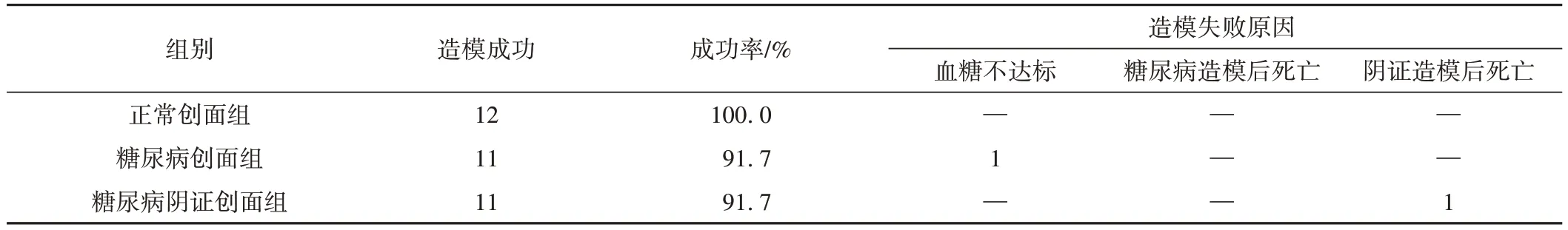
表1 造模成功率及失败原因
2.2 饮食、饮水、体质量情况比较
实验期间大鼠的体质量、饮食饮水量缓慢增长。糖尿病造模后,糖尿病创面组、糖尿病阴证创面组大鼠较正常创面组出现明显的多饮多食现象,差异有统计学意义(P< 0.05),创面造模后糖尿病创面组比糖尿病阴证创面组变化更显著(P< 0.05);正常创面组大鼠体质量持续增长,糖尿病创面组和糖尿病阴证创面组大鼠于创面造模后体质量明显下降,低于正常创面组大鼠(P< 0.05),其中糖尿病阴证创面组较糖尿病创面组降幅更大(P< 0.05)。结果见图1~图3。
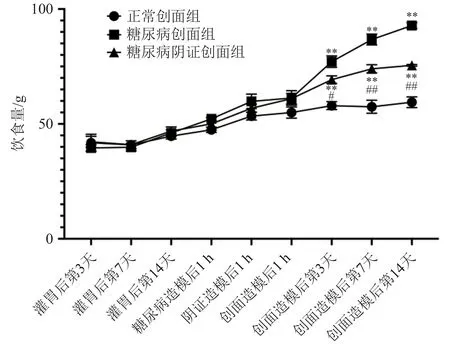
图1 各时间点不同组别大鼠饮食量变化趋势折线图
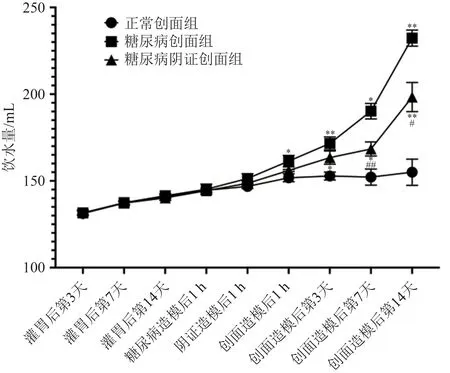
图2 各时间点不同组别大鼠饮水量变化趋势折线图
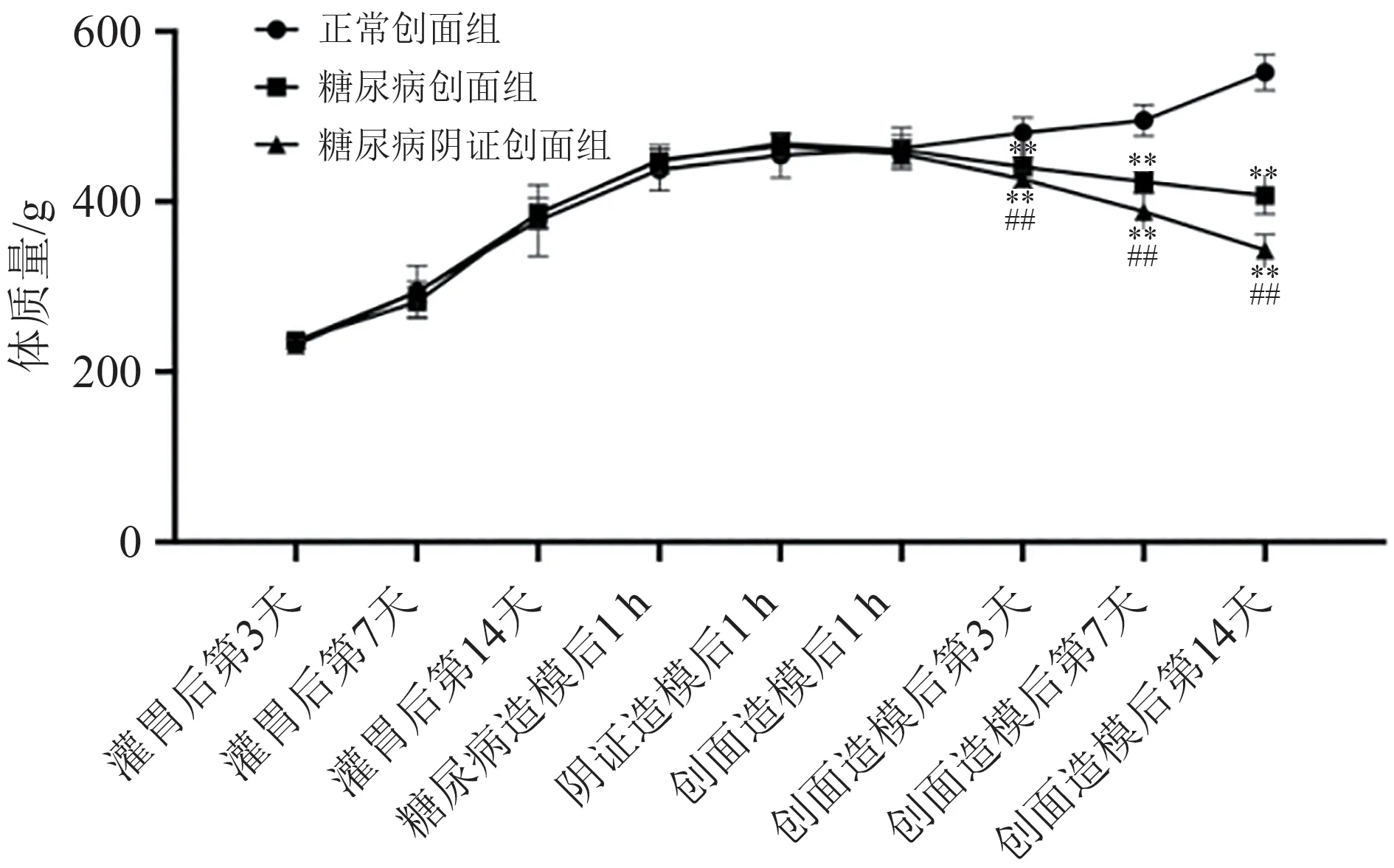
图3 各时间点不同组别大鼠体质量变化趋势折线图
2.3 血糖
糖尿病造模前,3 组大鼠随机血糖浓度均属正常范围,血糖值低于16.7 mmol/L。糖尿病造模后,糖尿病创面组与糖尿病阴证创面组大鼠血糖浓度明显高于正常创面组(17.1~26.2 mmol/L),差异有统计学意义(P< 0.05)。结果见图4。
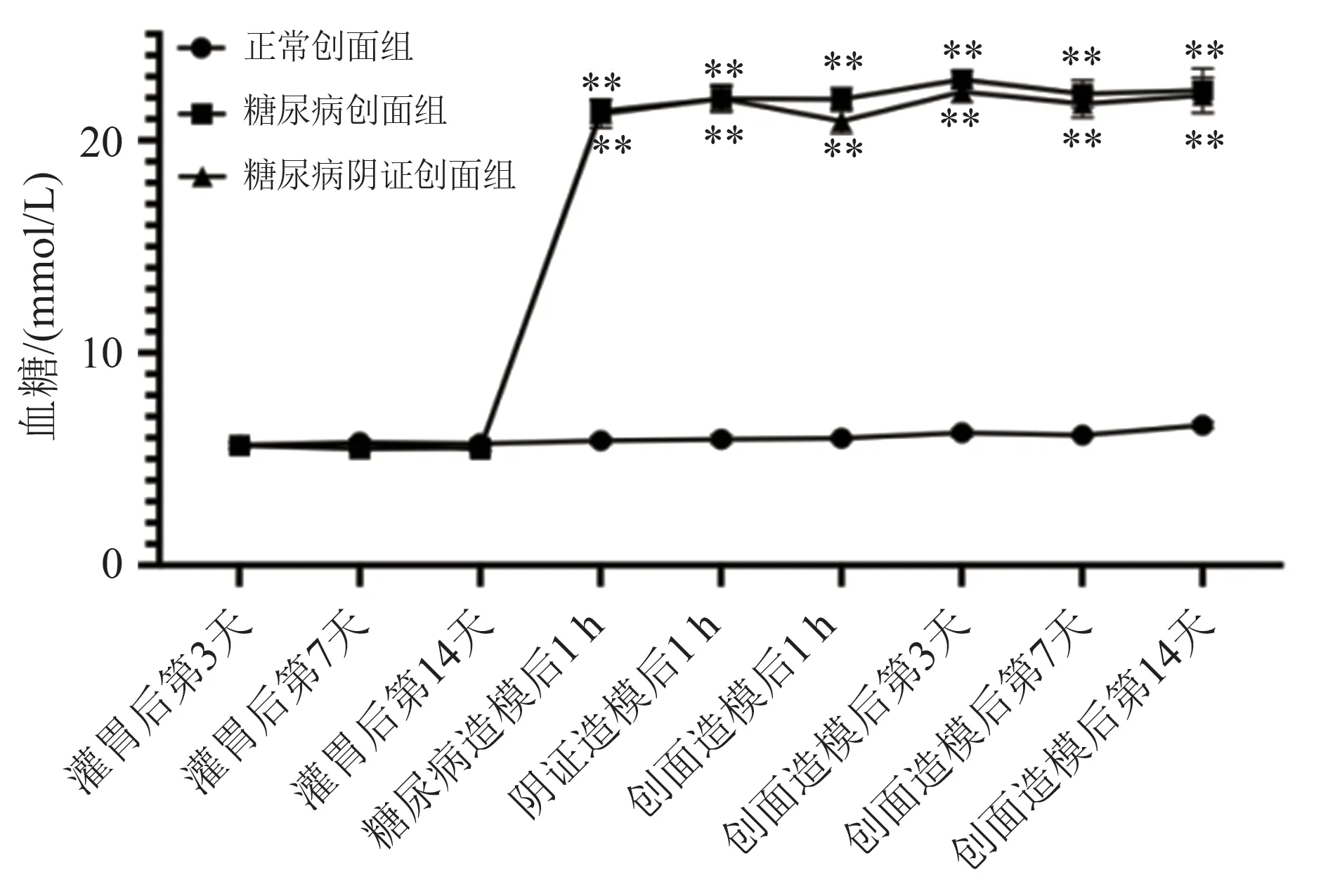
图4 各时间点不同组别大鼠血糖变化趋势折线图
2.4 OGTT试验测定结果
OGTT 试验结果表明,正常创面组、糖尿病创面组及糖尿病阴证创面组在未给予葡萄糖负荷前,均表现为非高血糖状态( < 13.6 mmol/L)。给予葡萄糖负荷后,正常创面组血糖出现上升且在30 min达到高峰,而后逐步下降,全程未出现高血糖状态。而糖尿病创面组及糖尿病阴证创面组血糖值高居不下,血糖清除明显减缓,30、60、120 min均高于正常创面组且表现为高血糖状态,差异有统计学意义(P< 0.01)。以上结果说明,糖尿病创面组及糖尿病阴证创面组大鼠存在胰岛素抵抗。结果见图5。

图5 OGTT试验不同时间点各组平均血糖曲线
2.5 脏器指数
取材后,糖尿病阴证创面组大鼠肾脏、脾脏、肾上腺、胸腺脏器指数均低于其余两组,差异有统计学意义(P< 0.05,P< 0.01);糖尿病创面组各类脏器指数高于正常创面组,差异有统计学意义(P< 0.05)。结果见表2和表3。
表2 各组7 d脏器指数比较( ± s,%)

表2 各组7 d脏器指数比较( ± s,%)
注:与正常创面组比较,*P < 0.05,**P < 0.01;与糖尿病创面组比较,##P < 0.01。
组别正常创面组糖尿病创面组糖尿病阴证创面组F值P值n6 5 5脏器指数/%肾脏0.604 ± 0.018 0.730 ± 0.014**0.594 ± 0.032##58.694 0.000脾脏0.256 ± 0.010 0.287 ± 0.017**0.245 ± 0.015##11.897 0.001肾上腺0.315 ± 0.022 0.345 ± 0.022*0.299 ± 0.021**5.523 0.018胸腺0.190 ± 0.004 0.195 ± 0.005 0.187 ± 0.004*4.602 0.031
表3 各组14 d脏器指数比较( ± s,%)
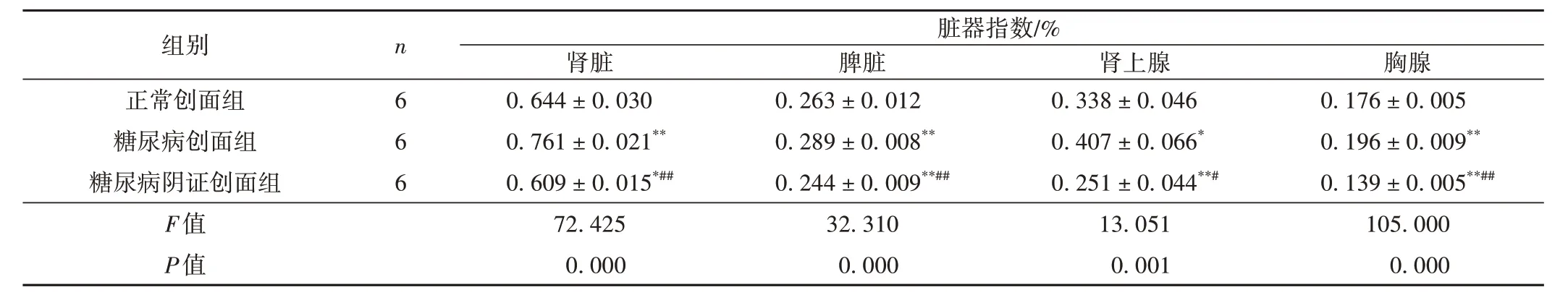
表3 各组14 d脏器指数比较( ± s,%)
注:与正常创面组比较,*P < 0.05,**P < 0.01;与糖尿病创面组比较,#P < 0.05,##P < 0.01。
组别正常创面组糖尿病创面组糖尿病阴证创面组F值P值n 6 6 6脏器指数/%肾脏0.644 ± 0.030 0.761 ± 0.021**0.609 ± 0.015*##72.425 0.000脾脏0.263 ± 0.012 0.289 ± 0.008**0.244 ± 0.009**##32.310 0.000肾上腺0.338 ± 0.046 0.407 ± 0.066*0.251 ± 0.044**#13.051 0.001胸腺0.176 ± 0.005 0.196 ± 0.009**0.139 ± 0.005**##105.000 0.000
表4 各组不同时间大鼠创面愈合率比较( ± s,%)
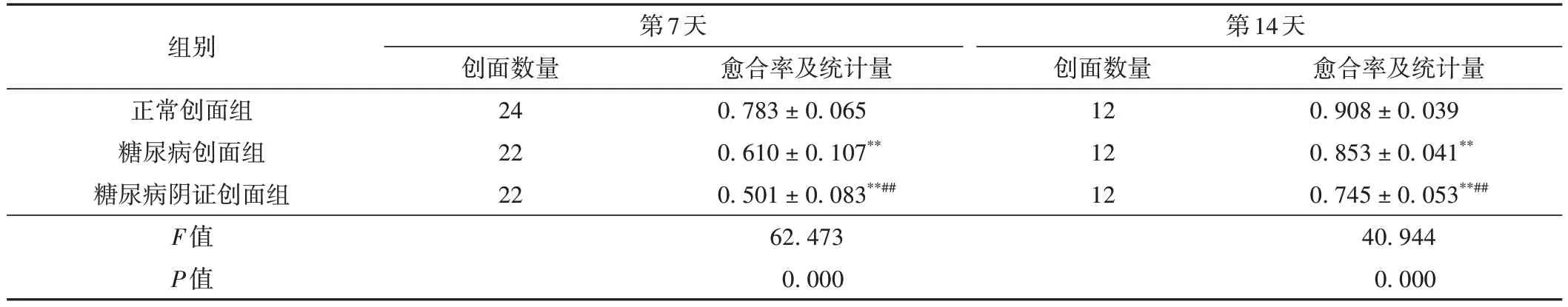
表4 各组不同时间大鼠创面愈合率比较( ± s,%)
注:与正常创面组比较,**P < 0.01;与糖尿病创面组比较,##P < 0.01。
组别正常创面组糖尿病创面组糖尿病阴证创面组F值P值第7天创面数量24 22 22愈合率及统计量0.783 ± 0.065 0.610 ± 0.107**0.501 ± 0.083**##62.473 0.000第14天创面数量12 12 12愈合率及统计量0.908 ± 0.039 0.853 ± 0.041**0.745 ± 0.053**##40.944 0.000
2.6 创面形态观察
正常创面组在第7 天创面干净,痂皮缩小且较薄;第14天,创面残存少许痂壳,基本修复。糖尿病创面组在第7天创面有痂皮形成,出现流脓渗血;第14天,创周痂皮基本干燥,修复趋势明显,上述各时间点与正常创面组比较,愈合效果差,差异有统计学意义(P< 0.01)。糖尿病阴证创面组在第7天,创面干燥,痂皮完整,创周有明显收势;第14天,创面色泽晦暗污秽,修复迟缓,各时间点与正常创面组、糖尿病创面组比较,愈合效果更差,差异有统计学意义(P< 0.01)。见图6~图7。
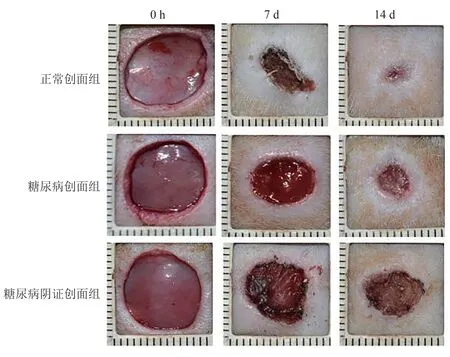
图6 各时间点大鼠创面肉眼观图
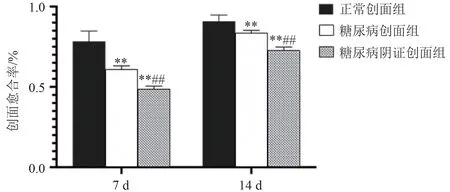
图7 各组创面愈合率情况比较
2.7 病理切片HE染色
2.7.1 皮肤组织
造模后第7 天:正常创面组创缘平整且薄,创面被新生肉芽组织覆盖,组织结构清楚(图8A1),肉芽组织和毛细血管较丰富,可见丰富细密而平行排列的胶原纤维(图8A2);糖尿病创面组生长缓慢,创面尚未有新生组织填充,创缘结构紊乱,痂皮、表皮层脱落(图8B1),新生细胞少,炎细胞浸润明显(图8B2);糖尿病阴证创面组生长迟缓,有厚重痂皮覆盖(图8C1),边缘可见纤细的胶原纤维向中央爬行(图8C2)。
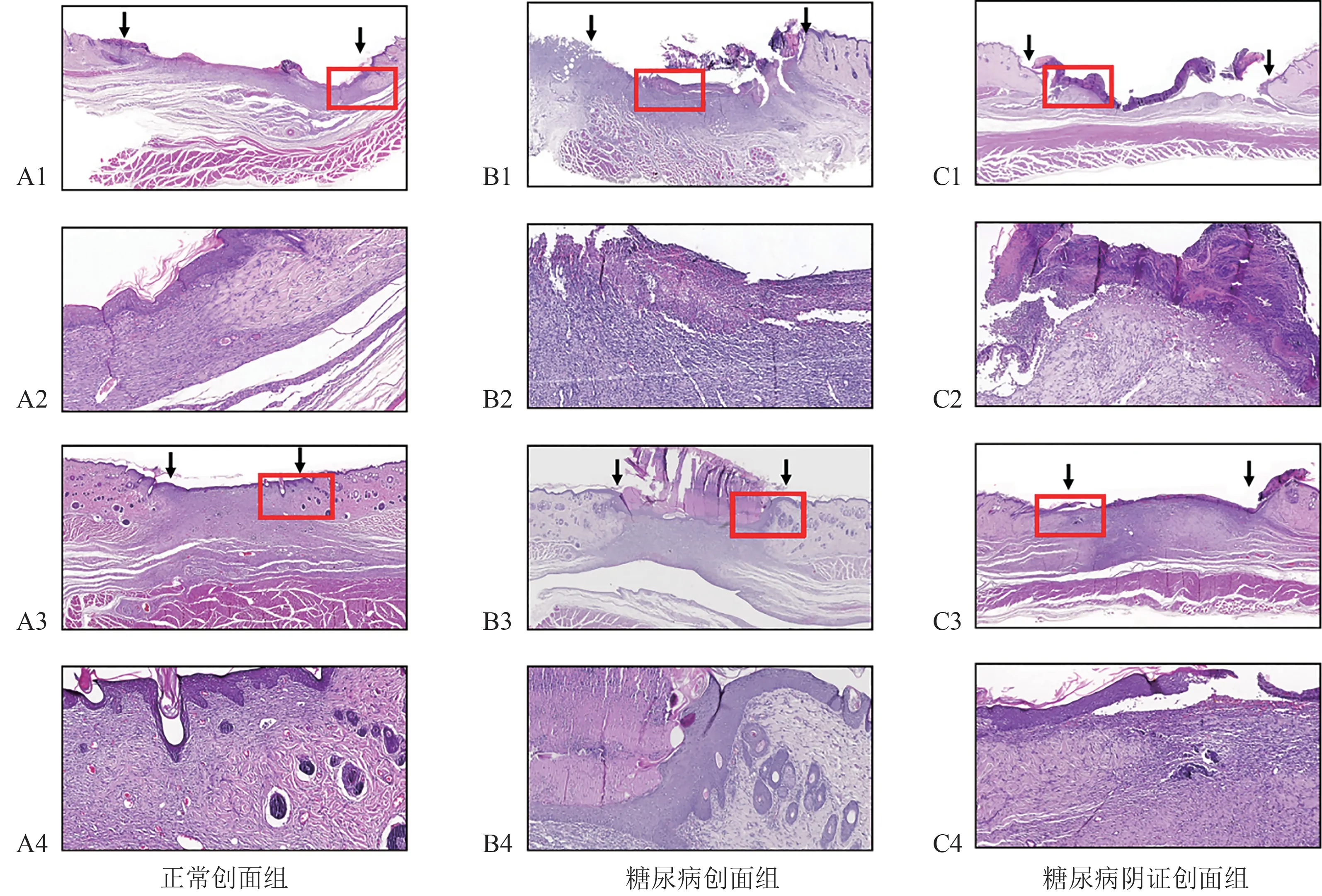
图8 创面病理形态观察(HE,× 20,× 100)
造模后第14 天:正常创面组表皮层出现且表面平整,各层组织细胞排列有序(图8A3),粗壮的胶原纤维排列整齐,填满缺损,炎细胞消退,肉芽组织趋于成熟,甚至可见毛囊生发,创面基本愈合(图8A4);糖尿病创面组皮肤组织肥厚,分泌物堆积,中间缺失(图8B3),可见明显的肉芽组织生长、爬行趋势,结构层次较紊乱,胶原排列疏松且不规则,伴有少量炎细胞浸润,表皮层尚未形成(图8B4);糖尿病阴证创面组可见全层皮肤较前两组薄,出现不连续的新生表皮覆盖,表皮生长不平整,尚未完全填充创面(图8C3),创面中成纤维细胞数量多,有炎细胞浸润,细胞排列紊乱(图8C4)。
2.7.2 胰腺
造模后第7 天:正常创面组大鼠胰腺组织肥厚、完整,胰岛数量多,呈类圆形,胰岛β细胞呈索状排列,细胞大小一致,细胞颗粒淡染,核染色质清晰,胞浆界线清楚(图9A1);而糖尿病创面组大鼠胰腺组织萎缩,胰岛处于逐渐消失状态,胰岛边界模糊,胞浆有空泡形成(图9B1);糖尿病阴证创面组胰岛边界消融,胰岛β 细胞排列紧密(图9C1)。
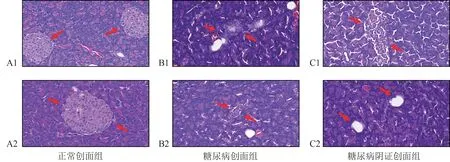
图9 胰腺病理形态观察(HE染色,× 400)
造模后第14 天:正常创面组大鼠胰腺组织愈加肥厚,胰岛多且大(图9A2);糖尿病创面组大鼠胰岛缩小甚至消失,β细胞皱缩,溶界消失(图9B2);糖尿病阴证创面组胰岛边界不均,排列稀疏,细胞核淡染,出现大量空泡(图9C2)。
3 讨论
全球糖尿病患者约4.63 亿,其中难愈合创面并发率高达20%[1],严重危害人类健康,给社会和家庭带来沉重负担。糖尿病慢性创面临床过程中常出现创面平塌、色泽灰白、渗液清稀、神疲乏力、生肌长肉迟缓等表现,有缠绵难愈、易于复发的特点,属于“阴证”范畴,严重时成为“脱疽”。中医学采用箍围、熏洗等外治方法治疗糖尿病并发症取得了良好的治疗效果[6-7]。糖尿病迁延日久,阳气虚衰,温煦推动失职,气血瘀滞,而气血不达肌表,阻碍新肉化生,创面迁延难愈[8]。这与糖尿病状态下机体代谢功能减弱、生长减缓等因素相符,创面特征为愈合受损、炎症延长和上皮化动力学降低[9]。因此,本实验模拟糖尿病慢性创面患者临床特征,制备糖尿病阴证创面大鼠模型,观察动物疾病特征、创面发展现象,建立合适的动物模型,并提供实验依据。
目前建立糖尿病大鼠模型的有效方法是使用胰岛细胞特异性毒性药物STZ 破坏胰岛细胞,通过影响胰岛素基因的表达转录翻译,直接减少胰岛素分泌,同时针对胰岛细胞对氧化应激不耐受的特性,STZ 直接诱导可造成胰岛细胞DNA 断裂,造成胰岛细胞功能障碍并死亡,胰岛形态破坏[10]。当前,注射STZ主要包括腹腔、肌肉、尾静脉注射等方法,其中,腹腔注射因操作简单、伤害小,且能有效避免因推注造成的血容量增长过快所致的心衰问题,成为目前主要的给药方式[11]。研究表明,高脂饮食可以引起糖脂代谢异常,影响胰岛素信号传导等途径,降低胰岛素敏感性,从而诱发胰岛素抵抗造成肥胖基础,之后采用高脂饮食配合高浓度高剂量单次注射STZ破坏胰岛是成功制备糖尿病大鼠模型的有效方法[12]。
阴证模型主要通过免疫抑制进行诱导,包括物理射线照射、注射免疫抑制剂等方法[13],其中通过大剂量注射糖皮质类激素诱导的阴证模型所表现出的蜷缩、皮温下降、大便溏稀、创面局部晦暗、脓液清稀,肉芽红而不泽等表现与糖尿病创面患者临床表现更为相似[14]。糖皮质激素在局部稳态、细胞发育和免疫细胞激活中具有重要的生理作用[15],而糖皮质激素过度使用会通过诱导淋巴细胞死亡并抑制免疫细胞的各项功能而发挥免疫抑制作用,从而影响胸腺、脾脏等免疫器官;并通过下丘脑-垂体-肾上腺轴(hypothalamicpituitary-adrenal axis,HPA)影响内分泌、消化系统[16-19],对大鼠造成全身改变,如喜静怠动、纳差便溏、形体消瘦等。这些表现与中医理论中阴证特点相符合,且病理机制与脾、肾等脏腑密切相关[20]。现代研究认为,HPA 的功能障碍是阳虚的病理基础,同时脏器指数降低说明造模后HPA 调节紊乱,脾、肾等功能下降[21-22]。此外,糖皮质激素直接影响物质代谢,通过抑制外周组织对葡萄糖的利用、加剧糖尿病,促进蛋白质分解同时抑制蛋白质合成、促进脂肪分解,减少细胞能量供应,造成大鼠体质量下降,消化吸收功能减弱[23]。糖皮质激素甚至存在阻碍创面皮肤愈合、导致皮肤萎缩的副作用[24]。
针对创面模型的制备,主要有全层皮肤切除术[25]、皮肤磁片压迫法[26]、高温烫伤法[27]等,实验过程中发现打孔器难以穿透皮肤或造成创面位置不统一;皮肤磁片压迫法、温度诱导法操作难度大、创面深度及面积不可控,且大鼠温度耐受不同,综上本实验选择了直接手术法。
本实验结果表明,糖尿病造模后的大鼠阴证症状突出,表现为毛发粗糙杂乱,二便剧增,气味烘臭、毛发黯淡污秽、行动迟缓、蜷缩畏寒、大便溏稀等。与正常创面组比较,糖尿病阴证创面组与糖尿病创面组大鼠血糖明显升高(P< 0.05),维持在17.1~26.2 mmol/L;OGTT 试验结果提示,糖尿病阴证创面组及糖尿病创面组大鼠存在胰岛素抵抗。相较于正常创面组,糖尿病阴证创面组与糖尿病创面组表现出糖尿病多饮、多食、体质量减轻等症状(P <0.05)。糖尿病阴证创面组大鼠肾脏、脾脏、肾上腺、胸腺脏器指数低于其余两组,糖尿病创面组各类脏器指数高于正常创面组(P<0.05)。HE 染色结果表明,正常创面组大鼠胰腺组织肥厚,胰岛完整,而糖尿病阴证创面组与糖尿病创面组胰岛边界模糊,β 细胞消融;第14 天较第7 天胰腺组织消融更明显。创面修复情况显示:糖尿病阴证创面组相较于糖尿病创面组、正常创面组修复速度明显缓慢,第7、14天时间点创面愈合率均更低(P< 0.01)。且糖尿病阴证创面组HE 切片染色可见全层皮肤较前两组薄,出现不连续的新生表皮覆盖,表皮生长不平整,创面中成纤维细胞数量多,有炎细胞浸润,细胞排列紊乱。综上所述,本实验建立的大鼠糖尿病阴证创面模型确有依据且符合中医辨证思路。本研究在取材过程中发现糖尿病阴证创面组大鼠脾、肾萎缩显著,有别于其他组,今后有望从此着手深入探究脾肾阳虚模型机制。
目前已有大鼠糖尿病创面模型[13]、小鼠糖尿病阴证创面模型[5]等相关研究,方法均为分步依次造模。但是大鼠糖尿病阴证创面模型各步骤造模方法尚未统一,模型效果也存在差距,影响了相关实验的稳定性与可重复性。本团队所采用的通过2 mL 高脂乳剂灌胃14 d 后,予以一次性腹腔注射50 mg/kg STZ-柠檬酸钠混合液联合2 mL/kg 肌内注射氢化可的松注射液7 d 后行创面手术,可建立稳定高效的糖尿病阴证大鼠创面模型。同时探索出制备符合中医阴证证候的糖皮质类激素的适宜浓度与注射方法,提高了糖尿病大鼠阴证创面的稳定性和可重复性,具有一定的推广意义。
