“糖脂清”调控自噬改善STZ诱导糖尿病模型小鼠认知功能的机制研究
2023-10-09赵云王旭张擎姚文强陈凯徐奚如
赵云,王旭,张擎,姚文强,陈凯,徐奚如
(1. 南京中医药大学第一临床医学院,江苏 南京 210029; 2. 南京中医药大学代谢病中医研究重点实验室,江苏 南京 210029; 3. 南京中医药大学附属医院,江苏 南京 210029)
糖尿病(diabetes mellitus,DM)是目前全球最常见的慢性疾病之一,其发病率正呈现逐年上升的趋势,而认知功能障碍,已被认为是DM 的一种重要的共病和并发症[1]。DM 作为一种逐年增长的代谢性疾病,威胁着全球数百万人的健康,认知功能障碍是DM 的一种日益严重的并发症,越来越受到人们的重视。预计到2040年,这一数字将增加到7亿,其中,2型糖尿病(type 2 diabetes mellitus,T2DM)占大多数(90%~95%);DM患者发生轻度认知障碍(高达60%)和痴呆症(50%~100%)的风险远高于非DM患者,因此认知功能的改善逐渐成为DM 疗效的评估标准之一[2-4]。现今对于糖尿病合并认知功能障碍(diabetic cognitive dysfunction,DCD)的产生机制尚未完全清楚,对其治疗也尚处于探索阶段,如何治疗DCD 成为当前研究的一大难点和热点,而中医药在治疗DCD上已取得了一定的成绩。
“糖脂清”是导师王旭教授多年临床经验总结并创制的中医经验方,全方由黄精、鬼箭羽、枸杞子、泽兰、僵蚕五味中药组成,获得国家专利(101829271A)。具益气养阴、益肾养肝、活血、化痰通络等功效,方中诸药对糖脂代谢、认知功能、自噬调节均具有一定的积极作用。前期研究表明,“糖脂清”能够提升DM 模型大鼠及DM 模型小鼠的学习记忆能力,改善其海马区内质网应激状态,缓解氧化应激异常状态,减少神经细胞凋亡,可在一定程度上调节自噬,从而保护海马区神经元得以改善DM 引起认知障碍的DCD 鼠的认知功能[5-8]。关于“糖脂清”通过调节自噬以改善认知功能的具体影响及作用机制仍有待进一步实验研究。本实验研究将从动物层面探讨“糖脂清”对T2DM 模型小鼠海马区神经元自噬机制,并对“糖脂清”通过调节自噬改善DCD状态小鼠认知功能的疗效进行验证,结合课题组前期研究成果,分析“糖脂清”在改善DCD 小鼠认知方面的作用机制及影响。
1 实验材料
1.1 动物
90 只SPF 级黑色雄性C57BL/6J 小鼠(南京青龙山动物养殖场),6~8 周龄,体质量(20 ± 3)g,饲养于南京中医药大学动物实验动物中心,饲养室为恒温、恒湿环境,温度18~25 ℃,湿度40%~55%,昼夜光照交替,噪声 < 60 dB。本次动物实验已通过南京中医药大学伦理委员会的标准,实验项目编号:012071001686,审查批号:202201A038。
1.2 试剂与药物
“糖脂清”方由黄精150 g,僵蚕150 g,鬼箭羽225 g,枸杞子180 g,泽兰180 g 组成,全部中药饮片全部购于江苏省中医院中药房,符合2020 年版《中华人民共和国药典》及相关规定。
无水柠檬酸(批号:B21313,上海源叶生物科技有限公司);柠檬酸钠(批号:S11110,上海源叶生物科技有限公司);链脲佐菌素(STZ)(批号:s-0130,美国Sigma 公司);盐酸二甲双胍片(批号:H20113492,华北制药股份有限公司);多聚甲醛固定液(中性)(批号:20170323,Solarbio 公司);HE 染液(批号:G1005,servicebio);全蛋白提取试剂盒(批号:KGP250,江苏凯基生物技术股份有限公司);BCA蛋白浓度测定试剂盒(批号:P0010,碧云天生物技术有限公司);小鼠自噬相关蛋白5(ATG5)酶联免疫分析(ELISA)试剂盒(批号:YJ822129)、小鼠自噬相关蛋白12(ATG12)酶联免疫分析(ELISA)试剂盒(批号:YJ823286)(上海酶联生物技术有限公司);β-Actin(内参)抗体(批号:bs-0061R,北京博奥森生物技术有限公司);ATG7 Monoclonal antibody(批号:67341-1-Ig)、LC3 Polyclonal antibody(批号:14600-1-AP)(武汉三鹰生物技术有限公司);Beclin 1 Rabbit Polyclonal Antibody(KO Validated)( 批号:AF5123)、ATG5 Rabbit Monoclonal Antibody(批号:AF2269)、辣根过氧化物酶标记山羊抗小鼠IgG(H + L)(批号:A0216)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:A0208)(碧云天生物技术有限公司);PCR 引物(上海捷瑞生物工程有限公司);SteadyPure 通用型RNA 提取试剂盒(批号:AG21017)、Evo M-MLV 反转录预混型试剂盒(批号:AG11728)、HS 预混型qPCR 试剂盒(含ROX)(批号:AG11718)[艾科瑞(AG)生物工程有限公司]。
1.3 溶液制备
1.3.1 “糖脂清”制备
将黄精150 g,僵蚕150 g,鬼箭羽225 g,枸杞子180 g,泽兰180 g 五味中药浸泡30 min,煎煮成浓度为每1 mL 含生药量1.5 g 的中药水煎剂,4 ℃保存备用。按照人与小鼠体表面积换算公式换算出小鼠相应的等效剂量[9],给药前将中药取出复温。
1.3.2 盐酸二甲双胍溶液制备
用天平称取一定质量的盐酸二甲双胍片(批号:H20113492,华北制药股份有限公司)置于研钵中碾碎成粉末,以双蒸水作为溶剂配置成1 mg/mL 二甲双胍溶液,经涡旋仪充分振荡混匀后4 ℃保存备用。
1.3.3 柠檬酸缓冲液制备
先准备两支装有100 mL 双蒸水的试管,然后称取2.1 g 柠檬酸溶于其中一支装有100 mL 双蒸水的试管中混匀配成A 液,再称取2.94 g 柠檬酸钠溶于另一支装有100 mL 双蒸水的试管中混匀配成B 液,根据STZ量计算所需柠檬酸缓冲液量(mL),按一定比例将A、B液混匀(按体积比A∶B = 1∶1 即可,A 液加B 液为所需柠檬酸缓冲液量),再根据混合液PH值,适当添加A、B液量,使混合溶液pH 值在4.2~4.5 范围内即可,置于4 ℃冷藏,柠檬酸缓冲液现配现用。
1.4 仪器设备
三诺血糖仪、血糖试纸(三诺生物传感股份有限公司);Morris 水迷宫设备(安徽正华生物仪器设备有限公司);天平(赛多利斯公司);生物荧光倒置显微镜(Olympus 公司,型号:CKX53);脱水机(武汉俊杰电子有限公司,型号:JJ-12J);包埋机(武汉俊杰电子有限公司,型号:JB-P5);病理切片机(上海徕卡仪器有限公司,型号:RM2016);冻台(武汉俊杰电子有限公司,型号:JB-L5);组织摊片机(浙江省金华市科迪仪器设备有限公司,型号:KD-P);烤箱(天津市莱玻瑞仪器设备有限公司,型号:GFL-230);正置光学显微镜(日本尼康,型号:E100);成像系统(日本尼康,型号:DS-U3);超净工作台(新加坡艺思高科技有限公司);旋涡混合器(上海驰唐电子有限公司,型号:XW-80A);多功能酶标仪(PE,型号:enspire);高速冷冻离心机(Eppendorf 公司,型号:5417R);台式恒温振荡器(中国上海精宏实验设备有限公司,型号:MM400);超微量分光光度计(Thermo);荧光定量PCR 仪(上海宏石医疗器械有限公司,型号:7500)。
2 实验方法
2.1 动物造模与分组
所有动物适应性喂养1 周,观察小鼠一般情况,包括饮食、体质量、精神状态等,确认小鼠状况良好后进行正式实验,将90只C57BL/6J雄性小鼠按照随机数字表法分为两组,即空白组(n= 12)和造模组(n= 78)。其中,空白组小鼠仅给予标准普通饲料和饮用水,造模组小鼠则给予高脂高糖饲料(具体成分:基础饲料59%,蔗糖20%,猪油18%,蛋黄粉3%)和饮用水喂养,喂养6周左右,使小鼠平均体质量达到30~35 g后准备造模。造模前一天,所有小鼠禁食不禁水过夜,按照每只小鼠120 mg/kg 计算STZ 量并配好缓冲液,空白组小鼠腹腔注射等量缓冲液,3 d 后对造模小鼠进行尾静脉采血,小鼠血糖 ≥ 16.7 mmol/L 即认为造模成功[9]。对于血糖不达标的小鼠根据血糖值补打STZ,3 d 后复测。造模成功的小鼠依据随机数字表随机分为模型组、糖脂清低剂量组、糖脂清中剂量组、糖脂清高剂量组以及二甲双胍组,造模期间体质量不达标小鼠4只(体质量17~25 g),血糖无法达标小鼠6 只,造模死亡小鼠7 只,最终分组为模型组14只,糖脂清低、中剂量组12只,糖脂清高剂量组11只,二甲双胍组12只。
2.2 给药
待所有小鼠造模成功并分组后,即对小鼠进行灌胃给药,给药频率为1次/d,固定时间灌胃。二甲双胍组依据参考文献[10]给予0.25 g/(kg·d)盐酸二甲双胍灌胃,糖脂清低剂量组给予6 g/(kg·d)糖脂清灌胃,糖脂清中剂量组给予12 g/(kg·d)糖脂清灌胃,糖脂清高剂量组给予24 g/(kg·d)糖脂清灌胃,空白组和模型组给予等体积蒸馏水灌胃,持续12周。
2.3 行为学检测
在灌胃给药12 周后,对所有小鼠进行Morris 水迷宫测试,整个试验过程共需6 d。每只小鼠在进行适应性训练1 d后,开始正式实验。实验分为定位航行和空间探索两个部分。将每只小鼠分别从4 个象限面面壁入水,通过计算机观察小鼠60 s 游泳运动轨迹。如果小鼠能够在60 s 内找到平台,并于平台上方逗留3 s,计算机会自动停止追踪,记录该小鼠找寻平台所用时间以作为逃避潜伏期。如果小鼠不能在60 s内找到平台,则系统自动记录该小鼠的逃避潜伏期为60 s,工作人员需要将小鼠人工引导放置于平台之上,令小鼠于平台上停留 15 s 后,再进行下一只小鼠测试。每日按照第Ⅰ象限、第Ⅱ象限、第Ⅲ象限、第Ⅳ象限的顺序对小鼠进行训练,连续进行5 d。
第6天即正式实验的第5天,需要撤去第Ⅳ象限的平台,实验期间不再需要人工引导,只需将小鼠从第Ⅰ象限入水点放入,电脑自动记录每只小鼠在60 s 内穿越的平台次数,通过高速摄影机记录每组小鼠的行动轨迹,运用计算机软件分析小鼠的空间探索记忆能力。
2.4 取材
行为学检测后,由于实验内容的不同,需对小鼠进行分组后进行不同方式的取材以制备标本。
①血液标本:在灌胃给药12周末,灌胃用药后24 h,禁食不禁水12 h,根据其体质量予20%乌来糖进行腹腔注射麻醉。麻醉成功后,使用消毒灭菌后的眼科镊摘除小鼠眼球,快速眼眶取血至1.5 mL 离心管中,将离心管静置于冰上,血液标本后期需转移至离心机,在4 ℃ 12 000 r/min 条件下离心10 min 后取出,小心吸取离心管上层淡黄色血清于新的离心管中,将血清标本放置于-80 ℃超低温冰箱保存备用。
②脑组织:将小鼠进行脱椎处死,并立即置于冰上,小心剥离颅骨,取出小鼠完整脑组织,将脑组织用中性多聚甲醛固定液固定,室温保存。
③海马组织标本:眼眶取血后,将小鼠迅速进行脱颈处死,并立即置于冰上,将小鼠用镊子剥离颅骨后取出完整的脑组织,摘除前端嗅球、小脑、丘脑等结构,翻转皮层后用玻璃分针对小鼠脑组织进行钝性分离,迅速取出小鼠双侧的海马组织并放入做好分类标记的冻存管中,将装有海马组织的冻存管放入液氮中冻存,待取材完毕后根据需要将标本进行提取使用,或转移至-80 ℃超低温冰箱中保存。
2.5 ELISA法检测Atg5、Atg12表达量
严格按照ELISA 试剂盒使用说明书进行操作,检测小鼠血清中的Atg5、Atg12表达量。
2.6 HE染色
将用中性多聚甲醛固定液固定的小鼠脑组织进行石蜡切片、脱水处理,处理完成后,将脑组织切片放入苏木素染液染色,返蓝液返蓝,再进行梯度酒精脱水,随后于伊红染液中染色,最后进行脱水封片处理,即用无水乙醇及二甲苯脱水后,再用中性树胶进行封片。标本制备成功后,用光学显微镜镜检观察,进行图像分析。
2.7 蛋白免疫印迹实验
首先对小鼠海马组织进行蛋白提取,BCA 法检测蛋白浓度,在正式免疫蛋白印迹实验前,须预先计算并设计Western blot 实验的蛋白样品上样量。常规电泳,转膜,用5%脱脂奶粉封闭,根据抗体说明书稀释抗体,孵育Beclin1(1∶500)、Atg5(1∶1 000)、Atg7(1∶1 000)、LC3(1∶1 000)的一抗,同时孵育β-actin(1∶5 000)抗体作为内参,孵育相应二抗(1∶1 000)。加ECL 化学发光底物显色,用化学发光成像系统进行显影,ImageJ软件分析目的条带的净光密度值。采用Western blot 检测蛋白表达小鼠海马Beclin1、Atg5、Atg7、LC3 自噬相关蛋白的表达。
2.8 Real-time PCR实验
提取小鼠海马组织RNA,反转录成cDNA,反应条件为:37 ℃孵育15 min,85 ℃度孵育5 s,4 ℃孵育结束。使用RT-qPCR 试剂盒检测各组关键基因Atg5、Atg7的基因表达水平。反应程序为:95 ℃预变性时间30 s;95 ℃,5 s;60 ℃,30 s 循环次数40 次。用相对定量2-ΔΔCT法对数据进行处理。引物设计见表1。
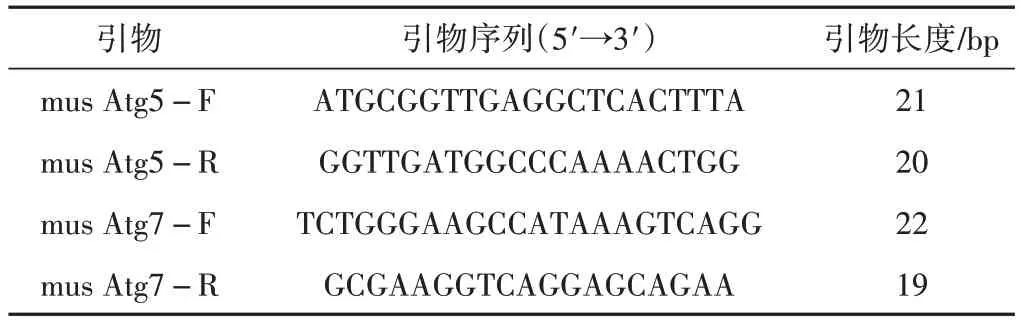
表1 引物序列表
2.9 统计学方法
所有数据采用 GraphPad Prism 8 的统计软件进行分析,其中计量资料用均数 ± 标准差(±s)表示,进行正态分布检验。多组间的比较采用方差分析和重复检验,两组组间比较采用独立样本t检验。对于不符合正态分布的样本,采用非参数检验。P< 0.05 为差异具有统计学意义。
3 结果
3.1 小鼠一般情况比较
实验过程中,有7 只小鼠于造模期间死亡,有8 只小鼠于灌胃给药期间死亡。其中,模型组小鼠死亡2 只,糖脂清低、中、高剂量组死亡小鼠数目分别为2、1、1 只,二甲双胍组小鼠死亡2 只,空白组小鼠未出现死亡。空白组小鼠精神状态良好,毛色有光泽,活动度良好,对外界声音或光线刺激能作出敏锐的反应,饮食、饮水、排泄均正常;模型组小鼠的整体精神状态欠佳,毛色晦暗欠光泽,对外界刺激作出反应较为迟钝,行动较为迟缓,多饮、多食、多尿;糖脂清各剂量组与二甲双胍组的小鼠精神状态稍欠佳,毛色光泽度及对外界刺激所做反应程度下降,活动度尚可,饮食量、饮水量、尿量明显增加,整体情况比空白组略差,与模型组相比则较好。
3.2 Morris水迷宫行为学测试结果
3.2.1 各组小鼠定位航行能力的比较
Morris 水迷宫定位航行实验显示:水迷宫实验第1 天,各组的逃避潜伏期无明显差异(P> 0.05);第2 天,各组小鼠的潜伏期均出现不同程度的缩短,但结果仍无统计学意义(P> 0.05);第3 天,与空白组小鼠比,模型组小鼠的逃避潜伏期延长(P< 0.05),提示模型组小鼠的学习记忆及空间探索能力下降;与模型组小鼠比较,糖脂清低、高剂量组以及二甲双胍组小鼠潜伏期明显缩短(P< 0.05);第4 天,与模型组小鼠相比较,糖脂清各剂量组与二甲双胍组小鼠的逃避潜伏期缩短(P< 0.05,P< 0.01),提示随着时间的延长,各组小鼠的学习记忆能力在逐渐得到提升,二甲双胍组小鼠的学习能力提升最明显(P< 0.01);第5 天,和模型组比较,糖脂清各剂量组及二甲双胍组的小鼠逃避潜伏期明显缩短(P< 0.05,P< 0.01),其中糖脂清高剂量组和二甲双胍组的学习能力提升最明显(P<0.01),说明糖脂清组小鼠学习记忆及定位航行能力明显优于模型组,但糖脂清各剂量组间统计学结果无明显差异(P> 0.05);二甲双胍组的逃避潜伏期虽明显缩短(P< 0.01),但和糖脂清各组比较,差异无统计学意义(P> 0.05)。提示“糖脂清”及二甲双胍可以提升认知造模后小鼠的学习记忆能力,从而提高其定位航行能力。结果见表2。
表2 各组小鼠逃避潜伏期比较( ± s,s)
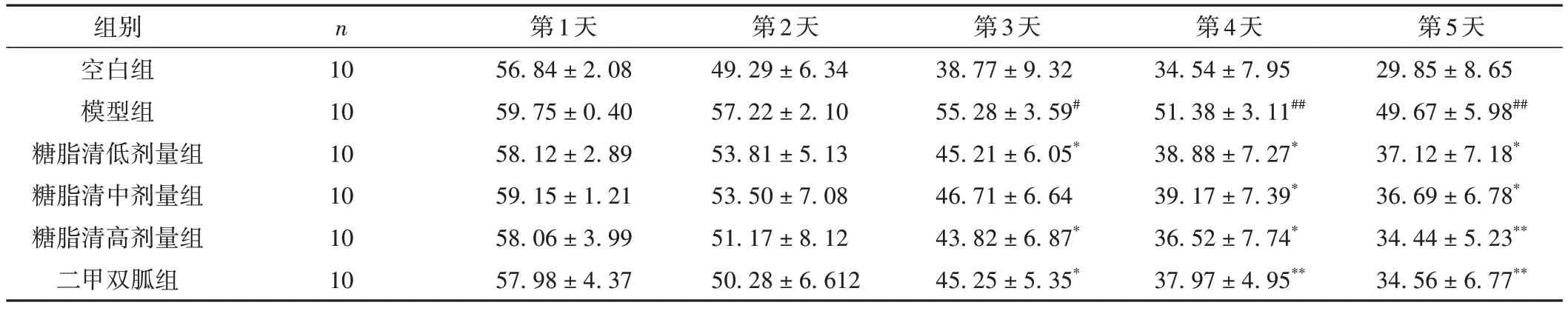
表2 各组小鼠逃避潜伏期比较( ± s,s)
注:与空白组比较,#P < 0.05,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01。
组别空白组模型组糖脂清低剂量组糖脂清中剂量组糖脂清高剂量组二甲双胍组n 10 10 10 10 10 10第1天56.84 ± 2.08 59.75 ± 0.40 58.12 ± 2.89 59.15 ± 1.21 58.06 ± 3.99 57.98 ± 4.37第2天49.29 ± 6.34 57.22 ± 2.10 53.81 ± 5.13 53.50 ± 7.08 51.17 ± 8.12 50.28 ± 6.612第3天38.77 ± 9.32 55.28 ± 3.59#45.21 ± 6.05*46.71 ± 6.64 43.82 ± 6.87*45.25 ± 5.35*第4天34.54 ± 7.95 51.38 ± 3.11##38.88 ± 7.27*39.17 ± 7.39*36.52 ± 7.74*37.97 ± 4.95**第5天29.85 ± 8.65 49.67 ± 5.98##37.12 ± 7.18*36.69 ± 6.78*34.44 ± 5.23**34.56 ± 6.77**
3.2.2 各组小鼠空间探索能力的比较
Morris 水迷宫空间探索实验结果显示:在撤去平台后,空白组小鼠的穿越平台次数明显增加,与空白组比较,模型组小鼠穿越平台次数明显减少(P< 0.01);但与空白组比较,糖脂清各剂量组以及二甲双胍组小鼠的穿越平台次数差异无统计学意义(P> 0.05);与模型组比较,各给药组小鼠的穿越平台次数明显增加,其中糖脂清中、高剂量组以及二甲双胍组小鼠的穿越平台次数明显增加(P< 0.05,P< 0.01),糖脂清低剂量组小鼠穿越平台次数虽较模型组高,但结果无统计学意义(P> 0.05),而糖脂清各剂量组之间,以及糖脂清各剂量组与二甲双胍组之间比较,差异均无统计学意义(P> 0.05)。结果见表3。
表3 各组小鼠穿越平台次数比较( ± s)

表3 各组小鼠穿越平台次数比较( ± s)
注:与空白组比较,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01。
组别空白组模型组糖脂清低剂量组糖脂清中剂量组糖脂清高剂量组二甲双胍组n 10 10 10 10 10 10剂量/[g/(kg·d)]——6 12 24 0.25穿越平台次数/次3.43 ± 1.13 1.14 ± 0.67##2.29 ± 0.76 2.43 ± 0.53*2.71 ± 0.76**2.86 ± 0.69**
各组小鼠每日的目标象限路程比及时间比结果显示:与模型组比较,各组小鼠的目标象限路程比及时间比均明显增加,但前四天的数据中,各组小鼠的路程比差异相对较明显,而时间比差异不明显,考虑因时间比差异受小鼠体力变化、游泳速度以及游泳路程等不确定因素影响,需结合路程比综合分析。第5 天,实验结果较为明显,与模型组相比,糖脂清各剂量组及二甲双胍组的目标象限路程比明显上升(P< 0.01),糖脂清低剂量组和高剂量组的目标象限时间比也明显升高(P< 0.01)。结果见图1和图2。
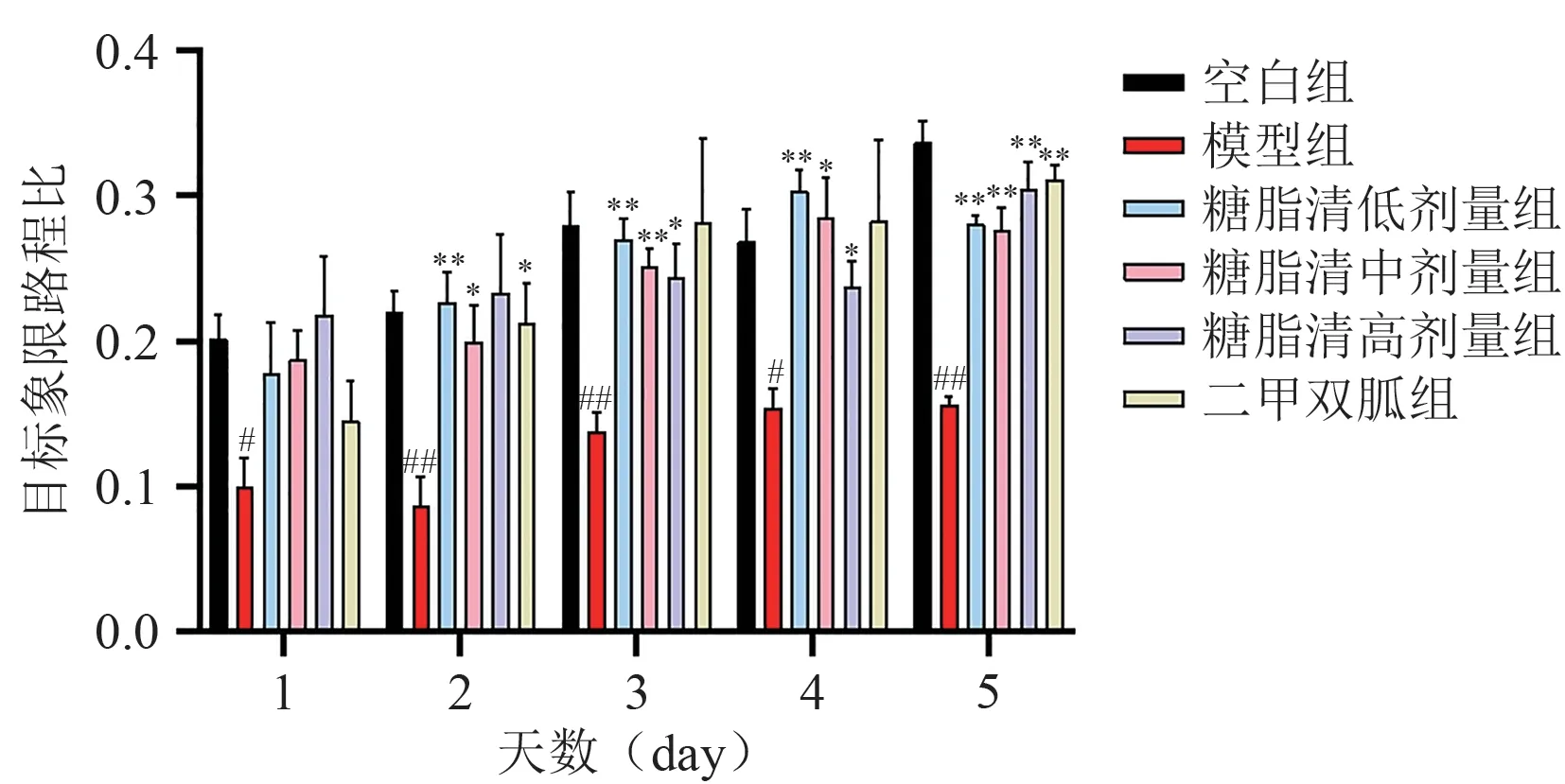
图1 各组小鼠目标象限路程比的比较
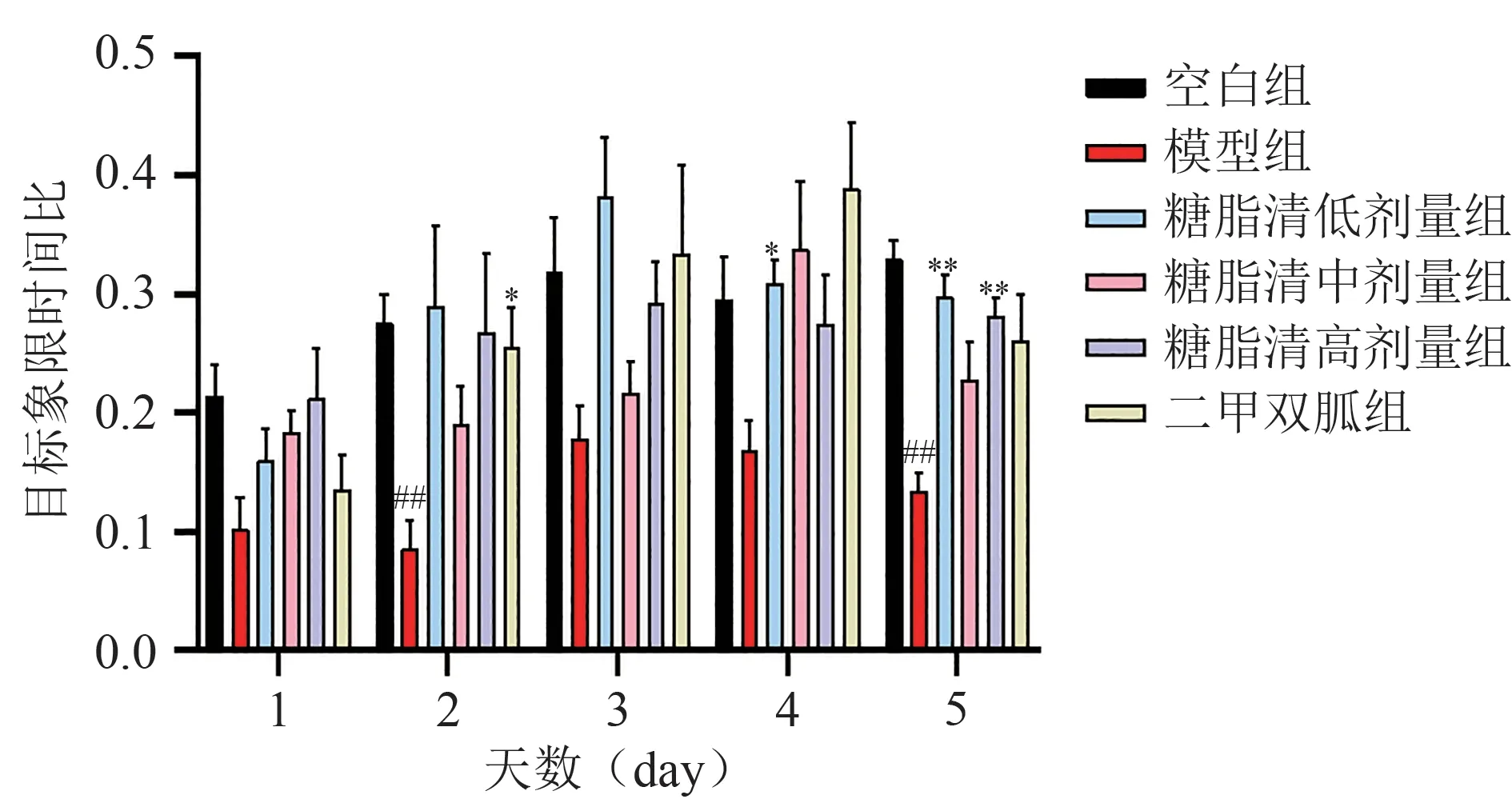
图2 各组小鼠目标象限时间比的比较
综合分析,造模后小鼠的空间探索能力出现明显下降,与模型组小鼠相比较,糖脂清各剂量组及二甲双胍组小鼠的学习记忆及空间探索能力则在不断提升,说明造模后小鼠认知功能受损,出现学习、记忆等认知水平下降的表现,而“糖脂清”及二甲双胍能够改善小鼠学习记忆能力、提升认知水平、提高其空间探索能力。
3.3 各组小鼠海马组织的CA1区和CA3区的比较
HE染色结果显示:空白对照组小鼠的海马神经元细胞,在CA1 区和CA3 区的排列均比较整齐且紧密,结构较完整,细胞膜清楚,细胞核仁和核膜清晰可见,胞质丰富,未见明显的变性或坏死;模型组小鼠的海马神经元细胞,在CA1 区和CA3 区的排列不够规则,结构疏散,细胞间隙明显,可见细胞胞体缩小,核固缩,呈深染状态,可见坏死细胞,细胞数目及层数减少;二甲双胍组及糖脂清各剂量组的小鼠海马神经元细胞,在CA1区和CA3区的细胞排列与模型组相比,排列整齐,结构尚且紧凑,细胞数量较多,糖脂清低、中剂量组可见部分细胞核固缩,但整体较模型组胞质丰富、结构完整,少有变性、坏死。提示“糖脂清”及二甲双胍对小鼠海马神经元有保护作用。结果见图3。

图3 各组小鼠海马CA1区、CA3区HE染色图
3.4 各组小鼠血清自噬相关蛋白Atg5、Atg12 含量的比较
ELISA 结果显示:与空白组比较,模型组的Atg5、Atg12 含量明显减少(P< 0.01),提示造模后小鼠自噬水平的下降,而糖脂清低剂量组血清中Atg5、Atg12 的含量虽较空白组减少(P< 0.05,P< 0.01),但较模型组增加(P< 0.01),提示“糖脂清”能够促进Atg5、Atg12 的表达,说明“糖脂清”可能对自噬具有促进作用。与模型组相比较,各给药组的Atg5 含量均明显升高,差异有统计学意义(P< 0.01);糖脂清低、高剂量组以及二甲双胍组的Atg12含量明显上升(P< 0.01),其中糖脂清高剂量组的Atg12 含量甚至超过空白组(P< 0.01),糖脂清中剂量组的Atg12 表达水平虽升高,但差异无统计学意义(P> 0.05),提示“糖脂清”及二甲双胍对造模后小鼠自噬水平的提高有促进作用。结果见表4和图4。
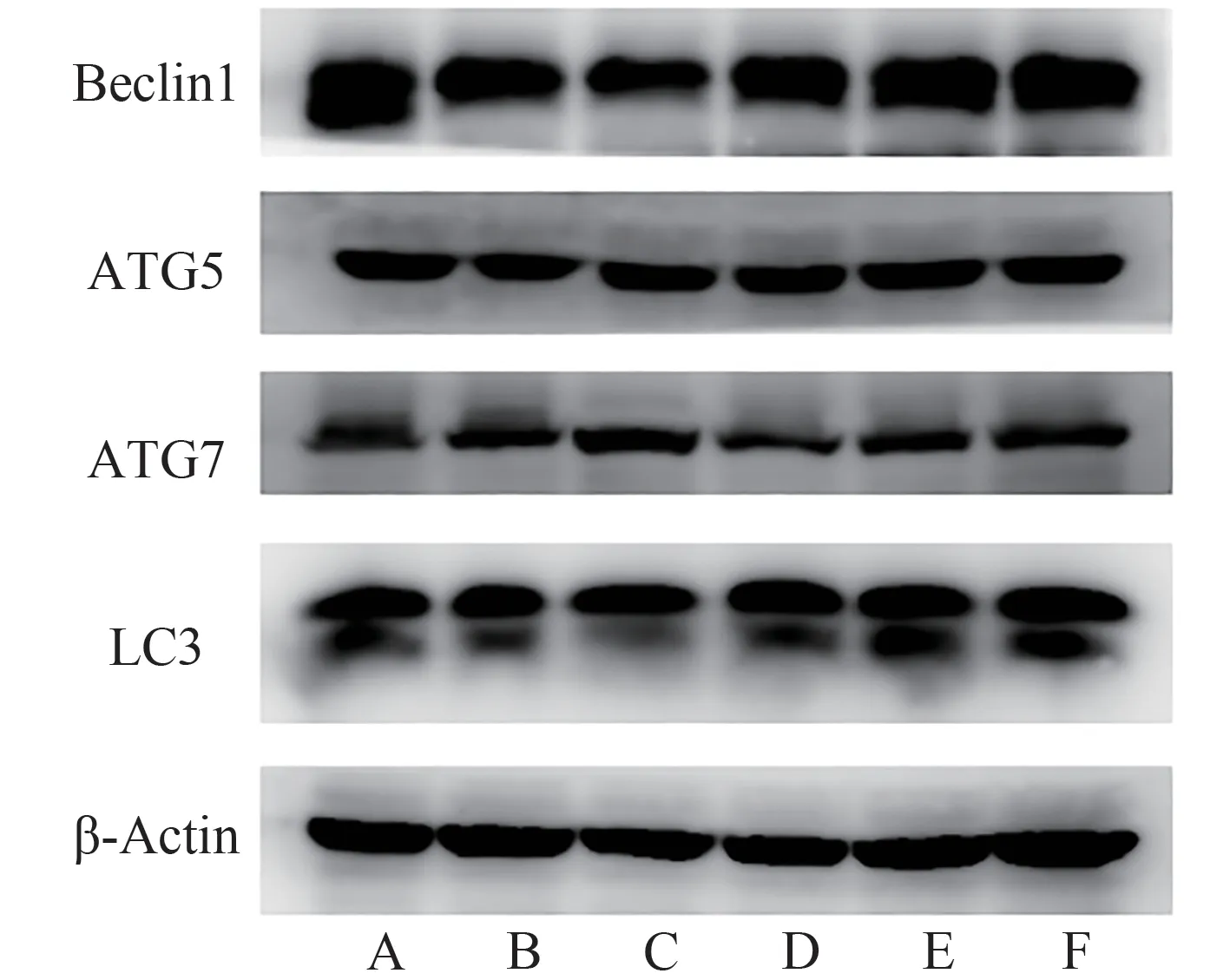
图4 各组小鼠海马组织中Beclin1、LC3、Atg5、Atg7蛋白表达
表4 各组小鼠Atg5、Atg12表达量比较( ± s,pg/mL)
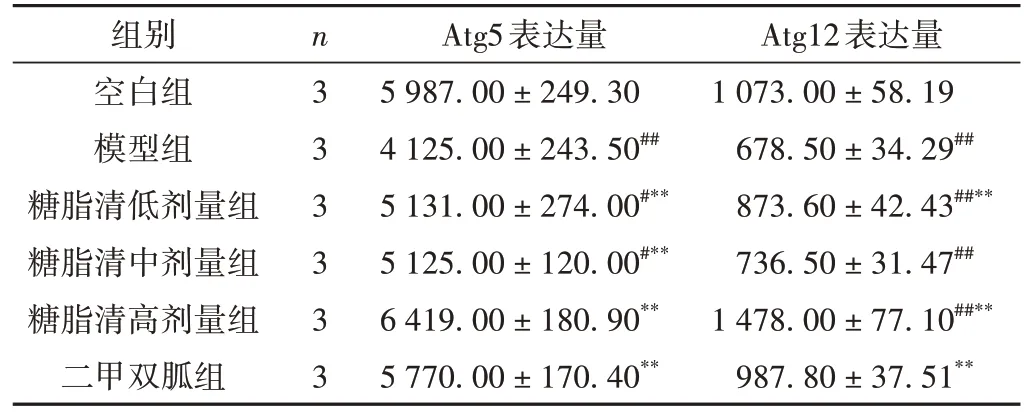
表4 各组小鼠Atg5、Atg12表达量比较( ± s,pg/mL)
注:与空白组比较,#P < 0.05,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01。
组别空白组模型组糖脂清低剂量组糖脂清中剂量组糖脂清高剂量组二甲双胍组n3 3 3 3 3 3 Atg5表达量5 987.00 ± 249.30 4 125.00 ± 243.50##5 131.00 ± 274.00#**5 125.00 ± 120.00#**6 419.00 ± 180.90**5 770.00 ± 170.40**Atg12表达量1 073.00 ± 58.19 678.50 ± 34.29##873.60 ± 42.43##**736.50 ± 31.47##1 478.00 ± 77.10##**987.80 ± 37.51**
3.5 各组小鼠海马区Beclin1、Atg5、Atg7、LC3 蛋白表达的比较
Western blot 结果显示:与空白组比较,模型组的Beclin1、Atg5、Atg7、LC3 蛋白表达水平均出现明显下降(P< 0.01),提示STZ造模后使得模型小鼠海马的自噬水平出现明显下降。与模型组比较,糖脂清高剂量组及二甲双胍组的Beclin1、LC3、Atg5、Atg7 蛋白表达水平出现了不同程度的升高,结果具有统计学意义(P< 0.05,P< 0.01);糖脂清低剂量组Atg7 的蛋白表达水平升高,糖脂清中剂量组LC3 的蛋白表达水平也呈明显上升趋势(P< 0.01),提示“糖脂清”及二甲双胍可能对模型小鼠海马的自噬功能恢复有促进作用,“糖脂清”及二甲双胍能够提高T2DM 模型小鼠海马的自噬水平。结果见表5。
表5 各组小鼠海马组织中Beclin1、LC3、Atg5、Atg7蛋白表达水平比较( ± s)

表5 各组小鼠海马组织中Beclin1、LC3、Atg5、Atg7蛋白表达水平比较( ± s)
注:与空白组比较,#P < 0.05,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01。
组别空白组模型组糖脂清低剂量组糖脂清中剂量组糖脂清高剂量组二甲双胍组n3 3 3 3 3 3 Beclin1/β-actin 0.42 ± 0.01 0.33 ± 0.07##0.39 ± 0.06 0.37 ± 0.00 0.43 ± 0.00**0.45 ± 0.03**LC3/β-actin 0.71 ± 0.13 0.51 ± 0.06##0.61 ± 0.03 0.80 ± 0.07**0.77 ± 0.04**0.79 ± 0.01**Atg5/β-actin 0.55 ± 0.04 0.34 ± 0.04##0.42 ± 0.04#0.43 ± 0.03 0.46 ± 0.03*0.51 ± 0.07**Atg7/β-actin 0.18 ± 0.00 0.17 ± 0.01##0.18 ± 0.00**0.14 ± 0.00##**0.18 ± 0.00**0.18 ± 0.01**
3.6 各组小鼠海马组织Atg5、Atg7 mRNA表达情况的比较
Real-time PCR 结果显示:对空白对照组、模型组以及糖脂清组(糖脂清高剂量组)的三组小鼠进行实时荧光定量检测,数据处理后发现,与空白组比较,模型组Atg5、Atg7 mRNA 表达呈下降趋势,但结果分析后提示无统计学意义(P> 0.05);与模型组比较,糖脂清组(糖脂清高剂量组)Atg5 mRNA 表达量出现明显升高(P<0.01);与模型组比较,糖脂清组(糖脂清高剂量组)Atg7 mRNA表达虽出现一定的升高趋势,但差异无统计学意义(P> 0.05)。结果见表6。
表6 各组小鼠海马组织Atg5、Atg7 mRNA表达水平比较( ± s)

表6 各组小鼠海马组织Atg5、Atg7 mRNA表达水平比较( ± s)
注:与模型组比较,*P < 0.05。
组别空白组模型组糖脂清组高剂量组n3 3 3 Atg5 1.00 ± 0.00 0.82 ± 0.16 1.22 ± 0.16*Atg7 1.0 ± 0.00 0.60 ± 0.56 0.97 ± 0.28
4 讨论
近年来诸多关于自噬的研究表明,在大多数自噬障碍导致的疾病中,大脑往往是受影响最严重的器官,自噬途径中涉及的基因突变往往与神经退行性疾病相关,这表明神经元严重依赖自噬来维持正常功能和体内平衡。与其他细胞类型不同,神经元是有丝分裂后细胞,无法通过有丝分裂途径清除有害物质[11-12]。因此,自噬清除功能在神经元中更为重要,自噬有助于清除脑中累积的细胞毒性蛋白,从而发挥其神经保护作用[13]。认知功能障碍疾病和自噬的关系尤为密切,包括神经系统慢性病变,如AD、脑微血管病变、帕金森病(Parkinson disease,PD)等,研究发现,神经元内自噬水平异常会破坏细胞稳态,严重时可影响患者的认知功能,通过调控各种细胞自噬信号通路可明显改善细胞缺氧、促进能量及物质代谢,改善认知功能[14]。ROCCHI等[15]通过敲入点突变F121A 至Beclin1/Becn1,生成细胞自噬活跃的小鼠模型,结果显示,细胞自噬激活后脑淀粉样蛋白积累减少,小鼠的认知缺陷得到改善。在自噬的诸多通路中,Beclin1 作为在哺乳动物中被鉴定出的第一个能够诱导自噬的基因,能够与不同的蛋白形成复合物从而发挥调控自噬的作用。GUAN 等[16]研究表明,Beclin1 介导的海马神经元自噬可能在老年DM 小鼠认知和情感障碍中发挥重要作用。中药及自噬在DCD 治疗中的积极作用不可否认[17-18],无论是自噬相关蛋白,还是自噬经典通路的相关研究,均表明自噬在DCD 为代表的神经退行性疾病中发挥重要作用,本课题的研究也是在此基础上,结合前期研究成果,以自噬相关蛋白ATG 系列,Beclin1、LC3 等切入,探究自噬相关通路下中药参与自噬调节并引起认知功能改变的机制可能,结果表明,自噬积极参与并影响DCD 的进程,中药对自噬功能的恢复有着积极作用。
本实验在课题组前期研究的基础上,选用C57BL/6J 雄性小鼠,通过注射STZ 诱导T2DM 模型小鼠,并逐渐进展为DCD,研究“糖脂清”对T2DM 小鼠后期出现认知功能受损的保护机制,进一步实现对“糖脂清”治疗和改善DCD 小鼠的效用机制的研究。前期实验表明“糖脂清”可能通过调节细胞凋亡相关因子的表达实现对DCD 小鼠认知功能的保护和修复,同时发现细胞自噬也参与了DCD 的发生、发展过程中,“糖脂清”也有可能通过调控细胞自噬的相关信号通路实现对DCD 小鼠的脑保护作用。细胞自噬作为一种存在于机体细胞的代谢过程,生理状态下,正常水平的细胞自噬参与细胞内衰老细胞器和异常蛋白质等成分的消化和降解,有利于维持细胞稳态;病理状态下,被适当激活的细胞自噬可加强细胞对内部废物和有害物质的消除,同样有利于细胞的存活。但当细胞自噬过程发生异常,细胞稳态被破坏,细胞生存将受到影响,甚至可能导致细胞死亡。越来越多的证据表明,过度自噬对神经元有害。过度自噬的阈值尚不清楚,相关机制的研究也缺乏有力的证据。细胞凋亡和细胞自噬之间相互联系,大量研究也表明细胞自噬在神经发育性疾病中发挥重要作用,结合课题组前期结果,有充分理由相信,自噬在DCD 的生成等相关机制中占据着重要的作用。本实验正是此基础上进行设计,通过注射STZ 构造T2DM 小鼠模型,通过水迷宫实验分析小鼠学习记忆能力,评估小鼠认知功能情况,通过组间数据的分析比较,发现模型组小鼠认知水平相较于其他各组小鼠明显下降,提示模型组小鼠出现DCD表现。
在本次研究中发现,经STZ 诱导后的T2DM 小鼠的学习记忆能力受到了明显损害,主要通过以下几个方面:①水迷宫行为学测试后发现,与空白组比较,模型组小鼠出现逃避潜伏期延长、目标象限路程比及目标象限时间比下降明显、穿越平台次数明显减少的现象,反映了DM 小鼠学习记忆、定位航行、空间探索等多方面能力的下降,是T2DM 小鼠存在显著认知功能障碍的表现。②海马组织病理切片提示,相较于正常组小鼠,T2DM小鼠的海马细胞排列不规则,细胞间出现间隙,其中很多细胞胞体缩小,胞核固缩,呈深染状态,提示T2DM 小鼠海马组织结构的破坏。③在对于海马组织分别采用ELISA 和Western blot 检测时发现,相较于空白组,T2DM 小鼠的自噬相关蛋白表达量明显减少,结合前期模型组相比空白组小鼠的认知功能明显受损,笔者有理由认为高血糖状态会导致小鼠的认知功能受损,高血糖是DCD 发生、发展的重要因素之一,而自噬参与这一过程并可能起着重要的作用。因为,相较于模型组,在对T2DM 模型小鼠给予“糖脂清”干预后,小鼠的逃避潜伏期缩短,目标象限路程比升高,提示T2DM 模型小鼠的认知功能障碍改善,也侧面反映“糖脂清”对DCD 的作用机制是正向、有益的。而结合细胞分子生物学的研究结果,相较于模型组,糖脂清各剂量组及二甲双胍组的自噬相关蛋白表达水平的明显升高,表明“糖脂清”对自噬的促进作用,也提示“糖脂清”改善DCD 小鼠的认知功能可能与促进细胞自噬有关。但糖脂清高剂量组对于其他给药组,自噬蛋白表达量明显升高,甚至高于空白组,但小鼠认知水平却较空白组低,因此有理由推测,自噬的水平和认知功能的修复未必呈正相关,这也说明“糖脂清”不同浓度、不同剂量可能引起了细胞自噬水平的变化,进而影响认知功能。对于自噬的正常水平和异常表达之间的界限,以及自噬和过度自噬对不同疾病的影响,仍有待进一步研究。而对于中药通过调控自噬实现对疾病进展过程的调控,虽存在很多局限性,但不可否认中药用临床疗效证明了自己的积极作用,因此相关作用机制的研究仍需得到重视。
5 结论
“糖脂清”能够改善DM 模型小鼠的认知功能障碍,减缓由DM 引起的模型小鼠的海马组织损伤,具体机制可能与细胞自噬有关。该研究结果可为后续研究“糖脂清”治疗DCD 提供一定的基础,也可为开发临床治疗DCD 方面的中药或中成药制剂提供一定的研究方法和科学依据。
