基于代谢组学探讨金藤清痹颗粒治疗类风湿关节炎的作用机制
2023-10-09赵灵灵周政贾文瑞王娟
赵灵灵,周政,贾文瑞,王娟
(郑州大学第一附属医院,河南 郑州 450052)
类风湿关节炎(RA)是一种常见的全身性自身免疫性炎症疾病,其临床特点主要表现为关节疼痛、肿胀,可严重损害患者身体功能和生活质量[1]。一项对41个国家的67项RA队列发病率和患病率研究的荟萃分析发现,1986—2014 年全球RA 的患病率为0.46%(95%CI,0.37%~0.57%))[2]。有报道显示,目前我国RA 患病率为0.42%,总患病人数已达500 万[3]。大量的临床研究表明,与普通人群相比,RA 患者发生严重感染、呼吸道疾病、骨质疏松症、心血管疾病、癌症和死亡的风险更高[1,4-5]。因此,寻找安全、有效的治疗RA药物具有重要的意义。
金藤清痹颗粒具有清热解毒、活血消肿、通痹止痛之功,临床主要用于RA 活动期[6]。目前,有关金藤清痹颗粒治疗RA 的基础研究报道较少,多为临床疗效观察[7-8]。代谢组学技术因其具有整体性、动态性、高灵敏度和高通量等优势广泛应用于生命科学的各个领域,利用现代分析技术定量测定生物体液内源性代谢产物,如脂质、氨基酸和有机物的变化,结合生物信息学阐明内源性小分子代谢物变化规律,为揭示中药发挥药效的“多途径-多靶点”作用机制提供了可能[9-10]。因此,本研究基于代谢组学开展金藤清痹颗粒治疗RA的作用机制,为金藤清痹颗粒向临床进一步深入推广提供参考和依据。
1 实验材料
1.1 实验动物
SPF级健康SD雄性大鼠30只,来源于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2020-0004),6 周龄,清洁级,体质量(170 ± 10)g,饲养于郑州大学动物实验中心,饲养条件为温度(25 ± 2)℃,相对湿度(45 ± 5)%,12 h 光照条件下饲养7 d 后开始实验。本实验取得郑州大学第一附属医院生命科学伦理委员会批准,批准号:K2020-0005。
1.2 药品
双氯芬酸钠(中国希恩思生化科技有限公司,批号:201007);金藤清痹颗粒(鲁南厚普制药有限公司,批号:28210041)。
1.3 主要试剂与仪器
C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、类风湿因子(RF)试剂盒(武汉华美生物工程有限公司,批号分别为2010-2、2008-2、Z18037186);牛Ⅱ型胶原蛋白(CⅡ)、弗氏不完全佐剂(IFA)、弗氏完全佐剂(CFA)(Sigma 公司,批号分别为20200235、SLBR0324A、SLBR3879V);乙腈(Merck 公司,批号:1499230-935);乙酸铵(Sigma公司,批号:70221)。
色谱柱:Waters, ACQUITY UPLC BEH Amide(2.1 mm × 100 mm, 1.7 μm);BX53 型电子显微镜、DP72CCD 相机(日本Olympus);Sunrise 酶标仪(瑞士Teacan 公司);TGL-16M 型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);DW-HL508 型超低温冰箱(安徽中科美菱低温科技股份有限公司);Leica UC7 型超薄切片机(Leica);AB Triple TOF 6600质谱仪(AB SCIEX);Agilent 1290 Infinity LC 超高压液相色谱仪(Agilent)。
2 实验方法
2.1 动物分组及造模
SD 大鼠适应性饲养7 d,依据体质量随机分为对照组(Control 组)、模型组(Model 组)、双氯芬酸钠阳性药组[SLFSN 组,3 mg/(kg·d)]、金藤清痹颗粒高剂量组[JTQB-H 组,6.30 g/(kg·d)]和金藤清痹颗粒低剂量组[JTQB-L 组,3.15 g/(kg·d)],每组6 只。Control组和Model 组大鼠灌胃给予生理盐水,其余组给予相应药物,给药周期为28 d。除对照组外,其余各组大鼠参考文献[11]采用胶原诱导RA 大鼠模型,实验第1天,多点给予CⅡ 5 mg/mL 与含结核分枝杆菌CFA的混合乳剂注射大鼠尾部和左后足进行初次免疫;实验第21 天,在大鼠尾根部相同部位多点给予CⅡ与IFA 的混合乳剂加强免疫。对照组在相同实验周期给予生理盐水注射。
2.2 取材
末次给药后,大鼠腹腔注射戊巴比妥钠麻醉,腹主动脉采血,部分全血置于涂有肝素钠的EP 管中,其余全血放于普通试管中,3 000 r/min 离心10 min 分离血浆和血清,其中血浆用于代谢组学研究,血清用于检测TNF-α、IL-1β、RF 水平。处死大鼠后,采用线环绕踝关节方法测量关节的肿胀度,取部分踝关节组织,置于4%多聚甲醛固定用于病理学观察。
2.3 代谢组学分析
2.3.1 血浆处理
将各组血浆于4 ℃环境解冻后,取适量样本加入预冷甲醇/乙腈/水溶液(2∶2∶1,V/V),涡旋混合,低温超声30 min,-20 ℃静置10 min,14 000 ×g4 ℃离心20 min,取上清真空干燥,分析时加入100 μL乙腈水溶液(乙腈∶水 = 1∶1,V/V)复溶,涡旋,14 000 ×g4 ℃离心15 min,取上清液进样分析。
2.3.2 色谱条件
Agilent 1290 Infinity LC 超高效液相色谱系统(UPLC),HILIC 色谱柱进行分离;柱温25 ℃;流速0.5 mL/min;进样量2 μL;流动相组成为A:水+25 mmol/L乙酸铵+ 25 mmol/L氨水,B:乙腈。梯度洗脱条件:0→0.5 min,95% B;0.5 min→7 min,95%→65% B;7 min→8 min,65%→40% B;8 min→9 min,40% B;9 min→9.1 min,40%→95% B;9.1 min→12 min,95% B。
2.3.3 质谱条件
采用AB Triple TOF 6600 质谱仪进行样本一级、二级谱图的采集。ESI 源条件:Ion Source Gas1:60,Ion Source Gas2:60,Curtain gas:30,IonSapary Voltage Floating:± 5 500 V(正负两种模式);TOF MS scan m/z range:60~1 000 Da,product ion scan m/z range:25~1 000 Da;二级质谱采用information dependent acquisition获取,并且采用high sensitivity 模式,Declustering potential: ± 60 V(正负两种模式),Collision Energy:(35 ±15)eV。
2.3.4 数据分析
将质谱采集的数据信息导入R 软件,进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)。OPLS-DA 模型的变量重要性投影(VIP)初步筛选出各组代谢物,选取VIP > 1.0 且P< 0.05 的变量进行进一步数据分析。
2.3.5 质控
质控样本(QC)由所有样本的提取液等体积制备而成,每个QC 的体积与待测样本分析方法一致,以考察整个检测过程的稳定性。
2.4 统计学方法
实验数据用SPSS20.0(IBM, Armonk,USA)统计分析软件进行处理,先进行方差齐性检验,结果用±s表示,两组间均数比较采用t检验。P< 0.05为差异有统计学意义。
3 结果
3.1 各组大鼠踝关节肿胀度的比较
与Control 组比较,Model 组大鼠踝关节肿胀度显著升高(P< 0.01),踝关节部位红肿较严重。与Model组比较,SLFSN、JTQB-H、JTQB-L 组大鼠踝关节肿胀度显著降低(P< 0.05),踝关节部位红肿明显减轻。结果见图1。
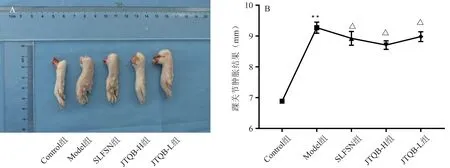
图1 各组大鼠关节肿胀度情况比较
3.2 各组大鼠踝关节病理情况比较
Control 组大鼠踝关节组织结构正常完整,Model组大鼠踝关节内出现明显的病变和损伤,其中滑膜细胞增生显著,并伴随大量炎性细胞浸润。SLFSN、JTQB-H 和JTQB-L 组踝关节病变和损伤均得到一定改善,其中滑膜细胞出现轻度增生,炎性细胞浸润有所减少。结果见图2。
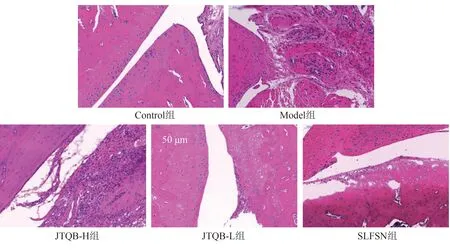
图2 各组大鼠踝关节HE染色图(×200)
3.3 各组大鼠血清TNF-α、IL-1β和RF水平比较
与Control组比较,Model组血清IL-1β水平显著升高(P< 0.01),与Model 组比较,SLFSN、JTQB-H 和JTQB-L组血清IL-1β显著降低(P< 0.01,P< 0.05);与Control 组比较,Model 组血清TNF-α 显著升高(P<0.01),与Model 组比较,SLFSN、JTQB-H 组血清IL-1β 显著降低(P< 0.01,P< 0.05);与Control 组比较,Model组血清RF显著升高(P< 0.01),与Model组比较,SLFSN组血清RF显著降低(P< 0.05),其余各组均无显著变化,差异无统计学意义(P> 0.05)。结果见表1。
表1 各组大鼠血清TNF-α、IL-1β和RF水平变化(± s,pg/mL)
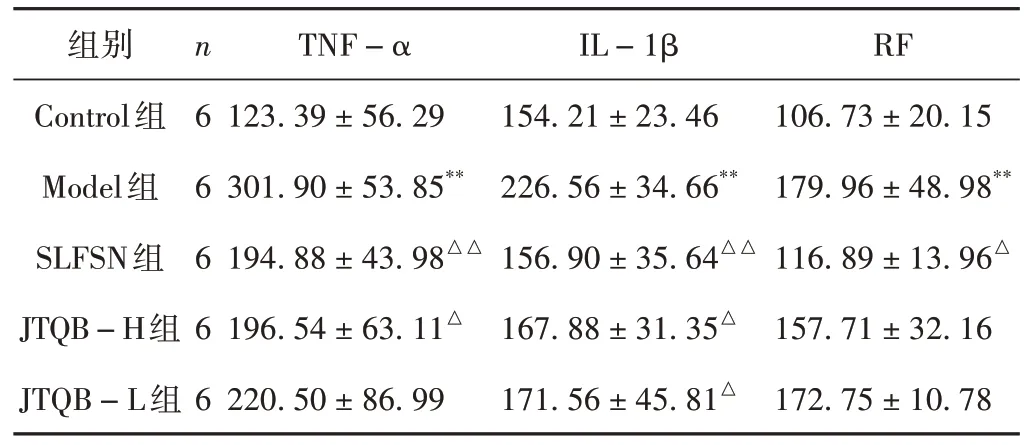
表1 各组大鼠血清TNF-α、IL-1β和RF水平变化(± s,pg/mL)
注:与Control 组比较,**P < 0.01;与Model 组比较,△P < 0.05,△△P < 0.01。
组别Control组Model组SLFSN组JTQB-H组JTQB-L组n6 6 6 6 6 TNF-α 123.39 ± 56.29 301.90 ± 53.85**194.88 ± 43.98△△196.54 ± 63.11△220.50 ± 86.99 IL-1β 154.21 ± 23.46 226.56 ± 34.66**156.90 ± 35.64△△167.88 ± 31.35△171.56 ± 45.81△RF 106.73 ± 20.15 179.96 ± 48.98**116.89 ± 13.96△157.71 ± 32.16 172.75 ± 10.78
3.4 各组RA大鼠血浆代谢组学情况比较
病理学观察和药效学显示,JTQB-H 组改善RA大鼠踝关节肿胀度和炎症状态、抗炎药效指标显示出更好的优势,因此本研究选择JTQB-H 组大鼠开展代谢组学相关研究。
3.4.1 QC样本总离子流图比较
将QC 样本总离子流图进行谱图重叠比较,结果各色谱峰的响应强度和保留时间基本重叠,说明在整个实验过程中仪器误差引起的变异较小。结果见图3。
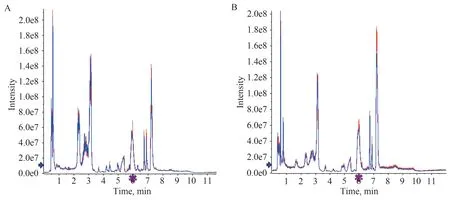
图3 不同离子模式 QC 样本总离子流图重叠谱图
3.4.2 各组样本代谢轮廓分析
对所得数据使用PCA 分析,结果表明Control 组与Model 组明显分离,说明CIA 造模成功,给予金藤清痹颗粒后,JTQB-H 组与Model 组分离明显,且有向Control 组回调趋势,说明金藤清痹颗粒对RA 模型具有较好的治疗作用。结果见图4。
3.4.3 差异代谢物筛选
基于OPLS-DA进一步对正、负离子模式下Model组和JTQB-H 组所检测到的所有代谢物进行差异分析,并绘制正、负离子代谢物火山图。以VIP > 1、P<0.05 作为筛选差异代谢物条件,并结合HMDB、KEGG等数据库,最终筛选出12 个差异代谢物,其中负离子模式下筛选出4 个差异代谢物,正离子模式下筛选出8个差异代谢物。结果见图5和表2。
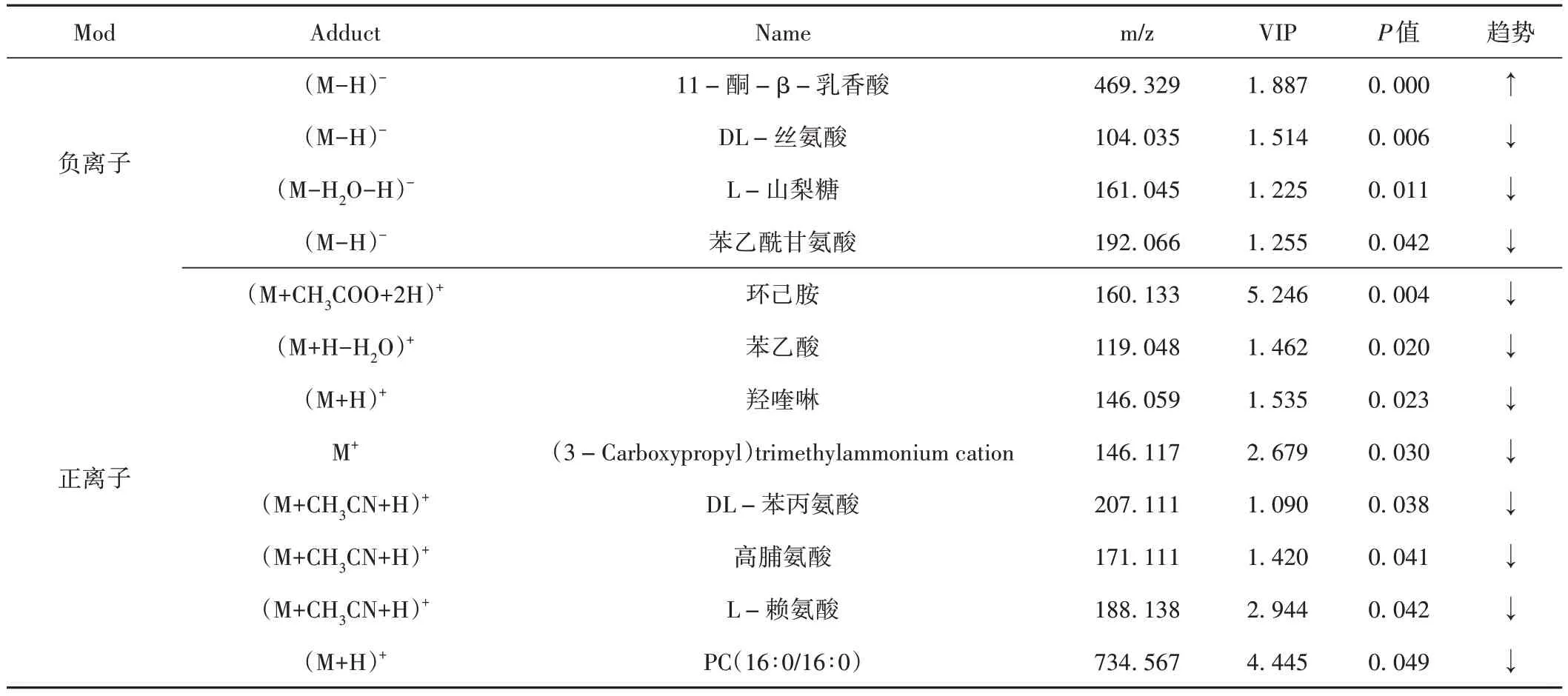
表2 正、负离子模式显著性差异代谢物
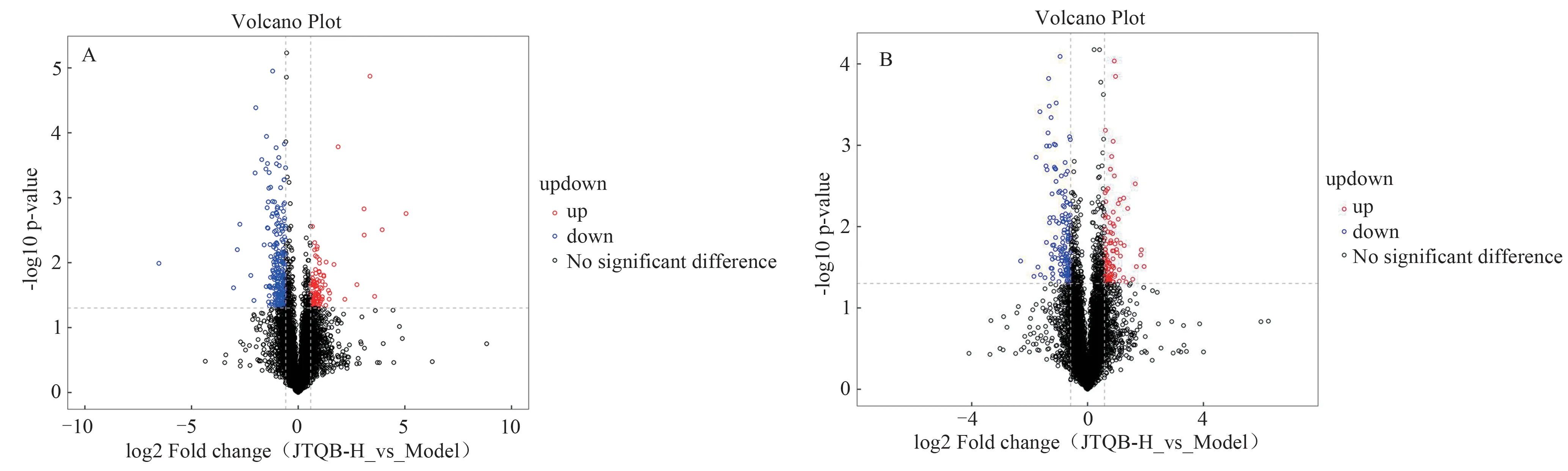
图5 不同离子模式下Model组和JTQB-H组代谢物火山图
3.4.4 差异代谢物的相关通路分析
对上述差异代谢物通过KEGG 进行生物途径富集分析,筛选潜在的关键代谢通路,结果提示金藤清痹颗粒主要通过调节甘氨酸,丝氨酸和苏氨酸代谢、亚油酸代谢、苯丙氨酸代谢等通路发挥治疗RA 的作用。结果见图6。
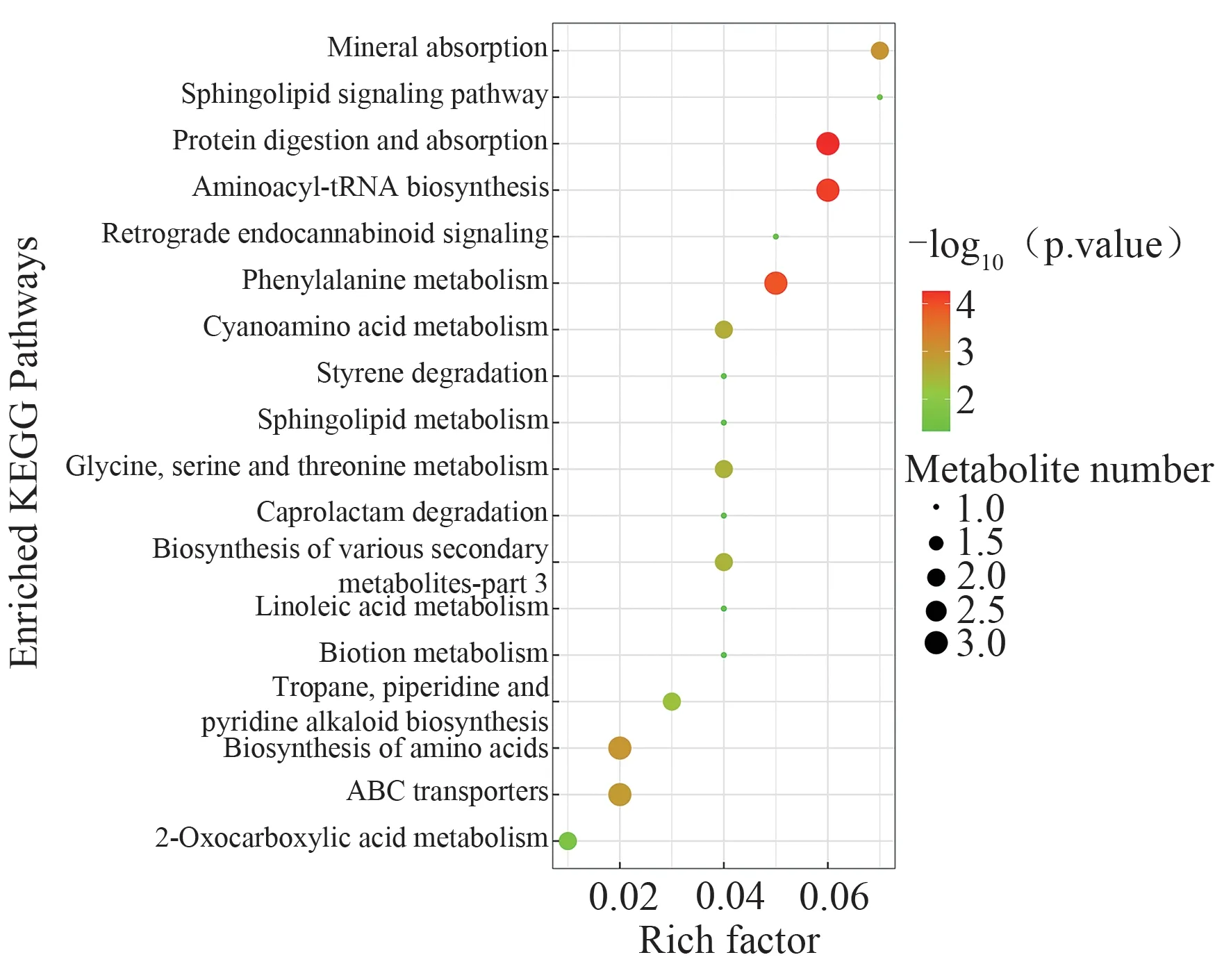
图6 KEGG富集通路图
4 讨论
研究显示,RA的早期诊断和治疗可以避免或减缓90%的患者关节损伤的进展,从而防止不可逆的残疾[12]。目前,临床中常用治疗RA 的药物有抗风湿药、糖皮质激素、生物制剂等[13-15],上述药物可有效减轻RA患者疼痛和肿胀,并改善身体功能和抑制关节结构性损伤进展。但部分药物会出现一系列的不良反应,严重限制了其在临床中的使用,如抗风湿药甲氨蝶呤在使用过程中易引起肝、肾毒性、加重感染及胃肠道不适等不良反应[16];糖皮质激素药泼尼松龙长期使用易引起多系统代谢紊乱,如骨质疏松症和胃溃疡等[17];生物制剂如肿瘤坏死因子抑制剂会增加老年患者首次住院和心力衰竭加重的风险[18]。因此,对RA 治疗药物的安全性、有效性提出了更高的要求。
金藤清痹颗粒由金银花、青风藤、白芍、生地黄、白花蛇舌草、当归、鹿衔草、玄参、蜈蚣和甘草组成,源于清代鲍相璈所编《验方新编》中的四妙勇安汤[8]。有研究显示,青风藤中总生物碱可通过降低RA 大鼠关节肿胀,血清中的P-选择素和血小板内皮细胞黏附因子的表达,从而缓解RA 症状[19]。白芍中的白芍总苷可通过降低类风湿因子、C 反应蛋白、调节粪球菌属Coprococcus 的相对丰度诱导自身免疫耐受和减轻炎症反应治疗RA[20]。白花蛇舌草中的阿魏酸通过抑制血栓素的分泌,下调血管内皮生长因子及软骨细胞中的基质金属蛋白酶-3 的表达,进而改善软骨基质治疗RA[21]。鹿衔草可减少炎症早期的渗出,抑制组织增生和肉芽形成,且能增加胸腺和脾脏重量,提高免疫功能[22]。蜈蚣可明显减轻治疗大鼠炎症和关节损伤,调节T 淋巴细胞亚群平衡,下调TNF-α 和IL-1β、上调IL-4 和IL-10 水平,显著抑制抗Ⅱ型胶原抗体水平[23]。综上可知,金藤清痹颗粒可能通过多组分、多途径发挥治疗RA的作用。
本研究对金藤清痹颗粒治疗RA 进行了初步的药效学考察,结果显示给药4 周后,与Model 组相比,JTQB-H 组可显著降低大鼠血清TNF-α、IL-1β 水平(P< 0.05),JTQB-L 组可显著降低大鼠血清IL-1β 水平(P< 0.05),且呈一定的量效关系,此外JTQB-H、JTQB-L 组均能有效降低CIA 大鼠踝关节肿胀及减少滑膜细胞增生和炎性细胞浸润,说明RA具有较好的治疗RA 作用。唐今扬等[24]研究发现,金藤清痹颗粒可减轻RA 大鼠关节肿胀,显著降低外周血中IL-1β、IL-17水平(P< 0.05),与本研究结果一致。金藤清痹颗粒可通过调控TLR4/NF-κB 信号通路来改善免疫微环境,从而缓解RA相关症状[25]。
为进一步深入探讨金藤清痹颗粒治疗RA 的作用机制,本研究采用代谢组学观察JTQB-H 对RA 大鼠体内代谢物的影响。结果显示,JTQB-H 可上调11-酮-β-乳香酸,下调DL-丝氨酸、苯乙酸、苯乙酰甘氨酸等在内的12 个显著差异代谢物。有研究发现,11-酮-β-乳香酸的纳米颗粒配方不仅可增加其1.7 倍抗炎活性,更能提高其7 倍的口服利用度[26]。ZHANG 等[27]在探讨中药复方黄连解毒汤及其成分对RA 大鼠作用机制时,发现其可使RA 模型组大鼠苯乙酰甘氨酸水平恢复正常。苯乙酸致炎状态可能与其增加多形核白细胞各种功能的激活和表面CD11b 和CD18 的表达有关[28]。以上报道结合本次筛选的差异代谢产物结果,提示金藤清痹颗粒发挥治疗RA 药效可能是通过调控多个代谢物共同发挥作用。
对上述差异代谢物进行通路分析,发现金藤清痹颗粒主要通过调控甘氨酸,丝氨酸和苏氨酸代谢、亚油酸代谢、苯丙氨酸代谢、氨酰tRNA 生物合成等通路来发挥疗效。石爱华等[29]利用代谢组学探讨清热养阴汤治疗RA 的作用机制,发现其调控通路涉及氨酰tRNA 生物合成、丝氨酸和苏氨酸代谢、亚油酸代谢等通路。赵传怡[30]在探讨牛白藤中龙胆苦苷治疗RA及其代谢组学研究,发现其调控的通路主要与苯丙氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,氨酰生物合成等代谢通路相关。可见,甘氨酸,丝氨酸和苏氨酸代谢、亚油酸代谢、苯丙氨酸代谢、氨酰tRNA 生物合成与RA 密切相关,金藤清痹颗粒可通过调控上述氨基酸代谢通路发挥治疗RA疗效。
