CO2 在离子液体N-乙基吗啉乙酸盐中的溶解度
2023-09-29杨园园程华农郑世清
王 宁, 杨园园, 程华农, 郑世清
(青岛科技大学 化工学院, 山东 青岛 266042)
二氧化碳(CO2)是一种温室气体,大量排放会加速全球变暖。全球平均气温的上升会导致气候恶化,对生态环境和人类社会造成重大影响[1]。此外,CO2会降低气体燃料的热值,并且在有水分存在的情况下,会导致运输管道和工艺设备的腐蚀。因此,高效捕获CO2是全球范围内减少温室气体排放以及气体净化的有效途径[2-4]。
目前,工业上常用的气体净化方法主要分为化学吸收和物理吸收。胺洗涤是最常用的去除CO2的化学吸收方法[5],然而,胺易蒸发和降解,会造成损失和设备腐蚀,并且溶剂再生能耗高[6]。对于高分压CO2的捕获,物理溶剂比化学溶剂更加高效。但物理溶剂工艺(如低温甲醇法[7])往往需要在低温、高压下操作,增加了工厂的运营成本和过多的能源消耗[8]。
近年来,离子液体作为一种绿色溶剂受到了广泛关注。由于离子液体的饱和蒸气压很低,在使用和储存的过程中,不易造成损耗和环境污染;高热稳定性和化学稳定性使得离子液体不易造成设备腐蚀[9-12]。自BLANCHARD 等[13]报道CO2在离子液体[BMIM][PF6]中具有较高溶解度以来,许多研究人员研究了离子液体在CO2捕集方面的应用[4,6]。离子液体的物理化学性质主要受阴阳离子组成和结构的影响[14]。对于采用物理吸收的离子液体,REN 等[15]研究表明,随着阳离子烷基链长的增加,阳离子的色散力也随之增加,使CO2可以更好地与离子液体进行相互作用。因此,阳离子烷基链长的增加可以增大CO2在离子液体中的溶解度。与阳离子相比,阴离子对CO2在离子液体中溶解度的影响更为显著[16-17]。由于气体在离子液体中的溶解度与离子液体的摩尔体积密切相关,阴离子体积较大的离子液体具有较高的摩尔体积,从而更有利于溶解CO2[18]。然而,离子液体的合成和纯化过程复杂繁琐,生产成本是传统溶剂的100~1 000倍[19],严重限制了离子液体的工业化应用。
最近,质子型离子液体引起了研究人员的注意,与传统的非质子离子液体不同,质子型离子液体的合成是基于质子转移反应,通过相应的酸和碱结合,采用一步法制备。质子型离子液体的合成工艺简单[20],用于工业过程中,成本较低,与丙酮等有机溶剂的成本相当[19]。并且已经证实,质子型离子液体对CO2具有良好的捕集能力[21-26]。ZHAO 等[27]报道了10种羧酸质子型离子液体,用于吸收H2S。其中,N-乙基吗啉乙酸盐([NEMH][Ac])制备简单、成本低,并且在298.2 K 时,黏度不到10 cP,这将有利于质子型离子液体的工业化应用。将[NEMH]·[Ac]应用到工业气体净化中时,还缺乏CO2的溶解度数据。为了扩大这一领域的研究,本研究将测定温度298.15~338.15 K 下,CO2在质子型离子液体[NEMH][Ac]中的溶解度并采用Soave-Redlich-Kwong(SRK)立方型状态方程对其进行拟合,为工业应用提供参考。
1 实验部分
1.1 实验材料
二氧化碳,青岛宇燕特种气体有限公司;N-乙基吗啉、乙酸、无水乙醇、氘代氯仿、1,3,5-三噁烷,Macklin公司;[NEMH][Ac],自制。
本研究按照既定的方法[27-28],通过质子交换反应,合成了质子型离子液体N-乙基吗啉乙酸盐([NEMH][Ac])。首先,向装有回流冷凝器和温度计的圆底烧瓶中加入0.1 molN-乙基吗啉和50 m L乙醇,在不断搅拌的过程中,通过滴液漏斗缓慢加入等物质的量的乙酸。添加过程在N2气氛下进行,温度控制在0℃左右。然后将混合物加热至50℃并在N2气氛下搅拌48 h。最后旋转蒸发除去乙醇,并在真空下干燥48 h,得到离子液体[NEMH]·[Ac]。以氘代氯仿(CDCl3)为溶剂,1,3,5-三噁烷为内标物,通过1H NMR(Bruker Avance 500MHz NMR)定量分析,确定了[NEMH][Ac]的结构和纯度,如图1所示。
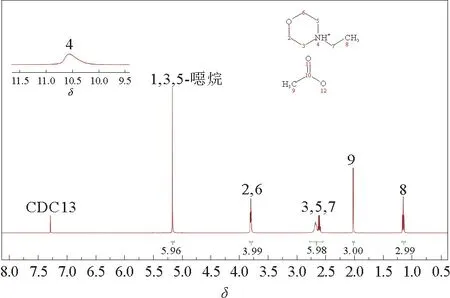
图1 [NEMH][Ac]的1 H NMR光谱Fig.1 1 H NMR spectra of [NEMH][Ac]
1.2 实验装置与步骤
本工作中用于测定溶解度的实验装置见图2。实验装置和步骤与本课题组之前工作中报道的H2S溶解度测量方法相似[29]。该测量系统主要由体积为547.4 m L(V1)的缓冲罐和155.6 m L(V2)的相平衡釜组成。缓冲罐的材质为316 L 不锈钢,用于储存CO2气体。相平衡釜的材质为哈氏合金,内部装有机械搅拌装置,用于测定气液平衡。温度由TES 1320 TYPE-K热电偶测量,稳定性优于0.03 K。两个YK-100B 压力传感器分别用于测量缓冲罐和相平衡釜内的压力。

图2 测定溶解度的实验装置图Fig.2 Experiment device for measuring solubility
实验开始时,向相平衡釜中加入已知质量(m)的[NEMH][Ac]。通过循环水浴调节缓冲罐和相平衡釜至所需温度T。 向系统中充入一定量的N2,检查装置的气密性。下一步,整个系统通过真空泵持续抽真空,确保系统内压力小于0.1 k Pa,记下此时的压力P1。在阀门V7关闭时,向缓冲罐中充入一定量的CO2,1 h 后,记下缓冲罐中的压力P2。 接下来,短暂打开阀门V7 后关闭,使部分CO2从缓冲罐进入相平衡釜中,记下缓冲罐中剩余气体的压力P3。 通过计算机监测压力随时间的变化,得到相平衡釜内的最大压力PP,用于估计相平衡釜内液相的体积VL。 在最后阶段,打开相平衡釜内的搅拌装置,促进气液混合。当相平衡釜内的压力在1 h内不再变化时,表明达到平衡状态,记下此时的平衡压力P4。继续向缓冲罐中充入一定量的CO2,测定更高压力下CO2在[NEMH][Ac]中的溶解度。
1.3 溶解度的计算
[NEMH][Ac]中溶解CO2的摩尔分数xt,i和质量摩尔浓度mt,i,可以通过以下方法计算。
其中,nIL和wIL分别为相平衡釜中[NEMH][Ac]的物质的量和质量。nt,i为第i次实验达到平衡时,CO2在液相中的物质的量,用方程(3)和(4)计算:
式中,Δni为第i次实验CO2溶解在[NEMH][Ac]中增加的物质的量;na,i为第i次实验从缓冲罐充入到相平衡釜中的CO2物质的量;ng,i为第i次实验,达到平衡时,相平衡釜气相中CO2的物质的量。na,i和ng,i可由真实气体状态方程计算。
其中,T为平衡温度;R为理想气体常数;VL为达到平衡时,相平衡釜内的液相体积;P2,i和P3,i为第i次实验从缓冲罐向相平衡釜中注入气体前后缓冲罐中气相的压力;Z2,i、Z3,i、ZCO2,i分别为CO2在温度T和压力P2,i、P3,i、下的压缩因子,使用Aspen Plus软件计算获得,热力学方法选择SRK。为第i次实验达到平衡时,相平衡釜内CO2的分压,可由式(7)计算:
式(7)中,P4,i为第i次实验的平衡压力;P1为系统抽真空后的压力;PL为达到平衡时,相平衡釜中溶剂的气相分压。由于离子液体在实验温度范围内的蒸气压很低,所以PL可以忽略。
采用JALILI等[30-31]提出的方法,通过已知缓冲罐的初始压力P2,i,注气前相平衡釜内的平衡压力P4,i-1,注气后相平衡釜内的最大压力PP,i,以及温度T,用公式(8)计算液相体积VL。
公式(8)中的参数ajklm通过已知体积的316 L不锈钢球在不同温度T和多组压力P2,i、P4,i-1、PP,i下校准系统得到。温度范围为298.15~338.15 K,压力范围为0~1.2 MPa。参数ajklm和溶解度实验中相平衡釜内的液相体积见表1和表2。

表1 公式(8)中的参数值Table 1 Parameter values in equation(8)
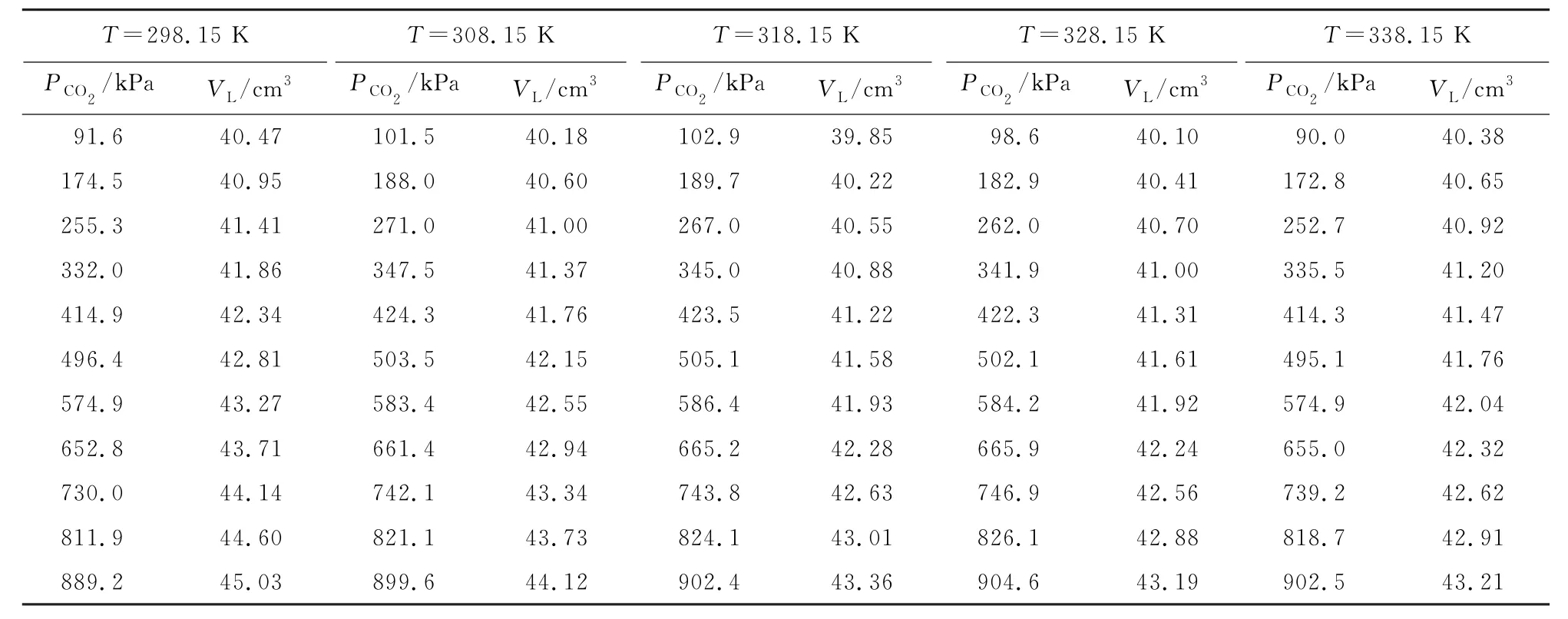
表2 相平衡釜内的液相体积Table 2 Volume of liquid phase in the phase equilibrium kettle
2 模 型
2.1 亨利定律常数的计算
通过实验获得的溶解度数据,确定了零压力下CO2在[NEMH][Ac]中基于质量摩尔浓度的亨利定律常数,如式(9)所示。
式(9)中,m0=1 mol·kg-1。f(T,P)是CO2在温度T和压力下的逸度,使用Aspen Plus软件计算获得,热力学方法选用SRK。对每个温度下CO2的逸度与质量摩尔浓度作图对比,根据拟合数据的二阶多项式的极限斜率估算了每个温度下的亨利定律常数[32]。
对每个温度下CO2的逸度与质量摩尔浓度作图对比,如图3中所示。CO2的逸度f(T,P)与质量摩尔浓度mt可用二阶多项式关联,即式(10)。

图3 不同温度下CO2 逸度随溶解在[NEMH][Ac]中CO2 质量摩尔浓度的变化Fig.3 Variation of the fugacity of CO2 with molality of CO2 dissolved in [NEMH][Ac]at different isotherms
每个温度下的亨利定律常数可由二阶多项式的极限斜率估算,即
溶剂化热力学性质可以为理解CO2在[NEMH][Ac]中的溶剂化过程提供有用的信息。根据亨利定律常数与温度的关系,用下列关系式可以得到无限稀释下CO2在[NEMH][Ac]中的偏摩尔吉布斯自由能,偏摩尔焓和偏摩尔熵。标准状态压力P0=100 k Pa。
2.2 SRK 立方型状态方程
CO2在离子液体中的溶解度可以用立方型状态方程模拟[31,33-35]。本工作中的溶解度数据采用了Soave-Redlich-Kwong立方型状态方程[36-37]进行关联。
式(15)中,am和bm分别为混合物的引力和协体积参数。采用Mathias-Klotz-Prausnitz混合规则[38],将其与相应的纯组分参数相关联:
二元交互作用参数表示为温度的函数:
状态方程的纯组分参数计算如下:
3 结果与讨论
3.1 验证实验的结果
为了验证实验装置的可靠性,在温度为308.15 K 下,测定了CO2在纯水中的溶解度。纯水在实验温度下的蒸气压不可忽视,为了减少溶剂损失,当系统内压力低于2 kPa时,关闭所有阀门和真空泵,记下系统内的压力P1。大约2 h后,相平衡釜内纯水在气液两相中已达到平衡,此时相平衡釜内气相主要由水蒸气和少量氮气组成。接下来的实验步骤与测定CO2在[NEMH][Ac]中溶解度的实验相同。
将3 次验证实验的结果与Aspen Plus ENRTL-RK 模型VLE数据和DALMOLIN 等[39]得到的结果进行比较,如图4所示。Ptot为平衡时气相中CO2和H2O 的总压力。结果显示出很好的一致性,表明本实验装置是可靠的。
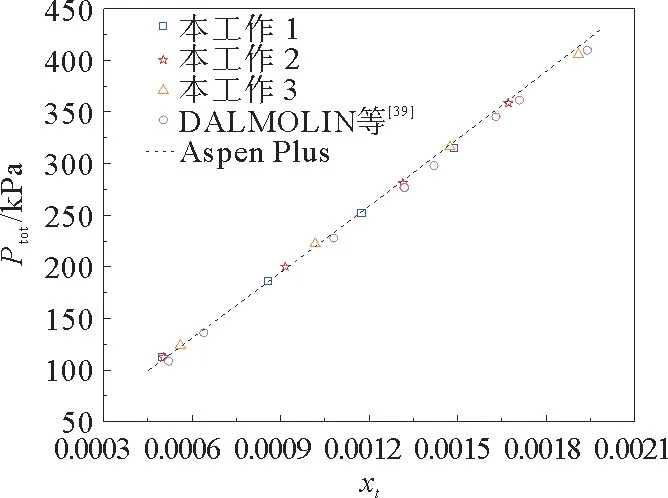
图4 比较308.15 K 时CO2 在纯水中溶解度的实验数据和文献数据Fig.4 Comparison of experimental and literature data of CO2 solubility in pure water at 308.15 K
3.2 CO2 在[NEMH][Ac]中的溶解度
表3中总结了在温度298.15,308.15,318.15,328.15,338.15 K 下,CO2在[NEMH][Ac]中溶解度的实验结果以及不确定度。不确定度根据不确定度传播定律估算[40]。CO2在[NEMH][Ac]中的质量摩尔浓度溶解度绘制在图5中。可以看出,在一定温度下,CO2在[NEMH][Ac]中的溶解度随着压力的增加以近似线性的方式显著增加。温度对CO2在[NEMH][Ac]中的溶解度也有显著影响。在900 k Pa下,当温度从298.15 K 升高到338.15 K 时,CO2在[NEMH][Ac]中的质量摩尔浓度溶解度降低了50%左右。上述结果表明,[NEMH]·[Ac]通过物理吸收的方式溶解CO2。
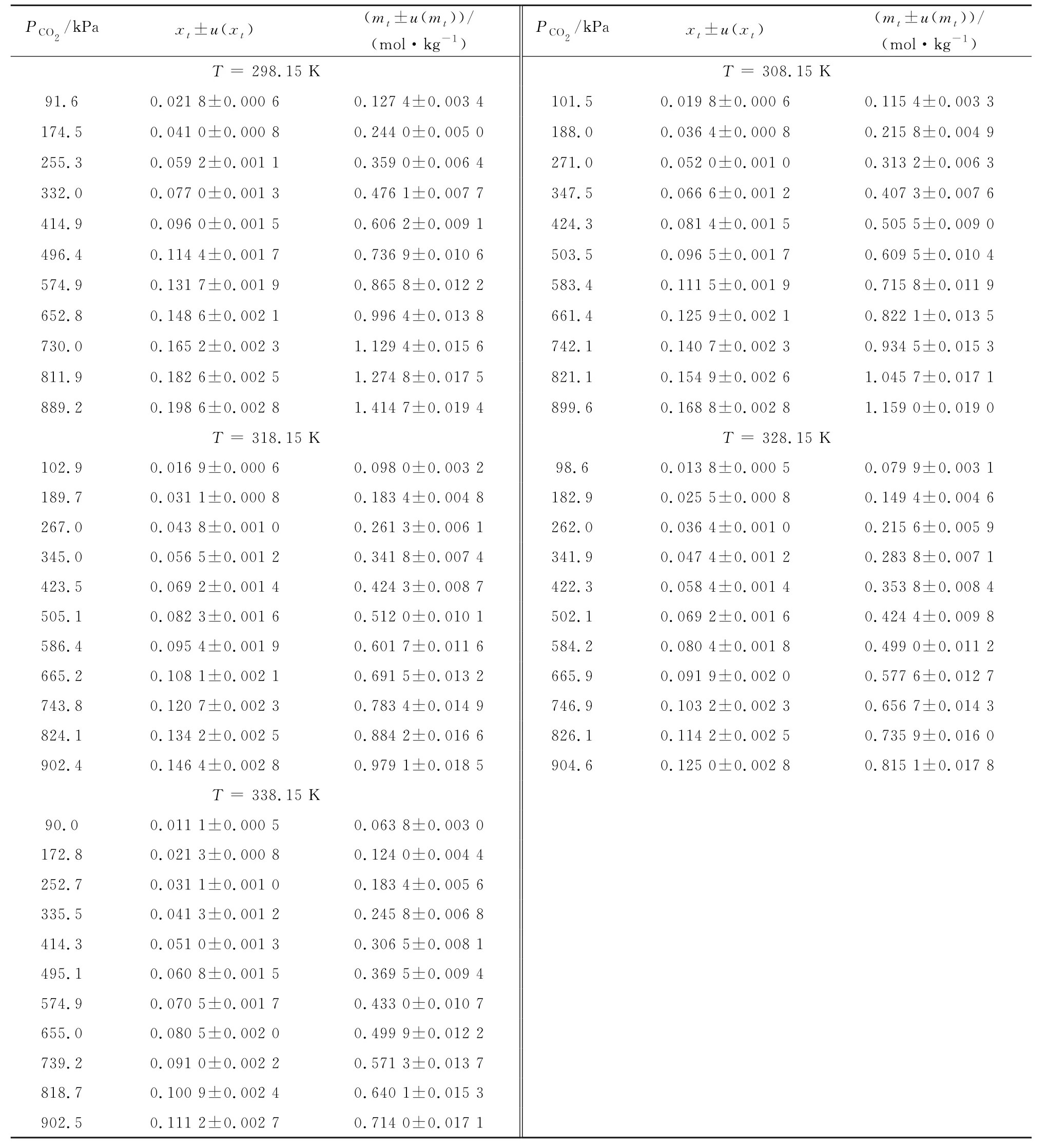
表3 CO2 在[NEMH][Ac]中的实验溶解度数据Table 3 Experimental solubility data of CO2 in[NEMH][Ac]

图5 不同温度下CO2 分压随溶解在[NEMH][Ac]中CO2 质量摩尔浓度的变化Fig.5 Variation of partial pressure of CO2 with molality of CO2 dissolved in [NEMH][Ac]at different isotherms
3.3 与其他离子液体中CO2 溶解度的比较
在实际工业应用中,以质量摩尔浓度表示的CO2在吸收剂中的溶解度具有重要意义。CO2质量摩尔浓度越大,所需的吸收剂的质量流量越小,动力能耗越低。在298.15 K 下,CO2在不同离子液体中溶解度的比较如表4 中所示。可以看出,[NEMH][Ac]具有中等水平的摩尔分数溶解度,但分子量明显低于普通咪唑类离子液体。因此,CO2在[NEMH][Ac]中具有更高的质量摩尔浓度溶解度。与普通咪唑类离子液体相比,[NEMH][Ac]不仅具有较低的黏度,还具有较高的CO2捕集能力,更加适用于工业气体的净化过程。
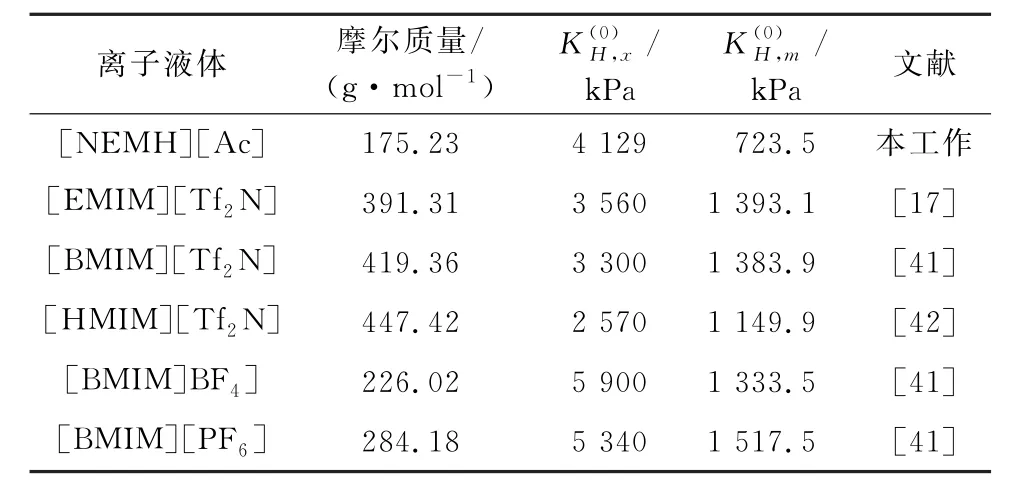
表4 298.15 K 下CO2 在不同离子液体中溶解度的比较Table 4 Comparison of solubility of CO2 in different ionic liquids at 298.15 K
3.4 溶液的热力学性质
CO2在[NEMH][Ac]中零压力下的亨利定律常数如表5中所示。可以看出,亨利定律常数随着温度的升高而增大,这表明升高温度会降低CO2在[NEMH][Ac]中的溶解度。温度对的影响可由式(24)描述。平均相对偏差和最大相对偏差分别为0.63%和0.84%。
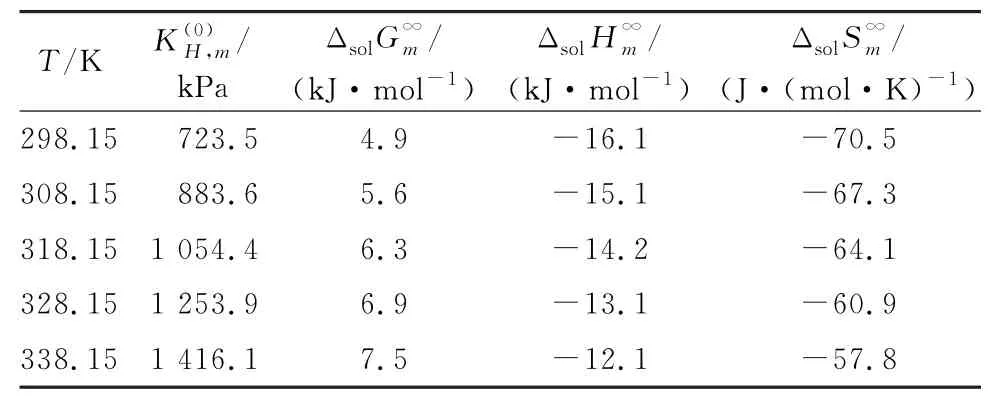
表5 CO2 在[NEMH][Ac]中的热力学性质Table 5 Thermodynamic properties of CO2 in[NEMH][Ac]
298.15 ~338.15 K 下,CO2在[NEMH][Ac]中无限稀释下的偏摩尔吉布斯自由能,偏摩尔焓和偏摩尔熵列于表5中。正如预期的那样,二元体系的为正值,且随着温度的升高而增大。表明[NEMH][Ac]对CO2的亲和力随着温度的升高而降低。负的值表明CO2在[NEMH][Ac]中的溶解是放热的,从能量的角度来看,有利于CO2的溶解。CO2在[NEMH]·[Ac]中溶解的偏摩尔焓值与水、乙醇等极性溶剂相似,它们通过物理吸收的方式溶解CO2,相互作用是色散力和偶极/诱导偶极。对于具有化学络合可能的化合物,如单乙醇胺(MEA)和甲基二乙醇胺(MDEA),的值要大得多[43]。较低的偏摩尔焓值表明,CO2的解吸能耗较低,吸收剂更容易再生。的值表示与气体溶解相关的溶液中的有序程度。从表6中可以看出,CO2在[NEMH]·[Ac]中的有序度随着温度的上升而降低。

表6 纯化合物的摩尔质量、临界性质和偏心因子Table 6 Molar mass,critical properties and acentric factors of pure compounds
3.5 溶解度数据的相关性
表6中总结了[NEMH][Ac]以及CO2的临界性质和偏心因子。[NEMH][Ac]的临界温度(Tc)、临界压力(Pc)和偏心因子(ω)通过修正的Lydersen-Joback-Reid基团贡献法估算[44]。
使用Aspen Plus软件对SRK 立方型状态方程中的二元交互作用参数kij和lij进行回归,结果见表7。

表7 SRK 立方型状态方程的二元交互作用参数Table 7 Binary interaction parameters of SRK cubic EoS
通过CO2质量摩尔浓度溶解度的平均相对偏差和最大相对偏差Sm来讨论溶解度数据相关性的质量。结果表明,SRK 立方型状态方程可以很好地关联溶解度数据,和Sm分别为0.94% 和2.86%。
4 结 论
测定了温度298.15~338.15 K 下,CO2在质子型离子液体[NEMH][Ac]中的溶解度。采用Soave-Redlich-Kwong(SRK)立方型状态方程成功关联了溶解度数据,模型的预测值和实验值的平均相对偏差小于1%。CO2在[NEMH][Ac]中的质量摩尔浓度溶解度明显高于普通咪唑类离子液体。[NEMH][Ac]具有较低的黏度和优异的CO2吸收能力,表明它在工业气体净化工艺中具有良好的应用前景。
