组蛋白乳酸化通过HDAC2影响抗结核药物性肝损伤炎症的机制研究
2023-09-28龙奕妃李雪莹刘越李金凤
龙奕妃 李雪莹 刘越 李金凤
华北理工大学公共卫生学院 河北唐山 063210
抗结核药物性肝损伤(Anti-tuberculosis drug-induced liver injury,ADLI)是结核病治疗中多药联合应用产生的最为严重的副反应[1],其发生与遗传[2-3]和环境[4-5]密不可分,而表观遗传学正是连接环境与基因的纽带。2019 年 Zhang等[6]研究报道组蛋白乳酸化是一种全新的表观遗传修饰,自此开启了组蛋白乳酸化这种全新的翻译后修饰的研究。HDAC2在1996年由Yang等[7]发现,属于I类HDAC中的一员,其活性位点具有催化机制,在转录调控、细胞周期等过程中起重要作用[8],而且有研究发现HDAC2可以加速糖酵解[9],与组蛋白乳酸化密切相关。门冬氨酸氨基转移酶(Aspartate transaminase,AST)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)是检测肝脏功能的常用指标,二者异常升高提示出现肝损伤[10],AST分布在肝细胞胞核和线粒体,其升高提示肝损伤可能已经损伤细胞器;ALT则主要分布在肝细胞胞浆,其数值升高则反映胞膜的破坏。因此本研究采用异烟肼、利福平、吡嗪酰胺三联用药方案在AML12细胞中构建ADLI细胞模型,并外源添加组蛋白乳酸化促进剂和抑制剂,旨在研究组蛋白乳酸化通过HDAC2对ADLI炎症的影响,为组蛋白乳酸化治疗ADLI提供理论支持。
1 材料和方法
1.1细胞与试剂 AML12细胞购自上海中科院;异烟肼、利福平、吡嗪酰胺购自日本TCI公司;乳酸、草氨酸钠购自美国MedChemExpress生物科技公司;CCK8、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;ALT、AST试剂盒购自南京建成生物工程有限公司。
1.2方法
1.2.1溶液配制 异烟肼:利福平:吡嗪酰胺按照3:6:16的比例,取异烟肼0.15g,利福平0.3g,吡嗪酰胺0.8g,溶解于5mL DMSO,得到(30000+60000+160000)μg/mL的三联药原液;取8μL乳酸溶解到1.11mL DEPC水中,得到100mmoL/L的乳酸原液;取500mg草氨酸钠粉末溶解到9mL DEPC水,得到500mmoL/L的草氨酸钠原液。以上原液均4℃保存备用。
1.2.2细胞活性检测 使用CCK8试剂盒检测细胞活性。当细胞培养密度达到80%~90%时,将其调整到3×104个/mL后接种到96孔板,贴壁生长后分别加入含不同浓度促进剂和抑制剂的培养基,37 ℃ 5%CO2培养箱孵育培养24h后,每孔加入100μL的CCK8稀释液培养4h检测各孔OD值,计算细胞活性。以对照组为参照,取细胞活性为80%时所在浓度为最终应用浓度。
1.2.3细胞培养及细胞分组 AML12细胞在37 ℃ 5%CO2培养箱孵育培养,并分为对照组、三联药组、乳酸组、草氨酸钠组、三联药+乳酸组、三联药+草氨酸钠组。细胞培养24h后收集培养基上清液。
1.2.4mRNA相对表达量检测 RT-PCR方法测定各指标mRNA表达水平。冰上操作,TRIZOL法提取总RNA,按照逆转录试剂盒说明书制备cDNA,克隆目的基因PCR。扩增程序如下:变性98℃, 10 sec;退火68℃, 30 sec;延伸72℃,Forever,45个循环。引物序列如表1所示。
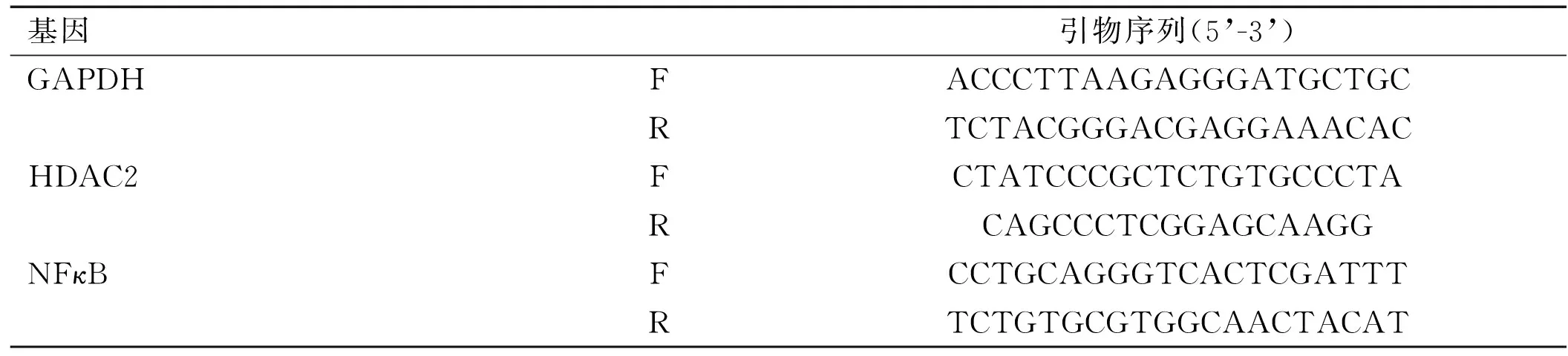
表1 引物序列
1.2.5蛋白表达水平 Western Blot法检测细胞炎症蛋白表达水平。冰上操作,裂解细胞后BCA蛋白定量试剂盒定量至5μg/μL,之后金属浴5min蛋白变性,备用。蛋白上样,经凝胶电泳后转至 PVDF 膜,用含5%脱脂奶粉的TBST室温封闭2h,加入HDAC2一抗(1:5000)、NFκB一抗(1:5000)、GAPDH一抗(1:1000)4 ℃孵育过夜。TBST漂洗三次,用HRP标记的羊抗兔二抗(1:5000)室温孵育2h,TBST漂洗三次,ECL发光液显影。
1.2.6AST、ALT酶活性检测 取适量细胞培养上清液,使用测试盒测定细胞内 AST、ALT酶活性,酶标仪510 nm波长检测各组OD值。
1.3统计学处理 采用SPSS 23.0统计学软件进行数据分析。计量资料采用单因素方差分析,两组间的比较采用Student-t检验,检验水准α=0.05。采用Pad Prism软件(Ver. Prism 8)绘制统计图。
2 结果
2.1乳酸浓度确定 AML12细胞活性在乳酸浓度0~40 mmoL/L范围内逐渐升高,但乳酸浓度超出40 mmoL/L后,细胞活性降低。故其培养浓度取8mmoL/L。见表2。

表2 不同浓度乳酸中细胞活性检测结果(%)

乳酸浓度(mmoL/L)01520304050AML12细胞活性100198.38±0.099200.21±0.283211.42±0.080223.49±0.14067.85±0.202
2.2草氨酸钠浓度确定 AML12细胞活性随着草氨酸钠浓度的升高而降低,见表3。故其培养浓度取其最高值18mmoL/L。

表3 不同浓度下抑制剂草氨酸钠中AML12细胞活性(%)

草氨酸钠浓度(mmoL/L)01416182030AML12细胞活性10085.19±0.04083.43±0.03879.35±0.08475.05±0.20570.23±0.337
2.3组蛋白乳酸化水平变化对ADLI蛋白和mRNA表达的影响 与对照组相比,三联药组HDAC2的mRNA和蛋白表达明显降低,NF-κB表达明显升高,差异均有统计学意义(P<0.05);与三联药组相比,HDAC2的mRNA和蛋白在三联药+乳酸组表达升高,在三联药+草氨酸钠组表达降低;而NF-κB mRNA和蛋白在三联药+乳酸组表达降低,在三联药+草氨酸钠组表达明显升高,差异均有统计学意义(P<0.05)。见图1。
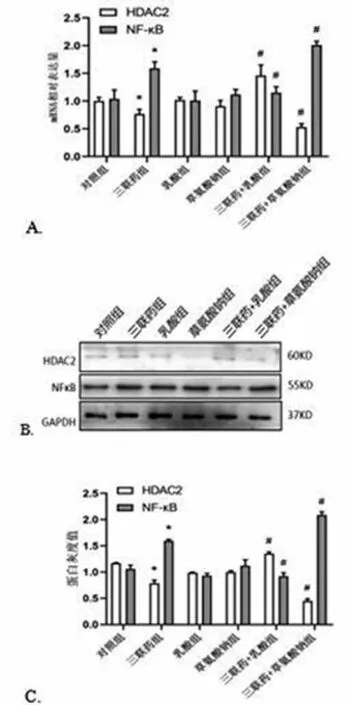
图1 各组细胞中HDAC2、NF-κB mRNA和蛋白表达情况注:*表示与对照组比较P<0.05;#表示与三联药组比较P<0.05。
2.4乳酸、草氨酸钠对上清AST、ALT酶活性的影响 与对照组相比,三联药组的AST、ALT酶活性显著升高,差异有统计学意义(P<0.05);与三联药组相比,三联药+乳酸组的AST、ALT酶活性显著降低,差异有统计学意义(P<0.05)。见图2。
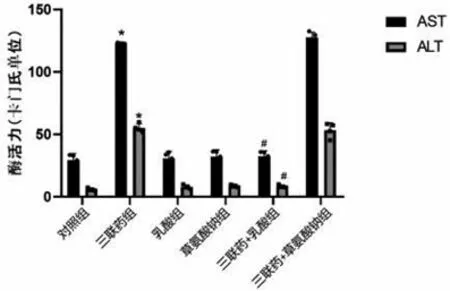
图2 各组细胞上清液中AST、ALT酶活性注:*表示与对照组比较P<0.05;#表示与三联药组比较P<0.05。
3 讨论
ADLI是抗结核治疗过程中危害最大且最常见的药物不良反应,严重时能导致肝衰竭危及生命,故其治疗显得至关重要。组蛋白乳酸化是全新的翻译后修饰调控,2019 年 Zhang等在人和小鼠细胞的核心组蛋白上鉴定发现了28个乳酸化位点,为理解乳酸的非代谢功能及其参与感染、免疫等过程提供了新角度。组蛋白乳酸化是糖酵解的结果,在维持细胞稳态、胚胎发育、神经元活动等生理过程中起关键作用[11-13],更在病理过程中具有调节免疫的功能,其水平的高低常常与疾病的预后密切相关[14-16],甚至可以驱动肿瘤基因表达并加速肿瘤发生[17]。
HDAC2在细胞增殖、细胞信号传导、癌症发生和进展、炎症和基因表达调控中发挥重要作用,其主要靶向组蛋白H3和H4[18]。HDAC2已经被多个研究团队证明有减轻炎症反应的功能[19]。另外有研究指明严重哮喘患者体内HDAC2表达降低,其介导的糖皮质激素受体乙酰化状态改变能刺激NF-κB的活化,进而促进严重哮喘的发生[20];2018年Peter J也提及在严重哮喘和COPD患者的上皮细胞、巨噬细胞和外周血白细胞中HDAC2表达降低,而募集HDAC2可以逆转核心组蛋白的乙酰化,继而关闭气道中激活的炎症基因[21]。2019年Lai团队观察到暴露在室内尘螨环境中的HDAC2+/-小鼠出现明显的炎症细胞浸润增强,认为HDAC2是通过抑制了T-2细胞因子和IL-17A表达水平而起作用,证实了HDAC2过表达可阻止炎症因子的进一步发展[22];同年Tang团队研究发现p300/YY1/miR-500a-5p/HDAC2信号轴调控人类结直肠癌细胞增殖,其中HDAC2是miR-500a-5p的功能靶点,也是该miRNA的靶基因,介导了miR-500a-5p对结直肠癌细胞的增殖和侵袭,而这些功能离不开HDAC2对肿瘤微环境炎症的调控作用[23]。
NF-κB能控制DNA转录、细胞因子的产生和细胞存活[24]。NF-κB信号通路在慢性炎症和自身免疫性疾病中的研究最为丰富,其激活与癌症、自身免疫性疾病、心血管疾病等病理过程相关[25]。NF-κB在接收到刺激的第一时间被激活,引起免疫反应相关基因的激活,发挥促进炎症的作用,在炎症消退后又可恢复至正常。
AST存在于心肌细胞和肝细胞的线粒体中,当肝组织受到严重损害血清AST会升高[26]。ALT主要存在于肝细胞胞质中,在重型肝炎、肝硬化、肝癌药物中毒性肝细胞坏死等病理进程中,AST、ALT会大量释放入血,血清中二者含量急速升高。
本研究在AML12小鼠肝细胞中构建ADLI模型,通过改变组蛋白乳酸化状态发现,组蛋白乳酸化促进剂乳酸可升高HDAC2的表达水平,同时抑制NF-κB的活性,降低细胞上清液中ALT、AST酶活性,在一定程度上缓解肝脏损伤;而组蛋白乳酸化抑制剂草氨酸钠的作用与之相反,与已有研究结果一致[27-29]。组蛋白乳酸化修饰水平升高可在一定程度上修复ADLI损伤,提示组蛋白乳酸化可能是治疗ADLI的新途径,本研究为ADLI的治疗提供理论支持。
