dpr基因对肺炎链球菌耐药及生化反应的影响
2023-09-28韩旭高春燕朱丽华
韩旭 高春燕 朱丽华
1华北理工大学基础医学院 河北唐山 063210;2唐山市妇幼医院检验科
肺炎链球菌( Streptococcus pneumoniae,Sp)能够导致一系列严重的感染性疾病:非侵袭性感染(中耳炎和肺炎),侵袭性感染(脑膜炎和败血症)。儿童下呼吸道感染发病率和死亡率主要归因于Sp感染。据报道全球范围内Sp每年造成约58.2~92.6万名5岁以下儿童死亡[1]。我国是全球Sp所致疾病负担最高的国家之一,且儿童Sp检出率呈逐年上升趋势[2-5]。且Sp的多重耐药菌(multi-drug resistance ,MDR)严重降低了抗生素的有效性,已成为严重威胁公众健康的问题。随着基因测序技术在耐药机制中的研究,耐药相关基因分析不仅可以为Sp感染治疗用药提供理论支持,有利于保障多重耐药感染患儿的治疗效果,还为MDR的防范提供指导[6]。遗传多样性分析表明,不同基因的变异与特定的抗生素耐药性有关[1]。dpr基因(DNA binding protein starved cells-like peroxide resistance protein)是链球菌中dps的同源基因[7],是肺炎链球菌R6株全基因测序中的第1430号基因[8],目前尚无dpr基因突变与Sp耐药相关性的研究。本研究对2020年唐山市妇幼医院收治的儿童感染性疾病病原菌分布情况、儿童Sp感染临床资料特点以及儿童Sp的耐药情况进行统计分析,现报告如下。
1 对象与方法
1.1研究对象 统计2020年1月~12月,唐山市妇幼医院收治的儿童感染性疾病共2996例,其中Sp感染806例,占26.9%。标本来源:痰液751例,血液18例,脑脊液1例,肺泡灌洗液12例,分泌物24例。侵袭性感染19例,非侵袭性感染787例;男496例,女310例。剔除来自同一患儿临床标本相同部位分离出的重复菌株。
1.2研究方法
1.2.1药物敏感性试验及生化反应 据菌落形态以及全自动细菌鉴定/药敏检测系统及配套试剂,进行细菌鉴定和药敏实验,筛选出Sp。参照 2020年美国临床和实验室标准协会(CLSI)M100-S30文件推荐的判断标准[9]。
1.2.2Sp DNA的提取与测序 Sp DNA提取试剂盒购自天根生化科技(北京)有限公司,测序由武汉凡朴科技有限公司完成。
1.3统计分析 使用细菌耐药监测WHONET5.6软件对药敏结果进行分析,用SPSS22.0软件对dpr基因突变情况与耐药及生化反应关系进行统计分析,计数资料用率(%)表示,组间比较采用卡方检验或Fisher精确检验,P<0.05为差异具有统计学意义,不敏感率=耐药+中介/总例数。
2 结果
2.1儿童感染性疾病感染特征分析
2.1.1儿童感染性疾病中各病原菌分布情况 在2020年我院收治的儿童感染疾病病原菌2996株中,Sp、金黄色葡萄球菌、卡他布兰汉菌位列前三。其中,Sp分离率最高,达到26.9%(806/2996)见图1。
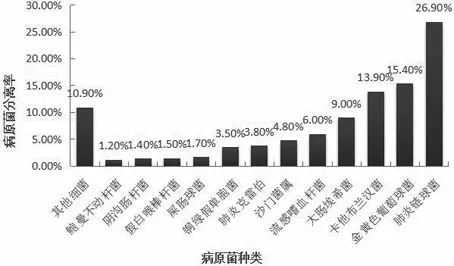
图1 2020年儿童病原生物分离率
2.1.2儿童Sp感染的临床资料特点 Sp感染发病率以12~36个月最高,占48.9%(394/806);四季均可发病,但秋冬两季明显升高。患儿以肺部感染、非侵袭性感染为主。见表1。
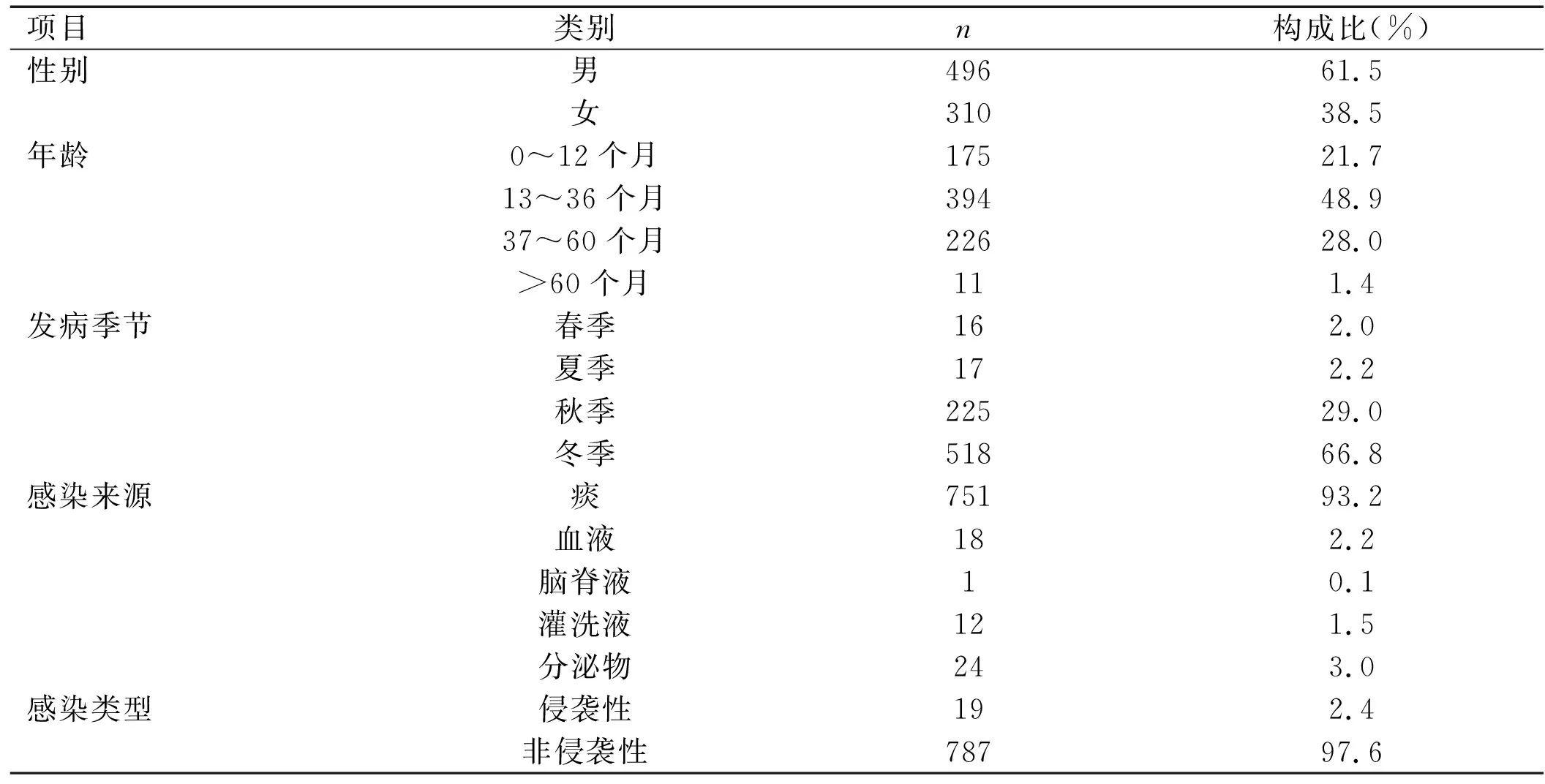
表1 806例儿童Sp感染临床资料特点
2.1.3Sp耐药情况 2020年我院收治儿童感染Sp的806例,未发现万古霉素、利奈唑胺耐药株,对奎奴普丁、红霉素、克林霉素、四环素的耐药率较高,见表2。
2.2Sp中dpr基因突变情况 本次研究随机抽取MDR的Sp菌株42株进行dpr基因测序,测序结果与Genebank(美国国家生物技术信息中心)中R6菌株(GenBank登录号ASM704v1)的dpr基因进行blast比对。结果显示: dpr基因突变率达到40.5%(17/42),单基因突变与多基因突变比例为1:2(6:12)。氨基酸突变的位点及突变率见图2,126号、133号、156号氨基酸突变率最高,均为11.9%;其次为58号。

图2 dpr基因突变位点和突变率
2.3dpr基因突变与耐药的关系 dpr基因未突变株和突变株与常见抗生素耐药关系,见表3。dpr基因突变与复方新诺明耐药性相关(P<0.05),与其他抗生素耐药性无关(P>0.05)。

表3 dpr基因突变与抗生素耐药的相关性
2.4dpr基因突变与生化反应的关系 细菌在新陈代谢过程中进行各种生物化学反应。因细菌的种类不同,催化这些反应的酶类及其活性也有所差异,代谢过程中所产生的代谢产物亦各不相同。42株Sp经全自动细菌鉴定/药敏检测系统。共测试43个生化反应,其中各菌株间结果出现差异的生化反应有:L-缬氨酸-7-氨酸-4-甲基香豆素(LVAL)、丝氨酸-酪氨酸-7-氨酸-4-甲基香豆素(SETY)、普鲁兰多糖(PUL)、腺嘧啶脱氧核苷(THY)、D-海藻糖(TRL)、4-MU-BD-半乳糖苷(BDGAL)、4-MU-BD-葡萄苷(BDGLU)、4-MU-N-乙酰-BD-氨基葡糖苷(NAG)、4-MU-AD-半乳糖苷(ADGAL)、对硝基苯-BD-半乳糖苷(GALB),dpr基因是否发生突变与全自动细菌鉴定检测系统中各生化反应的关系,见表4。dpr基因的突变与THY (腺嘧啶脱氧核苷)有相关性(P<0.05),其他生化反应不相关(P>0.05)。

表4 dpr基因突变与生化反应的相关性分析
3 讨论
本研究806例Sp感染患儿中侵袭性感染比例较低,为2.4%,通常儿童脑脊液样本非常有限,血培养的阳性率也不高,这对侵袭性Sp的诊断带来巨大挑战[10]。本次研究中Sp感染中男女比例与其他研究相一致,临床实践中应特别关注患儿性别的问题[11];24~36个月的患儿自身免疫力较低,活动范围及饮食结构的改变等原因造成发病率最高。Sp感染具有较强的季节差异,秋季和冬季是该病流行的季节,12月、1月达到高峰。秋冬季天气干燥,冷空气加大对鼻咽黏膜的损伤,从而为病原体的侵入提供便利。此外,该时期流感、副流感等呼吸道病毒性疾病频发,也会增加Sp感染的机率。
从Sp感染的耐药情况来看,奎奴普丁、红霉素、克林霉素、四环素的耐药率很高,均在90%以上,青霉素的耐药率为68.4%,复方新诺明的耐药率也达到了50.7%,与中国儿童细菌耐药监测组 2020年儿童细菌感染及耐药监测耐药率一致[12-13]。因此红霉素、克林霉素、四环素、青霉素在本地区已不能再作为临床治疗Sp感染的选择。虽然已经采取了许多措施来规范医院抗生素的使用,但抗生素的滥用仍然很普遍[14]。本次研究结果显示利奈唑胺、莫西沙星、万古霉素等抗生素具有较高的敏感率,但其并非治疗患儿的首选用药,利奈唑胺可造成骨髓抑制,莫西沙星可能影响儿童关节和软骨发育,万古霉素可引起肾毒性, 因此,临床医生对儿童选择用药时应该避免药物的毒副作用,谨慎用药[15]。
本研究简要地分析了Sp分离株中存在的dpr基因变异,并分析了基因变异与特定抗生素耐药的相关性。细菌在生长繁殖过程中由于基因变异,使其对营养基质的分解能力发生了变化,从而代谢产物较突变前不同,进而导致了生化反应中THY与dpr基因突变存在相关性。细菌的生化反应也是微生物分类鉴定中的重要依据之一。MDR分离株表现出一系列耐药机制,包括药物靶点的修饰、治疗药物的失活和外排泵的过表达[16]。有研究表明Sp中近90%的多态性是通过基因重组交换引入的[17-18]。Sp的基因组可塑性很强,有助于疫苗逃逸和抗生素抗性分离株的快速发展。有研究表明,在一轮转化中单个细胞中可发生29个以上基因重组,而在临床分离株中发现了长度高达50 Kb的基因重组株,基因组的多样性可能导致抗生素耐药相关基因的快速传播[19-20]。造成dpr基因突变的原因和耐药具体机制还有待于进一步探讨,但基于核酸扩增技术在耐药基因检测中的应用可以大大缩短临床报告时间,应尽早精准用药,进行靶向治疗,确定关键的耐药相关基因位点,为临床选择抗生素提供帮助,也为选择新的抗生素作用位点及研制特异性更强的疫苗等提供理论依据。
