牛源TAK1基因慢病毒载体构建及其在MDBK细胞中的表达
2023-09-22姜坤生王禹淳马金柱于立权宋佰芬
张 帆,姜坤生,王禹淳,马金柱,于立权,宋佰芬,2*
(1.黑龙江八一农垦大学生命科学技术学院,中国大庆 163319;2.中国农业大学动物医学院,中国北京 100093)
转化生长因子-β激活蛋白1(transforming growth factor-beta activator protein 1,TAK1)是一种丝氨酸/酪氨酸激酶,最初被鉴定为丝氨酸/酪氨酸蛋白激酶(MAPKKK)家族的成员,因是最早发现的转化生长因子-β或骨形态发生蛋白4(BMP-4)反应中的信号转导介质[1]而得名。有研究表明,TAK1在肿瘤坏死因子受体(TNFR)、白介素1受体I(IL-1RI)和Toll样受体(TLRs)介导的核因子κB (NF-κB)和丝裂原活化蛋白激酶(MAPKs)的活化中起着至关重要的作用[2]。此外,TAK1通过介导T细胞和B细胞受体信号在获得性免疫中发挥关键作用[3-4]。在所有这些途径中,TAK1被认为是NF-κB和MAPKs的关键调节因子,它在将上游信号从所指示的受体复合体传递到下游信号小体中起着至关重要的作用[5]。另一方面,TAK1被各种应激激活,包括DNA损伤和渗透冲击,表明TAK1参与应激反应信号传导[6-7]。因此,TAK1不仅参与免疫和炎症反应的发生,还可以通过调控细胞内多种信号转导从而发挥多种生物学作用[8]。越来越多的证据已经指出了TAK1作为一种多功能激酶的重要性,它可以应对各种刺激。
实验室前期通过转录组测序筛选出一个表达量差异显著且新组装的lncRNA-MSTRG.16919.1,为进一步研究lncRNA-MSTRG.16919.1的功能,将其沉默后再行转录组测序,结果显示该lncRNA可能与TAK1介导的信号通路有关,为了进一步确认该结果需要将TAK1基因进行过表达。因此,基于以上研究背景构建TAK1基因过表达慢病毒载体,筛选TAK1基因过表达稳转细胞株,为深入研究TAK1在lncRNA-MSTRG.16919.1参与的作用中以及BHV-1感染中机制的研究提供有效的帮助。
1 材料与方法
1.1 材料
1.1.1 细胞和载体 pCDH-CMV-MCS-EF1-turboRFP-T2A-Puro质粒购自上海汉恒生物科技有限公司,感受态EscherichiacoliDH5α、293T细胞系、MDBK细胞系均由黑龙江八一农垦大学细胞生物学实验室保藏。
1.1.2 主要试剂 EndoFree Plasmid Mini Kit,Omega公司产品;15 kb DNA Ladder、MiniBEST Agarose Gel Extraction kit Ver.4,Takara公司产品;限制性内切酶BamHI-HF、EcoRI-HF,NEB公司产品;DMEM培养基,美国Gibco公司产品;聚凝胺,中国百睿科技公司产品;嘌呤霉素,美国MCE公司产品;羊抗兔IgG-HRP抗体、Beta Actin Antibody,中国博奥森公司产品;ECL显色液,德国默克公司产品;预染蛋白质Marker、BCA定量试剂盒,中国Biosharp公司产品;RIPA裂解液,中国索莱宝公司产品;TAK1抗体,中国亲科生物公司产品。
1.1.3 主要仪器 电恒温水浴锅,上海博讯公司产品;Nanodrop 2000、高速离心机、低温恒温器和荧光显微镜,美国Thermo公司产品;PCR扩增仪、蛋白凝胶电泳仪、湿转转膜仪、琼脂糖凝胶电泳仪、ChemiDoc XRS+紫外凝胶成像系统,美国Bio-Rad公司产品;细菌摇床,华利达实验设备公司产品;倒置显微镜,广州明美光电技术公司产品。
1.2 方法
1.2.1 pCDH-CMV-TAK1-EF1-turboRFP-T2A-Puro载体构建 根据GenBank中牛源TAK1基因的全长序列(登录号:NM-001081595.1),设计并合成引物,序列如下:TAK1-F:GAATTCATGTCTACAGCCTCCGC;TAK1-R:GGATCCTGAAGTGCCTTGTCG。其中EcoRⅠ和BamHⅠ的酶切位点分别添加在正向与反向引物的两端。
以牛全基因组为模板扩增TAK1基因,对扩增产物进行回收。在37℃水浴中用EcoRⅠ和BamHⅠ两种酶分别对质粒pCDH-CMV-MCS-EF1-turboRFP-T2A-Puro和PCR回收产物进行双酶切,将得到的大分子量基因片段与TAK1酶切产物通过DNA ligase进行重组连接。根据文献制备化学感受态细胞[9],并进行热激转化获取阳性表达载体,提取质粒进行酶切及测序验证。
1.2.2 慢病毒包装 转染24 h前,取生长状态良好的293 T细胞于15 mL培养皿进行传代培养,待细胞密度达到70%~80%时进行转染试验。在试验前1~2 h需更换新鲜培养液,以减少对后续试验的影响。使用无菌的1.5 mL EP管进行试验,转染体系如下:A管成分穿梭质粒15 μg,包装质粒复合物15 μg,P3000 30 μg,Opti-MEM 750 μg; B管成分Lipo3000 45 μg,Opti-MEM 750 μg。将A、B两管试剂充分混合后转移至提前准备好的细胞中,放置于培养箱中培养。
培养6 h后,换液继续培养。48 h后,收集细胞上清液,以4℃、1 600 r/min离心5 min,并通过0.45 μm滤膜过滤上清液,最后再96 000 r/min离心90 min,丢弃上上清液,收集沉淀即为病毒浓缩液。将其分装保存于-80℃中。
1.2.3 慢病毒滴度测定 将HEK293T细胞在合适的条件下培养至对数生长期,培养结束后对培养皿中的细胞进行计数,并将其转移到96孔板中,每孔8 000个细胞,在37℃条件下培养12 h左右,当细胞密度达到30%~50%时符合转染试验要求。在转染试验开始前,将保存在-80℃的病毒液在冰盒上缓慢融化,以减少病毒的损失。将状态良好的细胞接种在96孔板中,对制备的慢病毒进行滴度测试。将不同梯度病毒稀释液加至孔板中,过夜培养;培养到第3天,弃去细胞孔板中的细胞培养液,换成100 μL新鲜培养液继续培养;培养至第5、第6天时,借助荧光显微镜观察96孔板中各病毒梯度处理的细胞荧光含量情况,通过统计表现荧光的细胞数量除以病毒稀释倍数计算病毒滴度。
1.2.4 TAK1最佳转染浓度筛选与过表达稳转细胞株的构建 对MDBK细胞进行传代培养,为后续试验准备。过表达试验分为慢病毒TAK1组、空病毒NC组、MDBK只加转染试剂组、MDBK不做任何处理组。
感染复数(multiplicity of infection,MOI)是细胞在感染时病毒与细胞数量的比值,通常MOI越高,整合到染色体上的病毒数量越多。MOI过低则达不到过表达效果,而MOI过高则会影响细胞状态,因此探索合适的MOI对后续试验是十分重要的。将MDBK细胞接种在96孔板中,过夜培养。当细胞融合率达到50%左右时,换液加入1/2体积预混合适浓度的Polybrene培养基。根据公式MOI值=病毒滴度×病毒体积(mL)/细胞个数,算出应该加多少慢病毒。慢病毒和空载体对照病毒NC按照MOI为0、60、120、180、240、300分别进行添加,慢病毒滴度为1×108TU/mL,加入慢病毒的体积分别为0、24、48、72、96、120 μL;空病毒滴度为5×108TU/mL,加入空病毒的体积分别为0、4.8、9.6、14.4、19.2、24 μL,混合均匀,试验重复3次,并且在37℃体积分数为5% CO2细胞培养箱中培养,4 h后添加余下培养基继续培养,从加入病毒的时间开始计算,24 h后换为含有1/2体积(50 μL)含有5 mg/L聚酰胺的培养基。感染病毒72 h后,借助荧光显微镜对细胞荧光表达效果进行评判,达到80%比例的样品对应的MOI为最佳MOI值。
将MDBK细胞按照1×106个/孔接种至6孔板,待汇合率达到30%~50%时,更换1/2体积含有5 μg/mL聚酰胺的完全培养基,按照MOI为180加入病毒进行培养,4 h后加入另一半培养基,24 h后对培养的细胞进行换液。感染72 h后,通过荧光显微镜统计荧光表达率,衡量目的基因的表达情况。确定荧光表达后,向稳定表达目的基因的试验组和未作任何处理的对照组细胞株中添加3 μg/mL的嘌呤霉素,观察到对照组细胞裂解完毕后,用含有3 μg/mL嘌呤霉素的培养基对试验组细胞进行筛选。培养1~2周后,细胞几乎无死亡现象,且在荧光显微镜下可观察到试验组与对照组均有红色荧光表达,对其进行扩大培养并保藏。随后对保存的细胞进行再次复苏进行培养,传至3~5代后,对细胞进行荧光观察。重复上述试验3~5次,依旧在显微镜下可观察到明显的荧光表达,且细胞生长状态良好,无明显的形态学变化,则表明TAK1过表达稳转细胞株制备成功。
1.2.5 Western blot检测TAK1蛋白表达情况 对细胞进行处理,制备蛋白样品。通过高效RIPA细胞裂解液对样品进行裂解,样品在冰上裂解30 min,每5 min轻轻敲打一次,将处理的样品收集到无菌离心管中。经离心后,对样品分装保存,同时进行蛋白浓度测定。根据文献[10]使用标签蛋白MYC抗体及TAK1蛋白抗体分别对TAK1表达量进行Western blot检测,通过AI600成像系统拍摄图像,并用Image J图像分析软件对蛋白进行定量分析。
2 结果
2.1 pCDH-CMV-MCS-EF1-turboRFP-T2A-Puro载体表达的构建
将连接产物进行转化后,挑取单克隆在37℃以220 r/min的条件下培养14 h后,提取质粒,用BamHⅠ和EcoRⅠ进行双酶切鉴定(图1),构建的重组质粒双酶切结果有两个条带,一条为1 790 bp,另一条为8 101 bp,与预计片段大小一致。然后将双酶切验证正确的质粒进行测序(图2),测序结果与参考序列一致,证明重组过表达载体pCDH-CMV-TAK1-MCS-EF1-turboRFP-T2A-Puro构建成功。
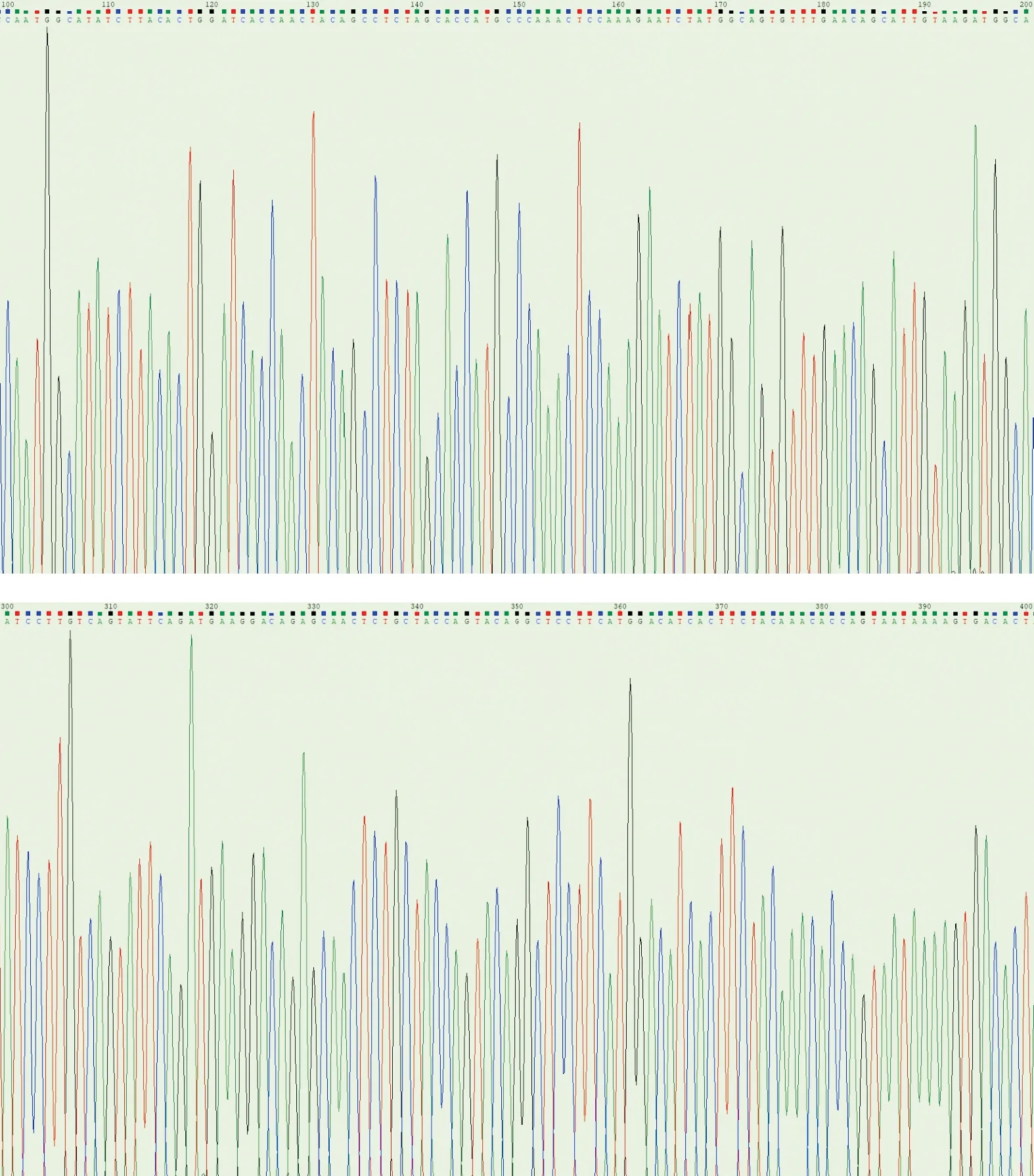
图2 目的基因测序结果
2.2 慢病毒制备及病毒滴度测定
将pCDH-CMV-TAK1-MCS-EF1-turboRFP-T2A- Puro质粒转染293T细胞,24 h后收集样品,收获含有TAK1基因的慢病毒。通过逐孔稀释法对所获得的病毒进行滴度检测。根据公式:病毒滴度=荧光细胞数目/相应稀释倍数,计算得到TAK1过表达阳性病毒滴度为1.0×108TU/mL,阴性对照病毒的滴度5.0×108TU/mL。
2.3 TAK1过表达最佳转染浓度确定及MDBK稳转细胞株制备
TAK1过表达慢病毒和阴性对照慢病毒分别以MOI量为60、120、180、240和300的剂量转染MDBK细胞,72 h后通过倒置荧光显微镜观察红色荧光的强度,结果显示(图3),MOI剂量为180时有较强的红色荧光表达,转染效率可达80%以上,而当MOI为240时,荧光强度变弱,可能是由于病毒量过大对细胞产生一定影响。因此,选择MOI为180的剂量作为转染剂量,进而筛选稳定过表达TAK1的细胞株。用慢病毒感染状态良好的MDBK细胞,病毒感染72 h后,加嘌呤霉素进行筛选,以空白对照组所有细胞死亡为准。经嘌呤霉素筛选且反复冻存复苏3~5次后,细胞生长良好,无明显形态学改变,能稳定持续表达红色荧光的细胞则为TAK1稳转细胞株(图4)。
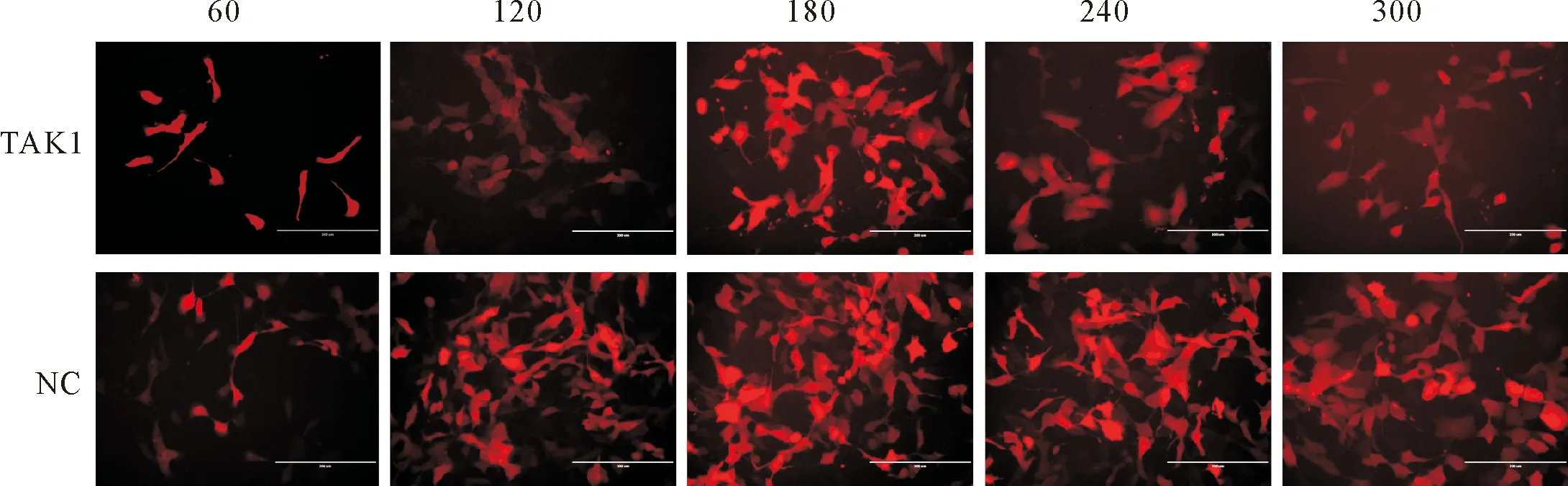
图3 不同MOI病毒转染MDBK细胞后荧光图片(100×)
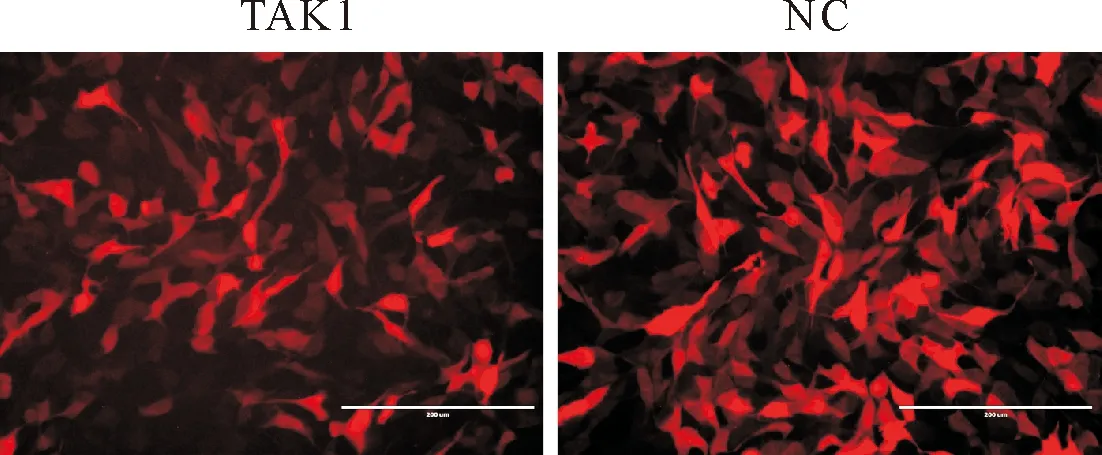
图4 TAK1稳转细胞株荧光图片(100×)
2.4 TAK1蛋白表达检测
用Western blot方法对3组细胞样本进行TAK1蛋白水平检测(图5),MYC标签抗体检测TAK1蛋白(a)显示过表达组在70 ku有一目的条带,而阴性对照组与空白对照组中未检测到该蛋白的表达。TAK1多克隆抗体检测结果(b)显示阴性对照组与空白组TAK1蛋白表达水平基本一致,而过表达组中TAK1蛋白表达量显著上调,由此表明TAK1过表达稳转株构建成功,且表达的蛋白能与购买的多克隆抗体结合,说明该蛋白具有良好的活性。

TAK1-MYC为TAK1基因过表达组,TAK1-NC为过表达阴性对照组;Blank为未作任何处理的MDBK细胞组;(a).MYC标签抗体检测结果;(b).TAK1多克隆抗体检测结果;(c).图(b)的定量分析图
3 讨论
TAK1是一种高度保守的MAPK激酶,受到多种水平的修饰[11]。多种病毒都可以激活TAK1。如HIV1的VPR蛋白和糖蛋白gp41与TAK1结合并诱导TAK1磷酸化和激活[12]。在艾滋病患者体内,人类免疫缺陷病毒1型激活TAK1是NF-κB和有效复制病毒所必需的[13]。TAK1是EB病毒蛋白潜伏膜蛋白1(LMP1)诱导的JNK1激活所必需的,但对于NF-κB的激活是必不可少的[14]。人参皂苷Rg3通过降解TRAF6和TAK1以及通过阻断HepG2细胞中JNK的激活来抑制乙型肝炎病毒复制[15]。其他研究表明,TAK1在单纯疱疹病毒、仙台病毒和RSV37-39激活NF-κB、p38和JNK过程中是必不可少的[16]。
另一方面,TAK1可以介导促炎症细胞因子的多种细胞内作用,如肿瘤坏死因子-α和白介素1-β(IL-1β)[17]。TAK1在上游信号从受体复合体到下游信号分子的通讯中是必不可少的[18]。如IL-1β与其受体IL-1R的结合导致与接头蛋白MyD88的相互作用[19]。MyD88招募IRAK家族成员,进而激活泛素E3连接酶TRAF6。泛素化的TRAF6与TAB和TAK1结合形成复合体,导致TAK1的激活。一旦激活,TAK1启动了一系列信号转导,包括IKK复合体的激活,IκB的磷酸化和泛素化,以及NF-κB到核的移位[20]。
LncRNA-MSTRG.16919.1是在BHV-1感染MDBK细胞中经转录组测序筛选出的新组装的lncRNA,关于它的功能还知之甚少,并且在lncRNA-MSTRG.16919.1功能发挥的过程中TAK1是否参与其中也未见报道。为了探究TAK1在这一过程中发挥的作用,通过过表达TAK1基因的方式进行探究。本文采用的pCDH-CMV-MCS-EF1-turboRFP-T2A-Puro载体为慢病毒载体,其优点是转染效率较高,对细胞损伤较小,更有利于下游的试验,在载体上选择了带有turboRFP红色荧光标签和嘌呤霉素抗性双重标记的载体,通过红色荧光的表达情况,在荧光显微镜下观察细胞内荧光表达情况判断转染是否成功,然后又通过嘌呤霉素抗性进一步筛选表达有TAK1蛋白的稳定转染细胞株,达到最终的试验目的。在验证TAK1是否表达方面,采用MYC标签抗体和TAK1抗体双重验证TAK1蛋白的表达,结果均显示TAK1蛋白被成功表达。
综上所述,TAK1慢病毒载体的构建成功,筛选出TAK1稳转细胞系,并且TAK1蛋白成功表达,为后续研究lncRNA-MSTRG.16919.1在BHV-1感染MDBK过程中的机制提供基础,并且为进一步探究lncRNA、病毒及宿主之间的关系奠定基础。
