不同培养条件对长枝木霉SMF2 和哈茨木霉T39生长与产孢的影响
2023-09-13赵晓彤王桂清
赵晓彤王桂清
(聊城大学农学与农业工程学院,山东聊城 252000)
生防真菌在防治作物病害(尤其是土传病害)方面发挥着巨大作用,其中研究最多和应用最广的为木霉菌(Trichodermaspp.)[1]。 木霉菌广泛分布于不同生态环境中,以丰富的次生代谢物和强大的竞争能力及重寄生特性实现其生物防治作用,在土壤修复、促进植物生长和控制病害方面发挥着重要作用[2],可作为高效、经济、环保的原材料应用于工业和农业生产[3]。 因其具有生长分布的广泛性、种类株系的适应性、拮抗真菌的广谱性、活性物质的多样性、作用机制的复杂性和对环境的友好性等特点而成为最有应用前途的生防因子[4-6]。
最为常见的木霉菌有哈茨木霉(Trichoderma harzianum)、棘孢木霉(Trichoderma asperellum)、长枝木霉(Trichoderma longibrachiatum)和绿色木霉(Trichoderma viride)等。 哈茨木霉是目前农业生物防治中最具商业化价值的木霉菌,应用广泛;长枝木霉是较为常见的拮抗类木霉,在植病生防中越来越受到重视。 哈茨木霉T22、T39 作为生防产品已登记注册,不仅可以诱导寄主防御基因表达产生抗病性而防治植物病害,还可以促进作物生长进而提高生物量[7-9]。 长枝木霉SMF2 主要通过产生抗菌肽康宁霉素(trichokonins, TKs)而对植物病害产生抑制作用,同时对苦瓜、白三叶草等植物具有明显的促生作用[1,10]。
木霉菌种类不同、菌株不同,其生态适应性也不同。 绿色木霉TR-8、哈茨木霉TH-1 均可在PDA 培养基上正常生长;光照可促进孢子产生,但二者最适生长温度、pH 值等略有不同;微量元素Mn 对TR - 8 菌丝生长有一定的促进作用[11-12]。 生物学特性是研究真菌繁殖条件、发生规律、生态调控等方面的理论基础,对生防菌的科学利用具有指导作用[13]。 本试验通过研究不同培养条件下长枝木霉SMF2 和哈茨木霉T39 的生物学特性,明确其生长繁殖条件,为其人工扩繁和工厂化生产奠定理论基础。
1 材料与方法
1.1 供试材料
供试菌种为长枝木霉(T. longibrachiatum)SMF2 和哈茨木霉(T. harzianum)T39,由聊城大学植物病理实验室提供。
将供试菌种在(25±1) ℃、L ∶D(光照∶黑暗)=12 h ∶12 h 的恒温光照培养箱内采用PDA 培养基培养3 d 后,用打孔器取直径0.7 cm 的菌饼备用。
1.2 试验设计
1.2.1 培养基供试培养基为马铃薯葡萄糖琼脂培养基(PDA:去皮马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L)、察氏培养基(CDA:葡萄糖20 g、KH2PO40.5 g、K2HPO40.6 g、MgSO4·7H2O 0.5 g、NaCl 0.1 g、天门冬酰胺5 g、CaCl20.1 g、琼脂20 g、蒸馏水1 L)、燕麦培养基(OMA:燕麦片40 g、琼脂20 g、蒸馏水1 L)、基础固体培养基(BCM:蛋白胨10 g、牛肉浸膏3 g、K2HPO41 g、NaCl 5 g、琼脂20 g、蒸馏水1 L)、麦芽糖琼脂培养基(MEA:麦芽糖20 g、琼脂20 g、蒸馏水1 L)[15]共5 种。
1.2.2 温度以PDA 培养基为营养源,温度范围5~40 ℃之间,设置5、10、15、20、25、30、35、40 ℃共8个处理。
1.2.3 光照以PDA 培养基为营养源,设置全光照、光暗交替(L ∶D=12 h ∶12 h)、全黑暗3个处理。
1.2.4 pH 值以PDA 培养基为营养源,使用1.0 mol/L HCl 溶液和1.0 mol/L NaOH 溶液调节PDA培养基的pH 值,设pH 值为3、4、5、6、7、8、9、10、11、12 共10个处理。
1.2.5 碳源以CDA 培养基作为基础培养基,用供试碳源等量替换其中的葡萄糖(标准碳),制成不同碳源培养基。 供试碳源选用蔗糖、麦芽糖、乳糖、果糖、海藻糖、阿拉伯糖、可溶性淀粉、微晶纤维素共8 种,并以无碳处理作为空白对照。
1.2.6 氮源以CDA 培养基作为基础培养基,用供试氮源等量替换其中的天门冬酰胺(标准氮),制成不同氮源培养基。 供试氮源选用硫酸铵、氯化铵、硝酸钠、牛肉膏、酵母浸膏、蛋白胨、甘氨酸共7 种,并以无氮处理作为空白对照。
1.3 测定项目及方法
将高压湿热灭菌后的培养基制成平板(直径9 cm),于培养皿内接种木霉菌饼,1 皿1 饼,重复3 次。 研究不同培养基、温度、光照、pH 值、碳源和氮源对SMF2、T39 菌丝生长和产孢量的影响。不同处理分别于(25±1) ℃、L ∶D =12 h ∶12 h 的恒温光照培养箱培养48 h 后,采用十字交叉法测量菌落直径,72 h 后用相机拍照记录培养性状,采用血球计数法计算产孢量[14-15]。
1.4 数据处理与分析
利用Microsoft Excel 2020 处理数据,用Adobe Photoshop 2020 软件处理照片,用DPS 19.05 中的Duncan’s 法进行多组样本间的差异显著性分析。
2 结果与分析
2.1 不同培养基对两种木霉菌丝生长和产孢能力的影响
图1 显示,SMF2、T39 在5 种供试培养基中均可生长,菌丝生长呈辐射状,色素颜色为黄绿色,培养基不同菌丝色素颜色深浅不同。 其中,二者在MEA 培养基上生长均不理想,菌丝稀薄,不产生色素,产孢量小。

图1 不同培养基条件下两种木霉培养结果比较
不同培养基条件下两种木霉菌丝生长速度和产孢量存在差异。 由图2 可知,二者在PDA 培养基上生长状况最好,菌落大、菌丝生长旺盛,产孢量大。 SMF2 菌落直径达7.69 cm,是T39 的1.25倍(表1),产孢量为2.64×1010个/皿;T39 菌落直径为6.16 cm,产孢量为3.86×1010个/皿。 在CDA、OMA、BCM 培养基上,二者生长状况较好,T39 的产孢量是SMF2 的1.27~6.55 倍(表1),且T39 在CDA 上的产孢量高达4.58×1010个/皿。
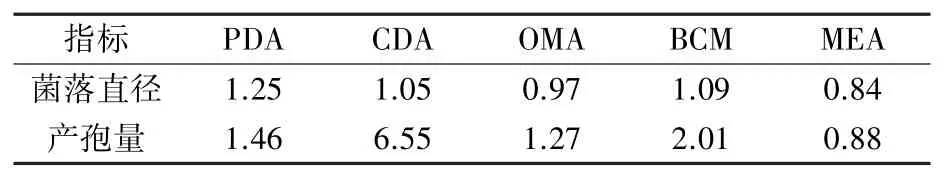
表1 不同培养基下SMF2 与T39生物量的倍数比较
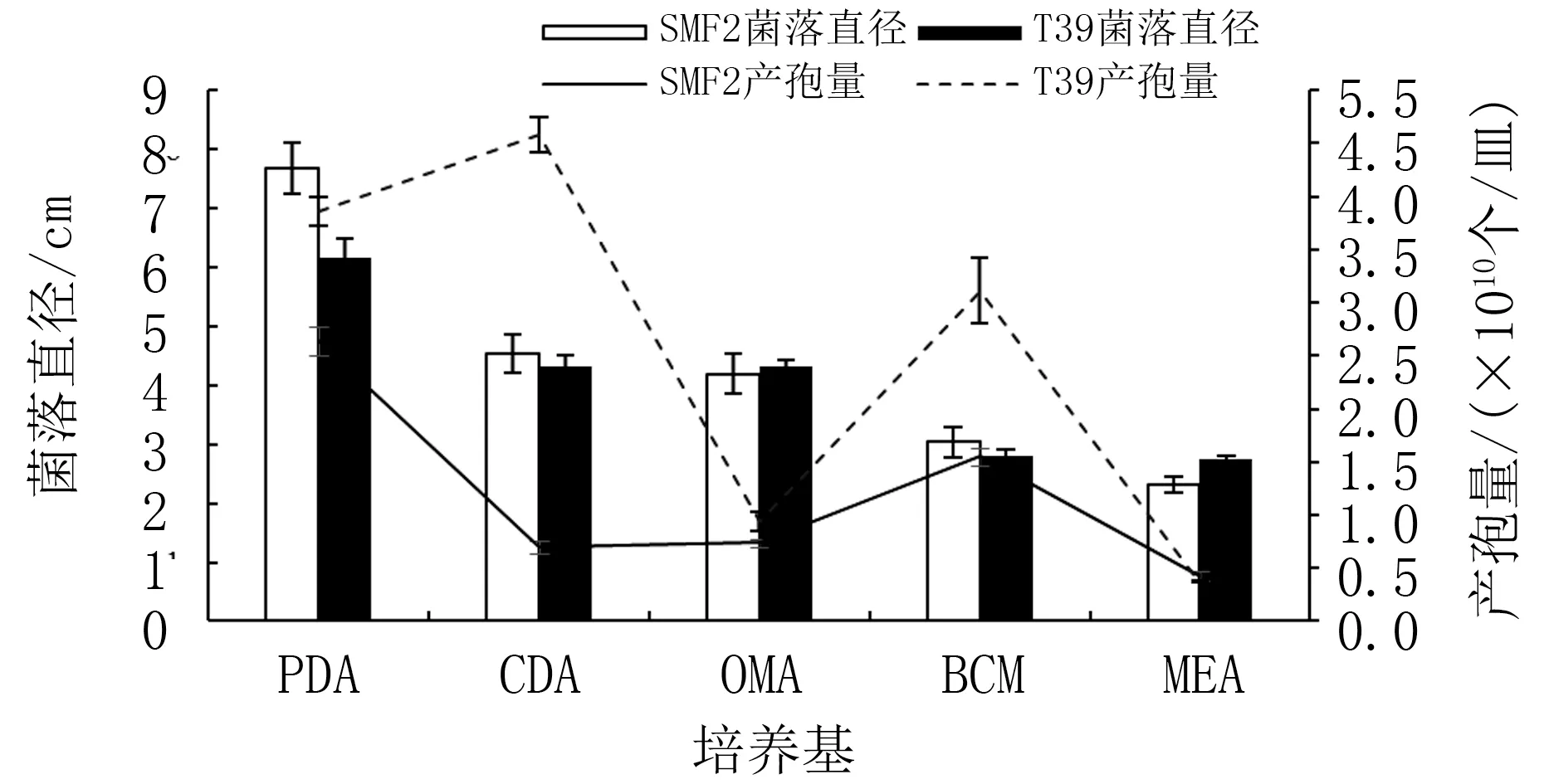
图2 不同培养基对两种木霉菌丝生长和产孢量的影响
综合菌丝生长速度、产孢量和培养性状,PDA为SMF2 菌株生长发育的最佳培养基,CDA 为T39 的最佳培养基。 T39 菌株的产孢能力明显大于SMF2。
2.2 不同温度对两种木霉菌丝生长和产孢能力的影响
由图3 可知,两种木霉在25 ~35 ℃范围内菌丝生长旺盛,呈辐射状,菌落致密,在整个培养基上密布成堆。 当培养温度≤20 ℃或高达40 ℃时,两种木霉生长状况均较差,菌丝稀薄,产孢量少。
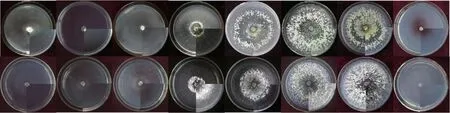
图3 不同温度条件下两种木霉培养结果比较
由图4 可知,供试温度范围内,随着温度升高,两种木霉的菌落直径和产孢量均呈现先升高后降低的变化。 SMF2 的菌落直径和产孢量拐点均出现在35 ℃,菌落直径最大达8.75 cm,是T39的1.29 倍(表2),产孢量最高达61.06×108个/皿;而T39 的菌落直径拐点出现在25 ℃,最大达8.35 cm,产孢量拐点出现在30 ℃,最高达206.46×108个/皿。 5~30 ℃范围内,同一温度下,T39 的产孢能力强于SMF2,前者的产孢量是后者的1.11~23.83 倍(表2);而35~40 ℃时,T39 的产孢能力低于SMF2,后者的产孢量是前者的1.06 ~1.96倍。

表2 不同温度条件下SMF2 与T39生物量的倍数比较
表明两种木霉在最适培养温度上有差异,SMF2 的菌丝生长和产孢最适温度均为35 ℃,T39 的菌丝生长最适温度为25 ~30 ℃,产孢最适温度为30 ℃。 相同温度下T39 产孢量整体较高。
2.3 不同光照对两种木霉菌丝生长和产孢能力的影响
图5 显示,SMF2、T39 在3 种不同光照条件下均能正常生长,菌落致密,菌丝呈辐射状,生长旺盛。 二者在全光照条件下产孢最多,光暗交替条件下次之,全黑暗条件下最少。
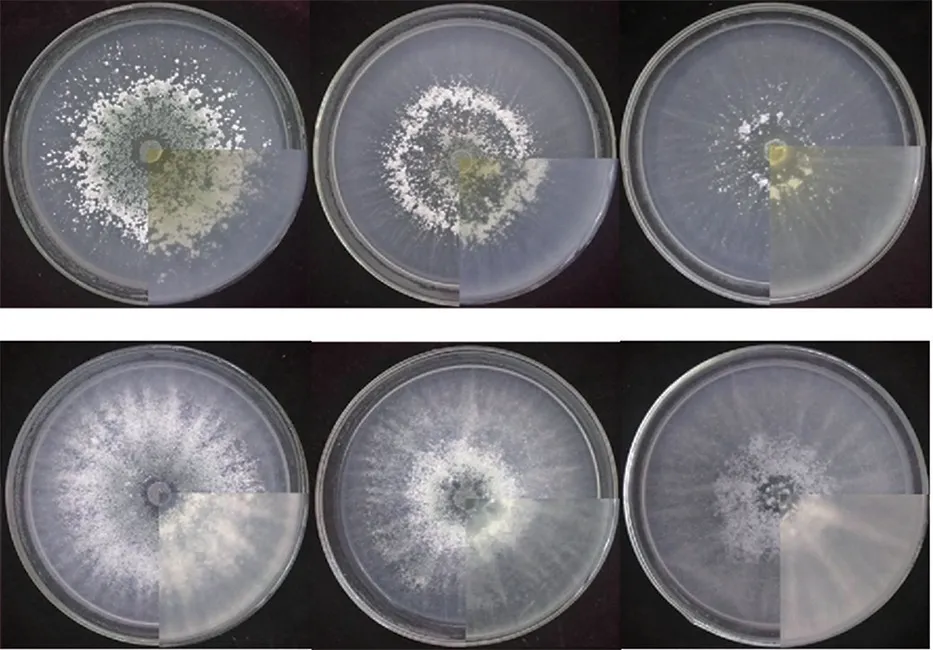
图5 不同光照条件下两种木霉培养结果比较
由图6 可知,不同光照条件下,SMF2、T39 的菌落直径范围分别为6.31 ~8.13、5.75 ~6.67 cm,且菌落直径均在全黑暗条件下达到最大,全光照条件下次之,光暗交替条件下最小。 SMF2 菌丝生长较快,是T39 的1.05~1.22 倍(表3)。
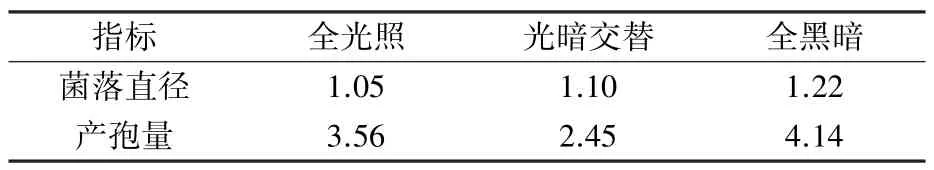
表3 不同光照条件下SMF2 与T39生物量的倍数比较
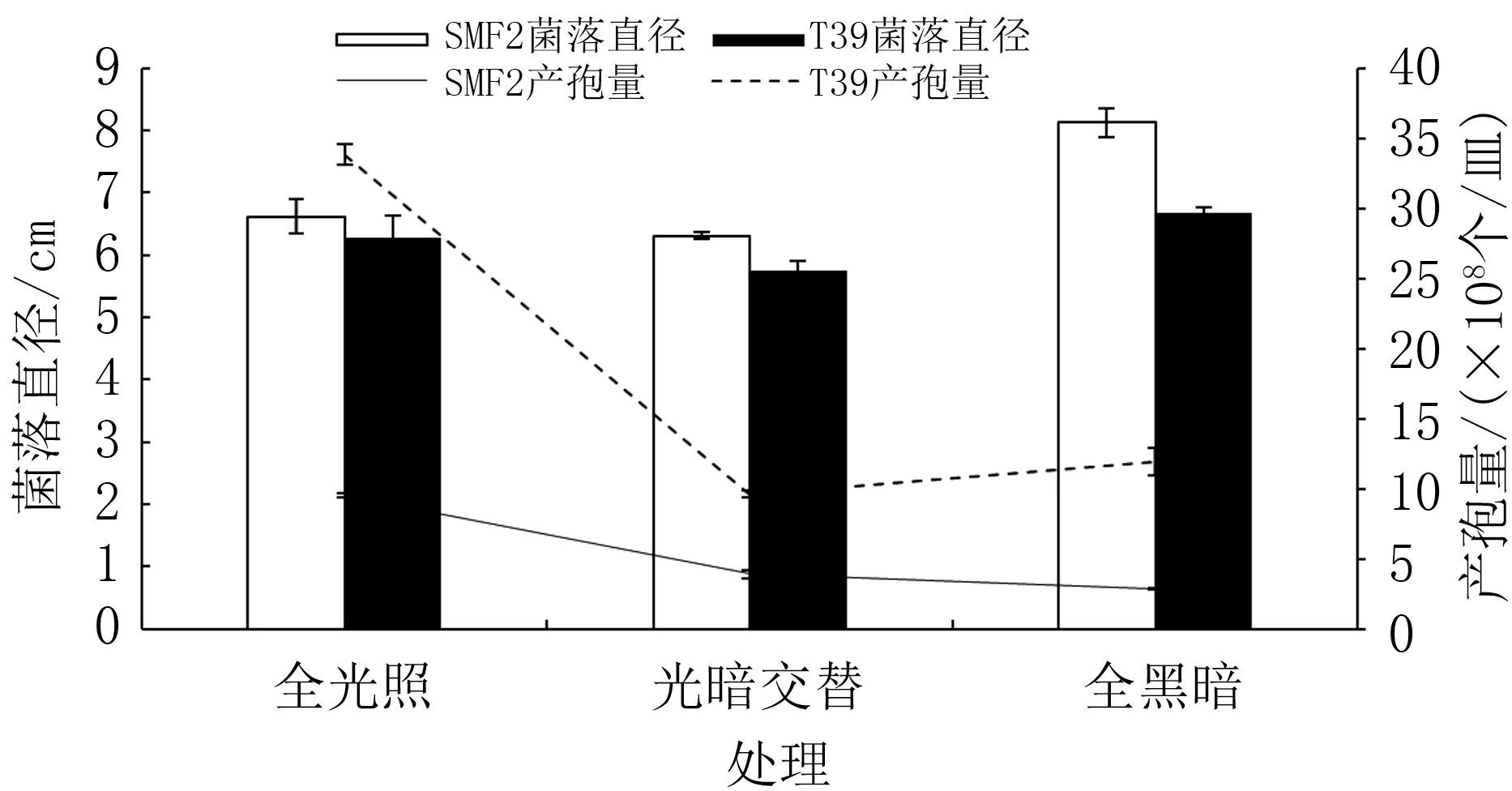
图6 不同光照条件下两种木霉菌丝生长和产孢量比较
T39、SMF2 产孢量均在全光照条件下达到最大,分别为33.83×108、9.50×108个/皿;不同光照条件下,T39 的产孢量为SMF2 的2.45 ~4.14 倍(表3)。 表明光照条件能够有效增加二者的产孢量,且同一光照条件下,T39 产孢量明显高于SMF2。
2.4 不同pH 值对两种木霉菌丝生长和产孢能力的影响
图7 显示,两种木霉在pH 值为4~11 条件下均可生长,菌落相对致密,菌丝生长比较旺盛,孢子均匀密布整个培养基;但极强的酸、碱环境即pH 值为3、12 条件下,二者生长状况较差,pH 值为12 条件下菌丝生长缓慢,菌落较小,产孢量较少;pH 值为3 条件下由于酸性过大,培养基无法凝固,两种菌生长缓慢,产孢极少。
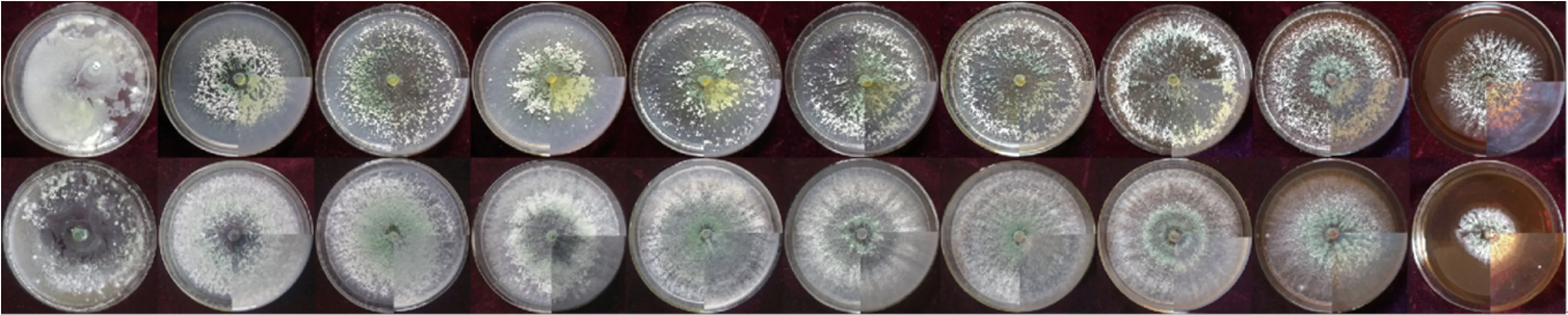
图7 不同pH 值条件下两种木霉培养结果比较
由图8 可知,pH 值为4~11 条件下,SMF2、T39 的菌丝生长和产孢量存在明显差异。 SMF2的菌落直径范围为6.51~8.45 cm,pH 值为9 时菌落直径最大;T39 的菌落直径范围为4.95 ~7.48 cm,pH 值为4 时菌落直径最大,且随pH 值增大整体呈减小趋势。 pH 值为4~5 时,T39 的菌丝生长比较快,其菌落直径是SMF2 的1.07 ~1.15 倍;pH 值为6~11 时,SMF2 的菌丝生长比较快,其菌落直径是T39 的1.17~1.59 倍(表4)。
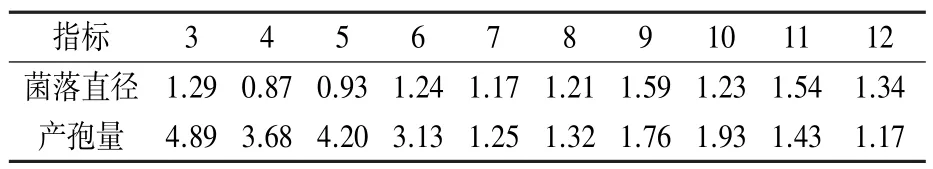
表4 不同pH 值条件下SMF2 与T39生物量的倍数比较
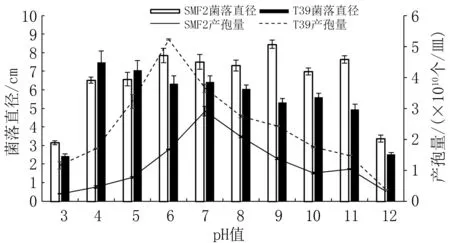
图8 不同pH 值条件下两种木霉菌丝生长和产孢量比较
pH 值为4 ~11 条件下,SMF2 的产孢量为(0.46~2.91)×1010个/皿,pH 值为7 时孢子量最多;T39 的产孢量为(1.48 ~5.22)×1010个/皿,pH值为6 时孢子量最多。 相同pH 值下T39 的产孢量是SMF2 的1.25~4.20 倍(表4)。
表明中性偏碱环境有利于SMF2 的生长和繁殖,其菌丝生长和产孢的最适pH 值分别为9 和7;偏酸条件则更有利于T39 的生长发育,其菌丝生长和产孢的最适pH 值分别为4 和6。
2.5 不同碳源对两种木霉菌丝生长和产孢能力的影响
图9 显示,两种木霉在无碳培养基上可产孢,但产孢量较少、生长较差,菌落直径相对较小,菌丝稀疏;在其他碳源培养基上菌丝生长均较旺盛,产孢量大,呈辐射状,分生孢子密布于菌落上。 不同碳源处理下两种木霉的生长发育状况较无碳对照均明显提高,表明其对碳源的要求不严格,但对单糖(果糖、阿拉伯糖)的利用效果优于双糖(海藻糖、麦芽糖、蔗糖、乳糖)和多糖(可溶性淀粉、微晶纤维素)。 微晶纤维素由于自身溶解性较差,以其为碳源时,菌丝生长和产孢能力不理想,但其生长发育状况仍优于无碳对照。
由图10 可知,无碳条件下,SMF2 和T39 菌落直径均低于5 cm,产孢量不超过1.00×1010个/皿。不同碳源处理下,SMF2 的菌落直径为5.16 ~7.71 cm,产孢量为(0.95 ~1.62)×1010个/皿,分别是无碳培养基的1.06~1.59、2.71~4.63 倍;T39 的菌落直径为4.20 ~5.62 cm,产孢量为(1.56 ~2.50)×1010个/皿,与无碳培养基相比,前者产孢量是后者的1.68~2.69 倍,菌落直径的倍数关系在1.01~1.36 之间,差异较小。 阿拉伯糖为SMF2 和T39菌丝生长的最适碳源,果糖为二者产孢的最佳碳源。
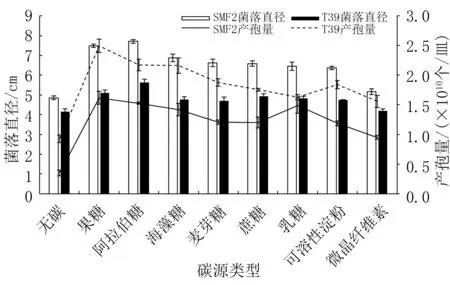
图10 不同碳源条件下两种木霉菌丝生长和产孢量比较
由表5 可知,不同碳源条件下,SMF2 的菌丝生长较快,菌落直径是T39 的1.23 ~1.47 倍;T39的产孢能力明显大于SMF2,前者是后者的1.10 ~1.64 倍。

表5 不同碳源条件下SMF2 与T39 生物量的倍数比较
2.6 不同氮源对两种木霉菌丝生长和产孢能力的影响
图11 显示,无氮条件下,两种木霉的孢子肉眼几乎不可见。 相比较无氮对照,两种木霉在以蛋白胨、酵母浸膏、牛肉膏、甘氨酸为氮源的培养基上生长良好,菌丝致密,产孢量较多;而在其他氮源培养基中,菌丝稀薄,产孢量少,生长、产孢均不理想。
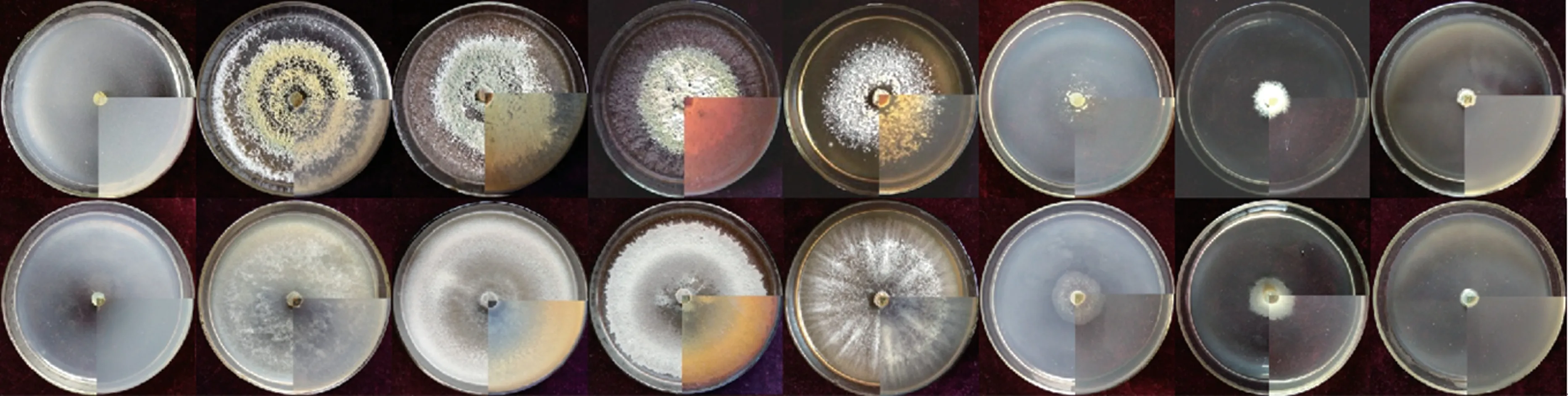
图11 不同氮源条件下两种木霉培养结果比较
由图12 可知,不同氮源条件下两种木霉的菌丝生长差异明显。 在以有机氮(蛋白胨、牛肉膏、酵母浸膏)、氨基酸态氮(甘氨酸)为氮源的培养基上生长速率均快于铵态氮(硫酸铵、氯化铵)和硝态氮(硝酸钠)。 在有机氮、氨基酸态氮为氮源的培养基上菌落直径为4.28 ~7.69 cm,在其他氮源培养基上的菌落直径仅为0.92 ~1.87 cm。 其中,SMF2 在有机氮、氮基酸态氮、硝态氮为氮源的培养基上菌落直径大于T39,前者是后者的1.03~1.39 倍(表6)。

表6 不同氮源条件下SMF2 与T39 生物量的倍数比较
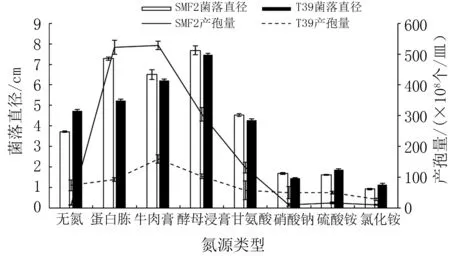
图12 不同氮源条件下两种木霉菌丝生长和产孢量比较
无氮条件下,SMF2 和T39 的菌落直径分别为3.72、4.72 cm,产孢量为9.17×108、73.75×108个/皿。不同有机氮源条件下,SMF2 产孢量达到(304.38~528.33) ×108个/皿,T39 产孢量达到(91.88~159.38)×108个/皿,SMF2 的产孢量是T39的2.94~5.69 倍;而以硝态氮和铵态氮为氮源时,T39 的产孢能力增强,其产孢量是SMF2 的2.73 ~4.68倍(表6)。
添加有机氮源培养基的SMF2 和T39 菌落直径、产孢量分别是无氮源添加的1.11 ~2.07、1.25 ~57.64倍。 且两种木霉的菌落直径和产孢量均在有机氮源培养基中达到最大值,其菌落直径和产孢量的最佳氮源分别为酵母浸膏和牛肉膏,表明二者对有机氮源的利用情况优于其他氮源。
3 讨论
培养基、温度、光照、酸碱度、碳源和氮源均对木霉菌的菌丝生长和孢子形成有不同影响。
3.1 不同培养基对两种菌培养的影响
培养基是微生物学研究和微生物发酵工业的基础,其营养组成直接影响微生物生长发育。 目前培养木霉菌常用的培养基有PDA、CDA、MEA、PSA、糖浆培养基、玉米粉葡萄糖培养基、小麦汁培养基和玉米培养基[16]等。 马铃薯是PDA 的重要组分,含有丰富的B 族维生素、纤维素、微量元素、氨基酸、蛋白质、脂肪和优质淀粉等营养元素,为微生物生长提供充裕碳源、氮源、维生素和无机盐;葡萄糖是活细胞的能量来源和新陈代谢的中间产物,能够提供优质碳源。 CDA 中葡萄糖和天门冬酰胺为重要的碳源、氮源,含量较高的氯化钠具有抑制细菌和减缓毛霉生长的作用,其他成分则提供必需离子;OMA 中的燕麦含有丰富的蛋白质、脂肪、淀粉、微量元素和膳食纤维,是氮源、碳源和微量元素等的重要来源;BCM 中的牛肉膏和蛋白胨为碳源、氮源、磷酸盐和维生素的主要来源,氯化钠则提供无机盐。
有研究表明,长枝木霉T05 在PDA、MEA、CDA、BCM 上都能生长,且菌丝在PDA 上生长最快[17];哈茨木霉TH-1 分别在PDA、MEA、CDA、BCM 上培养均能产孢,其中PDA 为最适培养基[12]。 本试验中PDA、CDA、OMA、BCM 四种培养基因营养成分丰富,成为SMF2 和T39 菌丝生长及孢子繁殖的适宜培养基,以PDA 和CDA 最佳,而MEA 培养基成分单一,除凝固剂琼脂外,仅含有麦芽糖,故两种木霉在其上生长发育不理想。这与前人研究结果大体一致,进一步证明木霉菌株对营养环境的广泛适应性。
3.2 不同温度对两种菌培养的影响
木霉菌是一种嗜温真菌,棘孢木霉PZ6 在15~37 ℃均能生长,25~37 ℃菌丝生长较好,以30 ℃菌丝生长最快[16];长枝木霉HQ1、非洲哈茨木霉BB12 菌株适宜培养温度为28 ~33 ℃[18]。 本试验中T39、SMF2 在25 ~35 ℃范围内生长发育良好;在高温(40 ℃)或低温(20 ℃及以下)环境条件下,由于没有达到木霉菌生长发育的起点温度或有效积温积累不足,或者环境温度过高导致菌体内蛋白质、核酸等重要组成物质遭受不可逆的破坏,致使其生长较差。
3.3 不同光照对两种菌培养的影响
光为木霉菌菌丝生长和孢子形成提供能量。光照对哈茨木霉TH-1 菌丝生长影响不大但明显影响菌株产孢量,光照时间越长产孢量越大[12];全黑暗条件有利于长枝木霉GAAS L3-1-0.8 菌丝的营养生长,而光暗交替条件则对产孢有利[19],即光照可以促进分生孢子产生。 本试验中T39、SMF2 在全光照、光暗交替、全黑暗3 种条件下均可正常生长,全黑暗条件对菌丝生长更为有利,而全光照条件对产孢更有利。 这与前人的研究结果相吻合,且相同光照条件下,长枝木霉SMF2 菌丝生长较快,而哈茨木霉T39 产孢量更大。
3.4 不同pH 值对两种菌培养的影响
pH 值不仅通过影响真菌体内的酶活性而影响酶促反应效率,而且还通过影响膜结构稳定性和细胞质膜的通透性而影响其对营养物质的吸收。 有研究表明,棘孢木霉PZ6 最适生长和产孢的pH 值为5 ~9[16];哈茨木霉Th-81、短密木霉(T. brevicompactum)Tb-50 和长枝木霉T1-70 在pH 值为2 ~7 时均能生长,最适生长的pH 值为4[20]。 本试验中,T39、SMF2 对酸碱度的适应性较强、范围较广,在pH 值为4 ~11 条件下均生长较好,且中性至弱碱性(pH 值7~9)为SMF2 培养的最佳酸碱条件,其菌丝生长、产孢最适pH 值分别为9 和7;T39 培养的最佳酸碱条件为弱酸和偏酸(pH 值4~6),其菌丝生长、产孢最适pH 值分别为4 和6。
3.5 不同碳源对两种菌培养的影响
碳源物质是真菌生长的碳素来源。 木霉菌对单糖、双糖、多糖、嘌呤、嘧啶和氨基酸等的利用效果均较好[21]。 不同木霉菌其最适碳源有所差异,长枝木霉GAAS L3-1-0.8 以葡萄糖、麦芽糖、果糖和乳糖为碳源时,菌丝生长和产孢较好,葡萄糖为最适碳源[19];木糖、果糖和蔗糖有利于哈茨木霉T21 的菌丝生长和产孢,木糖为最适碳源[22]。本试验中,SMF2 和T39 在无碳源添加的培养基中虽能生长,但其菌丝质量和产孢量均不理想。碳源的加入提供了必要的营养物质,提升其生长发育质量。 微晶纤维素主要成分为以β-1,4-葡萄糖苷键结合的直链式多糖类物质,由于自身不易溶解致使碳源的促生作用较差。 单糖(果糖、阿拉伯糖)补充热能的效果比双糖、多糖更快,故以果糖和阿拉伯糖为碳源时SMF2 和T39 的生长发育最优,且SMF2 的菌丝生长优于T39,但T39的产孢能力更强,这可为二者混合使用以防治病害提供理论基础。
3.6 不同氮源对两种菌培养的影响
氮源是真菌生长的重要氮素来源,主要用于合成蛋白质等含氮物质,有助于产孢。 有机氮源像蛋白胨、牛肉膏和酵母浸膏等成分复杂、营养丰富,微生物在其培养基中常表现出生长旺盛、菌体增长迅速等特点。 有研究表明,蛋白胨和酵母膏分别为长枝木霉T05 和GAAS L3-1-0.8 营养生长和产孢的最适氮源[17,19],哈茨木霉T21 在以牛肉膏为氮源的培养基中菌丝生长和产孢最优[22]。氨基酸态氮(甘氨酸)存在于土壤蛋白质和多肽类化合物中,降解后只释放出相应的氨基酸为微生物生长发育提供单一营养;硝态氮和铵态氮为无机氮源(硫酸铵、氯化铵、硝酸钠),易被菌体直接利用,促进菌体生长,但与有机氮源相比,因其成分简单、缺乏营养物质、利用效率低致使木霉菌菌丝稀薄、产孢量较少。 因此,相比于氨基酸态氮、硝态氮和铵态氮,SMF2 和T39 在以有机氮(蛋白胨、牛肉膏、酵母浸膏)为氮源的培养基中生长发育更优,有机氮源为SMF2 和T39 生长发育的适宜氮源,这与前人的研究结果一致。 且SMF2 和T39 对氮源的要求相较于碳源而言更严格。
4 结论
本研究结果表明,SMF2 和T39 具有广泛的适应性,对环境条件要求不严格,在常温、黑暗、非强酸强碱、含有碳源和有机氮源的条件下,二者的菌丝生长和孢子形成状况均较为优良。 光照、果糖、牛肉膏更有利于二者孢子形成;PDA 和CDA最适宜产孢;且二者对氮源的要求相较于碳源而言更严格,两种木霉在无碳条件下可产孢,但产孢量较少,而在无氮条件下孢子肉眼几乎不可见。SMF2 和T39 在添加碳源培养基中的菌落直径、产孢量是无碳源添加的1.01 ~1.59、1.68 ~4.63倍,而在添加有机氮源培养基中的菌落直径、产孢量是无氮源添加的1.11~2.07、1.25~57.64 倍。
相同条件下,SMF2 菌丝生长较快,而哈茨木霉T39 产孢能力更高。 35 ℃、pH 值为7 时最利于SMF2 产孢,而30 ℃、pH 值为6 时最利于T39产孢。 人工扩繁时,可通过调节环境温度和培养基酸碱度调控SMF2、T39 的产孢情况;有机氮和单糖更有利于SMF2 和T39 菌丝生长和孢子形成。
