球孢白僵菌与哈茨木霉对玉米苗期促生抗逆的影响
2023-09-13李子正蔡廷阳李元鑫杨婧张蕾蕾燕志翔褚鹏飞孟维伟王旭清
李子正蔡廷阳李元鑫杨婧张蕾蕾燕志翔褚鹏飞孟维伟王旭清
(1. 聊城大学农学与农业工程学院,山东聊城 252000;2. 山东省农业科学院作物研究所,山东济南 250100)
玉米(Zea maysL.)作为我国三大主粮作物之一,广泛种植于我国北方地区,产量已超过稻谷、小麦[1]。 玉米生长除遭受干旱、高温及土壤营养不足等非生物胁迫外,病虫害也是影响玉米产量形成的重要因素[2]。 近年来,随着玉米单产和种植面积增加,化肥和化学农药用量逐年升高,加剧了土壤营养流失和微生物多样性丧失,导致植食性害虫抗药性增加[3]。 因此,人们陆续实施可持续粮食生产系统行动和战略,如有害生物综合管理(IPM)和发展有机农业等[4-5],其中一项重要措施是生物防治剂(BCAs)的应用,即基于微生物及其代谢产物控制病虫害对作物的危害,增强植物对非生物胁迫的“免疫力”和促进作物生长等[6-7]。
哈茨木霉(Trichoderma harzianum)作为木霉属最常见的菌种,广泛存在于土壤、植物残体及根际等[8]。 有研究表明其在植物体内的定殖可以发挥防治植物病原菌和促进植物生长的双重作用[9-10],一些哈茨木霉菌株的定殖可通过直接作用或间接诱导植物防御机制来抵御害虫的危害[11]。 亦有研究证实,某些昆虫病原真菌[如球孢白僵菌(Beauveria basssiana)]可通过人工接种的方式定殖于多种作物体内(如玉米、小麦、高粱等)[12-13],并作为内生菌以直接或间接的方式提高植物对病虫害[14-15]或干旱等不良环境[16]的抗性,还可改善植物对养分的吸收,刺激生长类激素产生,促进植物生长[17]。
目前,生物防治剂的研发从单一有益菌的使用逐渐转向多菌种联合应用,以发挥对植物更积极的影响[18]。 Shrivastava 等[19]研究指出,丛植菌根(AMF)与球孢白僵菌联合施用条件下,番茄植株部分萜类物质(如单萜、倍半萜、新单萜)含量显著增加,甜菜夜蛾危害显著减少。 Farias 等[20]研究发现,淡紫拟青霉、球孢白僵菌、金龟子绿僵菌、厚垣普奇尼亚菌、棘孢木霉5 种菌株联合施用显著促进大豆和玉米生长。 Batool 等[21]研究指出,球孢白僵菌与棘孢木霉联合处理种子的玉米株高、产量显著增加,同时有效降低了亚洲玉米螟的危害,植株体内的过氧化物酶和过氧化氢酶等防御酶活性以及脯氨酸含量提高,且与茉莉酸-乙烯信号通路及抗氧化酶相关的基因表达量增加。
本研究分析球孢白僵菌与哈茨木霉单独或联合土壤施用条件下玉米苗期干物质积累量、农艺性状、光合特性和抗性相关酶活性的变化规律,旨在探明两种生防真菌对玉米苗期生长的影响及其诱导玉米植株抗性的协同效应,以期为球孢白僵菌与哈茨木霉在农业生产中的联合施用提供理论依据。
1 材料与方法
1.1 试验材料
本研究使用的球孢白僵菌菌株购于中国农业微生物菌种保藏中心,该菌株来源于吉林省农业科学院,菌种保存号为ACCC No. 30110;哈茨木霉菌株由德国哥廷根大学植物保护系提供,菌株号为T39。 供试玉米品种为黄淮海地区广泛种植的郑单958。
1.2 试验设计与方法
1.2.1 试验设计试验共设置4个处理:CK(无菌水施用土壤)、BB(球孢白僵菌孢悬液施用土壤)、TH(哈茨木霉孢悬液施用土壤)和BB+TH(球孢白僵菌与哈茨木霉孢悬液联合施用土壤)。
1.2.2 孢子悬浮液的制备将球孢白僵菌孢子粉接种至PDA(potato dextrose agar)培养基培养21 d,刮去孢子粉并用无菌水(含0.1% Tween80)混匀,通过内置脱脂棉的灭菌注射器过滤残渣,置于磁力搅拌器上充分振荡混匀15 min 后,使用Neubauer 血细胞计数板计算孢子数量。 接种前将孢子悬浮液调整至1 × 108conidia/mL 备用。 在PDA 培养基上进行孢子萌发试验,萌发率达到90%以上方可使用。 哈茨木霉孢悬液制备同球孢白僵菌的方法,接种前将孢子悬浮液调整至1 ×107conidia/mL 备用。
1.2.3 玉米种植及菌株接种玉米种子消毒参考Akello 等[22]的方法,略有改动。 种子在70%乙醇中表面消毒3 min,1.5%次氯酸钠表面消毒3 min,然后用无菌水冲洗3 次。 吸取100 μL 冲洗水在PDA 培养基上培养,进行消毒效果评价。
将泥炭土与蛭石按照2∶1 的比例混匀后装入塑料花盆(15 cm×15 cm×20 cm)。 每盆种两粒玉米种。 温室条件(25 ℃±1 ℃,每天光照14 h、黑暗10 h,相对湿度75%)下生长至三叶一心,分别于幼苗根际附近均匀施入孢子悬浮液10 mL,连续2 d 各施用1 次,第2 次施用的第2 天开始记录接种天数。 随后将玉米放在温室条件下生长。所有花盆每周浇水施肥1 次,以保证幼苗正常生长发育。
1.3 测定项目及方法
1.3.1 不同菌株在玉米植株内的定殖率接种后10、20、30 d,每个处理选取5 株玉米的根、茎、叶分别进行测定。 根、茎、叶清洗后分别用1.5%次氯酸钠表面消毒3 min,再用70%乙醇表面消毒3 min,用100 μL 无菌水冲洗3 次[23]后在无菌滤纸上干燥。 将已消毒处理的根、茎和叶切成约0.5 cm2的小块放入PDA 培养基上,每个培养皿放置同一植株同一器官的9 份样品,(25±2) ℃避光培养21 d,定期观察真菌生长情况。 最后冲洗的100 μL 无菌水在选择性培养基上培养2 周,用以检测是否有菌丝生长,确定消毒效果[23]。 根据公式计算定殖率:定殖率=生长菌丝的样品数/样品总数[24]。 每处理重复5 次。
1.3.2 玉米生长指标接种后10、20、30 d,每处理选玉米5 株,使用SPAD-502Plus 叶绿素仪(日本KONICA MINOLTA 公司)测定叶片SPAD 值;挖取玉米整株,测量株高、茎粗、最大叶长和叶宽,统计叶片数;将其地上部和地下部分别装入纸袋,75 ℃烘干后称重,计算干物质积累量和根冠比。
1.3.3 玉米叶片光合特征参数接种后第3 天和第7 天选取完全展开的功能叶,用便携式光合仪(CIRAS-2,美国汉莎科学仪器有限公司)测定功能叶净光合速率(Pn)和气孔导度(Gs)。
1.3.4 玉米叶片光合色素含量和生理指标接种后第3 天和第7 天选取完全展开的功能叶,取样后立即用液氮冷冻,在-80℃超低温冰箱中保存。 采用分光光度计法测定玉米叶片光合色素含量[25],分别在470、645、663 nm 处测定吸光度。采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,采用紫外吸收法测定过氧化氢酶(CAT)活性,采用愈创木酚法测定过氧化物酶(POD)活性,分别在560、240、470 nm 测定吸光度[26]。 每个指标重复测定5 次。
1.4 数据处理与分析
采用SPSS 23.0 软件进行单因素方差分析(one-way ANOVA),通过Duncan’s 法进行多重比较,采用GraphPad Prism8 软件进行绘图。
2 结果与分析
2.1 不同处理下玉米植株不同部位真菌定殖率分析
由表1 可知,与CK 比较,不同采样时期玉米各器官均有一定比例的菌定殖。 BB 处理条件下,接种后10 d,茎和根中的菌定殖率达到最高,分别为51.00%和37.60%,根、茎、叶中的菌定殖率表现为茎>根>叶;接种后20 d,叶中的菌定殖率达到最高,为31.00%。 TH 处理条件下,根、茎、叶中的菌定殖率均在接种后10 d 达到最高,分别为84.60%、28.60%、13.20%。 BB+TH 处理下根、茎、叶中的菌定殖率均在接种后10 d 达到最高,分别为82.40%、75.60%、39.80%。
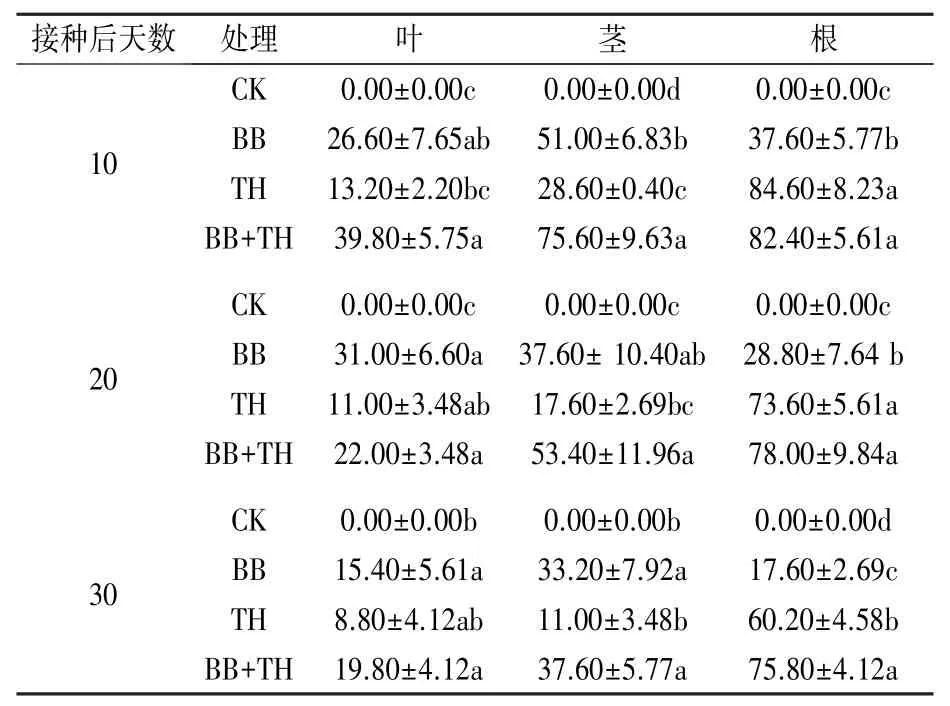
表1 不同处理玉米植株不同部位真菌定殖率 %
2.2 不同处理对玉米苗期生长指标的影响
2.2.1 对苗期干物质积累的影响由表2 可知,球孢白僵菌和哈茨木霉单独或联合土壤施用条件下,3个采样时期玉米植株地上部干重、根干重和总生物量较CK 均有一定增加。 其中,BB+TH 处理下3个采样时期的地上部干重、根干重和总生物量均最高。 接种后30 d,地上部干重、植株总生物量处理间差异显著,均表现为BB+TH >TH >BB>CK。 接种后10 d 时BB 处理的根冠比显著低于CK,接种后30 d 时TH 和BB+TH 处理的根冠比显著低于CK,其余时期各处理间差异不显著。

表2 不同处理玉米苗期单株干物质积累量
2.2.2 对苗期农艺性状及SPAD 值的影响接种后10 d,各处理的株高、茎粗及最大叶宽和叶长变化规律一致,均表现为BB+TH >TH >BB >CK。BB+TH 处理的株高、茎粗、最大叶长和叶宽较CK分别显著增加15.08%、10.59%、9.43%、4.85%(图1A~D);各处理间叶片数无显著差异(图1E);BB+TH、TH、BB 处理的叶片SPAD 值均显著高于CK,BB+TH 与TH 和BB 处理间差异显著,TH 与BB 处理间差异不显著(图1F)。

图1 不同处理下玉米苗期农艺性状及SPAD 值
接种后20 d,各处理的株高和茎粗变化规律一致,均表现为BB+TH>TH>BB>CK。 BB+TH 处理的株高和茎粗较CK 分别显著增加13.88%和12.70%(图1A、B)。 各处理的最大叶宽、最大叶长、叶片数和叶片SPAD 值变化规律一致,均表现为BB+TH>BB>TH>CK。 BB+TH 处理的最大叶长、最大叶宽和叶片SPAD 值较CK 分别显著增加17.71%、4.34%和8.82%。 各处理间叶片数无显著差异。 BB+TH、TH、BB 处理的叶片SPAD 值均显著高于CK;BB+TH、TH 处理间差异显著,但与BB 处理间差异均未达显著水平(图1C~F)。
接种后30 d,BB+TH、TH、BB 处理的株高和茎粗均显著高于CK,BB+TH 处理的株高和茎粗较CK 分别显著增加12.52%、14.38%(图1A、B)。BB 和BB+TH 处理的最大叶长和最大叶宽均显著高于CK,BB+TH 处理的最大叶长和最大叶宽较CK 分别显著增加9.14%和15.96%,BB 处理则较CK 分别显著增加4.84%和8.45%(图1C、D)。各处理间叶片数无显著差异(图1E)。 BB+TH、TH、BB 处理的叶片SPAD 值均显著高于CK,其中,BB+TH 处理较CK 显著增加9.11%,且显著高于BB 和TH 处理,BB 与TH 处理间差异不显著(图1F)。
上述结果表明,单独或联合施用球孢白僵菌和哈茨木霉,玉米植株的农艺性状指标及SPAD值均有一定程度增加,以联合施用效果最好。
2.3 不同处理对玉米叶片净光合速率、气孔导度的影响
图2 显示,与CK 相比,各处理接种后第3 天和第7 天的叶片净光合速率和气孔导度均有一定增加,以BB+TH 处理的提升幅度最大。

图2 不同处理玉米叶片净光合速率、气孔导度
接种后3 d,各处理间叶片的净光合速率和气孔导度无显著差异;接种后7 d,BB、BB+TH 处理的净光合速率分别较CK 显著提高6.39%、9.18%,BB+TH 处理的气孔导度较CK 显著提高14.14%。
表明单独或联合接种球孢白僵菌和哈茨木霉均能提高玉米叶片净光合速率,增加气孔导度,进而提高光合产物形成,促进玉米生长。
2.4 不同处理对玉米叶片光合色素含量的影响
与CK 相比,BB、TH 和BB+TH 处理接种后第3 天和第7 天玉米叶片光合色素含量均有一定程度的增加(图3)。

图3 不同处理玉米叶片光合色素含量
接种后3 d,BB、BB+TH 处理叶绿素a 和叶绿素a+b 含量分别较CK 显著提高6.34%、6.82%和5.98%、6.46%,TH 处理与CK 无显著差异;各处理的叶绿素b 和类胡萝卜素含量与CK 均无显著差异。
接种后7 d,BB、TH、BB+TH 处理叶片叶绿素a、b 含量分别较CK 显著提高7.64%、10.86%、10.26%和4.97%、9.00%、7.28%;BB、TH、BB+TH处理的叶绿素a+b 和类胡萝卜素含量分别较CK显著提高6. 98%、10. 40%、9. 51% 和8. 12%、12.33%、9.55%。
上述结果表明单独或联合施用球孢白僵菌和哈茨木霉均能增加玉米幼苗在接种初期的叶片叶绿素含量,为光合能力的提升和后期生长发育提供有力条件。
2.5 不同处理对玉米叶片抗性相关酶活性的影响
图4显示,各处理接种后第3 天和第7 天的CAT、SOD 和POD 活性均较CK 有所提高,部分处理间差异显著。
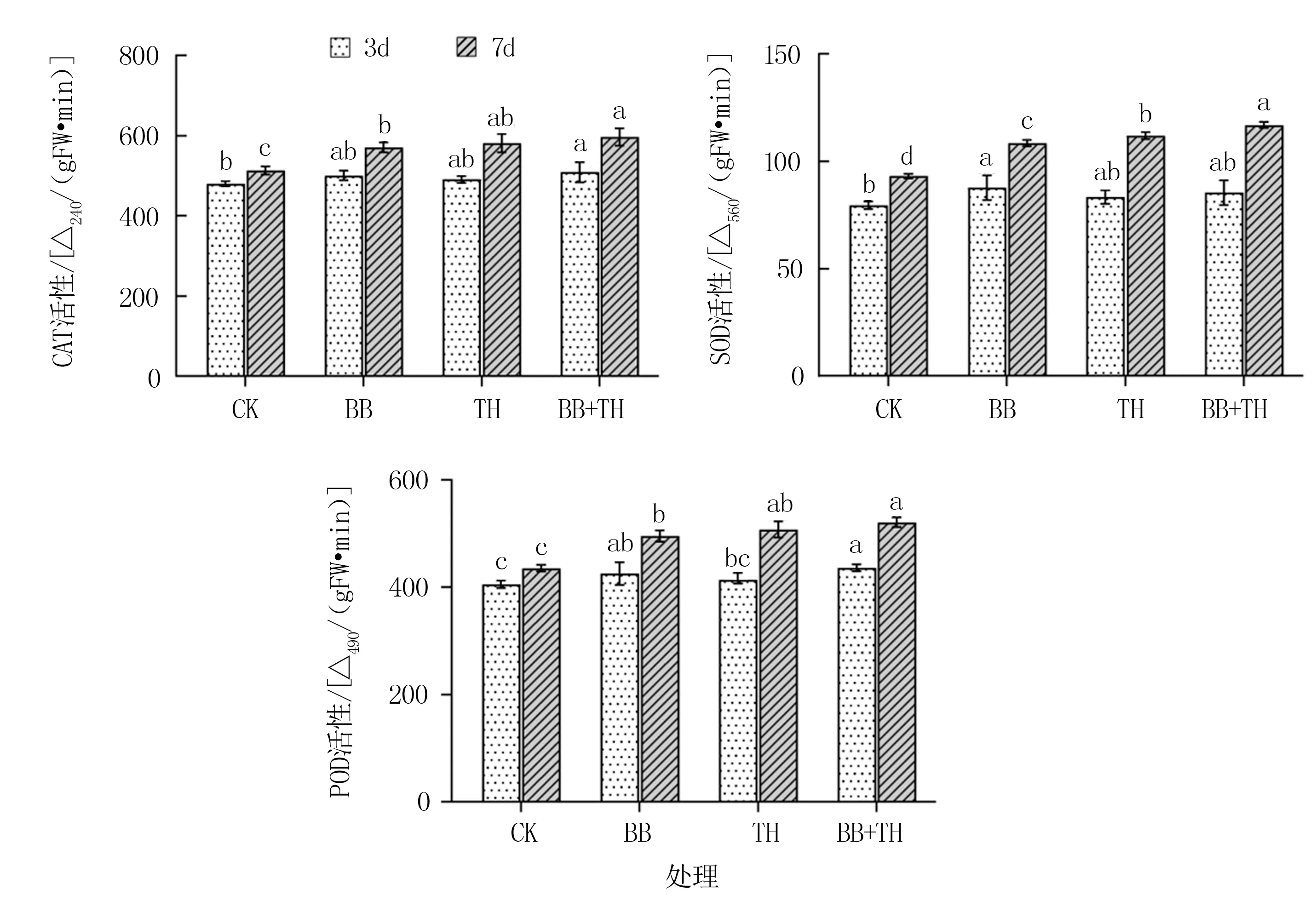
图4 不同处理玉米叶片抗性相关酶活性
接种后3 d,BB+TH 处理叶片CAT 活性较CK 显著提高6.02%;BB 处理叶片SOD 活性较CK显著提高10.37%。 BB 和BB+TH 处理叶片POD活性分别较CK 显著提高4.93%和7.67%。
接种后7 d,BB、TH、BB+TH 处理叶片CAT、SOD、POD 活性均显著高于CK,处理间表现为BB+TH>TH>BB>CK。 BB+TH 处理叶片CAT、SOD、POD活性较CK 分别显著提高16.23%、25.49%、19.64%;TH 处理叶片CAT、SOD、POD 活性较CK 分别显著提高13.20%、20.22%、16.58%;BB 处理叶片CAT、SOD、POD活性较CK 分别显著提高11.26%、16.41%、13.78%。
表明真菌单独或联合接种初期玉米抗性相关酶活性提高,使玉米产生诱导性系统抗性,从而减轻外界不良因素对玉米幼苗的伤害。
3 讨论与结论
Wei 等[27]发现在土壤施用条件下能够检测到球孢白僵菌在番茄植株根、茎、叶中的定殖且定殖率较浸种处理高。 Jaber 等[28]研究指出,球孢白僵菌土壤施用后其在甜椒茎和根内的定殖率最高且较为稳定。 影响内生生防真菌在玉米中定殖的因素有很多,包括栽培介质、接种方法、表面活性剂特性、菌株种类等[29]。 Batool 等[21]研究发现,球孢白僵菌与棘孢木霉联合土壤施用下能够从根部传播至叶片。 本研究同样发现球孢白僵菌和哈茨木霉联合土壤施用下,能够从根部转移至叶片内,且在玉米植株不同部位均检测到其定殖。此外,本试验条件下,两种真菌均能在玉米植株内定殖,单独施用时哈茨木霉更易在根部定殖,而球孢白僵菌在茎内的定殖率更高。 当两种真菌联合施用时,两者在根部和茎部均有较高的定殖率。
前人研究证实球孢白僵菌和哈茨木霉单独施用均具有促进植物生长的作用。 Gonzalez-Guzman等[30]研究表明,土壤施用球孢白僵菌能显著增加小麦总根长和茎伸长阶段的根表面积以及细根的根长和根表面积。 Pachoute 等[31]研究发现球孢白僵菌在土壤施用条件下显著提高豇豆植株的株高、叶片数和生物量,其叶片气孔导度、蒸腾速率、CO2同化率以及叶绿素a+b 含量亦显著升高。Shukla 等[32]指出,哈茨木霉在水稻根部的定殖促进根系生长。 齐素敏等[33]发现哈茨木霉根部定殖能够显著增加草莓植株的生物量、产量和叶绿素含量。 Batool 等[21]研究发现,球孢白僵菌和棘孢木霉联合施用较两种生防真菌单独施用更有利于促进玉米生长和产量形成。 本试验表明土壤施用条件下,球孢白僵菌和哈茨木霉单独施用均能促进玉米地上部和地下部生长,叶绿素含量亦增加,且两种真菌联合施用对玉米幼苗生长发育的促进效果更显著,但其协同机制尚需进一步研究。
有研究指出,生防真菌的定殖能够诱导植物自身诱导系统性抗性和获得系统性抗性,以提高其对病虫害等不良外界环境的适应能力:Tomilova 等[34]通过浸根的方式分别将球孢白僵菌和罗伯茨绿僵菌接种到马铃薯体内,发现球孢白僵菌浸根处理植株的SOD 活性和POD 活性有一定程度的增加;费泓强等[35]研究表明,球孢白僵菌的定殖能够增加玉米幼苗POD、SOD、CAT、PAL、PPO 活性,有利于提高玉米幼苗抗逆性;许绍欢等[36]研究发现球孢白僵菌和摩西球囊霉菌混合接种能够显著提高成熟期烟草植株的CAT、POD、SOD 活性,进而提高其抗逆性。 本试验结果表明,球孢白僵菌的定殖可增加CAT、SOD、POD 活性,从而提高植株的抗逆性,且球孢白僵菌和哈茨木霉联合接种处理叶片的酶活性均最高。
球孢白僵菌和哈茨木霉作为农林业生产中常见的昆虫病原真菌和病原拮抗真菌,探明两种真菌使用的最佳方式和浓度,能够减少化学肥料和农药的施用,不仅提高生产者的农业收入,而且还促进农林业的可持续发展。 本试验条件下,哈茨木霉和球孢白僵菌联合土壤施用(BB+TH)时,其在玉米植株不同部位的定殖率明显高于其他处理,且在根部的定殖率最高;BB+TH 处理下3个采样时期的地上部干重、根干重和总生物量均最高,植株农艺性状及叶片SPAD 值表现最优,明显提高叶片叶绿素含量,提高玉米叶片净光合速率,增加气孔导度;联合施用处理叶片CAT、SOD、POD 活性显著高于CK 和单球孢白僵菌处理(BB),较CK 分别显著提高16.23%、25.49%、19.64%。 本研究结果可为两种有益微生物的联合施用提供理论参考。
