晚期肝癌免疫相关治疗的获益和不良反应临床研究
2023-09-12刘小梅钟梅刘浩易军王洪云
刘小梅 钟梅 刘浩 易军 王洪云

【摘要】 目的 探討晚期肝癌(HCC)免疫相关治疗的获益和不良反应。方法 选取2020年1月—2021年6月在九江市第三人民医院住院治疗的50例晚期HCC患者,随机分为对照组及观察组,对照组25例采用肝动脉栓塞化疗术(TACE)治疗,观察组25例在对照组基础上给予免疫检查点程序性死亡蛋白1(PD-1)治疗。观察2组临床疗效、肝功能、生活质量、Child-Paugh评分以及不良反应发生率。结果 治疗后,观察组客观有效率(ORR)为56.00%、疾病控制率(DCR)为84.00%,均高于对照组的28.00%,56.00%(P<0.05);观察组甲胎蛋白(AFP)、丙氨酸转氨酶(ALT)及天冬氨酸转氨酶(AST)均低于对照组(P<0.05);观察组Kamofsky评分高于对照组(P<0.05);观察组Child-Paugh评分低于对照组(P<0.05);观察组不良反应发生率(20.00%)与对照组(12.00%)对比差异无统计学意义(P>0.05)。结论 将免疫检查点PD-1应用于晚期HCC患者中,能够改善肝功能,降低Child-Paugh评分,提升生活质量,有效提高治疗效果,且不增加不良反应发生率。
【关键词】 晚期肝癌; 免疫相关治疗; 获益; 不良反应
Clinical study on the benefits and adverse reactions of immune-related therapy for advanced liver cancer
Liu Xiaomei,Zhong Mei,Liu Hao,et al. The Third People's Hospital of Jiujiang City,Jiujiang,Jiangxi 332000
【Abstract】 Objective To investigate the clinical research on the benefits and adverse reactions of immune-related therapy for advanced liver cancer(HCC). Methods Fifty patients with advanced HCC who were hospitalized in our hospital from January 2020 to June 2021 were selected and randomly divided into control group and observation group.On the basis of the control group,the immune checkpoint programmed death protein 1(PD-1)treatment was given, and the clinical efficacy,liver function,quality of life,Child-Paugh score and incidence of adverse reactions were observed in the two groups. Results After treatment,the objective response rate(ORR)(56.00%)and disease control rate(DCR)(84.00%)of the observation group were higher than those of the control group(28.00%)and(56.00%)(P<0.05);the observation group Alpha-fetoprotein(AFP),alanine aminotransferase(ALT)and aspartate aminotransferase(AST)were lower than those in the control group(P<0.05);Kamofsky score in the observation group was higher than that in the control group(P<0.05);Child-Paugh score in the observation group lower than the control group(P<0.05);there was no significant difference in the incidence of adverse reactions between the observation group(20.00%)and the control group(12.00%)(P>0.05).Conclusion The application of immune checkpoint PD-1 in patients with advanced HCC can improve liver function,reduce Child-paugh score,improve quality of life,and effectively enhance treatment effect without increasing the incidence of adverse reactions.
【Key Words】 Advanced liver cancer; Immune-related therapy; Profit from something; Adverse reactions
中图分类号:R735.7 文献标识码:A 文章编号:1672-1721(2023)19-0020-03
DOI:10.19435/j.1672-1721.2023.19.007
肝癌(hepatocellular carcinoma,HCC)是一种发生于肝脏,且具有高病死率的恶性肿瘤。研究显示[1],HCC早期症状不明显,有将近70%的患者在确诊时已为晚期,不适合施行肝癌切除术,唯有姑息性治疗。现今,最为有效的治疗手段为肝动脉栓塞化疗术(TACE),其是利用穿刺造影将化疗药物注入病灶,以达到升高肿瘤区抗癌药物浓度,缩小肿瘤的目的。但受晚期HCC患者免疫功能以及肿瘤负荷特异性的影响,行TACE治疗无法深入组织对门静脉癌栓及肝外转移病变进行直接抑制,且术后所产生的局部缺氧效应对残存肿瘤细胞具有诱导作用,可增加肿瘤细胞中PD-L1配体高表达反应,促使免疫抑制分子增加,抑制机体抗肿瘤免疫反应,致使肿瘤重新复活生长,影响病情控制[2]。基于TACE的不足,近年来,免疫相关治疗的临床研究越来越多,并显示出良好效果。程序性死亡受体1(PD-1)抑制剂是一种免疫检查点,其包含的纳武利尤单抗可通过阻断T细胞活化,抑制TACE术后因PD-L1高表达而引起的免疫抑制效应,以增强肿瘤微环境免疫反应,阻止肿瘤血管衍生[3]。但目前TACE后应用免疫治疗尚缺乏循证医学证据支持。本文旨在探讨免疫相关治疗应用于晚期HCC的獲益,报告如下。
1 资料与方法
1.1 一般资料 选取2020年1月—2021年6月在九江市第三人民医院住院治疗50例晚期HCC患者,随机分为对照组及观察组,各25例。对照组男11例,女14例;年龄41~67岁,平均年龄(52.36±5.19)岁;肿瘤直径4~8 cm,平均(6.41±1.32)cm;手术部位:肝右前叶5例,肝左前叶7例,肝右后叶6例,肝左内叶4例,其他3例;Child-Paugh分级:A级11例,B级14例。观察组男13例,女12例;年龄42~66岁,平均年龄(52.23±5.12)岁;肿瘤直径4~8 cm,平均(6.39±1.27)cm;手术部位:肝右前叶4例,肝左前叶5例,肝右后叶7例,肝左内叶5例,其他4例;Child-Paugh分级:A级12例,B级13例。2组基线资料无统计学差异(P>0.05)。本研究经患者及家属知情同意,医院伦理委员会审核。
纳入标准:(1)符合肝癌的诊断标准[4];(2)东部肿瘤协作组(ECOG)体力评分为0~1分;(3)预期生存期在12周以上;(4)既往未进行免疫治疗。排除标准:(1)病灶转移至肝、肺,且短期内出现危及生命的并发症患者;(2)存在活动性自身免疫性疾病;(3)伴有人类免疫缺陷病毒(HIV)感染;(4)依从性差者。
1.2 方法 2组均给予2个月治疗,随访6个月。均予以保肝、护胃抑酸、水化等基础抗癌治疗。对照组采用TACE:在Seldinger技术下,经皮股动脉进行插管,之后行肝动脉造影对动脉方向、病灶大小、血供情况进行观察,明确后以肿瘤供血动脉为药物灌注点,将1 000 mg氟尿嘧啶(西安海欣制药,国药准字200505H011,规格100 mL/0.25 g)、60 mg表柔比星(力创山东新时代药业,国药准字H20123260,规格10 mg)、100 mg奥沙利铂(杭州赛诺菲安万特民生制药,国药准字J20100064,规格50 mg)等化学治疗药物与适量造影相混合后,经肝固有动脉行导管脉冲式注射。之后观察肿瘤动脉供血情况,待血流缓慢时将导管退至肝总动脉,再行高压造影,直至靶病灶染色消失,最后常规选用碘油或吸收性明胶海绵作为栓塞物进行填充。每3~4周治疗1次,每次治疗后4~6周内进行一次CT扫描。
观察组在对照组基础上给予免疫检查点PD-1治疗:纳武利尤单抗(Bristol-Myers Squibb Holdings Pharma,批准文号S20180015,规格40 mg/4 mL)静脉注射,每2周1次,每次3 mg/kg。
1.3 观察指标 (1)临床疗效[5]:治疗2个月后,病灶完全消失>4周为完全缓解(CR);肿瘤缩小范围>50%,且维持时间>4周为部分缓解(PR);病灶缩小范围<50%,或增大范围<25%,且无新病灶为稳定(SD);病灶增大25%以上,出现新病灶为进展(PD)。客观有效率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。(2)肝功能:抽取患者清晨空腹静脉血2 mL,采用全自动生化分析仪(济南来宝医疗器械,型号BK-280),以电化学发光免疫法检测患者甲胎蛋白(AFP)、丙氨酸转氨酶(ALT)及天冬氨酸转氨酶(AST)水平。(3)Kamofsky量表评分:治疗前、随访结束后,采用Kamofsky量表[6]进行评价,该量表总分100分,得分越高生活质量越好。(4)Child-Paugh评分:分别于治疗前、随访结束后评估患者Child-Paugh评分[7],总分5~15分,得分越高肝脏储备功能越差。(5)不良反应发生率:随访期间观察并记录2组皮肤毒性、结肠炎、肝脏毒性、免疫治疗相关性肺炎的发生情况。
1.4 统计学方法 应用SPSS 22.0统计学软件进行数据分析,计数资料以百分比表示,采用χ2检验,计量资料以x±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
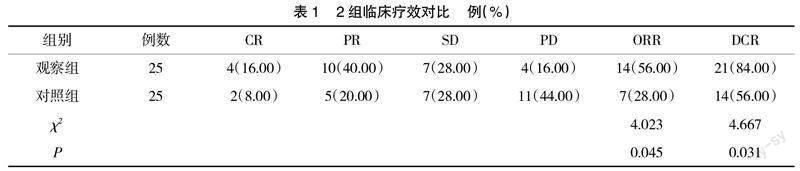
2.1 临床疗效 观察组ORR为56.00%、DCR为84.00%,均高于对照组的28.00%,56.00%(P<0.05),见表1。
2.2 肝功能 治疗前,2组AFP、ALT、AST对比差异无统计学意义(P>0.05);随访结束后,观察组均低于对照组(P<0.05),见表2。
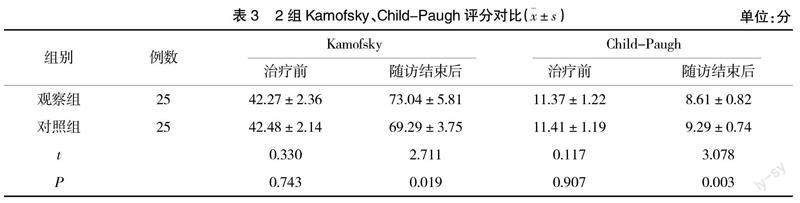
2.3 Kamofsky、Child-Paugh评分 治疗前,2组Kamofsky、Child-Paugh评分对比差异无统计学意义(P>0.05);随访结束后,观察组Kamofsky评分高于对照组,Child-Paugh评分低于对照组(P<0.05),见表3。
2.4 不良反应发生率 观察组不良反应发生率(20.00%)与对照组(12.00%)对比差异无统计学意义(P>0.05),见表4。
3 讨论
HCC是世界第六大常见肿瘤,也是引起肿瘤相关性死亡的第三大原因。HCC早期多无特异性症状,故大部分患者到院就诊时已处于晚期,行外科手术已无法根治,需行姑息治疗。TACE作为一项重要的介入技术,现已成为HCC患者非手术治疗的首选标准治疗方案。其可经皮穿刺股动脉,于肝固有动脉及其分支注射栓塞剂,以阻断肿瘤血供,致使肿瘤坏死缩小,从而延长患者生存时间。但该方式只是一种局部治疗,不能使肝外转移病变全部坏死,且术后所诱导的缺氧诱导因子1释放,可增加残存肿瘤细胞的PD-L1表達,从而对抗肿瘤适应性免疫产生抑制反应,诱使肿瘤生长转移,加大病情控制难度[8]。PD-1抑制剂中纳武利尤单抗能够解除T淋巴细胞功能抑制,有效对抗肿瘤在PD-L1免疫抑制效应下实现的免疫逃逸,将其用于晚期HCC患者可能会弥补TACE的不足。
本研究中,观察组客观有效率、疾病控制率均高于对照组(P<0.05),说明PD-1抑制剂可提高临床疗效,增强疾病控制。可能的原因是,PD-1与其受体结合后,可对PD-L1信号通路进行阻断,增加去磷酸激酶竞争,促使免疫受体酪氨酸转换基序去磷化,从而引起激酶蛋白失活,增加机体肿瘤杀伤效能,抑制细胞增殖,促进细胞凋亡,进而控制病灶衍生,改善疾病预后[9]。此外,本研究结果显示,2组不良反应发生率对比差异无统计学意义(P>0.05),提示PD-1抑制剂不增加不良反应,安全性高。值得指出的是,PD-1与受体结合以解除免疫抑制的同时,也会导致机体自身正常免疫反应增强,继而产生免疫失衡,引起自身免疫样相关性肺炎,但并未增加整体不良反应。故PD-1抑制剂可在提高药物有效浓度,改善患者临床症状的基础上有效保障治疗安全性,与王毅欣等[10]的研究结果相符。
AFP与肝脏密切相关,当肝细胞发生恶变时,该物质可进入肝脏,促进ALT、AST等具有运输氮源作用的转氨酶因子释放入血,以抑制机体分解代谢,造成肝脏再灌注损伤。本研究中,观察组AFP、ALT及AST均低于对照组,Kamofsky评分高于对照组,Child-Paugh评分低于对照组(P<0.05)。说明PD-1能够增加肝脏储备,改善肝功能,降低Child-Paugh评分,提高生活质量。可能的原因是,PD-1中纳武利尤单抗是一种产生于细胞免疫信号通路的跨膜蛋白,可经耦联结合阻断肿瘤细胞免疫逃逸信号通路,以增加T淋巴细胞增殖,促进肝细胞修复再生,增加肝血流量,有效改善肝功能。同时,该药物主要经肠道吸收,符合免疫因子经门静脉进入肝脏的生理特点,有利于体内蛋白合成,刺激胃肠恢复,减轻肝脏负担。此外,PD-1与配体PD-L1相互作用后,可促进T细胞增殖活化,以增加机体对肿瘤细胞所产生的免疫应答效应,阻止肿瘤细胞逃离出宿主的免疫监视杀伤,有效避免因肿瘤药异常增殖而导致大血管侵犯而造成的肝脏储备损伤;并对核因子-κB进行调控,防止HCC产生PD-L1高表达,降低AFP,有效激活细胞、体液免疫,从而为HCC提供正常的免疫微环境,有效避免肝细胞耗竭,进一步抑制HCC进展。
综上所述,将免疫检查点PD-1应用于晚期HCC患者中,能够改善肝功能,降低Child-Paugh评分,提升生活质量,有效提高治疗效果,且不增加不良反应发生率。
参考文献
[1] 邓烽丞,党文呈,万燊燚,等.PD-1介导的T细胞衰竭在肝癌免疫治疗中的概况[J].中华普通外科杂志,2021,36(5):397-400.
[2] 王俊旗,徐锋.程序性死亡受体1及其配体PD-L1、细胞毒性T淋巴细胞相关抗原4抑制剂在晚期肝癌治疗中的进展[J/CD].中华普通外科学文献(电子版),2021,15(4):304-308.
[3] 王辉.PD-1抑制剂联合靶向药物治疗晚期原发性肝癌的安全性及临床疗效观察[D].吉林大学,2021.
[4] 陈万青,崔富强,樊春笋,等.中国肝癌一级预防专家共识(2018)[J].中华肿瘤杂志,2018,40(7):550-557.
[5] 中华人民共和国卫生和计划生育委员会医政医管局.原发性肝癌诊疗规范(2017年版)[J].中华消化外科杂志,2017,16(7):635-647.
[6] 王建平,崔俊南,陈仲庚,等.癌症患者生活质量状况及影响因素研究[J].中国临床心理学杂志,2000,8(1):25-28.
[7] 丛文铭,步宏,陈杰,等.原发性肝癌规范化病理诊断指南(2015年版)[J].中华肝脏病杂志,2015,23(5):321-327.
[8] 周疆帆,单云峰.免疫检查点PD-1/PD-L1抑制剂与CAR-T治疗在肝癌中的研究进展[J].肝胆胰外科杂志,2020,32(2):65-70,74.
[9] 杨圆圆,林芳珍,范冬梅,等.PD-1抗体联合CXCL10对肝癌的抑制作用及其机制研究[J].天津药学,2021,33(1):3-6,70.
[10] 王毅欣,胡宗涛,张永康,等.PD-1治疗晚期原发性肝癌患者的安全性及临床疗效观察[J].肿瘤防治研究,2020,47(4):298-302.
(收稿日期:2023-04-01)
