代谢相关脂肪性肝病患者血清HIF-1α、Chemerin和脂联素水平变化及临床意义探讨*
2023-09-12辛春红牛洪凯兰春祥
蔡 欣,辛春红,牛洪凯,兰春祥
代谢相关脂肪性肝病(metabolic dysfunction associated fatty liver diseases, MAFLD)既往被称为非酒精性脂肪性肝病(nonalcoholic fatty liver diseases, NAFLD),2020年亚太肝病学会将其更名为MAFLD,其疾病谱包括非酒精性脂肪肝、非酒精性脂肪性肝炎及其相关的肝纤维化和肝硬化等[1]。近年来,随着大众生活方式和饮食结构的改变,如久坐不动、高脂饮食等,糖尿病、肥胖及其代谢功能障碍人群增多,MAFLD患病率逐年升高,已成为全球范围内最常见的慢性肝病之一[2]。早诊断并及时采取有效防治措施是延缓MAFLD病情进展、改善患者预后的重要方法,但MAFLD发病机制尚未完全阐明,临床仍缺乏积极有效的治疗手段。因此,分析影响MAFLD疾病进展的相关因素,探究治疗的新方向,已成为国内外学者研究的热点[3,4]。脂肪负荷过重使MAFLD患者肝细胞肿胀,引起肝窦变形及微循环障碍,血流减慢,局部组织缺氧,而缺氧是脂肪组织功能障碍的关键因素,可诱导脂肪纤维化及肝脏脂肪代谢异常,加剧MAFLD进展。缺氧也是MAFLD发生、发展的风险因素[5]。缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)是细胞及组织缺氧标志。近年研究发现[6],HIF-1α可通过上调血管内皮生长因子和血管生成素-2表达,促进肝纤维化发展,诱导肝细胞癌变。脂联素(adiponectin,ADPN)为脂肪细胞特异性分泌蛋白,具有抗炎作用,还可增强肝脏对胰岛素的敏感性,延缓脂肪性肝炎进程,可能是MAFLD疾病进展的保护因子[7]。另外,Chemerin是一种新发现的脂肪因子,与机体血脂、血压、胰岛素抵抗等均存在相关性,参与代谢功能障碍的发生。近年研究指出[8],Chemerin可能通过调节脂代谢、炎症和胰岛素等通路,参与MAFLD的发病过程。本研究检测了MAFLD患者血清HIF-1α、Chemerin和ADPN水平变化,现将结果报道如下。
1 资料与方法
1.1 病例来源 2020年3月~2022年10月我院诊治的MAFLD患者86例,男性52例,女性34例;年龄为30~63岁,平均年龄为(38.6±6.9)岁。符合2020年亚太肝病学会更新的MAFLD诊断标准[9]:基于血生化、影像学检查,同时符合⑴超重/肥胖;⑵Ⅱ型糖尿病;⑶代谢功能障碍。3项中任一项阳性,支持诊断。排除标准:⑴既往有肝脏、脾脏或胆道手术史;⑵合并病毒性肝炎;⑶合并自身免疫性、酒精性肝病或药物性肝损害;⑷合并甲状腺功能亢进或减退症、血液系统疾病、心肺功能不全、恶性肿瘤;⑸妊娠或哺乳期女性;⑹入组前1个月内应用过非甾体类抗炎药物。另选择同期经年龄和性别匹配的健康体检者43例作为对照组,男性26例,女性17例;年龄为30~62岁,平均年龄为(38.2±6.5)岁。本研究获得我院医学伦理委员会审核、批准。
1.2 肝脏脂肪变程度判断 使用日本佳能Aplio i900彩色多普勒超声诊断仪(探头频率为1~8 MHz)探测肝脏,参考《非酒精性脂肪性肝病防治指南(2018年更新版)》[9]将肝脏脂肪变程度分为轻度(肝实质回声密集增强,肝内管道结构及膈肌清晰可见)、中度(肝脏形态饱满,近场回声增强,远场回声稍衰减,光点密集,肝内管道结构显示不清,膈肌回声中断)和重度(肝脏增大,近场回声明显增强,远场回声明显衰减,肝内管道结构和膈肌不可见)。
1.3 实验室指标检测 使用日本奥林巴斯株式会社提供的全自动生化分析仪检测空腹血糖(fasting plasma glucose,FPG)和其他血生化指标;采用ELISA法检测血清HIF-1α、Chemerin和ADPN水平(武汉新启迪生物科技有限公司)。
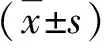
2 结果
2.1 两组血糖和血脂水平比较 MAFLD组FPG、血清TG、TC和LDL-C水平显著高于对照组(P<0.05,表1)。
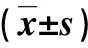
表1 两组血糖和血脂水平比较
2.2 两组血清HIF-1α、Chemerin和ADPN水平比较 MAFLD组血清HIF-1α和Chemerin水平显著高于对照组,而血清ADPN水平显著低于对照组(P<0.05,表2)。
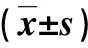
表2 两组血清HIF-1α、Chemerin和ADPN水平比较
2.3 不同肝脂肪变的MAFLD患者血清HIF-1α、Chemerin和ADPN水平比较 重度肝脂肪变的MAFLD患者血清HIF-1α和Chemerin水平显著高于中度或轻度脂肪变患者,而血清ADPN水平显著低于中度肝脂肪变或轻度肝脂肪变患者(P<0.05,表3)。
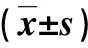
表3 不同脂肪变患者血清HIF-1α、Chemerin和ADPN水平比较
2.4 影响MAFLD患者肝脂肪变程度的多因素Logistic回归分析 经Logistic回归分析显示,血清FPG、TG、TC、LDL-C、HIF-1α和Chemerin高水平及血清ADPN低水平是影响MAFLD患者肝重度脂肪变的独立危险因素(P<0.05,表4)。
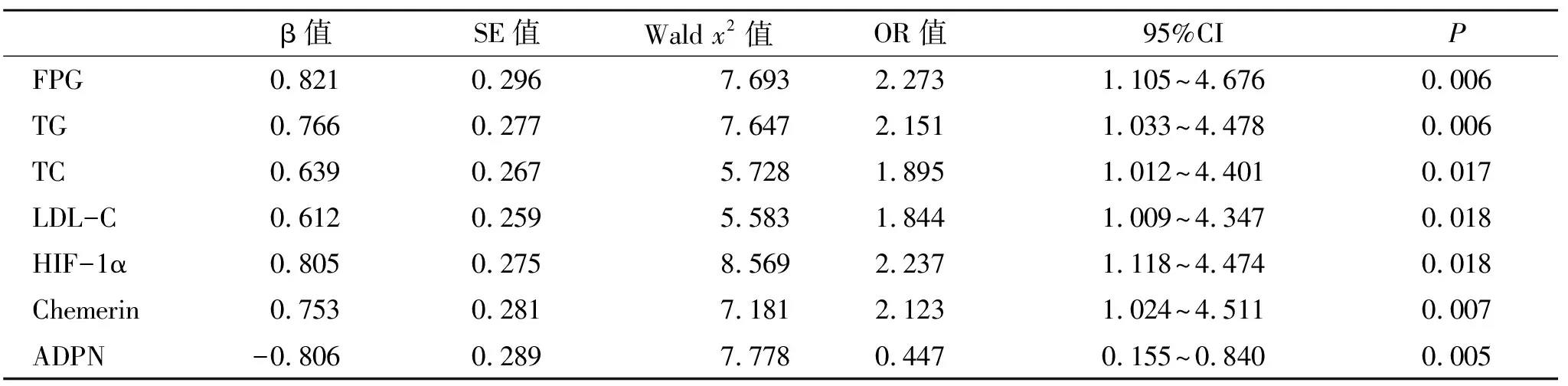
表4 影响MAFLD患者肝脂肪变程度的Logistic回归分析
2.5 血清HIF-1α、Chemerin和ADPN评估MAFLD患者肝重度脂肪变的效能情况 经ROC曲线分析显示,联合应用血清HIF-1α、Chemerin和ADPN水平评估MAFLD患者肝重度脂肪变的AUC显著大于三项指标单一评估(P<0.05),其评估效能最高(表5、图1)。

图1 血清HIF-1α、Chemerin和ADPN评估MAFLD患者肝重度脂肪变的效能
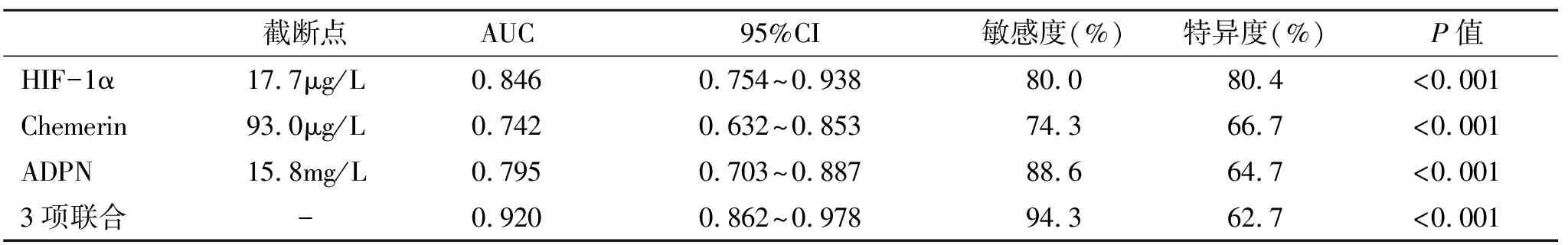
表5 血清HIF-1α、Chemerin和ADPN评估MAFLD患者肝重度脂肪变的效能
3 讨论
目前,MAFLD发病机制尚在探索阶段,但普遍认为其主要与脂代谢紊乱、胰岛素抵抗和氧化应激反应有关[10]。MAFLD患者胰岛素敏感性显著降低,导致其对糖脂代谢的调节作用减弱,造成血糖及血脂水平异常,而这种改变越明显,肝脏脂肪沉积就越重,肝损伤也进一步加剧[11]。Chemerin作为本世纪初期发现的脂肪因子,与肥胖和代谢综合征发生机制密切相关,可募集单核细胞源性巨噬细胞和浆细胞样树突状细胞聚集于炎症反应部位,调控局部炎症反应[12]。近年来有报道称[13],Chemerin可通过蛋白激酶B磷酸化及磷酸腺苷活化激酶活化,影响胰岛素敏感性,且能募集中性粒细胞和淋巴细胞聚集于肝内,加剧肝组织炎症反应,而作为胰岛素敏感性调节因子和炎症反应介质,参与MAFLD的发生和发展。Chemerin与疾病发生机制的相关报道主要集中在肥胖和代谢综合征[14],其是否通过影响胰岛素敏感性及肝内炎症反应,调控MAFLD的发生。
健康人群血浆含有丰富的ADPN,而在代谢综合征、肥胖和糖尿病人群ADPN水平显著下降[15]。MAFLD患者肝组织和血浆ADPN水平均显著下降。ADPN可通过影响肝组织炎症反应,参与MAFLD的发生[16]。在慢性乙型肝炎合并MAFLD患者,肝脂肪变越严重者血清ADPN水平越低[17]。
肝脂肪变不仅可引起肝细胞处于缺氧状态,脂肪沉积于肝组织也可导致肝脏对缺血缺氧的耐受性下降,更易发生肝损伤。据文献报道[18],MAFLD患者肝细胞处于缺氧状态,可诱导HIF-1α上调,激活转化生长因子β1和血管内皮生长因子信号通路,诱导血管新生,加速病情进展[19]。在小鼠模型实验发现,酒精性脂肪性肝病肝组织HIF-1α表达也显著上调,并通过调节炎症反应及氧化应激水平,参与肝损伤的发生。研究发现[20,21],缺氧诱导HIF-1α激活,使核因子κB亚基向核转运,诱导一系列炎症因子的分泌和释放,增强炎症反应。
