直接抗病毒药物治疗慢性丙型肝炎患者疗效研究*
2023-09-12李亚玲杨发成蒋亚西
李亚玲,杨发成,蒋亚西
丙型肝炎病毒(hepatitis C virus,HCV)感染是一个全球性的健康问题。大多数HCV感染者会转变成慢性疾病状态,可能导致慢性肝炎、肝纤维化、肝硬化,甚至是肝细胞癌(HCC)[1,2]。过去,传统标准治疗HCV感染的方法是应用α-干扰素联合利巴韦林(ribavirin,RBV)方案。多项研究表明,以α-干扰素为基础方案治疗后获得持续病毒学应答(sustained virological response,SVR)可以有效预防肝功能失代偿、降低HCV相关肝硬化和HCC的发生风险。此外,该方案还可以改善与肝病相关的生存状况[3-5]。然而,以α-干扰素为基础的治疗方案也存在着一定的不良事件发生。自从新一代直接抗病毒药物(direct acting antivirals,DAAs)的研制问世以来,治疗慢性丙型肝炎(chronic hepatitis C,CHC)已经进入无干扰素方案时代[6,7]。这些DAAs药物是有效的、安全的,甚至在老年或肝硬化患者也有很好的耐受性。真实世界研究发现DAAs类治疗者SVR依然可以超过95%。不过,也有些研究报道了应用DAAs治疗患者存在HCC发生的潜在风险或HCV相关肝癌进展[8-11]。因此,DAAs治疗CHC患者存在着HCC新发或病情复发的不确定性。机体的免疫功能在病毒感染和HCC发生发展过程中起着重要的作用。应用DAAs清除HCV感染后,机体免疫系统对肿瘤的监测能力可能下降,被认为是病情进展或复发的潜在的发病机制。本研究探讨了应用DAAs治疗CHC患者的疗效情况,现报道如下。
1 资料与方法
1.1 病例来源 2019年6月~2022年1月我院诊治的CHC患者65例,男37例,女28例;年龄为40~69岁,中位年龄为58(46,65)岁。诊断符合《丙型肝炎防治指南》(2019年版)的标准[12]。血清HCV RNA载量为6.2(3.0,7.3)lgIU/ mL。排除标准:合并存在其他嗜肝病毒感染、肝内外梗阻性黄疸、自身免疫性肝病、酒精性肝病或伴有药物滥用史或药物性肝损伤;存在肝性脑病、肝肾综合征等肝硬化严重并发症者;既往有肝脏和胆道手术史、近半年接受过α-干扰素治疗史;伴有严重的心血管疾病、消化性溃疡、肝癌等恶性肿瘤者;合并重要器官功能障碍者、妊娠或哺乳期妇女。所有研究对象签署知情同意书,本研究经我院医学伦理委员会批准。
1.2 治疗方法 给予37例CHC患者索非布韦(SOF,美国吉利德公司)400 mg口服,1次/d,联合RBV(四川美大康药业股份有限公司)300 mg口服,3次/d,给予28例SOF(同上)联合达拉他韦(中美上海施贵宝制药有限公司)60 mg口服,1次/d。所有患者均持续治疗12 w,随访24 w。
1.3 检测方法 采用实时荧光定量PCR法检测血清HCV RNA(中山大学达安基因股份有限公司),停药随访结束时血清HCV RNA载量低于检测下限为SVR;采用基因测序法检测HCV基因型(德国凯杰公司);使用美国贝克曼库尔特公司生产的LH780型全自动血液分析仪检测血常规;使用日本日立公司的7600型全自动生化分析仪检测血生化指标,根据患者年龄、肝功能指标和血常规检查结果,计算天冬氨酸氨基转移酶/血小板比值指数(aspartate aminotransferase- to - platelet ratio index,APRI)、基于4因子的纤维化指数(fibrosis index based on the 4 factors,FIB-4),计算公式为:FIB-4 =年龄×AST/PLT×ALT1/2;APRI = AST(ULN)/ PLT(×109/L)×100(其中ULN为AST的正常参考值上限)[13];使用杭州艾森生物有限公司提供的流式细胞仪检测外周血T淋巴细胞亚群。
1.4 肝硬度检查 使用法国Echosens公司生产的FibroScan诊断仪行肝脏硬度检测(liver stiffness measurement,LSM)。
1.5 肝穿刺活检 使用美国Bard公司提供的MG15-22 型全自动活检穿刺枪吸取肝组织,置于10%甲醛溶液中固定,常规石蜡包埋,行HE染色,在光学显微镜下观察。参照《肝纤维化诊断及疗效评估共识》作出病理学诊断,其中F1期:汇管区纤维化扩大,纤维化局限于窦周或小叶内;F2期:汇管区周围出现纤维化,并形成纤维间隔,但小叶结构完整;F3期:纤维间隔形成,小叶结构紊乱,无肝硬化;F4期:早期肝硬化或肯定的肝硬化[14]。
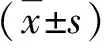
2 结果
2.1 不同肝纤维化分期的CHC患者临床资料比较 在65例CHC患者中,经肝组织学检查发现≤F2期31例,≥F3期34例;入组时,≥F3期年龄、LSM、APRI、FIB-4、PLT和血清AST水平与≤F2期比,存在显著性差异(P<0.05,表1);在随访结束时,本组患者SVR为100%。
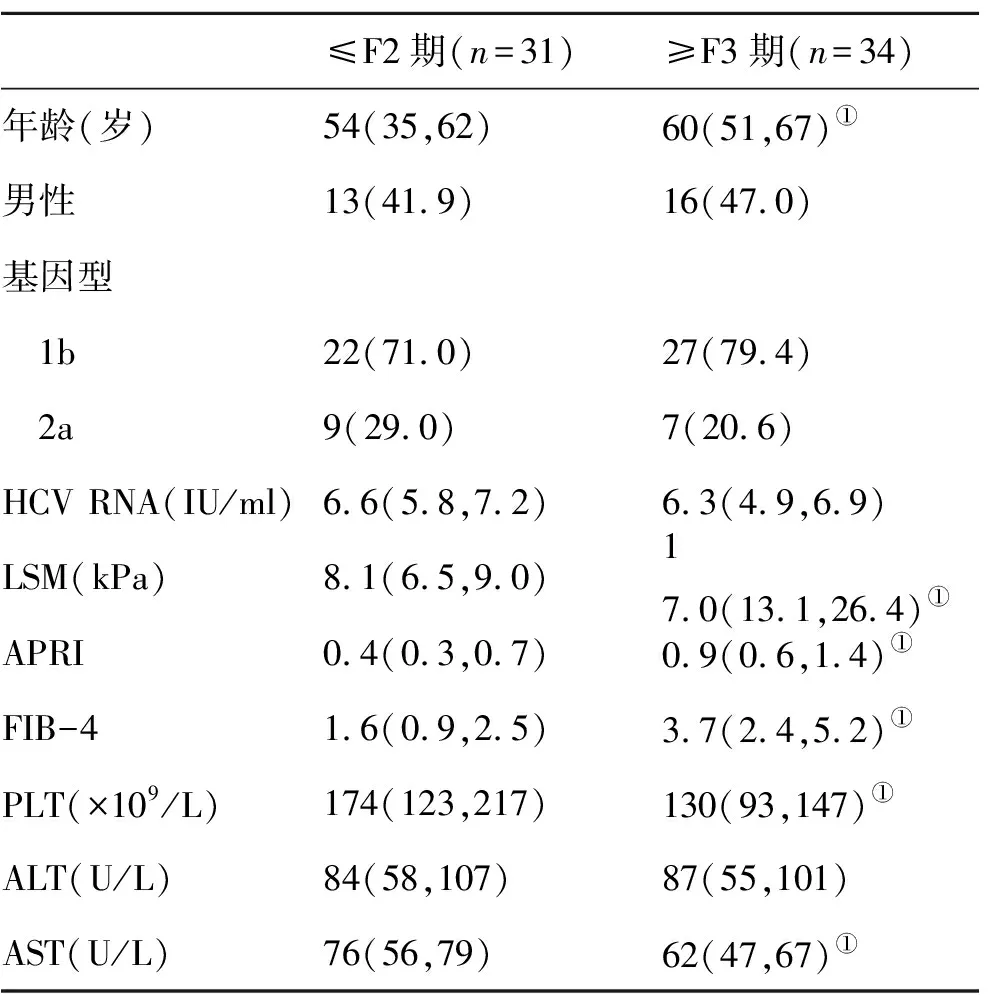
表1 两组CHC患者临床资料【%,M(P25,P75)】比较
2.2 两组外周血淋巴细胞亚群变化比较 在治疗后,所有CHC患者外周血CD4+细胞百分比和CD4+/CD8+细胞比值上升,但治疗前后两组变化无显著性差异(P>0.05,表2)。
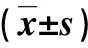
表2 两组外周血淋巴细胞亚群变化比较
3 讨论
应用DAAs治疗根除HCV感染的目标是防止肝病进展和改善肝纤维化。由于在根除HCV感染后采用连续肝活检检查诊断和监测CHC患者病情变化是不可行的,而许多非侵入性方法被广泛用于评估肝纤维化状态。
本研究在应用DAAs进行抗HCV感染治疗后,发现≥F3期CHC患者在治疗结束时LSM显著下降,并且这种下降趋势在随访结束时仍被观察到,与以前的研究结论描述是相似的。有报道称应用DAAs治疗后,全部CHC患者获得SVR,此时中位LSM下降了30%,其中晚期肝纤维化和肝硬化患者LSM改善程度更为显著[15]。在172例丙型肝炎肝硬化患者进行队列研究,经过DAAs治疗后,LSM从基线水平的16.9 kPa迅速降低至治疗24 w后的11.9 kPa[16]。此外,在招募的749例患有F3/F4期肝纤维化的CHC患者,他们的中位LSM从DAAs治疗前的19.3 kPa下降到治疗结束时的15.2 kPa[17]。由此可见,DAAs能够有效改善≥F3期CHC患者肝纤维化状态并得到证实。LSM的改善反映着慢性肝病患者肝纤维化状态的真正消退,或者更确切地说是肝脏炎症的消退。不过,有些研究称慢性肝病患者LSM下降并不一定说明肝纤维化的消退,因为后者也会受到机体炎症和脂肪变性的影响。此外,DAAs治疗不同基因型CHC患者的效果存在着差异。在本研究纳入的病例,发现DAAs治疗后基因1b型患者LSM呈持续性下降,而在基因2a型患者中并没有观察到类似的变化(资料未列出)。
外周血T细胞亚群水平变化可客观地反映机体的免疫功能状态。淋巴细胞参与了嗜肝性病毒感染的清除过程以及肝组织损伤反应[18,19]。CD4+T细胞能够抑制病毒复制和变异,可有效降低病毒载量,从而减轻机体的免疫损伤,而CD8+T细胞属于细胞毒性亚群,可导致细胞免疫功能紊乱[20,21]。本研究结果显示≤F2期与≥F3期CHC患者在DAAs治疗后外周血CD4+T细胞以及CD4+/CD8+细胞比值均较治疗前显著上升,这些结果表明经过DAAs的系统治疗能够有效地调节CHC患者机体紊乱的免疫反应,可能也协助了抗病毒治疗应答过程。
综上所述,CHC患者存在不同程度的肝纤维化,应用DAAs治疗不同程度肝纤维化的CHC患者均可获得很好的临床疗效,表现为持续性病毒学应答反应,肝功能指标复常,LSM降低提示可有效抑制肝纤维化进程,而纠正了紊乱的免疫功能可能也控制了炎症反应,提高疗效。对这些治疗应答患者进行长期随访,将有助于观察其长期疗效以及对减少肝硬化和肝癌发生方面的作用。
