核苷(酸)类似物治疗慢性乙型肝炎患者血清HBV pgRNA变化及其临床意义探讨*
2023-09-12吴育龙庄见齐刘志成马侠槟
吴育龙,庄见齐,刘志成,马侠槟
慢性乙型肝炎(chronic hepatitis B,CHB)是全球性公共卫生问题。全球有超过4亿HBV感染者,每年近100万患者死于HBV感染导致的肝衰竭、肝硬化和肝癌[1]。核苷(酸)类似物[nucleos(t)ide analogues,NAs]是临床治疗CHB患者最常用的抗病毒药物,经持续治疗后,血清肝功能正常,HBV DNA阴转,肝组织炎症和纤维化等均可得到有效控制[2,3]。尽管NAs是多数患者抗病毒治疗的主要选择,但由于多方面因素的影响,也存在完全应答率不理想和停药后复发的问题[4]。因此,如何早期精准地预测NAs抗病毒治疗的疗效是目前研究的重点课题。血清HBsAg转阴是目前公认的抗HBV治疗的理想目标,但大量研究数据表明应用现行的抗病毒药物治疗1年,仅有不到3%CHB患者血清HBsAg转阴,绝大多数患者难以获得停药的目标[5]。研究[6,7]发现,HBV前基因组核糖核酸(HBV pregenomic ribonucleic acid,HBVpgRNA)是HBV复制的中间产物,与影响抗病毒治疗疗效、导致停药后复发的肝细胞内共价闭合环状脱氧核糖核酸(covalently closed circular deoxyribonucleic acid,cccDNA)转录活性密切相关,可反映HBV cccDNA的存在状态。基于上述背景,本研究主要比较了接受NAs抗病毒治疗后不同应答和停药后是否复发的CHB患者血清HBV pgRNA等相关指标的变化差异,以探讨HBV pgRNA水平与NAs抗病毒治疗疗效和停药后病情复发的关系。
1 资料与方法
1.1 一般资料 2019年9月~2021年9月我院收治的CHB患者78例,男性56例,女性22例;年龄为19~62岁,平均年龄为(34.9±15.8)岁。诊断符合《慢性乙型肝炎防治指南(2019年版)》[8]的标准。纳入患者均为初始治疗者。排除合并原发性肝癌、其他嗜肝病毒感染、酒精或非酒精性脂肪肝、药物性肝损伤、自身免疫性肝病等其他肝病、艾滋病、妊娠或哺乳期妇女、重要器官疾病者。本研究经我院医学伦理委员会批准,患者签署知情同意书。
1.2 治疗与随访 依据《慢性乙型肝炎防治指南(2019年版)》给予所有患者NAs抗病毒治疗。随访截止时间为2022年10月1日。
1.3 疗效评估 同时出现病毒学和生化学应答者为完全应答,其中,病毒学应答为血清HBV DNA载量较基线下降≥2 lg IU/mL或<500 IU/mL;生化学应答为血清ALT水平降至40 U/L以下水平。
1.4 血清检测 采用实时荧光定量聚合酶链反应(qRT-PCR)法检测血清HBV DNA和HBV pgRNA水平。清晨采集空腹外周静脉血5 mL,3000r/m离心10 min,分离血清。应用核酸提取纯化试剂(广州海力特生物科技有限公司)采用磁珠法提取血清总RNA,检测RNA质量和浓度,应用cDNA合成试剂盒(Thermo Fisher Science,Waltham)逆转录合成cDNA,使用Lightcler 2.0实时荧光定量PCR仪(罗氏公司)和HBV核苷酸定量检测配套试剂盒(上海复兴长征医学科学有限公司)检测血清HBV DNA水平;使用宏石SLAN96P荧光定量PCR仪和HBV pgRNA定量检测试剂盒(上海宏石医疗科技有限公司)检测血清HBV pgRNA水平;使用日本日立公司生产的HITACHI 7600型全自动生化分析仪检测血生化指标;采用ELISA法检测血清HBsAg水平(美国Bio-TEK公司生产的ELX800全自动酶联仪和厦门英科新创科技有限公司试剂)。
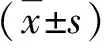
2 结果
2.1 CHB患者经NAs抗病毒治疗后的疗效情况 78例CHB患者均接受NAs抗病毒治疗,在48周末,获得病毒学应答75例(96.2%),生化学应答70例(89.7%),获得完全应答66例(84.6%)。
2.2 完全应答与未完全应答患者有关指标比较 入组时,完全应答患者血清HBV DNA载量、HBsAg和HBV pgRNA水平显著低于未完全应答患者(P<0.05,表1)。
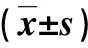
表1 两组有关指标比较
2.3 影响抗病毒治疗CHB患者疗效的风险Cox回归分析 将治疗不应答作为因变量(1=不应答发,0=应答),经Cox回归分析显示,入组时血清HBsAg和HBV pgRNA水平为影响抗病毒治疗的CHB患者疗效的因素(P<0.05,表2)。
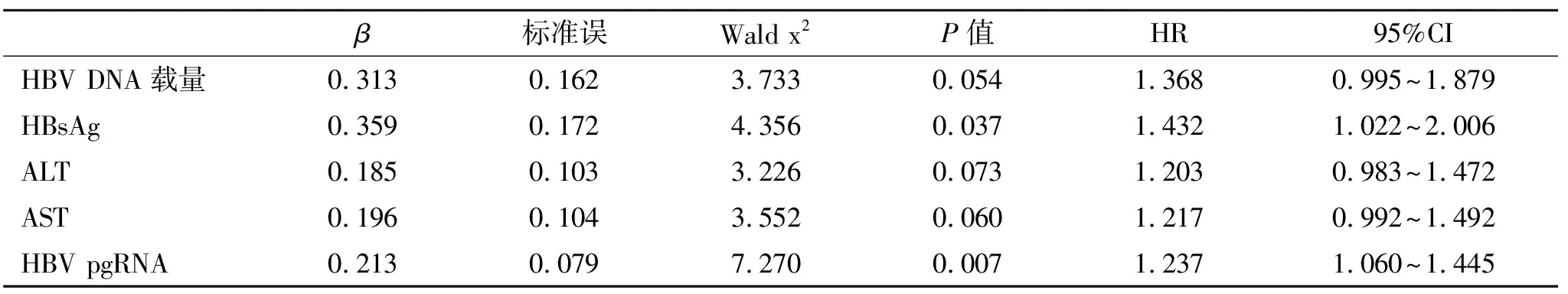
表2 影响抗病毒治疗CHB患者疗效的Cox回归分析
2.4 血清HBV pgRNA预测NAs抗病毒治疗CHB患者疗效的ROC曲线分析 经ROC分析显示,血清HBV pgRNA预测NAs治疗CHB患者完全应答的最佳截断点为4.8 lg copies/mL,其AUC值为0.825(95%CI:0.722~0.902),预测的灵敏度为89.4%,特异度为83.3%(图1)。
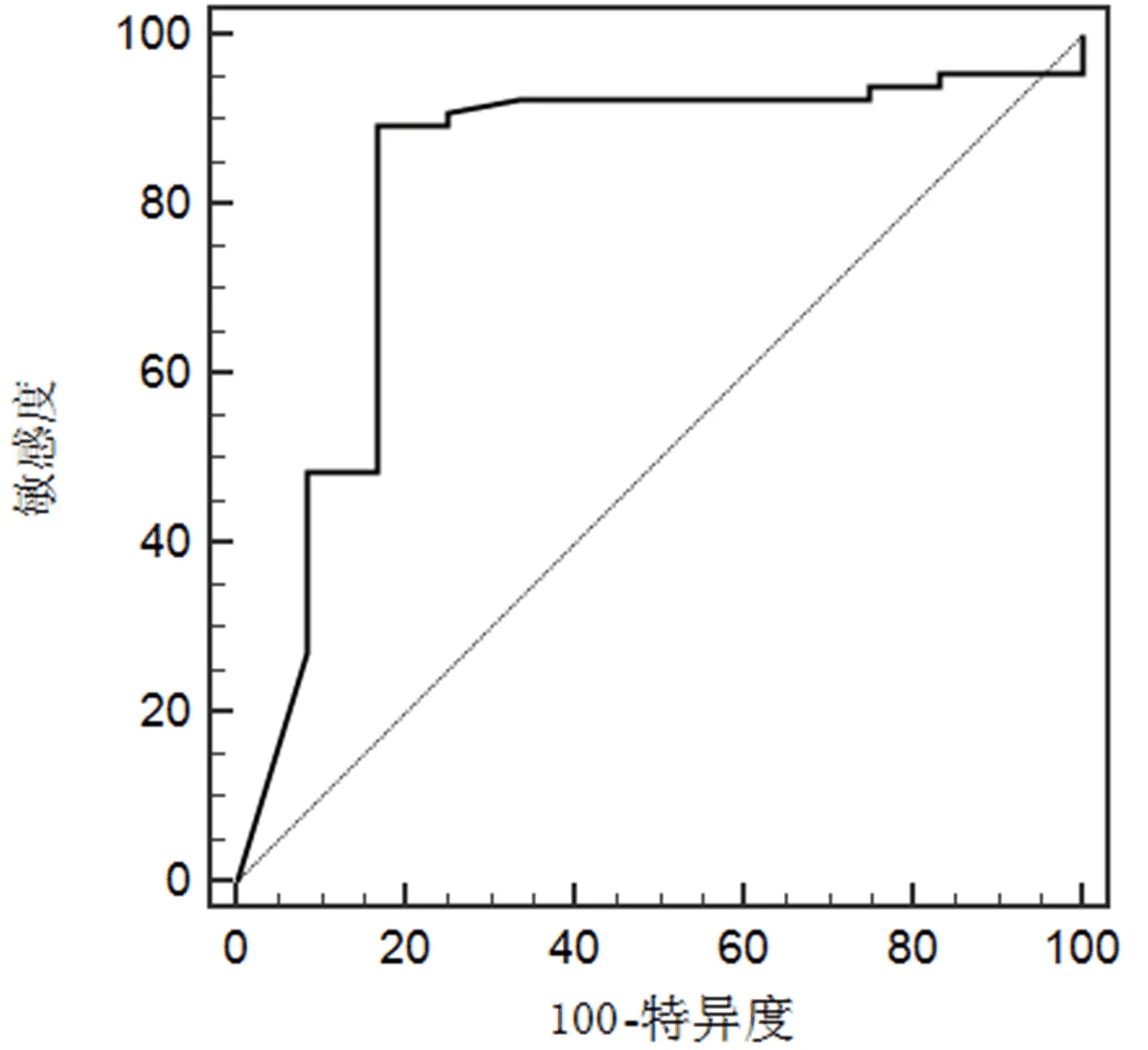
图1 血清 HBV pgRNA预测NAs抗病毒治疗CHB患者完全应答的ROC分析
3 讨论
最大限度地长期抑制或消除HBV感染是临床治疗CHB患者的主要目标。NAs作为临床抗HBV治疗的主要药物,具有抑制HBV复制、减轻肝细胞炎性、延缓肝纤维化发生和进展等作用[9]。在本研究,78例CHB患者经NAs抗病毒治疗48周,完全应答率为84.6%,与既往研究[10]结果相近,进一步证实NAs抗病毒治疗对CHB患者具有较好的临床疗效。目前,国内外各指南主要依据血清HBV DNA载量、HBsAg和HBeAg水平对NAs抗病毒治疗疗效进行评估,并制定了治疗终点,但临床实践证明,超过1/3患者在达到指南治疗终点标准后停药的半年时间内会发生病毒学反弹,相关治疗终点指标的应用存在局限性[11,12]。因此,寻求更为有效的生物标志物以预测NAs抗病毒治疗的疗效,对优化治疗方案,改善患者预后意义重大。
HBV cccDNA是反映HBV复制状态的指标,其半衰期长、不易降解,是HBV持续复制的重要因素[13]。研究[14]发现,HBV cccDNA转录生成的HBV pgRNA参与了病毒核心颗粒反转录为子代DNA负链的过程,不仅可反映HBV cccDNA水平和转录活性,还能指导CHB患者抗病毒治疗前和治疗过程中对疗效的判断。本研究发现,入组时,完全应答患者血清HBV DNA载量、HBsAg和HBV pgRNA水平显著低于未完全应答患者,提示NAs抗病毒治疗前较低水平的血清HBsAg及HBV DNA和HBV pgRNA载量患者可能在接受NAs抗病毒治疗后获得较好的应答率。有研究也发现,接受NAs抗病毒治疗后,应答患者血清HBV DNA载量、HBsAg和HBV pgRNA水平与不应答患者存在显著性差异,且不同NAs治疗CHB患者应答率相当,认为血清HBV pgRNA水平下降能较敏感地反映NAs抗病毒治疗的疗效[15]。既往研究[16]发现,血清HBsAg的来源不仅是HBV cccDNA,整合到人类基因组中的HBV DNA片段也可以产生HBsAg,导致血清HBsAg水平不稳定,不能正确地反映NAs抗病毒治疗的效果。血清HBV pgRNA仅来源于HBV cccDNA,以衣壳化病毒颗粒的形式存在于血清中,因此在反映治疗窗内的病毒学应答方面,效果优于血清HBsAg[17]。本研究经ROC分析结果显示,当血清HBV pgRNA最佳截断点为4.8 lg copies/mL时,其预测NAs抗病毒治疗CHB患者完全应答的灵敏度和特异度分别为89.4%和83.3%,进一步表明血清HBV pgRNA在预测NAs抗病毒治疗CHB患者临床疗效方面,具有良好的预测价值。
国内外相关指南均明确指出应用NAs治疗CHB患者的适应证和停用标准,但部分达到停药标准的患者仍存在一定的病情复发的可能。一项有关[18]CHB患者停用NAs抗病毒药物后病情复发的回顾性研究发现,患者停药后持续病毒学抑制率随时间的延长而下降,停药后12个月病情复发率为32.5%。有关NAs停用后引发的不同临床结局已成为临床研究的热点和难点之一。NAs治疗CHB患者需要长期治疗,短期内不能停药,也找不到可以预测停药后病情不复发的指标。Cox回归分析显示,入组时血清HBsAg和HBV pgRNA水平为CHB患者接受抗病毒治疗后影响应答的因素。血清HBV pgRNA水平来源的单一性使得HBV pgRNA具备代替HBsAg能反映肝细胞内HBV cccDNA载量和HBV活跃程度的准确率更高,而血清HBV pgRNA载量持续低于检测下限提示HBV cccDNA可能处于转录静默状态或被潜在清除,患者获得病毒学和生化学应答的概率较高[19,20]。在本研究,血清HBV DNA、ALT等指标不是影响CHB患者抗病毒治疗应答的影响因素,与既往研究[21]结论存在某些差异,考虑与纳入患者样本量、地域、病情和纳入标准不同有关。
综上所述,检测血清HBV pgRNA水平预测CHB患者应用NAs抗病毒治疗后的疗效具有一定的临床应用价值,其水平高低可作为选择CHB患者抗病毒治疗的纳入条件。但HBV pgRNA本身的动态变化规律还不清楚,检测血清HBV pgRNA载量的方法还初步应用于临床,其准确性还有待于证实。
