氨调控宰后牦牛肉中低氧诱导因子-1α表达对线粒体细胞凋亡及嫩度的影响
2023-09-12辛可启余群力张新军孔祥颖宋仁德
田 凯,辛可启,余群力,*,韩 玲,张新军,孔祥颖,宋仁德
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.宁夏夏华肉食品股份有限公司,宁夏 中卫 755000;3.青海省海北畜牧兽医科学研究所,青海 海北 812200;4.青海省玉树州畜牧兽医工作站,青海 玉树 815000)
牦牛(Bos grunniens)是生活在青藏高原及周边等高海拔环境的牛种[1],并且在海拔高、温差大(15 ℃以上)、低温和缺氧等恶劣环境条件下能大量繁育。这样特殊的环境造就了牦牛肉脂肪低、蛋白质高、富含脂肪酸、氨基酸和矿物质等营养丰富的特点[2],因此受到广大肉品消费者的喜爱。肉的嫩度能够反映肉中各类蛋白质特性,作为消费者衡量食用肉的重要指标之一,会影响消费者的购买欲[3]。在宰后成熟阶段,肌肉由钙离子激活酶、组织蛋白酶和细胞凋亡酶等多种酶相互作用,共同促进其嫩化[4]。细胞凋亡是一种特殊的细胞死亡形式,宰后肌细胞会出现收缩、细胞核收缩并边缘化等现象[5]。线粒体细胞凋亡途径是当今公认的一种凋亡方式,细胞因受到应激状态及凋亡因子的调控,引起线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)开放程度、线粒体膜电位(mitochondrial membrane potential,MMP)降低,并引起细胞凋亡酶家族级联反应,导致细胞凋亡[6]。部分肌原纤维蛋白受到凋亡酶的作用发生降解,对肉的嫩度产生影响[7]。
牦牛宰后处于缺氧应激状态,低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)作为一种关键的“氧气感受器”,在调控宰后肌肉细胞能量代谢方面具有重要意义。HIF-1是由氧调节亚单位HIF-1α和结构亚单位HIF-1β构成的一种异源二聚体蛋白性调节因子[8-9]。在低氧状态下,脯氨酰羟化酶(prolyl hydroxylase,PHD)活性钝化,HIF-1α不能被泛素化降解,造成HIF-1稳定表达[10]。与肉牛肉相比,牦牛肉中HIF-1α表达水平更高[11],说明牦牛更能在高原缺氧环境下生存繁育。HIF-1作为氧依赖性转录激活因子,可以调控血管生长、能量代谢和细胞凋亡等相关的多种靶基因[12]。Xin Keqi等[13]研究发现HIF-1α通过调节糖酵解途径在宰后牦牛肉嫩化成熟过程起到负调控作用。胡博等[14]的研究结果表明脯氨酰羟化酶通过上调HIF-1α表达提高糖酵解酶活性,加速糖酵解过程,从而使肌肉嫩度变差。
氨作为氨基酸脱氨作用和谷氨酰胺代谢过程的新陈代谢毒性副产物[15],能够在常氧条件下导致细胞HIF-1α积累[16],上调乳腺癌细胞MDA-MB-231细胞HIF-1α的表达水平[17]。Xiong Zhong等[18]发现结肠癌细胞中HIF-1α通过与细胞凋亡诱导因子(apoptosis inducing factor,AIF)启动子中的低氧反应元件(hypoxic response element,HRE)直接结合从而抑制AIF转录,同时HIF-1α能够控制MPTP开放以稳定MMP,并降低心脏缺血再灌注损伤后的线粒体氧化应激[19]。在肾小管细胞中,HIF-1α通过介导血红素加氧酶-1下调因缺氧产生的线粒体膜电位降低和活性氧(reactive oxygen species,ROS)生成[20]。与线粒体外膜相关的HIF-1α通过直接调节电压依赖性阴离子通道1来保护线粒体稳定并防止细胞凋亡[21],说明HIF-1α可通过调控AIF、MPTP、MMP等因素,减少线粒体耗氧并维持其稳定,防止由线粒体损伤引发的细胞凋亡。近年来,关于HIF-1α与细胞凋亡的研究主要集中于医学癌细胞领域,且两者间的作用机制尚未完全明确。与癌细胞类似,宰后肌肉细胞也处于缺氧应激环境,目前鲜见HIF-1α与细胞凋亡是否存在类似机制,以及氨在调控宰后牦牛肉成熟过程中HIF-1α表达与线粒体细胞凋亡之间是否存在作用的报道。因此,对于氨调控宰后牦牛肉中HIF-1α表达对线粒体细胞凋亡以及肉嫩度的影响具有理论研究价值。
1 材料与方法
1.1 材料与试剂
牦牛肉样品选自青海裕泰食品有限公司的6 头公牦牛,体质量(350±50)kg左右。牦牛发育优良,生长年龄平均在3~4 岁左右,无任何健康问题且体质良好,宰前禁水2 h,禁食16~18 h。
氯化铵、氯化钾、氯化镁、磷酸三钾、甘露醇、蔗糖、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、NaN3天津市致远化学试剂有限公司;MOPS缓冲液、牛血清白蛋白(bovine serum albumin,BSA)、Hepes缓冲液 上海麦克林生化科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒 武汉赛维尔生物科技有限公司;NO测定试剂盒、ATP含量测定试剂盒、Na+-K+-ATPase试剂盒、Ca2+-ATPase试剂盒南京建成生物工程研究所;MMP试剂盒、Caspase-3/9活力测定试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
DW-86L416G超低温冰箱 杭州诺丁科学器材有限公司;FJ200-SH分散均质机 上海沪析实业有限公司;FA2004B电子天平 上海精科天美仪器有限公司;SP-756P紫外-可见分光光度计 上海光谱仪器有限公司;TGL-16M高速台式冷冻离心机 上海卢湘仪离心机仪器有限公司;C-LM4型数显式肌肉嫩度仪 上海精密科学仪器有限公司;BV-2电泳仪 北京伯兰特仪器设备有限公司。
1.3 方法
1.3.1 样品处理
每头牦牛经屠宰放血干净、除去无用组织后,各取其背最长肌500 g,再切割为100 g左右的肉块以便处理。肉块分为3 组,每组约900 g肉样,分别注射浓度为10 mmol/L NH4Cl溶液、0.9%的生理盐水和浓度为10 mmol/LN-硝基-L-精氨酸甲酯盐酸盐(N-nitro-Larginine methyl ester hydrochloride,L-NAME)溶液,以1∶1的质量体积比进行多点位注射。本实验以10 mmol/L NH4Cl溶液、10 mmol/LL-NAME溶液作为处理组,以0.9%的生理盐水作为对照组。肉样经处理后在4 ℃下成熟0、6、12、24、72、120、168 h取样,用滤纸吸取多余液体后进行相应指标测定,针对其余不便测定的指标,将肉样置于-80 ℃的超低温冰箱中备用。
1.3.2 免疫印迹分析
参考任钰昕等[22]的方法修改,取1 g肉样剪碎置于9 mL裂解液中,13 000 r/min冰浴匀浆30 s,重复多次,冰上静置裂解30 min。将匀浆液于4 ℃、12 000 r/min条件下离心10 min,上清液用BCA法测定蛋白质量浓度。将上述样液蛋白质量浓度调节至1.5 μg/μL,按体积比4∶1向蛋白溶液中加入5×上样缓冲液,沸水煮15 min。用12%的分离胶和5%浓缩胶进行SDS-PAGE,电泳分离后将蛋白转移至聚偏氟乙烯(poly(vinylidene fluoride),PVDF)膜上,在脱色摇床上用5%的脱脂奶粉进行1 h封闭,加入一抗(GAPDH:GAPDH小鼠单克隆,1∶2 000;HIF-1α:多克隆兔抗小鼠,1∶1 000),4 ℃孵育过夜。用TBST缓冲液在脱色摇床上清洗3 次,每次5 min,清洗后加入二抗(山羊抗兔,1∶3 000)室温孵育1 h。在暗室中进行化学发光,洗净后定影,利用PhotoShop软件整理去色,利用Alpha软件处理并计算光密度值。
1.3.3 NO含量测定
取1 g肉样置于50 mL离心管中,加入10 倍体积预冷的0.86%生理盐水,利用分散均质机匀浆,13 000 r/min冰浴匀浆30 s,重复多次,4 ℃、4 000 r/min条件下离心15 min,保留上清液待测。利用试剂盒测定NO含量。
1.3.4 Na+-K+-ATPase、Ca2+-ATPase、ATP水平测定
Na+-K+-ATPase、Ca2+-ATPase与ATP水平按照试剂盒说明书进行测定。
1.3.5 线粒体提取
参考王琳琳[23]的方法稍作修改,将牦牛肉样剪碎后加入10 倍体积的线粒体分离缓冲液(220 mmol/L甘露醇、70 mmol/L蔗糖、5 mmol/L MOPS、2 mmol/L EDTA和0.5% BSA,pH 7.4)中,用分散均质机在12 000 r/min下冰浴匀浆30 s,重复多次。用高速台式冷冻离心机于在4 ℃、1 000×g条件下离心10 min,相同条件下离心两次,取上清液4 ℃、8 000×g离心25 min,弃上清液,取沉淀即为线粒体。利用Biuret法测定蛋白质量浓度。
1.3.6 MPTP开放程度测定
参考Wang Linlin等[24]的方法测定吸光度,通过吸光度变化描述MPTP开放程度。取分离纯化后的线粒体用MPTP测试液(230 mmol/L甘露醇、70 mmol/L蔗糖、3 mmol/L Hepes,pH 7.4)将蛋白质量浓度调整至0.3 mg/mL。按体积比1∶3将线粒体悬浮液与MPTP测试液混匀,在540 nm波长处测定其吸光度,以吸光度表征MPTP开放程度,当吸光度越小时,MPTP开放程度越大。
1.3.7 线粒体膜电位测定
MMP采用JC-1试剂盒检测,取总蛋白质量浓度为100 μg/mL的纯化线粒体加入10 倍体积的JC-1染色液,孵育20 min,使用荧光分光光度计测定荧光强度,红绿荧光强度比值能反映MMP水平(检测JC-1单体时,激发波长490 nm、发射波长530 nm;检测JC-1聚合物时,激发波长525 nm、发射波长590 nm)。
1.3.8 Caspase-3/9活力测定
样品处理参照Caspase-3/9活力测定试剂盒说明书稍作修改,取0.1 g肉样,加入1 mL Caspase-3/9裂解液,多次冰浴研磨,冰上静置20 min,4 ℃、15 000×g条件下离心15 min,取上清液置于冰上,按照试剂盒说明书测定Caspase-3/9活力。
1.3.9 剪切力测定
参考NY/T 1180—2006《肉嫩度的测定 剪切力测定法》测定样品剪切力,取100 g长×宽×高不小于6 cm×3 cm×3 cm的整块肉样置于80 ℃恒温水浴锅中加热,待肉样中心温度达到70 ℃后,用直径为1.27 cm的圆形取样器取肉样,再将其置于C-LM4型数显式肌肉嫩度仪中测定其剪切力。
1.3.10 肌原纤维小片化指数测定
参考Gao Yongfang等[25]的方法并稍作修改,将3 g肉样与30 mL MFI缓冲液(100 mmol/L KCl、1 mmol/L MgCl2、1 mmol/L EDTA、1 mmol/L NaN3、20 mmol/L K3PO4,pH 7.1)按照质量体积比1∶10混匀,于10 000 r/min下冰浴匀浆30 s,重复多次。在4 ℃、2 000×g条件下离心20 min,弃上清液,取沉淀加10 倍体积预冷肌原纤维小片化指数(myofibril fragmentation index,MFI)缓冲液,再次在4 ℃、2 000×g条件下离心20 min,弃上清液,取沉淀加入10 mL MFI缓冲液溶解,用筛网过滤悬浮液,并使用MFI缓冲液冲洗滤网,得到蛋白溶液。用Biuret法测定蛋白质量浓度,用MFI缓冲液将蛋白质量浓度调至0.5 mg/mL,在540 nm波长测定吸光度,按下式计算MFI。
MFI=吸光度×200。
1.3.11 肌细胞形态观察
参考Fischer等[26]的方法,将肉样加入体积分数10%福尔马林溶液固定,组织切片后经苏木精-伊红染色。通过显微镜进行拍照观察,使用Image-Pro Plus 6.0软件分析其肌纤维横切面图像,每张图取30 组肌细胞分别测定其肌纤维面积、直径和间隙。
1.4 数据处理与分析
数据测定3 次以上,利用SPSS 26.0软件进行单因素方差分析和Duncan’s显著性检验(以P<0.05表示差异显著),处理类别、宰后成熟时间及其交互作用被认为是固定效应,动物被认为是随机效应;利用Origin 9.0软件作图。
2 结果与分析
2.1 氨调控宰后成熟过程中牦牛肉内环境及能量代谢变化
2.1.1 氨调控宰后成熟过程中牦牛肉HIF-1α表达量变化
牦牛经屠宰后,肌肉细胞受缺氧放血影响,细胞内HIF-1α表达量在宰后初期迅速增加。由图1可知,HIF-1α表达水平整体呈先升高后下降的趋势,在宰后24 h达到最高。这一结果与朱宏[27]的研究结果相似。在宰后缺氧状态下,宰后6~24 h,NH4Cl组HIF-1α表达水平显著高于对照组(P<0.05),L-NAME组HIF-1α表达量显著低于对照组(P<0.05),这一结果与Kitajima等[28]的研究结果相似,说明NH4Cl对宰后牦牛肉细胞中HIF-1α表达量起上调作用,相反,L-NAME处理对宰后牦牛肉细胞中HIF-1α表达量起下调作用。结合Kruczek[29]与Olson[30]等的研究分析,这可能与氨在肌肉代谢转换过程中产生的NO分子有关。因此,本实验后续测定了3 种不同处理中牦牛肉NO含量,试图揭示氨对HIF-1α的调控途径。

图1 HIF-1α免疫印迹及蛋白表达量Fig.1 Western blot analysis and protein expression analysis of HIF-1α
2.1.2 氨调控宰后成熟过程中牦牛肉NO含量
Metzen等[31]发现NO分子通过钝化PHD活性,造成HIF-1α不被降解而蓄积。NO是由一氧化氮合酶氧化L-精氨酸产生,并由尿素循环相关的酶介导[32]。由图2可知,随着宰后成熟,牦牛肉中NO含量先增加后减少,6 h时NO含量最高。宰后12 h,对照组NO含量比NH4Cl组低5.17%,比L-NAME组高8.78%,宰后6~168 h内,对照组NO含量显著高于L-NAME组(P<0.05),而显著低于NH4Cl组(P<0.05)。张攀高等[33]的研究表明,L-NAME作为一种一氧化氮合酶抑制剂可抑制一氧化氮合酶活性,降低NO生成量。由本研究结果可知,氨可以通过代谢转化过程产生NO分子,造成肌细胞中NO含量升高,而L-NAME处理可以有效减少肌细胞中NO产生,这与李雪茹等[34]的研究结果一致。

图2 宰后成熟过程中NO含量变化Fig.2 Variation in NO content during postmortem aging
2.1.3 氨调控宰后成熟过程中牦牛肉Na+-K+-ATPase与Ca2+-ATPase活力
细胞能量代谢酶广泛分布于细胞膜、线粒体膜与内质网上,而Na+-K+-ATPase与Ca2+-ATPase作为主要的能量代谢酶,在调节细胞内环境方面起到重要作用[35]。由图3A可知,宰后0~168 h,Na+-K+-ATPase活力先升高后降低,且在24 h达到峰值,此结果与陈琳[36]的研究结果相似。宰后6~24 h,对照组Na+-K+-ATPase活力显著高于NH4Cl组(P<0.05),显著低于L-NAME组(P<0.05)。说明受氨调控的HIF-1α可下调Na+-K+-ATPase活力。在宰后缺氧条件下,HIF-1α的关键转录因子会降低电子传递链活性[37],并使蛋白翻译和Na+-K+-ATPase活力下调。Ca2+-ATPase存在于线粒体膜与细胞膜,在调节离子浓度平衡与线粒体膜通透性方面起到重要作用[38]。由图3B可知,Ca2+-ATPase活力在宰后初期先升高,随后逐渐降低。宰后12 h,对照组Ca2+-ATPase活力比NH4Cl组高9.08%,比L-NAME组低29.59%。说明经过NH4Cl介导的HIF-1α可能存在下调Ca2+-ATPase的作用,但其内在机制仍需进一步研究。

图3 宰后成熟过程中Na+-K+-ATPase(A)与Ca2+-ATPase(B)活力变化Fig.3 Changes in Na+-K+-ATPase (A) and Ca2+-ATPase (B) activities during postmortem aging
2.1.4 氨调控宰后成熟过程中牦牛肉ATP含量
ATP作为直接的能量物质,在调节宰后肌肉能量代谢与内环境变化方面极其重要。由于缺血缺氧等因素影响,宰后肌肉能量代谢因有氧呼吸终断,此时能够进行的能量代谢途径即糖酵解途径[39]。由图4可知,宰后0~168 h,ATP含量逐渐下降,NH4Cl组ATP含量下降81.53%,对照组下降90.50%,L-NAME组下降91.43%。宰后6 ~7 2 h,对照组AT P 含量显著低于N H4C l 组(P<0.05),且显著高于L-NAME组(P<0.05)。宰后成熟过程受缺氧应激影响,肌细胞进行各项生理活动仍需消耗ATP,且细胞凋亡过程也需消耗ATP。在缺氧状态下,HIF-1α通过调控糖酵解相关靶基因,促进糖酵解反应的发生,进而产生更多的ATP以维持细胞能量消耗[40]。综上,氨可能通过上调HIF-1α表达靶向调控糖酵解相关酶活性,促进糖酵解反应发生,增加ATP生成,以维持细胞内各项生理生化反应正常进行,减缓细胞凋亡的发生。

图4 宰后成熟过程中ATP含量变化Fig.4 Change in ATP content during postmortem aging
2.2 氨调控宰后成熟过程中牦牛肉线粒体途径细胞凋亡的变化
2.2.1 氨调控宰后成熟过程中牦牛肉MPTP开放程度
MPTP在调节线粒体膜的通透性方面具有重要作用,是细胞凋亡线粒体途径中的关键性结构。MPTP开放程度越大,线粒体引起的细胞凋亡越可能发生[41]。MPTP开放程度由吸光度反映,吸光度越小,MPTP开放程度越大。如图5所示,随着成熟时间推移,吸光度逐渐下降,说明MPTP开放程度逐渐增大,宰后6~120 h,NH4Cl组MPTP开放程度显著低于对照组(P<0.05),而L-NAME组显著高于对照组(P<0.05),说明氨可能通过促进HIF-1α表达,抑制MPTP开放及线粒体外膜通透性增大。Wang Linlin等[42]通过对宰后牦牛肉进行研究发现,氧化应激和ROS过量产生引起的钙超载可能影响MPTP的开放和MMP。Kim等[43]的研究表明,在低氧条件下,电子传递链发生故障,这使得葡萄糖代谢产物通过HIF-1介导了磷酸肌醇依赖性蛋白激酶-1表达从而引起线粒体呼吸减弱,抑制线粒体ROS产生,维持ATP水平。Xin Keqi等[13]的研究表明,与对照组相比,YC-1(HIF-1α抑制剂)处理抑制了磷酸肌醇依赖性蛋白激酶-1的表达。HIF-1α可能通过上调磷酸肌醇依赖性蛋白激酶-1表达,减弱线粒体呼吸作用,减少线粒体ROS产生从而抑制MPTP开放[19]。
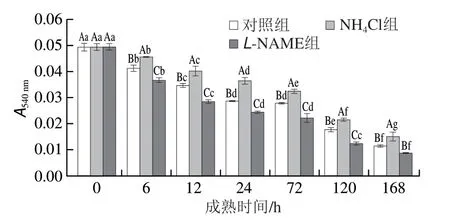
图5 宰后成熟过程中MPTP开放程度变化Fig.5 Change in MPTP openness during postmortem aging
2.2.2 氨调控宰后成熟过程中牦牛肉线粒体膜电位
细胞凋亡的标志性变化之一是MMP下降。由图6可知,随着宰后成熟,MMP整体呈现逐渐下降趋势,表明宰后成熟过程发生肌细胞凋亡。宰后0~168 h,NH4Cl组MMP下降47.72%,对照组MMP下降53.54%,L-NAME组MMP下降60.05%。与Xin Keqi等[13]的研究结果一致,YC-1(HIF-1α抑制剂)组的MMP均低于对照组。前人研究发现HIF-1α参与了VDAC1-mortalin-HIF-1α-HK-II复合体的形成,该复合体能够促进抗凋亡VDAC1-∆C的产生,维持MMP稳定,从而阻止因缺氧诱发的细胞凋亡[21]。综上,HIF-1α通过延缓MMP下降,维持线粒体内部结构与功能稳定,抑制细胞凋亡。

图6 宰后成熟过程中MMP变化Fig.6 Changes in MMP during postmortem aging
2.2.3 氨调控宰后成熟过程中牦牛肉Cas pa se-9与Caspase-3活力
MPTP开放程度增大与MMP降低能够引起细胞色素c(cytochrome c,Cyt-c)释放入胞质,消耗ATP,激活Caspase-9,活化后的Caspase-9进一步激活Caspase-3,导致细胞凋亡[44]。如图7所示,Caspase-9与Caspase-3活力随成熟时间延长先上升,随着ATP消耗,其酶活力逐渐下降,这与魏起超[45]的研究结果相近。宰后6、24 h与72 h,NH4Cl组Caspase-9活力显著低于对照组(P<0.05),L-NAME组Caspase-9活力显著高于对照组(P<0.05),宰后12~168 h,NH4Cl组Caspase-3活力显著低于对照组与L-NAME组(P<0.05)。王琳琳等[46]的研究表明能量代谢酶活力同Caspase-9与Caspase-3活力呈正相关,本实验结果与其一致。综上,氨通过调控HIF-1α维持线粒体结构与功能,抑制Caspase-9与Caspase-3活性,进而抑制细胞凋亡。

图7 宰后成熟过程中Caspase-9(A)与Caspase-3(B)活力变化Fig.7 Changes in caspase-9 (A) and caspase-3 (B) activities during postmortem aging
2.3 氨调控宰后成熟过程中牦牛肉嫩度变化
2.3.1 氨调控宰后成熟过程中牦牛肉剪切力
剪切力是衡量肉品嫩度的指标。肉品嫩度通常由pH值、钙激活酶、组织蛋白酶与细胞凋亡酶等因素共同影响。如图8所示,宰后0~168 h剪切力呈现先逐渐升高后逐渐下降趋势,这与马秀利等[47]的研究结果一致,宰后6~168 h,NH4Cl组剪切力显著高于对照组(P<0.05),L-NAME组剪切力低于对照组。由2.2.3节结果可知,氨通过上调HIF-1α表达能够抑制Caspase-9与Caspase-3活性。Kemp等[48]的研究结果证明细胞凋亡酶可以对肌原纤维蛋白进行部分降解,从而影响剪切力等嫩度评价指标。综上,氨通过调控HIF-1α对肌肉嫩度产生负作用,推测可能与HIF-1α调节糖酵解过程造成pH值下降以及抑制线粒体细胞凋亡途径中细胞凋亡酶活性有关。

图8 宰后成熟过程中剪切力变化Fig.8 Change in shear force during postmortem aging
2.3.2 氨调控宰后成熟过程中牦牛肉MFI
在宰后过程肉质不断得到改善,通过内源酶的共同作用,肌肉嫩度不断提高。MFI用于描述肌原纤维降解程度,由图9可知,随宰后成熟牦牛肉的MFI整体逐渐升高,这与高永芳等[49]的研究结果一致。在多种内源酶的作用下,肌原纤维破裂为不同数目的多肽小片段,导致MFI值逐渐增大。宰后6~120 h,NH4Cl组MFI显著低于对照组(P<0.05),L-NAME组显著高于对照组(P<0.05)。综上,在宰后成熟过程,氨调控的HIF-1α通过抑制线粒体细胞凋亡、弱化细胞凋亡酶对肌原纤维蛋白的降解作用,进一步导致肌肉嫩度变差。
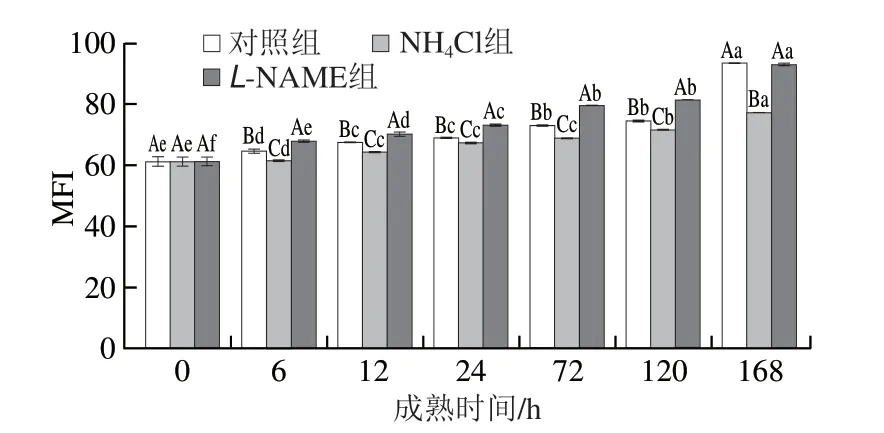
图9 宰后成熟过程中MFI变化Fig.9 Change in MFI during postmortem aging
2.3.3 氨调控宰后成熟过程中牦牛肉肌细胞形态变化
随着宰后成熟,肌纤维受pH值、ATP消耗、内源酶降解等多种因素影响,其形态会发生变化。由图10可知,随着宰后成熟,肌纤维形态上逐渐收缩,肌纤维面积、直径逐渐变小,细胞间隙逐渐增大。由表1可知,在宰后6~72 h,NH4Cl组的肌纤维面积显著大于对照组(P<0.05),对照组肌纤维面积显著大于L-NAME组(P<0.05);宰后6~24 h和72 h,NH4Cl组的肌纤维直径显著大于对照组(P<0.05),对照组肌纤维直径显著大于L-NAME组(P<0.05);宰后6~24 h对照组的肌纤维间隙显著大于NH4Cl组(P<0.05),显著小于L-NAME组(P<0.05)。NH4Cl组肌纤维形态收缩较对照组慢,嫩度改善效果较差,而L-NAME组较对照组肌纤维形态收缩较快。综上,NH4Cl处理显著抑制肌纤维形态收缩,NH4Cl可以通过调控HIF-1α表达抑制细胞凋亡发生与肌细胞形态变化。

表1 宰后成熟过程中不同时间肌纤维面积、直径及间隙Table 1 Muscle fiber area and diameter and space between muscle fibers at different time points during postmortem aging
3 结 论
随着宰后牦牛肉成熟,HIF-1α表达量、NO含量、Na+-K+-ATPase活力、Ca2+-ATPase活力、Caspase-9活力、Caspase-3活力与剪切力呈现先升高后降低趋势,ATP含量、MPTP开放程度、MMP与及肌纤维直径和面积呈现逐渐下降趋势,而MFI与肌纤维间隙呈现逐渐上升趋势。同时,与对照组相比,经NH4Cl处理的牦牛肉NO含量增加,可能是通过释放NO分子造成HIF-1α表达增加,而HIF-1α通过下调Na+-K+-ATPase与Ca2+-ATPase活力减缓ATP消耗,维持宰后缺氧环境引起的内环境稳定状态。HIF-1α通过抑制MPTP开放,减缓MMP下降,进而造成Caspase-9与Caspase-3活力降低,对线粒体细胞凋亡起抑制作用,进一步引起肌肉剪切力增大,MFI减小,肌纤维直径、面积增大,细胞间隙变小,使肌纤维细胞形态收缩变化较小,对肌肉嫩度产生负面影响。综上所述,氨能够上调宰后牦牛肉细胞中HIF-1α表达,调节肌肉内环境变化,通过抑制线粒体细胞凋亡,造成肌肉嫩度变差。本研究可为宰后牦牛肉成熟过程中细胞凋亡理论与嫩度调控提供一定的理论依据,同时为后续研究HIF-1α在宰后牦牛肉细胞中的调控机制提供新的思路。
