爱媛类芽孢杆菌抗菌肽对扩展青霉孢子的抑制作用机制
2023-09-12王志新刘丹丹贾紫伟黄玉清宁亚维贾英民
王志新,刘丹丹,贾紫伟,黄玉清,宁亚维,贾英民*
(1.河北科技大学食品与生物学院,河北 石家庄 050018;2.北京工商大学食品与健康学院,北京 100048)
苹果、梨、桃等日常食用的水果营养丰富,但是水果在采收、包装、运输和贮藏过程中容易出现机械损伤[1],加速病原真菌侵染果实[2],导致水果腐烂变质,采后阶段新鲜水果腐烂造成的巨大经济损失已成为全球性问题[3-5]。其中,由扩展青霉引发的青霉病不但能导致果实腐烂,还会产生展青霉素、棒曲霉素、桔青霉素等致病毒素从而危害人类健康[6-8]。因此,防止水果被青霉菌侵染已成为果蔬贮藏中亟需解决的问题。
目前,对水果采后青霉菌侵染的防治方法主要包括化学防治(噻菌灵、嘧霉胺和咯菌腈等)、物理防治(低温贮藏、热处理、微波处理和臭氧法等)和生物防治(拮抗微生物)。化学防治和物理防治会影响水果风味,并会使病原菌产生耐药性,同时还存在费用高、耗能大、不环保、不安全等问题。因此,亟需寻找安全、有效的防治措施来控制水果采后青霉菌的侵染。生物防治作为一种现代新兴技术,受到社会各界的广泛欢迎。
抗菌肽是广泛存在于自然界中具有抗菌活性的小分子生物活性肽,一般由10~60 个氨基酸残基组成,对细菌、真菌、癌细胞等具有较好的杀伤作用,其广谱性、无耐药性、高效性等优势使其成为炙手可热的潜在替代抗生素的抑菌物质[9-11]。基于此,许多学者开展了对抗菌肽抑菌机理的深入研究,这些研究推动了抗菌肽在食品、医药、农业、畜牧业等领域的发展[12]。
类芽孢杆菌是一种能产生抗性芽孢的好氧或兼性厌氧的杆状细菌,可以用于植物和动物疾病的生物防治[13]。类芽孢杆菌广泛分布于自然环境中,可以产生如多肽、环状脂肽、细菌素和挥发物等多种抑菌化合物以及细胞壁降解酶[14-15]。现已报道了多种具有抗性的类芽孢杆菌,如多粘类芽孢杆菌、爱媛类芽孢杆菌等,其中以多粘类芽孢杆菌居多。研究发现,类芽孢杆菌产生的抗菌肽对原生动物、酵母、真菌、病毒、癌细胞等具有杀伤作用[16],且天然抗菌肽具有稳定、无毒、耐药、高效等优点,已成为具有研究潜力的抑菌剂[17]。
爱媛类芽孢杆菌(Paenibacillus ehimensis)是一种具有拮抗作用的抗性菌株,其具有广谱抑菌性,对革兰氏阳性细菌、革兰氏阴性细菌和病原真菌具有较好的抑制作用。Hong等[18]研究发现P.ehimensisRS820对引起番茄根部病害的植物病原线虫具有显著的生长抑制作用。Naing等[19]从土壤中分离得到一株P.ehimensisKWN38,其产生的挥发性抑菌物质以及几丁质酶、纤维素酶、葡聚糖酶、蛋白酶能够较好地抑制立枯丝核菌AG-1、尖孢镰刀菌等植物病原真菌。Seo等[20]研究发现P.ehimensisMA2012分泌的几丁质酶对赤霉病菌孢子萌发具有较好的抑制作用。相比研究较多的粘类芽孢杆菌抗菌肽,对爱媛类芽孢杆菌抗菌肽的研究较少。Huang Zhaohui等[21]从P.ehimensisB7中分离出两种阳离子脂肽抗菌肽PE1和PE2,其分子质量分别为1 114 Da和1 100 Da,对病原细菌具有较好的抑制作用,如对耐甲氧西林金黄色葡萄球菌、大肠杆菌等致病菌均具有抑菌活性。Aktuganov等[22]从P.ehimensisIB-X-b代谢产物中分离纯化出具有抗真菌活性的杆菌霉素L和fengycin、plipastatin、agrastatin家族的环状脂肽。但目前鲜有关于爱媛类芽孢杆菌抗菌肽对扩展青霉抑制的研究报道。
本课题组前期从爱媛类芽孢杆菌HD中分离纯化出具有广谱抑菌性的抗菌肽,其对真菌抑制效果较好,且抑制作用高效、稳定[23]。爱媛类芽孢杆菌经过发酵后收集其发酵上清液,采用大孔树脂吸附-解吸附法获得抗菌肽的粗提液,进一步利用半制备高效液相色谱法进行抗菌肽的纯化,获得纯度不低于98%的抗菌肽,命名为爱媛类芽孢杆菌抗菌肽ehimensin。本研究以采后水果常见的腐败菌——扩展青霉作为指示菌,考察爱媛类芽孢杆菌抗菌肽对其抑菌活性,之后分别从孢子萌发、形态结构、细胞壁、细胞膜、活性氧累积等方面探讨抗菌肽对扩展青霉孢子的抑制机理,以期为水果采后防腐提供理论依据,并为新型天然果蔬保鲜剂的开发提供参考。
1 材料与方法
1.1 材料与试剂
扩展青霉(Penicillium expansum)CICC 40658由河北科技大学酶工程实验室保存。
爱媛类芽孢杆菌抗菌肽ehimensin由本课题组制备,抗菌肽呈粉末状,1 mg/mL抗菌肽溶液效价为22.5 AU/mL。
PDA、PDB培养基 北京奥博星生物技术有限公司;钾结合性苯并呋喃间苯二甲酸(potassium-binding benzofuran isophthalate,PBFI)、3,3’-二丙基硫杂羰花青碘化物(3,3’-dipropylthiadicarbocyanine iodide,DiSC3(5))、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)、1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH) 美国Sigma公司;SYTOX-Green、碘化丙啶(propidium iodide,PI)美国Thermo Fisher公司。
1.2 仪器与设备
ZSD-A1160恒温培养箱 上海智诚分析仪器制造公司;CX31显微镜 日本奥林巴斯株式会社;S-4800-I扫描电子显微镜、H-7650透射电子显微镜、F-7000荧光分光光度计 日本日立公司;Accuri C6 Plus流式细胞仪美国Becton Dickinson公司;Spectramax Plus 384酶标仪美谷分子仪器有限公司;3-18K高速冷冻离心机 德国Sigma公司。
1.3 方法
1.3.1 扩展青霉孢子悬液的制备
挑取1~2 环保藏的扩展青霉孢子,接种至PDA平板上,(25±1)℃培养7 d左右,轻轻刮取孢子,生理盐水洗脱,无菌脱脂棉过滤,血球计数板计数,生理盐水稀释备用。
1.3.2 抗菌肽对扩展青霉最小抑菌浓度的测定
参照Park等[24]的方法,采用微量二倍稀释法测定抗菌肽的最小抑菌浓度(minimum inhibitory concentration,MIC)。使用PDB培养基在96 孔板中对抗菌肽进行二倍梯度稀释,使其形成不同质量浓度的抗菌肽,再加入等体积扩展青霉孢子悬液(终浓度1×104CFU/mL),并设置真菌生长孔和空白对照孔。置于25 ℃下培养24~48 h,以孔底无可见孢子生长的最低抗菌肽活力为MIC。实验重复3 次。
1.3.3 抗菌肽对扩展青霉孢子的时间-杀菌曲线测定
分别向PDB培养基中添加抗菌肽,使其终质量浓度分别为0.5、1、2 MIC,以不加抗菌肽的培养基作为空白对照,标记为0 MIC,接种扩展青霉孢子悬液使其终浓度为1×104CFU/mL。25 ℃、150 r/min摇床培养,分别于0、1、2、3、4、6、8、10、12 h取样,稀释涂布,计算活菌数。以时间为横坐标、菌落总数(lg(CFU/mL))为纵坐标绘制时间-杀菌曲线。
1.3.4 扩展青霉孢子萌发率的测定
参照韩玉竹等[25]的方法,取扩展青霉孢子悬液,离心、收集菌体,并用PDB培养基重悬至1×107CFU/mL,等体积添加至用PDB培养基稀释的抗菌肽溶液中,使抗菌肽终质量浓度分别为0、0.5、1、2 MIC,混匀,将每个实验组添加至单个凹形滑槽中,置于有湿棉绒的培养皿中,25 ℃下培养。10 h后用光学显微镜观察,对不少于3 个视野和不少于200 个萌发和未萌发孢子进行计数,按照下式计算孢子萌发率。
1.3.5 扩展青霉孢子超微结构观察
取扩展青霉孢子悬液,收集菌体,用0.1 mol/L pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,重悬至孢子浓度为1×107CFU/mL,等体积加入PBS稀释的抗菌肽使其终质量浓度分别为0、0.5、1、2 MIC,作用12 h后用PBS洗涤3 次,制备扫描电子显微镜(5.0 kV、1 000×)和透射电子显微镜(80 kV、4 000×)样品,进行超微结构观察。
1.3.6 扩展青霉孢子细胞壁完整性的测定
参照王辉等[26]的方法,取扩展青霉孢子悬液离心收集菌体,并用PDB培养基重悬至1×107CFU/mL,添加抗菌肽使其终质量浓度分别为0、0.5、1、2 MIC,25 ℃、150 r/min振荡培养,于0、2、4、8、10、24、36、48 h取样,1 500 r/min离心10 min,取上清液,按照碱性磷酸酶(alkaline phosphatase,AKP)试剂盒测其AKP活力。
1.3.7 扩展青霉孢子细胞膜跨膜电势的测定
参照Wang Zichao等[27]的方法,取孢子悬液,离心弃上清液,用含有10 mmol/L葡萄糖的Hepes缓冲液(5 mmol/L、pH 7.2)清洗并重悬。加入荧光探针DiSC3(5)(终浓度为2 μmol/L),30 ℃避光孵育15 min,离心弃上清液,用Hepes缓冲液清洗并重悬,加入KCl溶液(终浓度100 mmol/L)。1×107CFU/mL孢子悬液与等体积抗菌肽溶液混匀使其质量浓度分别为0、0.5、1、2 MIC,使用荧光分光光度计进行时间扫描(λex=650 nm、λem=672 nm),扫描时间为180 s。
1.3.8 扩展青霉孢子细胞膜渗透性的测定
取扩展青霉孢子悬液收集菌体,用Hepes缓冲液(5 mmol/L、pH 7.2)清洗并重悬,调整孢子悬液浓度为1×107CFU/mL,加入PBFI探针。孢子悬液与不同终质量浓度(0、0.5、1、2 MIC)的抗菌肽溶液等体积混合作用30 min。在λex=346 nm和λem=505 nm条件下,使用荧光分光光度计测定荧光强度。
1.3.9 扩展青霉孢子细胞膜流动性的测定
取扩展青霉孢子悬液收集菌体,用生理盐水清洗并重悬,制备浓度为1×107CFU/mL的扩展青霉孢子悬液,分别等体积加入含有不同质量浓度抗菌肽的0.5%葡萄糖溶液,使抗菌肽的终质量浓度分别为0、0.5、1、2 MIC,25 ℃、150 r/min作用12 h。作用完成后4 ℃条件下离心并收集菌体,体积分数0.37%的甲醛溶液固定30 min后用50 mmol/L PBS(pH 7.0)洗涤两次。菌体在-40 ℃冰箱中冷冻5 min,加入0.6 mmol/L DPH溶液解冻并重悬,28 ℃孵育45 min,用PBS(50 mmol/L、pH 7.0)洗涤重悬,使用荧光分光光度计测定荧光强度(λex=350 nm、λem=425 nm)。
1.3.10 扩展青霉孢子细胞膜完整性的测定
扩展青霉孢子悬液与抗菌肽作用处理同1.3.9节,之后6 000 r/min离心10 min,用生理盐水洗涤,重悬。分别加入SYTOX-Green荧光染液和PI荧光染液,避光孵育30 min,再用生理盐水洗涤重悬。前者使用荧光分光光度计测定荧光强度并用荧光显微镜观察,后者使用流式细胞仪进行定量分析。
1.3.11 扩展青霉孢子活性氧的测定
扩展青霉孢子悬液与抗菌肽作用处理同1.3.9节,之后加入荧光染料DCFH-DA,30 ℃黑暗孵育20 min,PBS 洗涤重悬,在λex=485 nm、λem=530 nm条件下用荧光分光光度计测定荧光强度。
1.4 数据处理与分析
所有实验均进行3 次平行,结果以平均值±标准差表示。数据用SPSS 17.0软件通过单因素方差分析法进行统计分析,利用Origin 8.0、Excel软件绘图。
2 结果与分析
2.1 抗菌肽对扩展青霉孢子的抑菌活性
采用微量二倍稀释法测定抗菌肽对扩展青霉孢子的抑制作用。其MIC为3.5 AU/mL。
通过时间-杀菌曲线进一步探究抗菌肽对扩展青霉的抑菌活性。由图1可知,空白对照组(0 MIC)的孢子生长正常,菌体量稳定在初始浓度;处理组随着抗菌肽质量浓度的增加,扩展青霉孢子数量减少。2 MIC处理组在作用1 h后对孢子开始表现出抑制作用,作用12 h后可以完全抑制孢子的生长,将孢子全部杀灭。
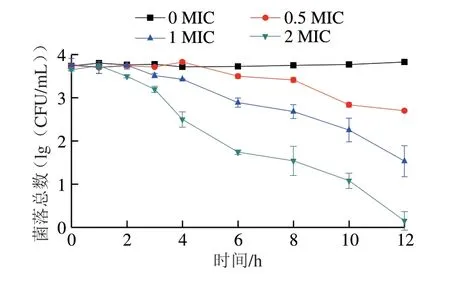
图1 抗菌肽对扩展青霉孢子的时间-杀菌曲线Fig.1 Time-killing curves of the antimicrobial peptide on P.expansum spores
2.2 抗菌肽对扩展青霉孢子萌发的影响
如图2、3所示,空白对照组(0 MIC)孢子的萌发率为100%,孢子全部萌发,且长出了较长的芽管。0.5 MIC抗菌肽对孢子产生了一定程度的抑制,萌发率为71.7%,与空白对照组相比降低28.3%(P<0.05),且芽管长度变短。当抗菌肽质量浓度为1 MIC时,孢子萌发率发生了较大的变化,下降到15.43%,与空白对照组相比降低84.57%,且芽管生长长度较短;2 MIC处理组孢子萌发率为0%。
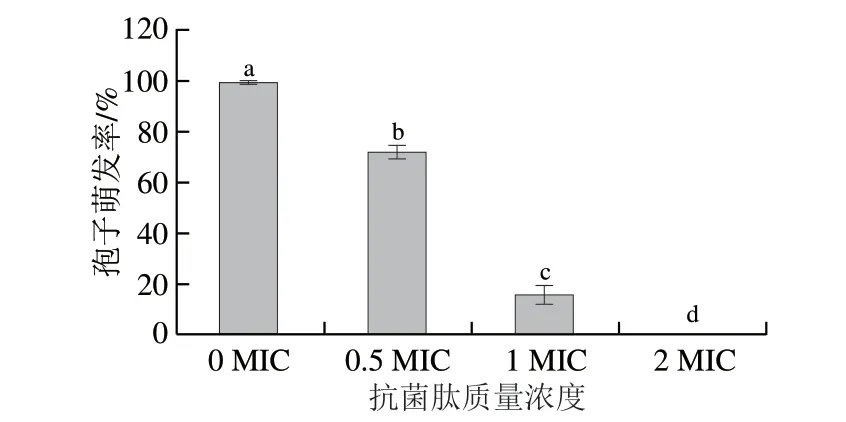
图2 抗菌肽处理后扩展青霉的孢子萌发率Fig.2 Spore germination rate of P.expansum treated with the antimicrobial peptide

图3 抗菌肽处理后扩展青霉孢子的生长状态Fig.3 Growth state of P.expansum spores treated with the antimicrobial peptide
Zhu Congyi等[28]的研究表明,质量浓度为0、400 μg/mL和600 μg/mL的单宁酸对指状青霉孢子作用12 h后孢子萌发率分别为90%、61.4%、12.4%。单从孢子萌发率看,本研究中抗菌肽对扩展青霉孢子萌发率的影响趋势与Zhu Congyi等[28]的研究结果一致,但Zhu Congyi等[28]发现被抑制萌发的指状青霉孢子会出现肿胀,而本研究发现被抑制萌发的扩展青霉孢子会发生皱缩。孢子萌发过程中会先吸水膨胀然后长出芽管,本研究中抗菌肽对孢子萌发的抑制效果较强,2 MIC处理组能够完全抑制孢子萌发,因此孢子未出现肿胀现象;同时结合后续扫描电子显微镜和透射电子显微镜观察结果可知,抗菌肽会使孢子出现凹陷、内容物泄漏等现象。这些原因均导致本研究的结果不同于Zhu Congyi等[28]的研究。
2.3 抗菌肽对扩展青霉孢子超微结构的影响
扫描电子显微镜观察结果如图4所示。空白对照组(0 MIC)孢子表面较为饱满、完整,且轮廓清晰,呈椭圆形。随着抗菌肽质量浓度的增加,孢子凹陷程度逐渐加剧,高质量浓度处理组甚至出现破裂现象,内容物的泄漏量也在逐渐增多。此结果与其他研究者观察到的抑菌现象相似,如鞠健[29]发现丁香酚和柠檬醛可以使娄地青霉和黑曲霉孢子表面发生褶皱、破裂、干瘪。

图4 扫描电子显微镜观察抗菌肽对扩展青霉孢子形态结构的影响Fig.4 Effect of the antimicrobial peptide on the morphological structure of P.expansum spores examined by SEM
透射电子显微镜观察结果如图5所示。空白对照组(0 MIC)孢子的细胞壁和细胞膜较完整且表面轮廓清晰,细胞质分布均匀。与空白对照组相比,1 MIC抗菌肽处理后的孢子表面形态发生了变化,细胞质稀薄且内容物出现泄漏。2 MIC抗菌肽处理的扩展青霉孢子细胞变形严重,质壁分离现象明显,细胞质密度严重降低。da Rocha Neto等[30]研究发现水杨酸作用扩展青霉孢子后其质膜产生内陷,细胞质紊乱,与本研究结果相似。综上,对孢子超微结构的观察结果表明抗菌肽会使扩展青霉孢子发生形态和结构变化。

图5 透射电子显微镜观察抗菌肽对扩展青霉孢子形态结构的影响Fig.5 Effect of the antimicrobial peptide on the morphological structure of P.expansum spores examined by TEM
2.4 抗菌肽对扩展青霉孢子细胞壁完整性的影响
AKP位于细胞壁和细胞膜之间,当菌体细胞壁完整性被破坏,AKP会从菌体中释放到体外,故可通过测定AKP的活力来判断抗菌肽对细胞壁通透性的影响。由图6可知,与空白对照组(0 MIC)比较,处理组的AKP活力高于空白对照组,可见,抗菌肽对扩展青霉孢子细胞壁具有一定的破坏作用。王辉等[26]发现柠檬苦素作用黑曲霉后,处理组AKP含量高于空白对照组,表明柠檬苦素破坏了细胞壁的完整性。

图6 抗菌肽对扩展青霉孢子AKP活力的影响Fig.6 Effect of the antimicrobial peptide on alkaline phosphatase activity of P.expansum spores
2.5 抗菌肽对扩展青霉孢子细胞膜跨膜电势的影响
DiSC3(5)是一种亲脂性荧光探针,进入细胞内质膜中会发生荧光猝灭,结构完好的细胞中存在一定的跨膜电势,当细胞膜的通透性发生变化或离子通道受到影响时,膜电势会消失,荧光染料会从细胞膜中释放出来,导致荧光信号增强。如图7所示,随着抗菌肽质量浓度的增加,荧光强度逐渐增加。处理180 s时,空白对照组(0 MIC)荧光强度为70.91,0.5、1、2 MIC处理组抗菌肽的荧光强度分别增加至119.4、138.2、163.3。由此说明该抗菌肽会造成扩展青霉孢子细胞膜跨膜电势降低,引起细胞膜去极化。
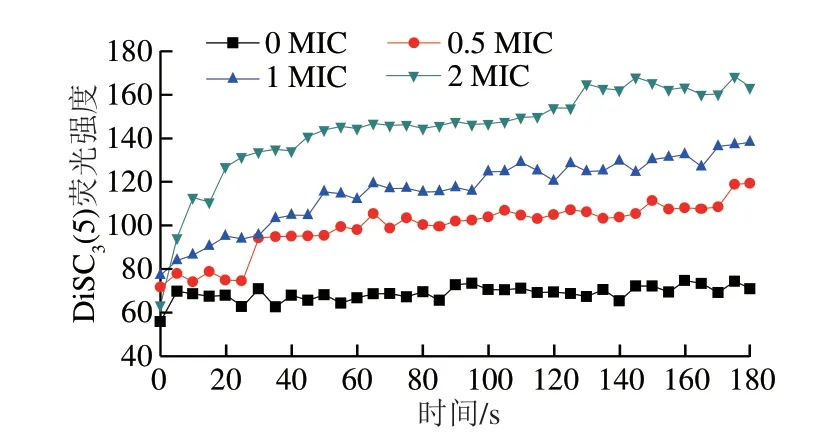
图7 抗菌肽对扩展青霉孢子细胞膜跨膜电势的影响Fig.7 Effect of the antimicrobial peptide on the transmembrane potential of P.expansum spores
2.6 抗菌肽对扩展青霉孢子细胞膜渗透性的影响
K+对于平衡质膜上的电荷至关重要,有助于维持细胞内pH值和膜电位。当扩展青霉细胞发生膜去极化时,K+的连续流失会导致细胞死亡[31]。通过不具备膜渗透性的PBFI探针考察不同质量浓度抗菌肽对扩展青霉钾离子泄漏的影响,结果如图8所示。抗菌肽与扩展青霉孢子作用30 min后,处理组荧光强度显著增加(P<0.05),K+泄漏量与抗菌肽的质量浓度呈正相关。由此推测,抗菌肽能够使扩展青霉孢子细胞膜的渗透性发生改变,导致K+泄漏,膜功能受到破坏,加速细胞死亡。
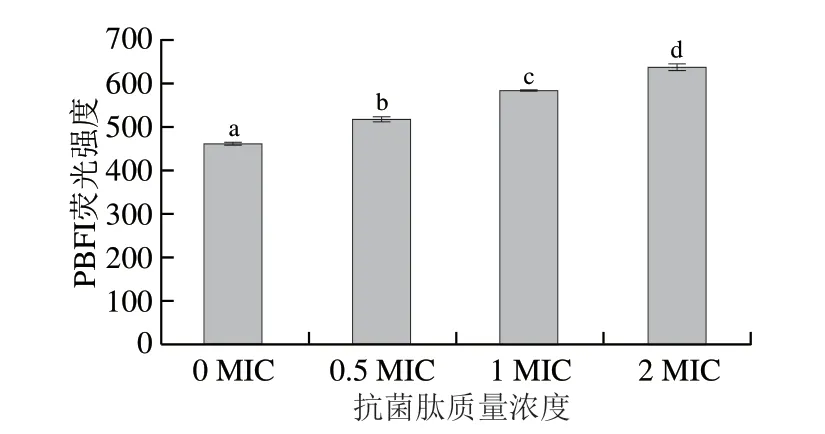
图8 抗菌肽对扩展青霉孢子细胞膜K 泄漏的影响Fig.8 Effect of the antimicrobial peptide on K+ leakage from P.expansum spores
2.7 抗菌肽对扩展青霉孢子细胞膜流动性的影响
DPH是一种用于研究膜脂流动性的荧光探针,可以与扩展青霉孢子的疏水区结合,而不会干扰脂质双层结构,DPH的荧光强度可以用来衡量细胞膜磷脂双分子层损伤的程度。如图9所示,经过0、0.5、1、2 MIC抗菌肽处理后,DPH的荧光强度分别为1 547.67、1 110.00、612.07和388.80;随着抗菌肽质量浓度的增加,DPH荧光强度显著降低(P<0.05),说明抗菌肽破坏了扩展青霉孢子细胞膜的流动性。Lee等[32]的研究表明,合成的杂合肽作用于白色念珠菌后,DPH的荧光强度显著降低,说明杂合肽影响了白色念珠菌细胞膜的结构功能。

图9 抗菌肽对扩展青霉孢子细胞膜流动性的影响Fig.9 Effect of the antimicrobial peptide on the cell membrane fluidity of P.expansum spores
2.8 抗菌肽对扩展青霉孢子细胞膜完整性的影响
SYTOX-Green荧光染料不具有膜渗透性,只有在膜完整性受损或者形成孔洞时,其可以与细胞核结合,在一定条件下发出绿色荧光。结合图10和图11可见,抗菌肽作用后的孢子荧光强度显著增加,说明该抗菌肽会使扩展青霉孢子细胞膜的完整性受损。空白对照组(0 MIC)荧光强度在130左右,在荧光显微镜下看不到绿色。0.5、1、2 MIC处理组孢子荧光强度分别为373、437和527。随着抗菌肽质量浓度的增加,呈绿色荧光的孢子比例增加,荧光强度逐渐增大,说明孢子的膜受损率增加。Han Yuzhu等[33]研究发现P852肽作用尖孢镰刀菌时,随着P852剂量增加,细胞内SYTOX-Green的绿色荧光信号强度也相应增加。

图10 荧光分光光度计分析抗菌肽对扩展青霉孢子细胞膜完整性的影响Fig.10 Effect of the antimicrobial peptide on the integrity of spore cell membrane of P.expansum analyzed by fluorescence spectrophotometry
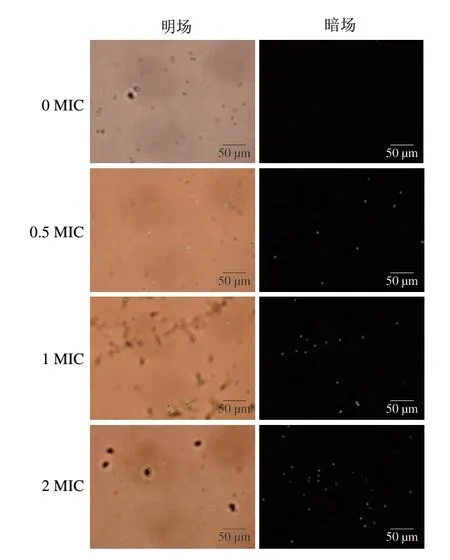
图11 荧光显微镜观察抗菌肽对扩展青霉孢子细胞膜完整性的影响Fig.11 Effect of the antimicrobial peptide on the integrity of spore cell membrane of P.expansum analyzed by fluorescence microscopy
如图12所示,空白对照组(0 MIC)的PI沾染率为3.3%,0.5、1、2 MIC处理组PI沾染率分别为7.7%,26.7%和73.3%。随着抗菌肽质量浓度的增加,PI的沾染率增加,说明抗菌肽对扩展青霉孢子细胞膜具有破坏作用,且与抗菌肽质量浓度呈正相关性。该结果与SYTOXGreen荧光染色结果趋势一致,进一步验证了抗菌肽会破坏扩展青霉孢子的细胞完整性。

图12 流式细胞术分析抗菌肽对扩展青霉孢子细胞膜的影响Fig.12 Flow cytometry analysis of the effect of the antimicrobial peptide on the cell membrane of P.expansum spores
2.9 抗菌肽对扩展青霉孢子胞内活性氧的作用
如图13所示,随着抗菌肽质量浓度的升高,DCFH-DA荧光强度逐渐增大。空白对照组(0 MIC)与0.5 MIC抗菌肽处理组DCFH-DA荧光强度差异不显著,但与1 MIC和2 MIC处理组之间有显著性差异(P<0.05)。说明抗菌肽影响了扩展青霉孢子中活性氧的积累,从而抑制了扩展青霉孢子正常的生长繁殖。

图13 抗菌肽对扩展青霉孢子胞内活性氧的影响Fig.13 Effect of the antimicrobial peptide on intracellular ROS accumulation in P.expansum spores
3 讨 论
新鲜水果在每年采后阶段的腐烂是全球性的问题,真菌是导致水果腐烂最大的微生物群体。大量化学试剂的使用让许多腐败真菌产生了耐药性。因此,自然界中无毒害且高效的新型生物抗真菌剂成为了热点研究方向,其中抗菌肽在应对真菌防治方面受到了极大关注。抗菌肽作为新型抑菌物质,其对细菌的抑菌机理报道较多,而对青霉菌的抑制机理报道较少。扩展青霉作为常见的采后水果腐败菌,其生长会导致水果腐烂变质,产生的展青霉素会危害人体健康,而且被展青霉素侵染的果制品难以根除其污染,因此要从根本上避免采后水果被青霉菌侵染。
本研究以新型的抑菌物质抗菌肽作为抑菌剂,探究其对引起水果腐败的常见病原菌——扩展青霉的抑菌作用。结果表明,经0.5、1、2 MIC抗菌肽处理后,扩展青霉孢子的萌发率分别为71.7%、15.43%和0%。张晨等[34]发现当蜜环菌发酵液浓度为MIC时,链格孢霉菌孢子萌发率为19.01%。Hu Fei等[35]研究发现丁香和肉桂精油能够显著抑制黑曲霉、米曲霉、赭曲霉孢子的萌发,且呈剂量依赖性;丁香精油对这3 种真菌孢子的MIC为0.25 mg/mL,其孢子萌发率在80%~90%之间。对比已有的报道,本研究中的抗菌肽对指示菌孢子萌发具有较好的抑制作用。孢子有坚实的孢子壁和皮层,孢子的破坏程度能反映抗菌肽对孢子的抑制效果。通过透射电子显微镜与扫描电子显微镜观察发现,随着抗菌肽质量浓度的增加,孢子破损严重。由此表明抗菌肽对扩展青霉具有良好的抑制效果。不同质量浓度的抗菌肽在较长时间内对扩展青霉孢子能持续发挥抑菌作用,且抑制效果与抗菌肽浓度呈正相关。该结果与Wang Kairong等[36]报道的抑菌肽polybia-CP的抑菌效果相似。在此基础上,本研究进一步开展了抗菌肽对扩展青霉孢子抑菌机理的研究。
细胞壁是维持细胞正常形态的重要组成部分,是免受外界因素干扰的第一道屏障,也是对物质运输起到很好传递作用的媒介。本研究中,抗菌肽可使扩展青霉孢子的AKP从菌体中释放到体外,由此可知其对扩展青霉孢子细胞壁完整性有一定破坏作用。
细胞膜能够维持病原菌细胞形态和正常生理功能,位于细胞外部环境与胞内营养物质的界面位置是环境胁迫下破坏的主要目标,也是应激条件的传感器[18-19,37]。本研究发现,抗菌肽可影响扩展青霉孢子的细胞膜流动性,并且使其电势消散,引起细胞膜去极化。细胞膜去极化将通过质膜电压门控钙离子通道和其他未知转运体诱导钙离子摄取,从而诱导细胞凋亡和细胞程序性死亡[38]。Choi等[31]也通过荧光分光光度计测定DiSC3(5)荧光强度的变化来评估阳离子抗菌剂聚六亚甲基胍盐酸盐对白色念珠菌细胞膜的损伤,结果表明聚六亚甲基胍盐酸盐能够有效消散膜电位,这是因为质膜上形成了孔洞,大量的离子发生转移导致。本研究中的抗菌肽在导致细胞膜去极化的同时,还改变了细胞膜的渗透性,使K+发生泄漏。K+渗透和细胞内的渗透压失衡反过来会导致细胞内细胞器的破坏和细胞收缩,进而导致细胞死亡[39]。
通过对扩展青霉孢子进行SYTOX-Green和PI染色发现,随着抗菌肽质量浓度的增加,SYTOX-Green荧光强度逐渐升高,PI沾染率也在不断增加。可见抗菌肽会破坏扩展青霉孢子细胞膜的完整性。观察扩展青霉孢子的超微结构也进一步验证了抗菌肽会破坏细胞膜的完整性,使细胞的形态发生改变、内容物泄漏。微生物细胞膜的完整性会直接影响细胞的生长繁殖,当细胞膜被破坏时,就会扰乱能量与信息传递,从而使微生物生长受到抑制甚至死亡[20]。
活性氧是真菌细胞凋亡的一个主要介导因素。正常情况下,细胞内部和线粒体基质中有完善的抗氧化防御体系,能够保持活性氧在一个比较低的生理浓度。在病理情况下,活性氧产生过多,会氧化细胞内的生物大分子,损伤细胞和线粒体,诱导细胞凋亡。DCFH-DA是一种可以检测胞内活性氧积累情况的探针,本身没有荧光,其进入细胞后,可以被细胞膜内的酯酶水解生成DCFH,而DCFH不会通过细胞膜,容易聚集在细胞内。细胞内的活性氧能够氧化无荧光的DCFH生成有荧光的DCF,绿色荧光强度与活性氧的水平成正比。Wei Qinghui等[40]的研究表明白屈菜红碱处理会明显影响稻曲病菌孢子细胞内活性氧的产生,并且白屈菜红碱以剂量依赖性方式诱导活性氧积累。王楚[41]发现经丙酮酸乙酯处理过的草酸青霉和葡萄孢属孢子中出现了活性氧积累,进而诱导胞体氧化损伤。本研究也得到了相似的结果,经抗菌肽处理的扩展青霉孢子中出现了活性氧的累积,从而抑制扩展青霉孢子正常的生长繁殖。
4 结 论
爱媛类芽孢杆菌抗菌肽对扩展青霉孢子具有良好的抑菌效果,可以抑制孢子萌发,对细胞壁完整性有一定破坏作用。爱媛类芽孢杆菌抗菌肽对扩展青霉孢子的抑制靶点主要为细胞膜。抗菌肽破坏了细胞膜的完整性,使细胞的形态发生改变、内容物泄漏;消散了扩展青霉孢子的跨膜电势;增加了细胞膜的渗透性,造成K+泄漏;增加了细胞膜的流动性。抗菌肽作用于扩展青霉孢子的另一个靶点是活性氧,抗菌肽使扩展青霉孢子中活性氧积累,影响其正常的生长代谢,从而抑制扩展青霉孢子正常的生长繁殖。本研究可为水果采后保鲜贮藏方面的应用提供一定的参考,并为水果病害的安全、高效防治提供理论依据。
