南美白对虾热风干制过程蛋白质与品质变化关系分析
2023-09-12徐文雅马倩云王佳荣孙剑锋汤轶伟王文秀
徐文雅,马倩云*,王佳荣,孙剑锋,汤轶伟,王 颉,王文秀*
(河北农业大学食品科技学院,河北 保定 071000)
南美白对虾(Penaeus vannamei)是当今世界上养 殖最多的三大优 良虾类之一,目前已成为我国 重要的养殖虾种。根据《中国渔业统计年鉴》,2020年中国南美白对虾养殖产量高达119.77万 t[1]。对虾水分含量高、组织柔嫩、结缔组织少,体内酶类在常温下活性强,因而极易发生腐败变质,故贮藏期较短。干制后的虾干因味道鲜美、营养丰富 而深受广大消费 者喜爱,并且具有易贮存、方便 携带等优点。因此,干制已成为延长对虾贮藏期的重要加工方式之一。
热风干制是一种常见的海鲜干制方法,具有生产量大、操作简便、流程简化且易自动控制等特点[2],因此在工业干制生产中常采用此方法。在干制过程中,受干制温度和时间的影响,水产品中水分不断蒸发、细胞液浓缩、化学键发生新生和断裂,氨基酸多肽链展开,从而导致蛋白质变性并逐渐丧失生物活性[3]。作为重要的肌肉成分,蛋白质变化可以实质性地影响虾的色泽和质构特性,因此,深入研究干制过程中对虾蛋白质变化规律及其与品质变化的内在联系,可为提高南美白对虾干制品质量提供理论依据。而现阶段对于对虾干制的研究主要集中在不同加工方式和加工工艺优化对干制品理化特性、营养成分等指标的影响方面[4-5],对引起理化品质变化的深层原因缺乏系统的研究,对干制过程中蛋白质变化规律及其与品质变化的相关关系尚不明确。
基于上述问题,本研究以南美白对虾为原料,对其进行热风干制加工处理,分析干制过程中色泽、质构、微观结构等品质特性变化规律,并深入探讨干制过程中蛋白质氧化降解程度、分子内价键、蛋白质二级结构、三级结构的变化,从分子层面揭示干制诱导的对虾蛋白变化规律。在此基础上,通过相关性分析解析蛋白质变化与品质的内在联系,以期明确蛋白质变化对虾干品质的影响,为进一步提升水产品干制品品质提供理论支撑。
1 材料与方法
1.1 材料与试剂
鲜活对虾购买于河北省保定 市南市区农大科技市场。
无水乙醇、乙酸乙酯、氯化钠溶液等化学试剂(均为分析纯) 西安三浦化学试剂 有限公司。
1.2 仪器与设备
DHG-914385-111电热鼓风干燥箱 吴江德顺电热设备厂;CR-400色彩色差计 美国HunterLab公司;TMS-Pro食品物性分析仪 美国FTC公司;TGL21M台式高速冷冻离心机 湖南易达京华仪器有限公司;F97荧光分光光度计 上海棱光技术有限公司;165-8001电泳仪 美国Bio-Rad公司;Tiss-24高通量组织研磨仪宁波新智生物科技有限公司;AccuRam拉曼光谱仪美国Ocean Optics公司。
1.3 方法
1.3.1 虾样品的制备
购买单只质量约为(15±3)g的活虾,低温运到河北农业大学果蔬加工与创新实验室,将其放入0 ℃冰水中直至死亡。将适量的虾在质量分数3%的盐水中煮沸2 min,然后取出去除表面水分,将虾样品置于55 ℃的恒温鼓风干燥箱中进行干制。根据前期研究结果,干制12 h时,虾干的口感最佳[6],因此设定总干制处理时间为12 h,每2 h取样一次,测定品质和蛋白质变化指标,实验重复3 次。
1.3.2 品质指标测定
1.3.2.1 色泽测定
利用CR-400色彩色差计对虾肉的L*、a*、b*值进行测定并计算色差∆E。其中L*值表示亮度,a*值表示红绿度,b*值表示黄蓝度。测试时需进行白 板校正。
1.3.2.2 质构特性测定
将对虾去壳进行质构特性分析(texture profile analysis,TPA),测定样品的硬度、黏附性、弹性、胶黏性和咀嚼性。测量模式为TPA测定程序,探头型号P/5,感应力量程为200 N,检测速率为30 mm/min,形变量为60%,起始力为0.5 N。
1.3.2.3 微观结构的观察
参考王稳航等[7]的方法,采用扫描电子显微镜(scanning electron microscope,SEM)观察虾肌肉组织的微观结构。将样品切成3 mm×3 mm×3 mm的正方体进行实验。用体积分数2.5%戊二醛溶液在4 ℃中浸泡样品24 h,然后分别用体积分数10%、20%、40%、60%、80%的乙醇溶液和无水乙醇进行梯度洗脱20 min,随后真空冷冻干燥得到样品。将试样进行喷金操作,抽真空后进行观察,放大倍数为1 000。
1.3.3 蛋白质指标测定
1.3.3.1 总巯基含量测定
总巯基含量测定参照 鲁耀彬等[8]方法,称取2.0 g虾肉样品放入50 mL离心管,加入10 mL 50 mmol/L的磷酸缓冲液(pH 8.0),8 500×g下匀浆2 min,再1 500×g离心10 min,取上清液1 mL并用蒸馏水制成10 倍稀释液,再加入20 μL 2 mmol/L的5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)试剂进行涡旋混匀,25 ℃遮光处理1 h后在412 nm波长处测定吸光度。用BCA试剂盒测定蛋白质量浓度。实验重复3 次,总巯基含量按公式(1)计算。
式中:A为吸光度;ρ为蛋白质量浓度/(mg/mL);ε为摩尔消光系数(13 600 L/(mol·cm));D为稀释倍数(10)。
1.3.3.2 蛋白羰基含量测定
蛋白羰基含量测定参考石径[9]的方法并进行适当修改。称取2.0 g肉样于10 mL含0.6 mol/L NaCl的20 mmol/L磷酸缓冲液(pH 6.5)中进行匀浆,1 500×g离心10 min,取400 μL上清液于2 mL EP管中,加入含10 mmol/L 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)的200 μL 2 mol/L HCl,30 ℃水浴锅中避光反应1 h。每EP管中加1 mL质量分数40%三氯乙酸(trichloroacetic acid,TCA)沉淀蛋白,静置20 min后10 000×g离心15 min,弃去上清液,用1 mL乙酸乙酯-乙醇溶液(1∶1,V/V)洗涤沉淀以除去未反应的DNPH,重复上述步骤至上清液无色,用3 mL 6 mol/L盐酸胍溶液溶解蛋白,沉淀完全溶解后在317 nm波长处测吸光度。实验重复3 次,BCA试剂盒测定蛋白浓度。蛋白羰基含量按公式(2)计算。
式中:A为吸光度;a为羰基分子吸光系数(22 000 L/(g·cm);b为光程(1 cm);ρ为蛋白质量浓度/(mg/mL)。
1.3.3.3 三氯乙酸-可溶性肽含量的测定
TCA-可溶性肽含量的测定参考徐永霞等[10]的方法并作适当修改。称取2.0 g样品,加入18 mL预冷的5 g/100 mL TCA溶液,匀浆1 min后于4 ℃冰箱静置1 h,4 ℃条件下10 000×g离心15 min,取上清液备用,采用双缩脲法测定蛋白(可溶性肽)质量浓度。
1.3.3.4 化学作用力的测定
化学作用力的测定参照邓丽[11]的方法并略加改进。取2.0 g虾肉样品于质量分数2.5%的NaCl中均质45 s。将处理后的样品加10 mL 0.6 mol/L NaCl(试剂S1),4 500×g下匀浆2 min,4 ℃冷藏1 h。然后4 ℃、18 600×g离心25 min,上清液于4 ℃保存。将上述离心的沉淀加10 mL 1.5 mol/L尿素和0.6 mol/L NaCl的混合液(试剂S2),后续处理相同。再将上述离心的沉淀加10 mL 8 mol/L尿素和0.6 mol/L NaCl的混合液(试剂S3),后续处理相同。将上述沉淀加10 mL pH 7的0.5 mol/L 2-巯基乙醇、0.6 mol/L NaCl和8 mol/L尿素的混合液(试剂S4),后续处理相同。将每步离心后上清液分别加等体积质量分数20% TCA溶液,使之充分沉淀。然后经4 000×g离心15 min,弃上清液。向沉淀中加入1 mL 1 mol/L NaOH溶液溶解沉淀并置于4 ℃层析柜保存,每步沉淀需对应标记清楚。实验过程中经试剂S1、S2、S3及S4提取后的上清液中蛋白含量分别对应离子键、氢键、疏水键和二硫键含量,利用福林-酚法测定蛋白质量浓度。
1.3.3.5 蛋白质二级结构测定
采用拉曼光谱测定蛋白质二级结构。将虾样品去皮平铺于载物台上进行拉曼光谱扫描。激光波长为785 nm,拉曼位移范围为200~2 000 cm-1,采集时间为10 s,累计2 次。每个样品取3 个点扫描,最终拉曼光谱曲线取3 次结果的平均值。采用拉曼光谱仪配套软件AccuRam对光谱进行基点校正和荧光背景扣除。
1.3.3.6 蛋白质三级结构测定
参考姜晴晴[12]的方法提取肌原纤维蛋白,参照Xu Yanshun等[13]的方法测定内源荧光强度。用0.6 mol/L NaCl溶液将肌原纤维蛋白溶液质量浓度稀释至0.05 mg/mL,然后使用荧光分光光度计测定内源荧光光谱,激发波长为295 nm,扫描速率为1 000 nm/min,发射波长扫描范围310~400 nm,激发和发射狭缝宽度均为10 nm。
1.3.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考Laemmli等[14]的方法并作适当修改。向0.1 g样品中加入10 mL PIPA裂解液,在高通量组织研磨仪中均质,将样品冰孵20 min,14 000×g离心10 min后获得的上清液为肌原纤维蛋白原液。用BCA试剂盒测定蛋白质量浓度,并用PIPA裂解液将所有样品蛋白原液质量浓度稀释至1 500 μg/mL。将获得的肌原纤维蛋白液与上样缓冲液按体积比4∶1混合,并在沸水中加热5 min。将混合液加到SDS-PAGE凝胶上样孔中,以130 V恒压进行电泳约100 min,然后使用SDS-PAGE染色液染色30 min后蒸馏水脱色,最后通过与蛋白质标记物(10~250 kDa)比较来确定蛋白质的分子质量。
1.4 数据处理与分析
实验数据以平均值±标准差表示,统计学处理和图形处理分别利用SPSS 22.0和Origin 2018软件进行,蛋白质二级结构定量通过PeakFit V4软件进行,采用Duncan法进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 对虾热风干制过程中品质的变化
2.1.1 色差
对虾在干制过程中色泽的变化如表1所示。L*值从新鲜时的40.71增加到煮沸后的63.85,这是因为煮沸过程中热量增加,导致蛋白质变性,最终影响虾的亮度[15]。随着干制时间的延长,L*值显著降低(P<0.05),这是由于干制过程中发生美拉德反应,导致干虾变黑,亮度降低。Ling Jiangang等[16]在研究高压辅助真空冷冻干制对虾的影响时也发现美拉德反应导致虾黑变的现象。a*和b*值在整个干制过程中具有相似的变化趋势,与鲜虾相比,干虾的a*和b*值显著增加(P<0.05),这是由于虾体内胡萝卜素在加热过程中分解,虾青素释放引起的颜色变化。在干制后期,a*和b*值略有下降,这可能是由于虾青素随着热风干制时间的延长而略有损失。对于ΔE,干制过程中ΔE均高于12,表明干制过程中虾的颜色与新鲜时的颜色有明显差异。

表1 热风干制过程对虾色泽的变化Table 1 Changes in the color of shrimp during hot air drying
2.1.2 质构特性
质构特性包括硬度、黏附性、弹性、胶黏性、咀嚼性等指标。如表2所示,硬度随干制时间的延长而显著增加,到干制终点增加至344.78 N(P<0.05),这是由于虾肌肉纤维干制过程发生收缩,肌动蛋白和肌球蛋白被破坏,导致肌纤维结构紊乱[17]。弹性呈先升高后降低的趋势,干制8 h时达到最高水平。弹性的变化与肌肉的收缩有关,干制过程肌肉组织因收缩而发生不可逆变形,导致弹性整体上呈降低趋势。咀嚼性代表咀嚼固体样品所需的能量,而胶黏性代表将食物与其接触材料分离所需的能量,虾样品的胶黏性和咀嚼性随干制时间的延长而增加,到干制终点分别增加至45.01 mJ和116.50 mJ,这是质构特性共同作用的结果。

表2 热风干制过程对虾质构特性的变化Table 2 Changes in the texture of shrimp during hot air drying
2.1.3 微观结构
对虾干制过程中微观结构变化如图1所示。新鲜样品切面与表面的肌肉组织光滑细腻,几乎没有裂痕。干制4 h时,水分损失严重,从样品的切面和表面可以看出虾肉肌纤维束发生形变,肌纤维细胞间隙出现裂缝,干制8 h时肌肉纤维收缩更加严重,直到12 h肌肉纤维发生断裂。Chang Haijun等[18]报道称此现象可能是肌原纤维蛋白脱水、热变性和纤维收缩共同作用的结果。肌纤维结构之所以发生变化是因为干制过程中蛋白质氧化变性,进而发生了交联和聚集,并且肌肉的肌节可能会发生聚合或收缩,从而使间隙增大;同时在体内蛋白酶的作用下,结缔组织不断降解,导致肌纤维与肌内膜发生了脱离,也使间隙增大[19]。另外,干制前后水分含量的降低也导致肌纤维裂缝的增大,并且热处理造成了肌肉收缩,破坏了肌纤维结构的完整性。Namsanguan等[20]的研究表明干制导致肌纤维细胞收缩,肌动蛋白结构被破坏,肌纤维间隙增大的同时虾的硬度随之增大,可见虾肌肉微观结构变化与质构特性存在密切联系。
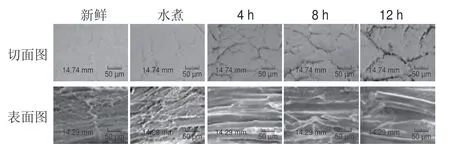
图1 对虾热风干制过程虾肌纤维切面与表面SEM图(×1 000)Fig.1 Cross-sectional and surface SEM images of shrimp during hot air drying (× 1 000)
2.2 对虾热风干制过程中蛋白质变化分析
2.2.1 总巯基和蛋白羰基含量
总巯基的损失量和蛋白羰基的生成量可反映蛋白的氧化程度。如图2所示,新鲜虾中总巯基含量为2.36 μmol/g,水煮后总巯基含量降低至0.77 μmol/g,表明存在于半胱氨酸残基中的巯基基团受到温度和有氧环境的影响,发生变性和延伸,巯基基团暴露并转化为二硫键,导致总巯基含量显著降低。随干制时间的延长,巯基基团继续被氧化,干制至终点时总巯基含量为0.36 μmol/g。Ko等[21]在研究罗非鱼热处理后成分变化时发现巯基易在分子内被氧化,生成二硫化物,导致巯基含量下降。羰基是自然氧化的主要产物,在干制过程中蛋白羰基含量从0.84 nmol/mg(鲜样)升高到2.03 nmol/mg,这是由于对虾在干制过程中赖氨酸、精氨酸和脯氨酸的侧链受到过渡金属和活性氧的攻击,肽链发生断裂,导致羰基含量升高[22]。
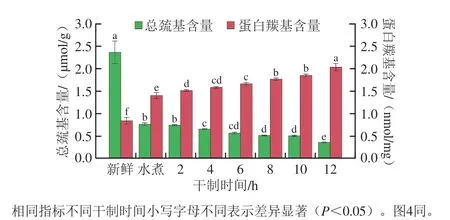
图2 对虾热风干制过程总巯基和蛋白羰基含量的变化Fig.2 Changes in total sulfhydryl group and protein carbonyl group contents in shrimp during hot air drying
2.2.2 TCA-可溶性肽含量
TCA-可溶性肽含量作为表征蛋白质降解的指标之一[23],能够反映对虾所含小分子肽的含量,从而反映蛋白质的降解程度。对虾在热风干制过程中TCA-可溶性肽的含量变化如图3所示。TCA-可溶性肽含量总体呈上升趋势。新鲜虾中TCA-可溶性肽的含量为0.56 μmol/g,水煮后降至0.43 μmol/g,之后随干制时间的延长,又逐渐增多。Nie Xiaohua等[24]发现内源酶有助于TCA-可溶性肽的释放,可以看出水煮过程使部分内源性蛋白酶失活,但并没有将虾中的内源酶完全去除,致使TCA-可溶性肽含量在干制过程中逐渐增多。干制6 h后TCA-可溶性肽含量增加更明显,这是因干制引起蛋白质变性、保水力降低、水分流失加快所致。

图3 对虾热风干制过程TCA-可溶性肽含量的变化Fig.3 Changes in TCA-soluble peptide content of shrimp during hot air drying
2.2.3 化学作用力的变化
离子键、氢键、疏水键、二硫键等 维持蛋白质分子构象的化学作用力变化可反映蛋白质的变性程度,热风干制过程各化学作用力变化如图4所示。离子键是较弱的键合力,在加热过程中容易被破坏。随干制时间的延长离子键的相对含量显著降低(P<0.05),从21.66%(鲜样)下降到11.62%(干制12 h),表明干制过程中虾蛋白质受温度的影响,电子吸收热能变得活跃,导致离子键不稳定而发生断裂,促使其相对含量降低。朱孔辉等[25]研究鳊鱼凝胶蛋白特性时发现离子键含量越高蛋白品质越好。氢键是指氢原子与电负性大的原子以共价键结合,同时与电负性大的原子Y形成X-H…Y形式的键,是形成蛋白质二级结构的主要作用力,对稳定蛋白质二级结构起重要作用[26]。氢键相对含量的变化趋势与离子键相似,从19.33%(鲜样)下降至9.23%(干制12 h),表明干制处理破坏了蛋白质多肽链中氨基和酰基之间形成的氢键,进而导致对虾蛋白质二级结构发生改变。这与邓丽[11]研究鲍鱼蛋白质加热过程中的化学作用力变化趋势一致(氢键相对含量显著降低(P<0.05))。疏水键在稳定 蛋白质三级结构和生物膜磷 脂双分子层结构方面起重要作用。疏水键相对含量的变化趋势与离子键相反,从12.35%(鲜样)上升至18.97%(干制12 h),表明干制促使虾蛋白的疏水性残基暴露,增加了疏水键的相对含量。二硫键在干制过程中相对含量随干制时间的延长而显著增加(P<0.05),到干制终点增加至28.94%,二硫键含量的增加与巯基(—SH)被氧化而形成—S—S—有关,这一结果与上述总巯基含量变化结果相印证。

图4 虾热风干制过程化学作用力的变化Fig.4 Changes in chemical forces in shrimp during hot air drying
2.2.4 蛋白质二级结构定量分析结果
拉曼光谱中酰胺I区(1 600~1 700 cm-1)峰的变化与蛋白质二级结构变化密切相关。酰胺I区含有C=O、C—N和N—H伸缩振动的信息[27]。蛋白质二级结构主要包含α-螺旋、β-折叠、β-转角和无规卷曲,其中α-螺旋与1 651~1 660 cm-1之间的峰有关,表征蛋白质分子的规整性;β-折叠和β-转角分别对应1 600~1 639 cm-1和1 661~1 700 cm-1之间的峰,β-折叠和β-转角反映蛋白质分子的松散性;无规卷曲对应1 640~1 650 cm-1之间的峰[28]。干制会使虾的蛋白质二级结构发生变化,因此酰胺I区的峰形会随之变化。由于表征蛋白质二级结构构象的多个振动吸收峰容易重叠,使拉曼图谱中出现宽峰,因此常采用求二阶导和曲线拟合的方法来得到单个谱带的信息[29]。
通过PeakFit V4软件对酰胺I区进行峰分离和曲线拟合处理,得到图5,然后根据α-螺旋、β-折叠、β-转角和无规卷曲对应的峰面积,计算出各结构的相对含量,如表3所示。新鲜对虾的α-螺旋相对含量为32.31%,干制至终点12 h时,其相对含量为18.37%,下降了43.14%,并且可以看出从新鲜对虾到水煮对虾α-螺旋相对含量下降了18.97%,表明温度的升高会显著影响α-螺旋结构的变化。对虾经过水煮后β-折叠相对含量显著降低22.20%,而干制过程对虾β-折叠相对含量从新鲜时的17.57%降至干制终点的14.67%,这是由于温度突然升高导致蛋白分子间氢键断裂,使其维持蛋白质二级结构的能力降低,导致β-折叠相对含量显著下降(P<0.05)。对虾经过水煮后β-转角相对含量显著升高13.45%,而干制过程β-转角含量变化不明显。对虾无规卷曲相对含量随干制时间的延长呈上升趋势,从新鲜时的15.76%上升至干制终点时的28.21%,整个干制过程发生了α-螺旋向β-折叠、β-转角和无规卷曲的转化,意味着干制过程蛋白质分子结构由规整向松散转化,并且与温度变化密切相关。蛋白质分子的加热变性、巯基氧化、水分子–蛋白质分子间氢键变化,造成了蛋白质原有的二级结构和空间构象的破坏。


图5 对虾蛋白拉曼光谱酰胺I区分峰和迭代拟合曲线Fig.5 Segregated and iterative curve-fitted Raman bands in amide I region of proteins in raw, boiled and dried shrimps
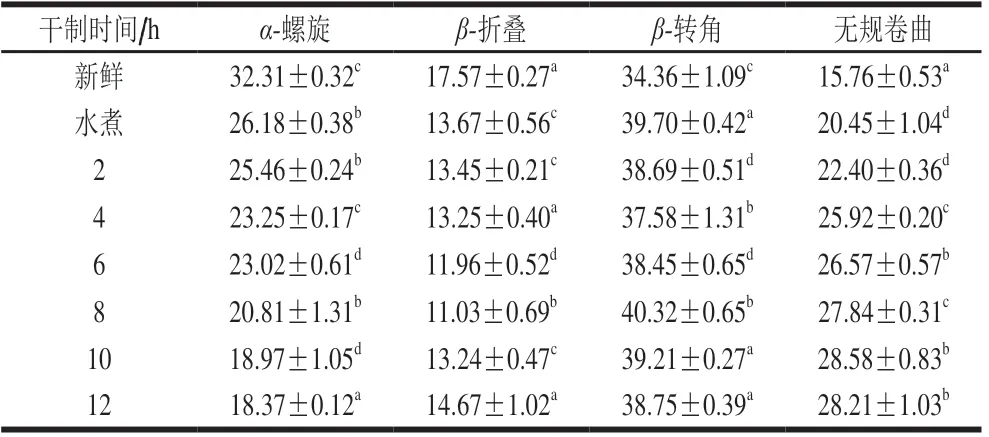
表3 对虾蛋白酰胺I区二级结构相对含量Table 3 Secondary structure contents from amide I band spectra of proteins in raw, boiled and dried shrimps %
2.2.5 蛋白质三级结构的变化
芳香族氨基酸的暴露程度表明蛋白质结构的展开程度,可表征蛋白质三级结构的变化[30]。相关报道显示,肌原纤维蛋白含有色氨酸残基,色氨酸吲哚侧链的暴露与内源荧光强度有关[31-32],因此,色氨酸成为最常用的内源荧光探针。对虾在干制过程中肌原纤维蛋白的荧光光谱如图6所示,可以看到新鲜虾的肌原纤维蛋白在343 nm波长处显示出最高的荧光强度,水煮后荧光强度略有降低。然而当进行热风干制时,荧光强度大幅度降低,并且随着干制时间的延长逐渐降低,这表明干制促进蛋白质变性,引起疏水性残基暴露,巯基氧化形成二硫键,从而使分子间作用增强,蛋白质发生再聚集,导致暴露出的色氨酸残基重新被包裹,进而导致荧光猝灭。另外,疏水键是表征蛋白质三级结构的重要化学作用力,其含量越高表明蛋白质的变性程度越大。如图4所示,疏水键的相对含量在干制过程中逐渐上升,肌浆蛋白的构象向不稳定状态转变,同时证明蛋白三级结构发生了改变。
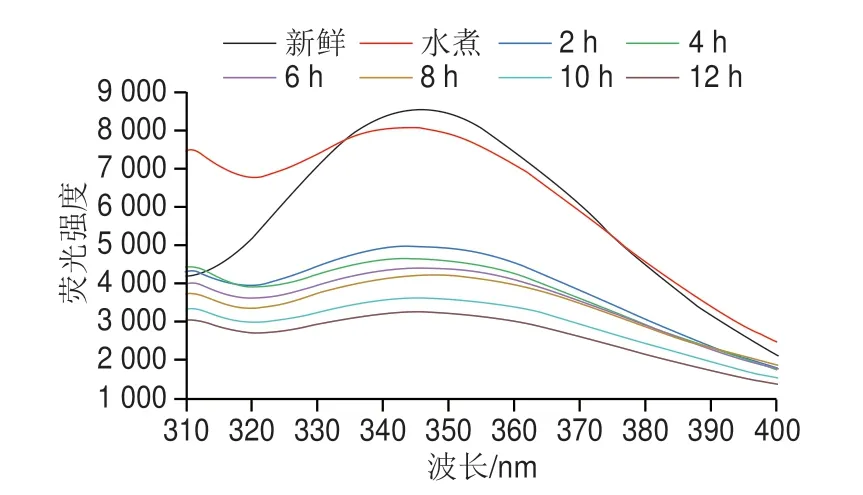
图6 对虾热风干制过程内源荧光强度的变化Fig.6 Changes in endogenous fluorescence intensity of proteins in shrimp during hot air drying
2.2.6 虾热风干制过程肌原纤维蛋白组成的变化
肌原纤维蛋白的特征条带包括肌球蛋白重链(myosin heavy chain,MHC)(220 kDa)、α-肌动蛋白(94 kDa)、肌钙蛋白(75 kDa)、肌动蛋白(43 kDa)、原肌球蛋白(36 kDa)和肌球蛋白轻链(<20 kDa)[33-34]。对虾肌原纤维蛋白的分子质量在干制过程中的变化如图7所示,鲜虾的分子质量条带较多,存在聚集的现象,表明未经任何处理的鲜虾样品中蛋白质成分较完整。当样品进行水煮处理后,MHC条带和α-肌动蛋白条带消失,肌钙蛋白和肌动蛋白条带明显变浅,而原肌球蛋白条带明显加深,并且23 kDa处出现明显条带,表明加热处理使MHC和α-肌动蛋白破坏降解,肌钙蛋白发生降解生成肌钙蛋白I(23 kDa)。随干制时间的延长,肌钙蛋白和肌动蛋白条带逐渐变浅,是因为干制使该分子质量的蛋白片段发生降解;而原肌球蛋白、肌钙蛋白I和肌球蛋白轻链条带明显加深,是因为大分子蛋白发生降解聚集,生成了一些分子质量小的蛋白片段。随干制时间的延长,10 kDa附近处的蛋白质条带加深,这可能是蛋白质降解产生的小分子肽。电泳结果结合TCA-可溶性肽含量从0.56 μmol/g(鲜样)增加至0.91 μmol/g(干燥终点)的结果综合证明了大部分蛋白质对加热处理都不具耐受性,热风干制会导致对虾中蛋白质降解。

图7 虾热风干制过程中肌原纤维蛋白SDS-PAGE的变化Fig.7 Changes in SDS-PAGE pattern of myofibrillar in shrimp during hot air drying
2.3 蛋白质与品质变化的相关性分析
为进一步确定热风干制过程中对虾品质变化与蛋白质的相关关系,对蛋白质变化指标(总巯基、蛋白羰基、TCA-可溶性肽、离子键、氢键、疏水键、二硫键、α-螺旋、β-折叠、β-转角和无规卷曲水平)与品质特征(L*值、a*值、b*值、硬度、黏附性、弹性、胶黏性和咀嚼性)进行了Pearson相关性分析。由图8可知,蛋白质变化指标与色泽和质构特性存在高度相关性。其中总巯基含量与颜色(L*、a*、b*值)存在显著负相关(P<0.05,P<0.01),相关系数分别为-0.91、-0.81和-0.84,氢键相对含量与L*、a*和b*值呈显著负相关(P<0.05,P<0.01),二硫键相对含量与L*、a*和b*值存在显著正相关(P<0.01,P<0.001),相关系数分别为0.94、0.85和0.88,同时,β-转角相对含量与L*、a*和b*值存在显著正相关关系(P<0.05,P<0.01)。干制过程中蛋白巯基基团被氧化并暴露生成二硫键,并且干制使肌红蛋白发生氧化,进而导致产品颜色发生改变。并且对虾经过热处理和较长时间的干制,蛋白质稳定的状态被破坏,其二级结构由较为稳定的α-螺旋向β-转角和无规卷曲转化,导致其理化特性和功能特性改变,造成了剧烈的体积收缩和水分流失。与此同时,蛋白质不断降解,生成更多的多肽和氨基酸,这些降解产物能够参与美拉德反应,伴随着蛋白质和脂质氧化程度的加深,导致对虾的颜色发暗、发黄。

图8 对虾在干制过程中蛋白质变化与品质变化相关性分析的热图Fig.8 Heatmap showing the correlation between changes in protein characteristics and quality changes of shrimp during drying
对虾中富含丰富的蛋白质,其质构特性的变化很大程度上取决于蛋白质的结构状态。由图8可知,蛋白羰基含量与硬度、胶黏性和咀嚼性呈极显著正相关(P<0.01),相关系数分别为0.88、0.92和0.87,TCA-可溶性肽含量与硬度呈极显著正相关(P<0.01),离子键、疏水键、α-螺旋和无规卷曲相对含量与胶黏性的相关系数分别达到-0.85、0.88、0.85和0.84,在干制过程中虾肌肉蛋白发生降解,蛋白质内部及蛋白质之间发生交联,增强了肌原纤维结构,使肌肉组织硬度增加。并且干制过程导致疏水相互作用力和二硫键不断增强,蛋白质二级结构发生变化,在一定程度上促进了硬度、咀嚼性的增加。Rodrigues等[35]在研究巴西淡水鱼的质构特性与TCA-可溶性肽含量的相关性时也发现了类似结果。由此可见虾在干制过程中蛋白质氧化主要影响色泽变化,虾肉的质构特性与蛋白质降解和变性关系更密切。
3 结 论
本研究深入分析了南美白对虾在热风干制过程中蛋白质变化和对虾品质的变化规律,并分析了二者的相关关系。干制过程中,虾的L*、a*和b*值逐渐下降,干燥终点时硬度、胶黏性和咀嚼性分别明显增加至344.78 N,45.01 mJ和116.50 mJ;表征蛋白质氧化的总巯基含量逐渐降为0.36 μmol/g,而羰基含量上升至2.03 nmol/mg,证明干制诱导蛋白质氧化变性;TCA-可溶性肽含量升至0.91 μmol/g,SDS-PAGE中MHC、α-肌动蛋白和原肌球蛋白条带消失,肌钙蛋白条带明显变浅,证明干制导致蛋白质降解;干制过程蛋白质分子构象发生改变,肌肉蛋白的空间结构变小,形成致密的网状结构,离子键和氢键相对含量分别显著降低至11.62%和9.23%,疏水键与二硫键相对含量分别增加至18.97%和28.94%;同时利用拉曼光谱特征峰解析蛋白二级结构变化,通过分析α-螺旋、β-折叠、β-转角和无规卷曲的相对含量,验证了α-螺旋向β-折叠、β-转角和无规卷曲转化,证明了干制过程蛋白质分子结构由规整向松散转化。色氨酸的荧光强度随干制时间的延长而减弱,反映出蛋白质三级结构变化。Pearson相关性分析结果证明蛋白质氧化与颜色变化有关,蛋白质降解变性显著影响虾的质构特性。综上,本研究结果可为评价干制加工对水产品品质的影响提供理论依据,通过探究蛋白质变性规律与品质变化的关联机制,可为提高产品质量提供理论支撑。
