麦洼牦牛肉和高山牦牛肉品质差异性的比较分析
2019-11-12王琳琳陈炼红
王琳琳,陈炼红
(西南民族大学生命科学与技术学院,四川 成都 610041)
牦牛是世界上的珍稀牛种,常年生活在高海拔、长冷季、低气压的高寒缺氧地区,是“世界屋脊”的著名牛种.目前,我国牦牛数量约1 600 万头,约占世界牦牛总量的95%,是世界上拥有牦牛数量最多的国家,且主要分布在西藏、青海、甘肃、云南、四川等地[1].牦牛特殊的生存环境使其具有极强的环境适应性和抗逆性,优质的天然牧草也使牦牛肉成为具有高蛋白、低脂肪,富含多种营养物质的优质天然绿色食品[2].然而,不同地区的地理环境和气候特点不同,致使我国高原地区形成了多种地方特有牦牛品种,并具有多种品种优势.
目前,我国牦牛品种主要有四川九龙牦牛和麦洼牦牛,青海高原牦牛和大通牦牛,甘肃天祝白牦牛和甘南牦牛,西藏高山牦牛、帕里牦牛以及斯布牦牛等,上述不同地区所繁育的不同品种的牦牛在外形特征、生长性能以及肉质性状等方面均存在诸多差异[3].有研究指出,甘南牦牛肉和青海牦牛肉在食用品质方面存在显著差异[4].侯丽等[5]指出大通成年牦牛肉、青南地区成年牦牛肉和环湖地区成年牦牛肉样的食用品质差异显著,并指出上述三种牦牛肉的营养品质也存在一定差异.同时,金川牦牛与麦洼牦牛在相同舍饲育肥条件下,肌肉品质也存在较大差异[6]. 四川麦洼牦牛是川西北高原重要的牦牛品种,主要分布在四川红原和色达等地,是川西北高寒地区特有的优良地方牦牛品种,具有较强的遗传稳定性和较高的产奶特性[6].西藏高山牦牛也叫当雄牦牛是我国优良的地方牦牛品种,主要分布在西藏自治区西北部青藏高原和藏南三江流域,也具有良好的肉质性状和较高的产奶率,并以当雄县和嘉黎县产的牦牛最为优良.目前,关于青海、甘肃等地不同品种牦牛肉品质比较相关研究报道较多,而关于四川红原县麦洼牦牛和西藏当雄县高山牦牛两个地方品种牦牛肉品质差异性比较的研究还尚未见报道. 因此,有必要对上述两个地区牦牛肌肉的品质进行比较分析,以期为合理开发利用不同地区牦牛资源,促进当地牦牛产业化发展提供数据支持和理论依据.
本文以四川红原县麦洼牦牛肉和西藏当雄县高山牦牛肉为试验材料,测定两种牦牛肉的食用品质、营养品质、氨基酸含量以及脂肪酸含量,并对上述指标进行比较分析,旨在探究麦洼牦牛肉和高山牦牛肉的品质差异性,以期为两地牦牛资源的开发利用提供科学依据.
1 材料与方法
1.1 试验材料与设备
1.1.1 样品采集
分别在西藏当雄地区和四川红原地区随机选取自然放牧条件下,发育正常、健康无病、年龄约为4 岁的牦牛各6 头,宰前禁食12 h.宰后立即取背最长肌,去除表面脂肪、结缔组织和筋腱后,将肉样切分成150 g 的肉样,并现场测定pH、肉色等指标,对于现场不便测定的指标,将肉样用自封袋包装后,置于4 ℃条件下冷藏保存带回实验室,并在成熟时间点0、1、2、3、5、6、7 d 取样测定相应指标.
1.1.2 主要仪器
PL303 型电子天平,梅特勒-托利多仪器上海有限公司;pH-STAR 型胴体肌肉pH 值直测仪,德国Matthaus 公司;CR-400 型色差仪,日本Konica minolta 公司;TA.XT. Plus 型质构分析仪,英国Stable Micro System 公司;BCD-243K 型冰箱,河南新飞电器公司;HH-6 型数显恒温水浴锅,国华电器有限公司;Trace DSQ型气相色谱-质谱联用仪,美国Thermo 公司.
1.2 试验方法
1.2.1 食用品质测定
(1)pH
探针用校准液校准后插入肉样中,测定各成熟时间点肉样的pH.每块肉样重复测定三次取平均值.
(2)肉色
用CR-400 型色差仪测定肌肉色度. 测定前用标准白板对仪器校正,测定时尽量保持肉样平整并使色度计探头完全被覆盖.每块肉样重复测定三次取平均值.
(3)剪切力
参照NY/T1180 -2006《剪切力测定方法》测定剪切力.将质量100 g 左右、厚度约4 cm 的肉样装入蒸煮袋中,用夹子封口后放入恒温水浴锅中,在80 °C水中加热肉样中心温度至70 °C 时,取出并冷却,然后用取样器沿肌纤维方向钻取测定样品,孔样长度不少于2.5 cm,取样位置距样品边缘大于5 mm.测前速度1.0 mm/s,测中速度1.0 mm/s,测后速度5.0 mm/s,时间间隔5 s.每组肉样重复测定三次取平均值.
(4)加压损失
参考France 等[7]加压滤纸测定法. 用取样器沿垂直于肌纤维方向取厚度1 cm,质量50 g 的肉样,精确称量肉样重量(M1),用纱布包裹后并在肉样上下面垫18 层滤纸,随后置于压力仪平台上,加压至35 kg,保持5 min 后,立即称量肉样质量(M2),按照下式计算肉样的加压损失率.
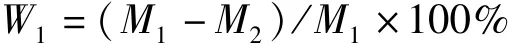
式中:W1—加压损失(%),M1—加压前肉样质量(g);M2—加压后肉样质量(g)
(5)滴水损失
参照D'Alessandro 等[8]方法并稍作修改. 取肌肉样品50 g,精确称量后(M1)用细线系起一端,小心将肉样悬空于袋中,注意使肉样与包装袋没有任何接触,并用细线将袋口扎紧,于4 ℃条件下悬挂静止24 h 后,对肉样进行第二次重量测定(M2),根据两次质量差按照下式计算滴水损失率.
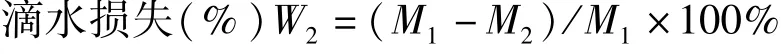
式中:W2—滴水损失(%),M1—悬挂前肉样质量(g);M2—悬挂后肉样质量(g)
1.2.2 营养品质测定
参照国标方法测定肉样4 种营养成分含量.水分含量测定参照GB 5009.3 -2010,直接干燥法;蛋白质含量测定参照GB 5009.5 -2010,凯氏定氮法;脂肪含量测定参照GB 5009.6 -2003,索氏抽提法;灰分含量测定参照GB 5009.4 -2010,灼烧法.每组肉样重复测定三次取平均值.
1.2.3 氨基酸及脂肪酸测定
取质量约150 g 的肉样,参照GB/ T 5009.124 -2003 氨基酸测定法,用全自动氨基酸分析仪测定肉样中氨基酸含量,每组肉样测定两次取平均值. 取质量约150 g 的肉样,参照GB/ T 9695.2 -2008 脂肪酸测定法,用气相色谱—质谱仪测定肉样中脂肪酸含量,每组肉样测定两次取平均值.
1.3 数据统计与分析
数据用平均值±标准差表示,用单因素方差分析(ANOVA)和多重比较(Duncan 新复极差法)进行差异显著性分析;P <0.01 表示差异极显著,P <0.05表示差异显著,用Origin 8.5 软件进行图形绘制.
2 结果分析与讨论
2.1 麦洼牦牛肉和高山牦牛肉成熟过程中pH 的比较
宰后缺血缺氧环境使肌肉能量代谢方式迅速由有氧呼吸转变为糖原的无氧酵解,肌肉能量代谢发生转变,且能量产生水平显著下降,无氧酵解中糖原分解产生的乳酸和ATP 分解产生的磷酸进一步造成肌肉pH 的快速下降[9].表1 反映了两种牦牛肉宰后成熟过程中pH 的变化情况.
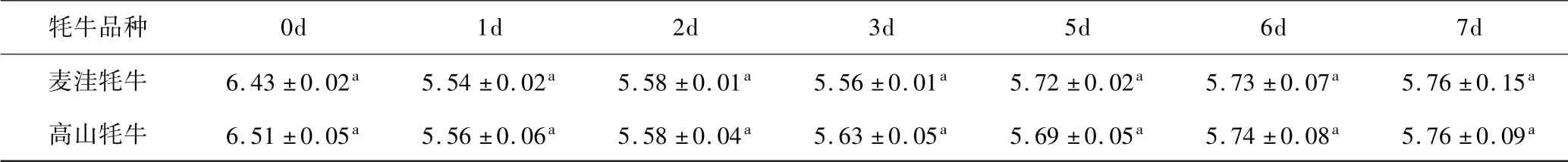
表1 麦洼牦牛和高山牦牛宰后肉成熟过程中pH 的变化Table 1 Changes in pH of Maiwa and mountain yak meat during postmortem aging
由上表可知,两种牦牛肉pH 均随着成熟时间延长呈先下降后缓慢上升的变化趋势.0 ~1 d,两种牦牛肉pH 分别下降13.84%和14.59%(P <0.05),说明宰后1 d 内牦牛肌肉能量代谢转为无氧酵解,肌肉内部产生了较多的酸性物质进而导致pH 显著下降;1~7 d,两种牦牛肉pH 均呈缓慢上升变化,说明在成熟后期残存的糖原出现有限降解,分解水平下降. 前人研究指出,宰后1 h 内,正常肌肉的pH 应在6.0 ~7.0 范围内,随后下降至极限pH 5.4 ~5.5,在成熟后期又所升高,与本研究结果一致,说明两种牦牛肉品质均在正常范围内.而在成熟后期,pH 又出现缓慢上升现象,这可能与贮藏时间延长,腐败微生物代谢产物的大量积累所致,Wang 等[10]和郭兆斌等[11]的研究也与本研究结果一致.同时,在整个成熟过程中,两种牦牛肉之间的pH 均无显著性差异.
2.2 麦洼牦牛肉和高山牦牛肉成熟过程中肉色的比较
牦牛因其常年生活在高海拔缺氧地区,肌肉内部肌红蛋白氧化、脂肪氧化和肉色的褐变速率明显慢于普通肉牛,故其肉色整体较普通牛肉深,这与牦牛本身基因和所处生存环境均有关[12],见表2.

表2 麦洼牦牛和高山牦牛宰后肉成熟过程中肉色的变化Table 2 Changes in meat color of Maiwa and mountain yak meat during postmortem aging
由表2 可知,成熟过程中,两种牦牛肉L∗值和b∗值整体均呈先上升后下降的变化趋势.宰后3 d,麦洼牦牛肉L∗值达最大值37.64,显著高于其他时间点,随后显著下降(P <0.05);宰后5 d,b∗值达到最大值13.2,显著高于其他时间点,随后显著下降(P <0.05).0 ~1 d,高山牦牛肉L∗值下降4.51%,随后显著上升达最大值37.07,显著高于其他时间点(P <0.05),随后下降;宰后5 d,b∗值也达到最大值12.42,显著高于其他时间点随后下降(P <0.05).宰后成熟过程中,两种牦牛肉L∗值均无显著性差异,但麦洼牦牛肉b∗值均显著高于高山牦牛肉(P <0.05),说明高山牦牛肉的色泽较麦洼牦牛肉略深,这可能与两种肌肉在成熟过程中肌内脂肪和肌红蛋白的氧化速度不同有关.
a∗值表征了肌肉红色度的变化,a∗值越大说明肉色越红.由上表可知,宰后成熟过程中,两种牦牛肉a∗值整体上呈先显著下降后又略微上升并在后期下降的变化趋势. 0 ~3 d,麦洼牦牛肉a∗值下降29.92%,随后略微上升;高山牦牛肉a∗值也在成熟3 d达到最小值15.58,与0 d 相比显著下降了21.72%(P <0.05),并在6 d 时,再次达到峰值16.89,两种肉样的a∗值在成熟过程中出现先上升后下降的变化规律与肌红蛋白氧化为氧合肌红蛋白再氧化为高铁肌红蛋白密切相关.李婕[13]和杨巧能[14]等研究指出,青海大通牦牛肉和甘肃甘南牦牛肉在成熟过程中,L∗值和b∗值也呈先上升后下降的变化,a∗值呈先下降后上升的变化规律,与本研究结果一致.同时,在整个成熟过程中,两种牦牛肉的a∗值均无显著差异.以上研究表明,两种牦牛肉在色泽方面没有较大差异,高山牦牛肉的色泽较麦洼牦牛肉略深.
2.3 麦洼牦牛肉和高山牦牛肉成熟过程中剪切力值的比较
剪切力是评价宰后肌肉嫩化程度的代表性指标,对于解释宰后肌肉嫩度变化具有重要意义[15-16]. 由图1 可知,两种牦牛肉的剪切力值均随着成熟时间延长呈先上升后下降的变化,3 d 时分别上升69.31%和61.83%并达最大值,说明此时肌肉进入最大僵直期,嫩度最差;3 ~7 d,两种牦牛肉剪切力值均呈显著下降变化,并在7 d 时达到最小值,分别为54.25 N 和58.56 N,说明3 d 后肌肉进入解僵期,嫩度得到改善.有研究指出,甘南牦牛肉在宰后成熟过程中同样在3 d 达到最大僵直期,与本研究结果相一致[11,17];然而,也有研究指出,在整个成熟过程中牦牛肉的剪切力值均呈显著下降变化,未见最大僵直期,与上述结果不同,这可能与成熟时间点的选择以及与牦牛的品种有关[18].同时,1 ~3 d,麦洼牦牛肉剪切力值均显著高于高山牦牛肉(P <0.05),而在5 ~7 d,呈相反结果但无显著性差异.以上结果说明,成熟早期麦洼牦牛肉嫩度比高山牦牛差,但在后期得到改善.

图1 麦洼牦牛和高山牦牛宰后肉成熟过程中剪切力的变化Fig. 1 Changes in the shear force of Maiwa and mountain yak meat during postmortem aging
2.4 麦洼牦牛肉和高山牦牛肉成熟过程中保水性的比较
肌肉的加压损失和滴水损失均是衡量肉品保水性的重要指标,对肌肉的贮藏加工性有重要影响,也与肉制品的嫩度、风味和口感等品质密切相关,是肌肉品质评价的重要指标,受pH 变化的显著影响[19].如图2A 所示,成熟过程中,两种牦牛肉加压损失率均呈先上升后下降的变化,且均在成熟3 d 达到最大值33.86%和24.32%,随后缓慢下降且无显著性差异.整个成熟过程中,麦洼牦牛肉的加压损失率均显著高于高山牦牛肉(P <0.05),说明高山牦牛肉的保水性优于麦洼牦牛肉,肉质更加鲜嫩多汁.如图2B 所示,两种牦牛肉的滴水损失率均随着成熟时间延长呈显著上升的变化(P <0. 05);且在成熟中后期(3 ~7 d),麦洼牦牛肉的滴水损失率均显著高于高山牦牛肉(P <0.05),说明从滴水损失角度分析,高山牦牛肉的保水性也优于麦洼牦牛肉,与加压损失结果相一致.
2.5 麦洼牦牛肉和高山牦牛肉营养品质的比较
由表3 可知,麦洼牦牛肉水分、蛋白质以及灰分含量均高于高山牦牛肉,但无显著性差异(P >0.05);同时,高山牦牛肉脂肪含量显著高于麦洼牦牛肉(P <0.05),说明高山牦牛肉具有更嫩的肉质特征,这可能与西藏高山牦牛更优的草地环境及饲草料种类有关.
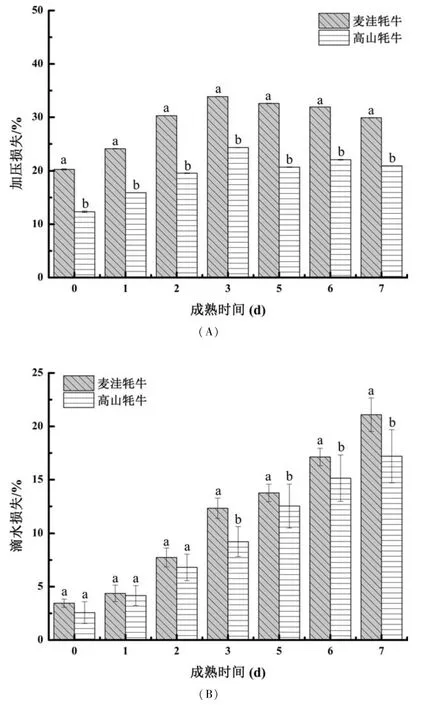
图2 麦洼牦牛和高山牦牛宰后肉成熟过程中保水性的变化Fig. 2 Changes in water holding capacity of Maiwa and mountain yak meat during postmortem aging

表3 麦洼牦牛肉和高山牦牛肉营养成分的对比Table 3 Comparison of nutrient composition between Maiwa and mountain yak meat
2.6 麦洼牦牛肉和高山牦牛肉氨基酸组成的比较
由表4 可知,16 种氨基酸在两种牦牛肉中均存在,且麦洼牦牛肉中除Thr、His、Met 三种必需氨基酸无显著差异外,其他必需氨基酸含量均显著或极显著高于高山牦牛肉(P <0.05;P <0.01);同时,麦洼牦牛肉中EAA 含量(8.69%)和高山牦牛肉(7.53%)存在显著差异(P <0.05);麦洼牦牛肉中TAA 含量极显著高于高山牦牛肉(P <0.01);且麦洼牦牛肉中EAA/NAA 比值也显著大于高山牦牛肉(P <0.05),但两种牦牛肉中NAA 含量以及EAA/TAA 均无显著性差异.
质量较好的蛋白质组成中EAA/TAA 应在40%左右,EAA/NAA 应在60%以上[20],本研究中两种肉样的EAA/TAA 均高于40%, EAA/NAA 均高于60%,说明本研究中两种牦牛肉品质较佳. 由上述结果可知,麦洼牦牛肉相比高山牦牛肉而言,具有更高的氨基酸含量和更优的蛋白质组成;表3 结果也指出,麦洼牦牛肉的蛋白含量高于高山牦牛肉,脂肪含量显著低于高山牦牛肉,说明麦洼牦牛肉比高山牦牛肉具有更好的氨基酸组成和更高的营养价值.

表4 麦洼牦牛肉和高山牦牛肉氨基酸含量对比Table 4 Comparison of amino acid contents between Maiwa and mountain yak meat
2.7 麦洼牦牛肉和高山牦牛肉脂肪酸组成的比较
由表5 可知,麦洼牦牛肉中饱和脂肪酸(SFA)、肉豆蔻酸(C14:0)和硬脂酸(C18:0)含量与高山牦牛肉相比均无显著性差异,且麦洼牦牛肉中棕榈酸(C16:0)含量极显著高于高山牦牛肉(P <0.01). 谭子璇等[6]在麦洼牦牛肉中检测出肉豆蔻酸(C14:0)、棕榈酸(C16:0)、硬脂酸(C18:0)和花生酸且各脂肪酸含量也与本研究结果接近.麦洼牦牛肉中UFA(50.14%)和MUFA(45.15%)均极显著高于高山牦牛肉中UFA(37.11%)和MUFA(34.99%)(P <0.01);同时,麦洼牦牛肉单不饱和脂肪酸(MUFA)中油酸(C18:1)含量极显著高于高山牦牛肉(P <0.01),而MUFA 的生理功能主要是由油酸(C18:1)所体现,在脂肪酸组成上看,油酸(C18:1)能较好地改善肉品风味,起到降低血液中胆固醇及低密度脂蛋白(LDL)的作用,对心血管疾病具有预防作用[21].
由表5 可知,麦洼牦牛肉中PUFA(4.99%)极显著高于高山牦牛肉(2.12%)(P <0.01),且亚油酸含量(C18:3)(4.3%)极显著高于高山牦牛肉(1.25%)(P <0.01),而亚油酸(C18:3)有降低人体血液中胆固醇和血脂的作用,可作为治疗动脉粥样硬化药物的原料.二十碳五烯酸(C20:5,EPA)具有提高智力、视力、抗癌、抗过敏以及降低血清中胆固醇的作用,但本研究只在麦洼牦牛肉中检测到了对人体有重要生理功能的EPA;而与二十碳五烯酸(C20:5)具有相似生理功能的二十二碳六烯酸(C22:6,DHA)却未在两种牦牛肉中检测到,该研究结果与谭子璇[6]研究结果一致,其在麦洼牦牛肉中也未检测到DHA.
总不饱和脂肪酸与饱和脂肪酸的比例(UFA/SFA)可以反映肉质的味道和口感[22],两种牦牛肉的UFA/SFA 分别为1.04 和0.83,比例较低并存在极显著差异(P <0.05). 对脂肪酸营养价值进行评价时,通常可用多不饱和脂肪酸和饱和脂肪酸的比例(PUFA/SFA)来衡量[23],WHO 推荐标准大于0. 4 为最好.但如表5 所示,两种牦牛肉PUFA/SFA 均未达到此标准,这可能与反刍动物瘤胃的氢化作用有关[24];麦洼牦牛肉的PUFA/SFA 相比于高山牦牛肉更接近于WHO 推荐标准. 综上所述,麦洼牦牛肉SFA 含量与高山牦牛肉差别不大,且UFA、MUFA 和PUFA 含量均极显著高于高山牦牛肉(P <0.01);同时油酸(C18:1)和亚油酸(C18:2)含量也均极显著高于高山牦牛肉(P <0.01).综上所述,与高山牦牛肉相比,麦洼牦牛肉具有更高的营养价值.
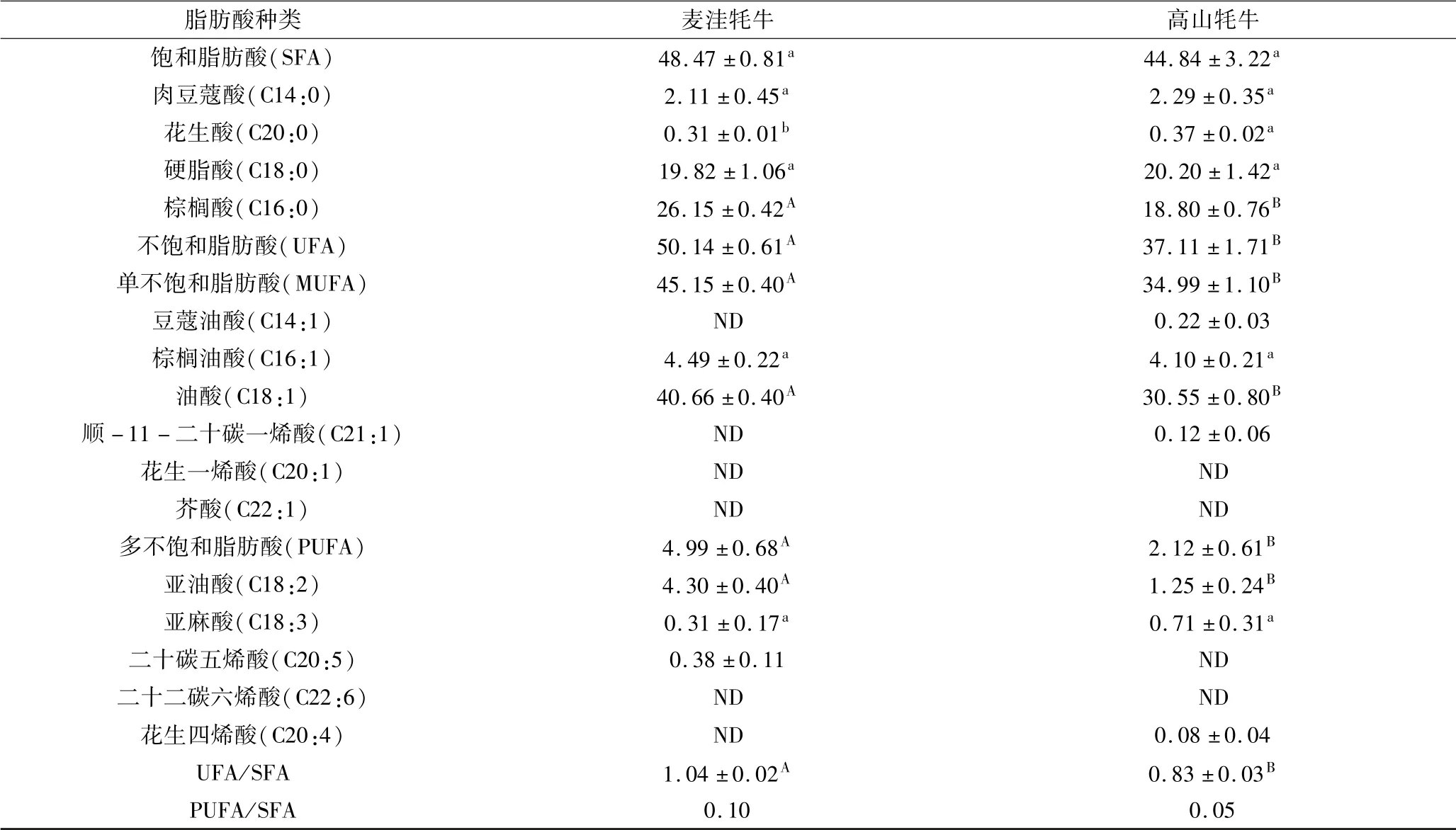
表5 麦洼牦牛肉和高山牦牛肉脂肪酸含量对比Table 5 Comparison of fatty acid content between Maiwa and mountain yak meat
3 结论
宰后成熟过程中,两种牦牛肉pH、L∗值和a∗值均无显著差异,但麦洼牦牛肉b∗值显著高于高山牦牛肉(P <0.05);麦洼牦牛肉成熟早期嫩度不及高山牦牛肉(P <0.05),但在后期得到改善;从加压损失和滴水损失分析可知,高山牦牛肉的保水性优于麦洼牦牛肉.上述结果表明,两种牦牛肉pH 和肉色均无显著差异,但高山牦牛肉嫩度和保水性优于麦洼牦牛肉.
两种牦牛肉水分、蛋白质和灰分含量均无显著性差异,但高山牦牛肉脂肪含量显著高于麦洼牦牛肉(P <0.05),说明高山牦牛肉具有更嫩的肉质特征;同时,两种牦牛肉均具有较好的蛋白质组成;且麦洼牦牛肉具有更好的氨基酸组成和更高的营养价值;麦洼牦牛肉中UFA、MUFA、油酸(C18:1)、PUFA、亚油酸(C18:2)、UFA/SFA 等脂肪酸含量或比例均极显著高于高山牦牛肉(P <0.01),说明麦洼牦牛肉虽然食用品质不及高山牦牛肉,但其具有更高的营养价值.
