香港牡蛎在异地基围育肥时的生长、形态及体成分变化
2023-09-09汤保贵赵力强伍栩民彭梓峰钟培贵
汤保贵 周 晖 赵力强 伍栩民 彭梓峰 钟培贵 于 鸽
(1. 广东海洋大学水产学院, 湛江 524088; 2. 湛江海思特水产科技有限公司, 湛江 524099;3. 湛江恒兴养殖技术服务有限公司, 湛江 524094)
在海水养殖产业中, 贝类养殖不仅能净化养殖水体, 更能高效利用水体中的碳酸氢根(HC), 促进沿海生态系统对大气CO2的吸收, 产生显著的“碳中和”效应[1]。经测算, 海水贝类养殖所形成的直接碳汇量是海藻养殖碳汇量的1.5倍, 而牡蛎又是海水贝类养殖碳汇量最大的品种[2]。中国牡蛎产量从2000年的329.20×107kg增加到2020年的542.46×107kg, 约占全球牡蛎产量的90%; 目前我国牡蛎产量约占贝类总产量的35%, 海水养殖总产量的25%[3]。因此, 牡蛎养殖碳汇是我国最有效的生物固碳方式之一, 具有巨大的市场化、产业化的潜力。但是, 随着近年来我国沿海区域城市化、工业化及港口建设的迅速发展, 各地围填海建设不断增加, 很多原来广泛开展贝类养殖的海湾及河口都被大量挤占, 导致可供贝类养殖的近海水域明显减少[4]。因此, 未来贝类养殖有向鱼塭和池塘转移的趋势,特别是与虾、蟹、刺参养殖相结合, 构建多营养层次综合养殖体系[5]。
香港牡蛎(Crassostrea hongkongensis), 又称香港巨牡蛎, 广泛分布于我国南方沿海地区, 是广东和广西贝类养殖的主要品种[6]。香港牡蛎在上市前会在秋冬季迁移到高盐海区快速育肥, 以获得适宜市场销售的肥蚝[7]。有关香港牡蛎育肥的研究报道较少, 而且这些研究通常是对比不同育肥方式[7,8]或者不同海域[9]的育肥效果, 没有分析香港牡蛎在异地基围育肥时, 生长及形态、体成分等参数变化的相关性。当香港牡蛎从广西自然海域转移到广东鱼虾混养基围进行异地育肥时, 生存环境会发生改变, 其身体成分也可能在短时间内发生显著的变化, 让研究者可以更容易观察到牡蛎生长和体成分变化之间的关系。本研究在秋季对基围中育肥的香港牡蛎进行连续样品采集, 研究育肥时间对牡蛎形态指标、生长指标、体成分及碳氮稳定同位素值的影响, 分析了这些参数变化的相关性, 为深入研究牡蛎对池塘综合养殖生态系统中碳、氮元素的利用提供基础数据。
1 材料与方法
1.1 牡蛎样品采集
2021年11月24日, 来源于广西钦州茅尾海, 初始体质量(68.00±25.75) g的香港牡蛎(已养殖25个月)运送到湛江市麻章区湖光镇赤忏村, 在湛江海思特水产科技有限公司基地的鱼虾混养基围中进行浮筏育肥。基围面积14.5 ha, 放置7 m×7 m的浮筏15个, 每个浮筏挂牡蛎约500串, 育肥区域水深1.3—1.5 m, 配备21台增氧机, 育肥期间基围水温24—31℃, 盐度21—23, 通过增氧维持水体溶氧>5 mg/L。在育肥0、8d、16d和44d时采集牡蛎样品, 在基围左、中、右3个位点分别选取1个浮筏, 每个浮筏分别采集左、中、右3个位置的样品, 每个位置随机采集牡蛎一串, 从每一串中随机选取3个牡蛎样品;样品用于生长参数及稳定同位素测定。在0和44d采样时额外从每个浮筏采集样品用于软体组织粗成分测定。
1.2 牡蛎样品生长指标及粗成分测定
去掉表面污物及其他附着物后, 用游标卡尺测量牡蛎样品的壳长、壳宽、壳高(精确度0.01 mm)。测量形态指标后的牡蛎用解剖刀开壳取完整软体组织, 沥干水分, 用电子天平测量壳质量和软体组织质量(湿重, 精确度0.01 g), 计算出肉率、特定生长率, 以及单位体重碳含量。牡蛎软体组织在烘箱中105℃烘干至恒质量, 软组织的粗蛋白采用凯氏定氮法测量, 粗脂肪采用氯仿-甲醇抽提法测量, 灰分采用550℃马弗炉灰化法测量[10]。
1.3 牡蛎样品碳、氮稳定同位素测定
软体组织: 真空冷冻干燥48h后研磨, 贮存于离心管中, 放在干燥器内直至分析。在广东海洋大学水产科学与技术国家级实验教学示范中心, 以元素分析仪(EA Isolink CNHO)与同位素质谱仪(DELTA V Advantage)联用(EA-IRMS), 进行碳、氮稳定同位素分析和碳氮含量测定。
牡蛎壳: 用刷子清洗干净壳表层, 然后用超纯水反复清洗, 冷冻干燥48h后, 利用超微粉碎机将其粉碎, 收集贮存于离心管中, 放在干燥器内直至分析。称取质量(0.60±0.05) mg牡蛎壳样品放入12 mL的样品瓶(Labco)中, 拧紧瓶盖, 按顺序放入恒温样品盘上。固定吹气针, 设定自动进样器工作程序, 依次对样品瓶进行长达5min的He气排空处理, 向经过排空处理后的样品瓶中加入8滴无水磷酸, 置于干式恒温器上70℃加热1h。以多用途在线气体制备和导入装置(GasBench-Ⅱ)与同位素质谱仪(DELTA V Advantage)联用(GasBench- IRMS),测定同位素分馏平衡后, CO2中碳的稳定同位素比值和碳含量。
测定的碳、氮稳定同位素值分别以国际通用的标准物质维也纳箭石化石(PeeDee)的碳和大气氮作为参考标准, 测量结果以δ13C值和δ15N值(‰)形式来表示[11]:
式中,X为13C或者15N,Rsample为样本的同位素比值,Rstandard为参考标准样品的同位素比值。为保证试验结果的准确性和仪器的稳定性, 每测定10个软组织样品后加测一个标准样品(usgs88), 在所测牡蛎壳样品前后各加入两个碳酸盐标样。标样测定的精密度为δ13C值0.10‰,δ15N值0.15‰。
1.4 参数计算
式中,Wa为软体组织湿重(g);Wb为牡蛎总湿重(g)。
式中,Mt(g)为牡蛎平均终末体质量或软体组织质量(湿重),M0(g)为牡蛎初始平均体质量或软体组织质量(湿重)。
式中,Wc为1 kg牡蛎中壳的湿重(g/kg),Wd为1 kg牡蛎中软体组织的湿重(g/kg),Cc为壳的碳含量(%),Ca为软体组织的碳含量(%)。
1.5 实验数据统计分析
实验数据用SPSS19.0进行数据的统计分析, 在多个样本的观察值服从正态分布, 各组间方差平齐的情况下用单因素方差分析,P<0.05表示差异显著。若样品数据方差不齐, 则用非参数统计中的Kruskal-Wallis检验。采用Pearson相关性分析香港牡蛎各项指标的相关性, 如P<0.05则显著相关,P<0.01则极显著相关。
2 结果
2.1 牡蛎短期育肥对其软体组织粗成分(湿重)的影响
如表1所示, 育肥44d的牡蛎水分含量无显著变化(P>0.05), 粗蛋白含量显著下降(P<0.05), 粗脂肪含量则显著上升(P<0.05), 灰分含量显著下降。育肥44d时, 浮筏内部和外侧(左右侧)样品的粗成分差异不显著(P>0.05)。

表1 育肥时间对香港牡蛎软体组织粗成分(湿重)的影响Tab. 1 The effect of fattening time on the coarse composition(wet mass) of the soft body of C. hongkongensis
2.2 短期育肥过程中牡蛎形态指标和生长指标变化
如表2所示, 随育肥时间的延长, 香港牡蛎壳长、壳宽无显著变化(P>0.05), 育肥44d样品的壳高显著大于初始样品(P<0.05); 平均体质量逐渐上升,但育肥44d的样品与初始样品并无显著差异(P>0.05);软体组织质量和出肉率也逐渐上升, 育肥16d时就已经显著高于初始样品, 育肥44d又再显著上升(P<0.05)。
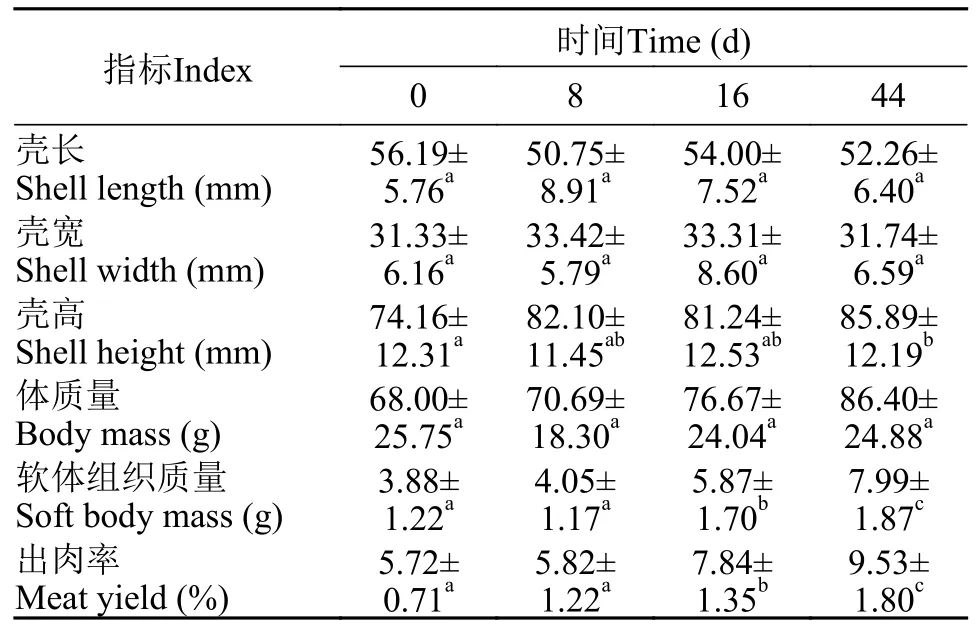
表2 育肥时间对香港牡蛎形态指标和生长指标的影响Tab. 2 Effects of fattening time on morphological and growthindexes of C. hongkongensis (n=27)
2.3 育肥过程中香港牡蛎碳、氮稳定同位素值及碳、氮含量的变化
如表3所示, 牡蛎软体组织δ15N值和δ13C值随着育肥时间的延长持续下降; 8d样品的δ13C值和16d样品的δ15N值就显著低于初始样品(P<0.05)。牡蛎软体组织的N%和C%同样随育肥时间的延长而降低, 育肥8d样品的N%和C%就显著低于初始样品(P<0.05), 此后N%持续显著下降, 而C%变化则不显著(P>0.05)。贝壳δ13C值变化比较缓慢, 44d样品δ13C值才显著低于初始样品(P<0.05)。贝壳C%逐渐下降, 16d样品C%显著低于初始样品, 但44d样品C%又显著上升(P<0.05), 与8d样品无显著差异(P>0.05), 但仍显著小于初始样品(P<0.05)。
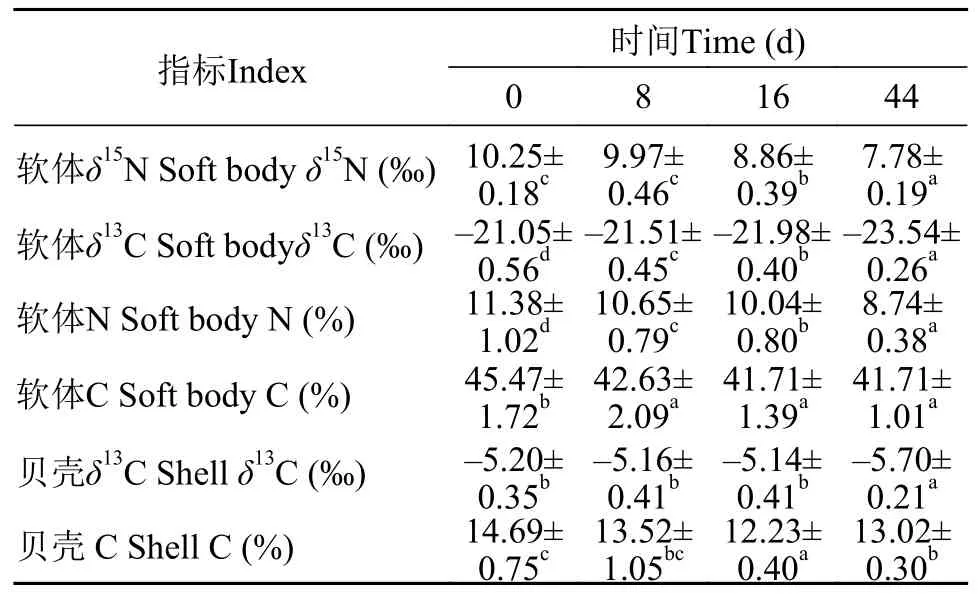
表3 育肥时间对香港牡蛎δ15N和δ13C值及碳、氮含量的影响Tab. 3 Effects of fattening time on δ15N and δ13C value and carbon and nitrogen contents in C. hongkongensis (dry weight,n=27)
2.4 基围育肥香港牡蛎的特定生长率和育肥前后碳含量变化
利用表2数据, 根据方程3计算出牡蛎在育肥过程中体质量和软体组织质量的特定生长率分别是0.53和1.64%/d。根据方程4计算出育肥前后香港牡蛎的碳含量分别为(143.51±4.51)和(125.83±1.32) g/kg, 差异显著(P<0.05)。
2.5 育肥过程中采集牡蛎样品的各项指标相关性分析
如表4所示, 在育肥过程中牡蛎的壳长、壳宽、壳高和体质量与贝壳及软体组织δ15N、δ13C值及碳氮含量无显著相关(P>0.05); 出肉率与软体质量极显著正相关(P<0.01), 与贝壳δ13C、软体δ15N、δ13C 、N%及C%极显著负相关(P<0.01); 软体质量则与贝壳及软体的C%无显著相关(P>0.05), 和壳宽显著正相关, 与壳长、壳高、体质量及出肉率极显著正相关(P<0.01), 与贝壳δ13C、软体δ15N、δ13C 和N%体质量极显著负相关(P<0.01); 贝壳C%与软体N%及C%显著正相关(P<0.05), 与软体δ15N极显著正相关(P<0.01); 而软体C%则与出肉率极显著负相关(P<0.01), 与贝壳C%和软体δ13C显著正相关(P<0.05), 与软体δ15N和软体N%极显著正相关(P<0.01)。
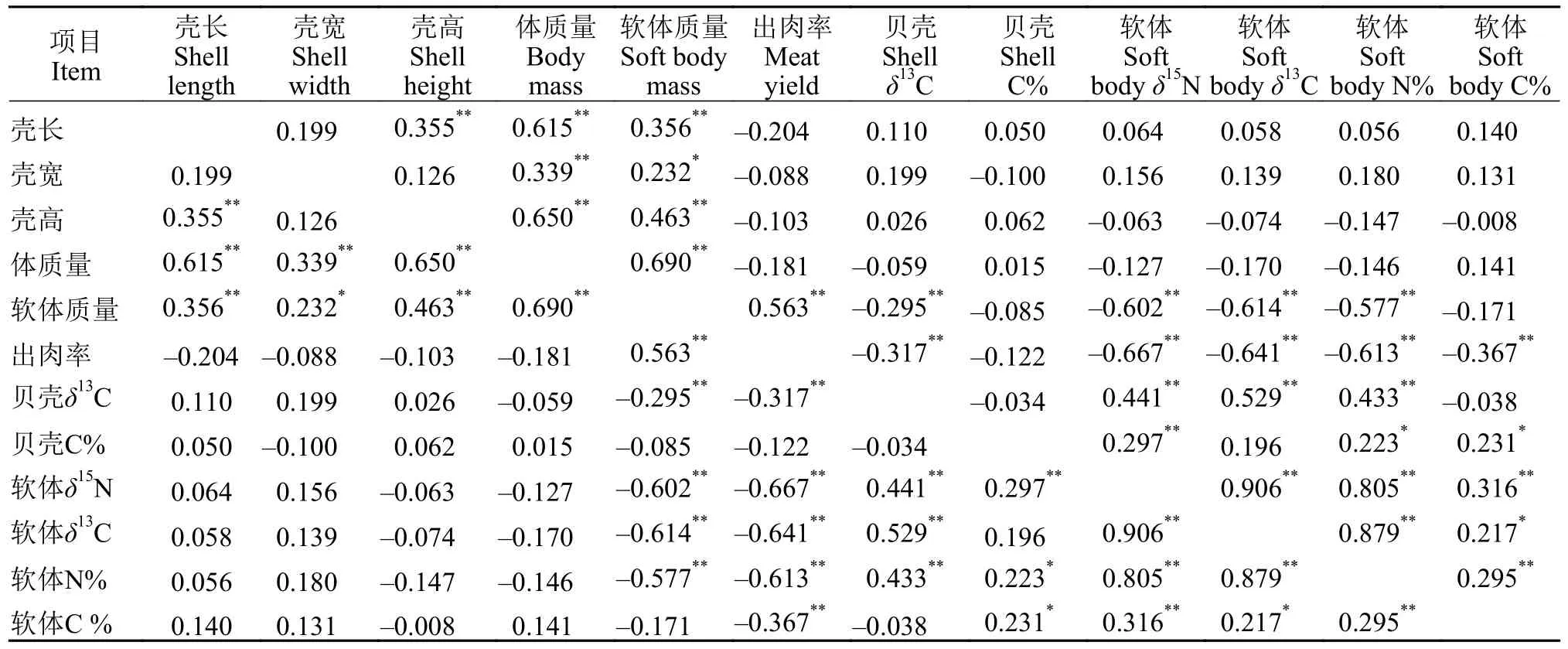
表4 采集的香港牡蛎性状相关分析Tab. 4 The correlation analysis for traits of sampled C. hongkongensis
3 讨论
3.1 香港牡蛎在鱼虾混养基围育肥的效果
牡蛎育肥方式主要有海区育肥和池塘育肥, 其中海区育肥是比较常用的育肥方式; 严雪瑜等[9]就报道了大风江和钦州港海域育肥的香港牡蛎分别在营养价值和风味口感上各具特色。但是, 在海区育肥的牡蛎死亡率较高, 若遇到台风更有可能遭受严重损失, 因此不少研究者开始探索牡蛎池塘育肥技术, 贾真等[7]的研究就发现池塘育肥比外海育肥效果更好。本项目采用的是鱼虾混养基围育肥方式, 从表2中出肉率这个育肥关键指标的迅速提升,以及软体组织较高的特定生长率, 可以看出这种育肥模式可以取得良好的效果。
3.2 香港牡蛎软体组织粗成分的时空差异比较
林海生等[12]对中国沿海主要牡蛎养殖品种的营养品质进行了比较分析, 发现不同养殖海域及不同品种牡蛎的粗蛋白、脂肪、灰分含量均具有显著差异, 广西钦州香港牡蛎灰分含量最高(2.69%),而广东湛江香港牡蛎中灰分含量最低(0.11%); 钦州香港牡蛎的蛋白含量(9.10%)也显著高于湛江香港牡蛎(8.40%)。本研究的结果就展示了广西钦州香港牡蛎转移到广东湛江育肥44d之后, 蛋白质和灰分含量显著降低的变化趋势(P<0.05)。林海生等[12]测定的广西钦州香港牡蛎和广东湛江香港牡蛎脂肪含量都较低(0.32%和0.30%), 明显小于本研究育肥前后的测定结果(1.55%和2.03%), 这主要是采样时间不同造成的。林海生等[12]采样时间是4—5月,香港牡蛎处于性腺分化和成熟期; 而本研究采样时间是11月至次年1月, 此时香港牡蛎处于性腺发育的休止期[13], 软体组织正在积蓄营养物质以备来年性腺发育。
沈永龙[14]研究发现盐度对瘤背石磺(Onchidium struma)体组成有显著的影响, 原因是贝类会通过调整生理代谢和能量分配来适应盐度的变化。丁丹勇等[6]也推测, 湛江东海岛、湛江官渡、阳江阳西、广西钦州养殖的香港牡蛎的一般营养成分和氨基酸的组成与含量之所以存在显著差异, 可能与不同养殖区海水的盐度差异有关。严雪瑜等[9]也报道了钦州湾不同育肥海区养殖香港牡蛎的常规营养成分含量存在一定的差异, 认为这可能与不同海域的海水理化环境存在差异有关。本研究也发现,来源于钦州茅尾海的香港牡蛎在湛江市麻章区湖光镇的基围中育肥44d后, 除水分含量之外, 粗蛋白、粗脂肪和灰分含量都发生了显著变化(P<0.05)。在本研究中, 香港牡蛎育肥基围的盐度为21—23,而广西钦州市茅尾海牡蛎养殖海区秋季的盐度变化幅度为17—19, 育肥海区较高的盐度可能是香港牡蛎育肥44d后体成分发生变化的重要原因之一。
贾真等[7]研究发现, 经过50d的池塘育肥, 2龄香港牡蛎的壳高、体质量和蛋白含量均显著升高, 而壳长、壳宽、软体质量和出肉率无显著变化; 本研究的结果则显示, 经过44d的基围育肥, 2龄香港牡蛎的壳高、软体组织质量、出肉率和脂肪含量显著升高(P<0.05), 而壳长、壳宽、体质量和水分含量无显著变化(P>0.05), 蛋白和灰分含量显著降低(P<0.05)。研究结果差异的主要原因可能是育肥时间[15](6—7月性腺成熟期和11至次年1月性腺发育休止期)和育肥区域(钦州和湛江)不同。
3.3 异地育肥对香港牡蛎δ15N和δ13C值的影响
研究综述发现, 消费者的δ13C值比它们的食物高1‰左右, 而δ15N高3.4‰左右; 因此δ13C常被用于研究消费者的食物来源, 而δ15N则被用于计算消费者的营养级[16]。Post等[17]的研究发现, 滤食性的贝类可以为估算湖泊等水域生态系统的中上层食物网研究提供良好的同位素基线, 但是不同生态系统的碳、氮稳定同位素基础水平可能存在差异显著,如果没有确定适当的同位素基线, 仅凭消费者的碳、氮同位素特征通常不足以推断其营养位置或碳源[18]。本研究的结果表明, 与香港牡蛎原来生活的广西茅尾海区相比, 湛江基围碳、氮稳定同位素基线水平较低, 这可能是因为基围受到了饲料投喂的影响。育肥过程中基围所用饲料的δ13C和δ15N值分别是(-23.46±0.14)‰和(2.71±0.14)‰, 与文献报道的牡蛎潜在天然食物源相比[19]处于较低水平。
Zhou等[20]研究发现, 养殖生物在食物改变之后, 其δ15N和δ13C值的变化速度体现了养殖生物的碳氮元素周转速度, 能够反映机体代谢和生长情况,可以作为养殖生物是否能够高效利用新食物的重要指标。在本研究中, 经过44d的育肥之后, 香港牡蛎软体组织的δ15N值、δ13C值及贝壳的δ13C值都显著下降(P<0.05), 特别是软体组织的δ15N值和δ13C值在育肥16d之后就与初始样品有了显著差异(P<0.05),这表明香港牡蛎能够迅速利用育肥基围中丰富的食物资源, 使自己的软体组织迅速生长, 从而改变了软体组织的δ15N和δ13C值。
以本研究结果为基础, 下一步可以利用稳定同位素技术确定牡蛎在基围育肥时各食物源对其生长的贡献率[21,22], 并以牡蛎为基线生物评估鱼-虾-贝多营养层次综合养殖系统的食物网结构。此外,本研究的结果还显示, 香港牡蛎体成分和碳、氮稳定同位素特征很容易受到短期育肥的影响, 在采用无机元素和碳、氮稳定同位素作为香港牡蛎产地溯源依据时[23,24], 必须考虑到异地育肥的干扰。
3.4 育肥过程中与出牡蛎肉率、软体组织质量及碳含量相关的指标
查明育肥过程中牡蛎各项指标的相关性, 特别是确定与出肉率、软体组织质量等育肥关键参数显著相关的指标, 对于进一步优化育肥技术具有重要意义。表4显示, 在育肥过程中出肉率与软体质量极显著正相关(P<0.01), 与贝壳δ13C、软体δ15N、δ13C 、N%及C%都极显著负相关(P<0.01), 而与壳长、壳宽、壳高和体质量等指标没有显著相关(P>0.05); 这说明在本次育肥过程中, 虽然牡蛎的整体形态和质量没有显著增大(P>0.05), 但软体组织则有显著增长(P<0.05), 进而引起软体δ15N、δ13C、N%及C%显著下降(P<0.05)。与牡蛎的生长和形态指标相比, 软体δ15N、δ13C、N%及C%等指标的标准偏差更小(表2和表3), 监测这些指标的变化可以更好地确定育肥牡蛎是否适应育肥环境, 能否获得充足的食物从而快速生长。
牡蛎的直接碳汇量取决于牡蛎贝壳及软体组织中的碳含量[25], 由表4分析结果可以看出, 在育肥过程中牡蛎贝壳C%与软体N%及C%显著正相关(P<0.05), 与软体δ15N极显著正相关(P<0.01); 而软体C%则与出肉率极显著负相关(P<0.01), 与贝壳C%和软体δ13C显著正相关(P<0.05), 与软体δ15N和软体N%极显著正相关(P<0.01)。这些相关性表明,育肥牡蛎的快速生长会导致香港牡蛎的单位体重碳含量在短期内显著下降(P<0.05), 与育肥前后香港牡蛎每千克体重碳含量的比较结果一致。另外值得注意的是, 本研究测定的香港牡蛎贝壳碳含量(12.23%—14.69%)高于褶牡蛎(Ostrea plicatula)[26]贝壳碳含量(11.4%—11.6%), 表明香港牡蛎贝壳具有更高的碳汇能力。
