红耳龟Amh基因在温度依赖型性别决定中的功能
2023-09-09陈佳文惠航博雷建东胡佳暄王宗吉葛楚天
陈佳文 孙 伟 金 琳 惠航博 雷建东 胡佳暄 王宗吉 葛楚天
(1. 浙江万里学院动物性别与发育重点研究所, 宁波 315100; 2. 浙江万里学院生物与环境学院, 宁波 315100)
在一些缺少性染色体的爬行动物(如红耳龟Trachemys scripta)中, 子代的性别由胚胎发育过程中外界的环境温度决定, 这种性别决定方式被称作温度依赖型性别决定(Temperature-dependent sex determination, TSD)[1—5]。与哺乳类、鸟类等动物的遗传型性别决定(Genetic sex determination, GSD)不同, TSD的调控机制更为复杂, 且研究较为滞后。最近TSD机制研究获重大突破, 揭示了红耳龟性别决定的上游调控通路——“温度-Ca2+-pSTAT3-表观因子Kdm6b”[6,7]。尽管TSD和GSD这两种性别决定方式的上游调控机制显著不同, 但对TSD动物性腺进行转录组测序及基因表达分析表明,Amh、Dmrt1、Sox9、Foxl2和Cyp19a1等与GSD动物性别决定和性腺分化紧密关联的调控基因同样存在于TSD系统中, 并且在胚胎性腺中呈现性别二态性表达分布[8—10], 这提示这些基因在TSD动物的性别分化通路中很可能仍然扮演着关键的调控角色。因此, 通过功能鉴定实验验证这些保守存在的基因在TSD中的具体功能, 成为解析TSD分子机理的一个突破口。
Amh(Anti-Müllerian Hormone), 抗缪勒氏管激素, 是转化生长因子β(The transforming growth factor beta, TGF-β)超家族的成员之一。在脊椎动物中,Amh基因因其在雄性性别决定/性别分化中的广泛作用而受到关注。目前, 从鱼类至哺乳类等不同进化地位的物种中都发现了Amh基因[11—15], 该基因是通过与受体AmhrII结合形成受体聚合物, 从而激活下游靶基因[16,17]。在哺乳动物中,Amh是由雄性胚胎性腺的sertoli细胞分泌, 负责诱导雄性缪勒氏管的退化, 而在雌性胚胎的发育过程中未检测到Amh表达, 缪勒氏管分化成输卵管等雌性特有结构[16,18,19]。在鸡的胚胎性腺中,Amh基因呈现雌雄二态性表达分布(雄性高表达), 能够诱导雄鸡两个缪勒氏管的退化[20]。在两栖动物(如日本粗皮蛙)中,Amh基因在性别分化阶段的雄性睾丸中高度表达[14,21]。与高等脊椎动物不同, 大多数硬骨鱼缺少缪勒氏管, 它们以更多样化的方式表达Amh, 但在不同发育阶段的两性性腺中同样能够检测到该基因的性别二态性表达[22—25]。值得关注的是在一些鱼类中,Amhy和Amhr2基因被认为是雄性性别决定的主控基因, 其缺失会导致性反转[26—33]。在爬行动物上, 课题组先前通过表达分析以及功能缺失和获得研究, 明确了Amh为GSD动物中华鳖早期雄性性别分化必需且充分的上游调控基因[34]。与GSD动物Amh的研究深度相比, 该基因在TSD中的相关报道主要集中在克隆和表达分析上, 尚未涉及功能研究。在美洲短吻鳄和红耳龟中, 研究发现在性腺的性别分化开始前,Amh的表达已经呈现性别二态性(MPT性腺高表达)[13,35], 提示该基因可能同样参与TSD过程, 但缺乏直接的功能鉴定数据来证明。
为了明确Amh基因在TSD系统中的生物学功能, 本研究以TSD典型物种红耳龟为实验对象, 在分析Amh在胚胎性腺中的表达模式和细胞定位的基础上, 采用慢病毒载体介导的RNA干扰和过表达技术, 揭示了Amh在TSD中必需的关键调控角色, 为解析TSD分子调控级联网络奠定基础。
1 材料与方法
1.1 胚胎孵化及组织收集
实验所需红耳龟受精卵采自养殖场, 将龟卵埋入孵化介质蛭石中后, 置于恒温恒湿孵化箱中进行孵化。孵化箱温度设置为26℃(产雄温度)或32℃(产雌温度), 利用雾化加湿器控制湿度(湿度: 75%—85%)。待胚胎孵育至第14期时, 分别将100枚龟卵从26℃或32℃移至32℃或26℃后继续孵化, 进行温度置换实验。在孵化过程中, 根据各时期红耳龟胚胎特征[36], 鉴别并收集特定发育时间点的胚胎, 用于分离性腺或性腺-中肾复合体。
1.2 Amh慢病毒干扰载体的构建及龟胚侵染
针对红耳龟Amh基因的CDS(Coding sequence)序列, 设计特异性shRNA序列, 构建Amh干扰的慢病毒载体(LV-U6-Amh-shRNA), 该载体携带绿色荧光蛋白GFP编码序列作为报告基因。由上海吉玛公司生产高滴度病毒浓缩液(×109units/mL)。红耳龟受精卵在以上恒温恒湿环境下孵化至第14期时,利用微量进样器向MPT胚胎注入5 μLAmh-shRNA慢病毒液, 实验中, 在26℃和32℃孵化温度下分别设置空白载体对照组(LV-NC-shRNA)。处理组及对照组注射龟卵各500枚。收集第21、第25期胚胎,分离性腺(每组60对性腺: 20对为1个重复, 3个生物学重复)和性腺-中肾复合体分别用于RNA提取和组织切片染色。
1.3 Amh慢病毒过表达载体的构建及龟胚侵染
根据红耳龟AmhORF(Open Reading Frame)序列, 设计构建过表达Amh的慢病毒载体(LV-EF1a-Amh-overexpression(OE)), 并生产高滴度的病毒浓缩液(×109units/mL, 上海吉玛公司)。使用上述注射方法对第14期FPT胚胎进行Amh-OE慢病毒液侵染处理, 实验中分别在32℃和26℃孵化温度下设空白载体对照组(LV-empty), 每组处理500枚龟卵。组织采集及用途同上。
1.4 RNA提取和实时荧光定量PCR
利用TRIzol试剂(Invitrogen, 美国)提取胚胎性腺中的总RNA, 按照逆转录试剂盒(K1622, Thermo Scientific, 美国)的操作说明, 合成cDNA, 用于基因mRNA水平的表达分析。以合成的cDNA为模板,按如下比例配制25 μL PCR反应体系: SYBR®Premix (来源于SYBR®Premix ExTaqTMⅡ试剂, TaKaRa)12.5 μL, 上下游引物各 0.5 μL, cDNA 2 μL, dH2O 9.5 μL。设置以下参数在ABI 7500 Real-time PCR仪(Appiled Biosystems, 美国)进行PCR反应: 预变性95℃, 30s; 变性95℃, 5s; 退火58℃, 20s; 共40个cycles。每个实验至少3个生物学重复(n≥3), 并设空白对照, 内参基因为Gapdh, 目的基因的相对表达量利用2-∆∆Ct方法计算。所得数据均表示为均值±SD,使用SPSS软件进行单因素方差分析及Duncan氏多重比较,P值<0.05被认为具有统计学意义(*P<0.05;**P<0.01; ***P<0.001)。所用引物序列信息见表1。
1.5 石蜡切片和苏木素-伊红染色
利用4%多聚甲醛保存刚分离的性腺-中肾复合体组织, 根据组织块大小于4℃下固定约24h后, 用50%酒精置换固定液, 2h后置于70%酒精中进行组织包埋或长期保存。将待包埋组织先后经70%、80%、90%、95%和100%的梯度酒精进行逐级脱水处理, 二甲苯透明后, 进行石蜡包埋。待石蜡冷却凝固后进行连续切片, 厚度设置5—6 μm。将烘干后的切片置于二甲苯中完全脱蜡后, 依次置于浓度由高到低的梯度酒精中进行水分渗透, 后经苏木素和伊红先后染色, 封片后于Nikon正置显微镜下观察拍照。
1.6 免疫组织化学染色
将完全脱蜡后的切片样品依次浸入由高到低的梯度酒精中后, 使用抗原修复液(10 mmol/L柠檬酸钠溶液)进行样品修复, 95℃以上维持30min。待切片冷却至室温, 滴加足量封闭液于组织上, 室温下孵育1h。吸去封闭液, 滴加适量一抗稀释液于组织上, 4℃过夜。次日, 用洗脱液清洗3次, 每次至少10min。在室温避光环境下, 针对一抗物种来源滴加适量的荧光二抗和DAPI染液, 孵育2h后, 清洗3次, 每次至少10min。洗脱干净后加抗荧光淬灭剂封片, 于共聚焦荧光显微镜(Nikon, A1 Plus)下观察拍照。本实验所用的一抗信息如下: 兔抗AMH(1﹕200, 华安生物制备)、鼠抗CTNNB1(1﹕250,Sigma, 美国)、兔抗VASA (1﹕500, Abcam, 英国)、兔抗SOX9(1﹕500, Millipore, 美国)、羊抗FOXL2(1﹕500, 华安生物制备)和鼠抗AROMATASE(1﹕250, 华安生物制备); 对应的二抗信息如下: 驴抗兔IgG594(1﹕250, Invitrogen)、驴抗鼠IgG488(1﹕250,Invitrogen)、驴抗羊IgG488(1﹕250, Invitrogen)。
2 结果
2.1 Amh基因的温度依赖型表达模式
为了解析Amh在红耳龟TSD中的调控作用, 本研究首先分析了Amh基因在早期胚胎性腺中的表达规律。qRT-PCR结果显示, 在性腺分化启动前的第15期时,Amh在产雄温度(MPT)性腺中的表达量显著高于产雌温度(FPT)性腺。随着胚胎发育,Amh在MPT性腺中的表达量逐步增加, 且在性别决定及随后的性别分化关键时期始终呈现MPT性腺特异性高表达(图1A)。同时, AMH蛋白的免疫荧光染色结果显示, 在性腺分化之前的第15—19期MPT性腺中, AMH蛋白表达信号逐渐增强, 定位在体细胞中, 而在FPT性腺中始终未检测到明显的荧光信号。红耳龟性腺发育至第21期时, 雌雄性腺结构差异分化明显。此时, AMH蛋白大量分布在MPT性腺性索上的sertoli前体细胞中, 生殖细胞未见表达(图1B)。此外, qRT-PCR结果显示在成体(1龄)雌雄红耳龟的不同组织中,Amh在睾丸组织中高度表达, 显著高于卵巢、心脏、肝脏、脾脏、肺脏、肾脏、肌肉和小肠中的表达量(图2A); 免疫荧光染色亦证实AMH蛋白在卵巢中几乎不表达, 在睾丸中主要分布于曲细精管基部的sertoli细胞上(图2B)。

图2 Amh在红耳龟成体组织中的表达分布Fig. 2 Expression distribution of Amh in adult tissues of T. scripta
为了进一步验证Amh基因这种温度依赖型表达模式, 本研究在第14期时进行了温度置换实验,观察Amh表达是否发生变化以及变化速率。qRTPCR结果显示, 与MPT性腺相比, MPT→FPT性腺中Amh的表达量在第15期时就已急剧下调(图1C), 说明Amh能够迅速响应新的FPT孵化温度。相反地,FPT→MPT置换后,Amh的表达则迅速上调(图1D)。以上结果表明,Amh的表达方式属于温度依赖型,且能够快速响应温度的变化, 提示Amh基因可能与TSD早期雄性分化高度关联。
2.2 Amh基因的功能缺失研究
为了进一步确定Amh在TSD中的调控角色, 本研究利用实验室先前在红耳龟上建立的基因功能在体鉴定技术[37], 向第14期MPT胚胎注射了携带LV-Amh-shRNA干扰片段的慢病毒液, 开展了Amh基因的功能缺失研究。首先, 通过qRT-PCR检测了Amh-RNAi处理后MPT性腺中Amh的表达变化, 结果显示在注射后的第15期,Amh的表达就已明显受到抑制, 这种表达下降趋势在第16期更为显著(图3A),表明此慢病毒载体系统能够高效敲低MPT性腺中Amh基因的表达量。
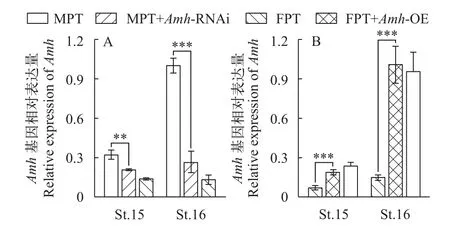
图3 慢病毒表达载体的有效性分析Fig. 3 Effectiveness analysis of lentivirus expression vectors
而后, 本研究通过观察性腺外形和内部结构以及生殖细胞的分布情况对敲低Amh基因后的MPT性腺进行了性逆转分析。第25期MPT(雄性)性腺外形呈粗短状(图4A); 而FPT(雌性)性腺则相对细长扁平(图4C)。敲低Amh后的MPT胚胎性腺外形与雌性性腺类似, 明显变得细长(图4B)。HE染色显示, MPT性腺的皮质区严重退化, 形成单细胞层, 髓质区高度发育, 其间布满由sertoli细胞围绕生殖细胞形成的原始性索结构(图4D和4D’); 而FPT性腺皮质区高度发育, 分布有大量生殖细胞, 髓质区退化明显, 形成空腔(图4F和4F’)。敲低Amh后的MPT性腺内部结构发生了显著变化, 主要体现在皮质区发育变厚, 有大量生殖细胞出现, 而在髓质区未见性索, 此时性腺出现雄性向雌性完全性逆转现象(图4E和4E’)。生殖细胞特异性VASA蛋白的免疫荧光染色进一步显示, 生殖细胞主要分布于MPT性腺髓质区性索上和FPT性腺的皮质区内(图4G—G”、4I—I”), 而在Amh敲低后MPT胚胎性腺中, 生殖细胞呈现完全类雌性的皮质区分布模式(图4H—H”), 进一步证明了性逆转的发生。
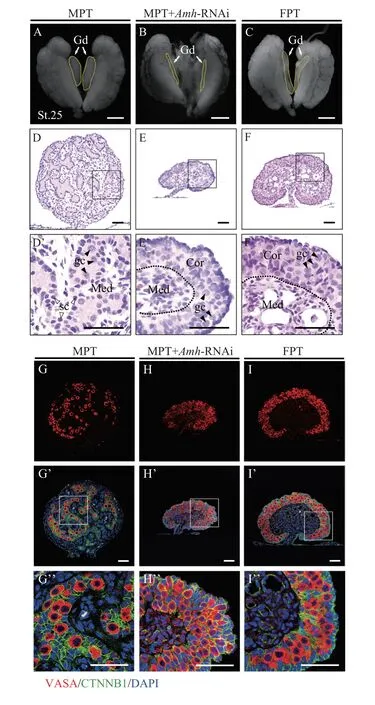
图4 敲低Amh后胚胎性腺的形态组织学变化Fig. 4 The morphological changes of embryonic gonads after Amh knockdown
为了进一步验证雄转雌性逆转现象的发生, 本研究还分析了Amh敲低对雄性分化因子Sox9及雌性分化因子Foxl2和Cyp19a1表达及分布的影响。qRT-PCR结果显示, 在第21期MPT性腺中,Sox9mRNA大量表达,Foxl2和Cyp19a1mRNA表达较低;而在FPT性腺中,Sox9仅微弱表达,Foxl2和Cyp19a1高度表达。在敲低Amh后, MPT性腺中Sox9基因的表达量出现显著下调, 而Foxl2和Cyp19a1基因的表达量则明显上调(图5A)。同时, 本研究通过免疫荧光染色检测了Amh基因敲低后第25期胚胎性腺中SOX9、FOXL2和CYP19A1(Aromatase, AROM)蛋白的分布情况(图5B)。结果显示在MPT性腺中,SOX9蛋白在髓质区性索上的sertoli细胞核中丰富表达, 未见FOXL2和AROM的表达; 而在FPT性腺中, FOXL2和AROM蛋白高度表达, 分别定位于性腺体细胞的细胞核和细胞质中, 并未检测到SOX9蛋白的荧光信号。MPT性腺经过Amh基因敲低后, SOX9蛋白表达量急剧下调, 几乎检测不到其表达信号, FOXL2和AROM蛋白则被诱导出现表达(图5B)。
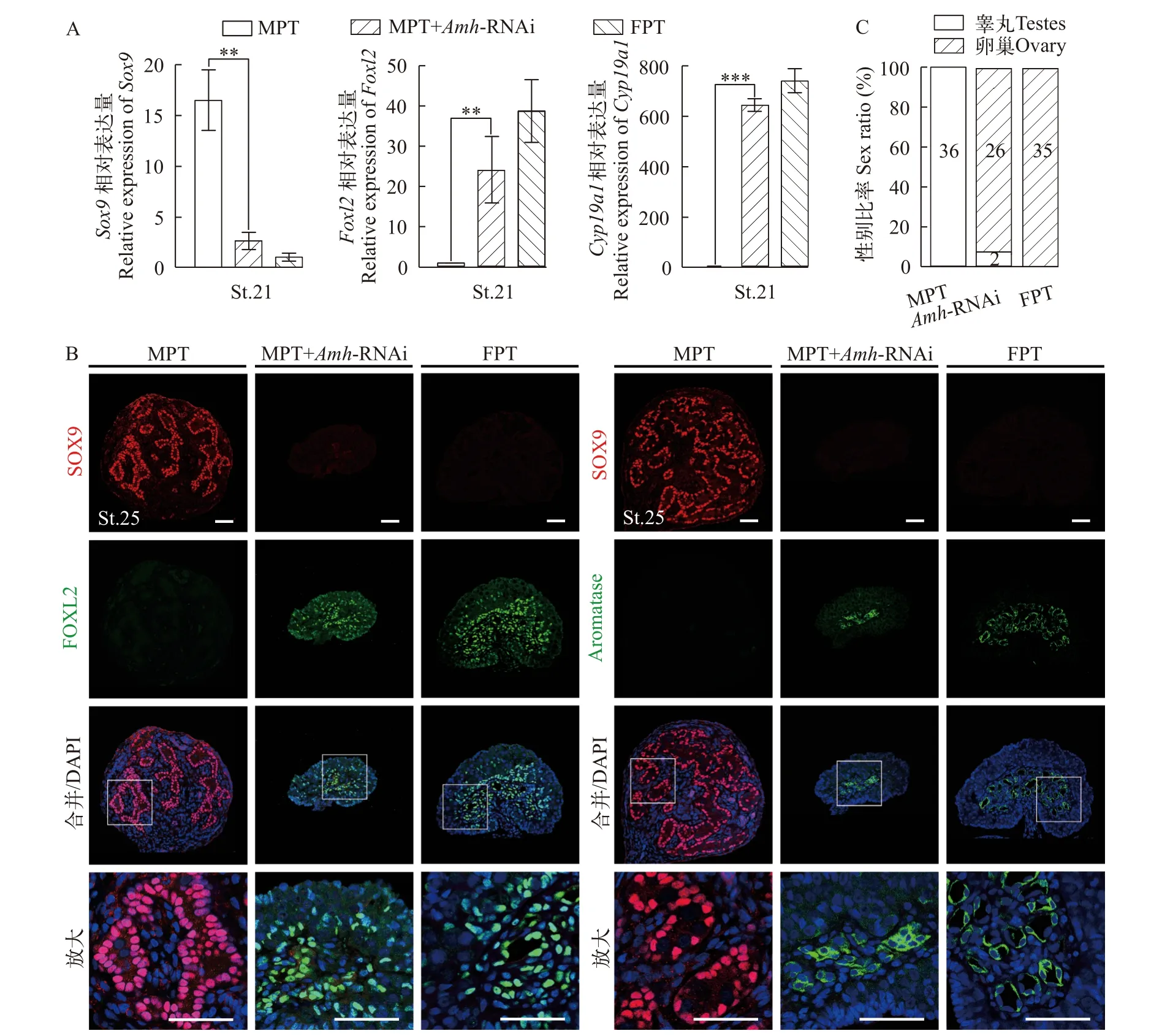
图5 敲低Amh后雌雄特异性基因和蛋白的表达分布变化及性逆转率Fig. 5 The expression and distribution changes of male- and female-specific genes and proteins after Amh knockdown and sex reversal rate
通过以上性腺组织学和分子、蛋白水平的研究证明, 敲低Amh基因确实能够导致红耳龟MPT性腺向雌性逆转。数据统计结果显示, 对照组MPT胚胎100%(36/36)发育为雄性, 对照组FPT胚胎100%(35/35)分化为雌性, 而在LV-Amh-shRNA处理后的MPT胚胎中, 92.86%(26/28)逆转为雌性, 性逆转率极高(图5C)。
2.3 Amh基因的功能获得研究
以上功能缺失实验表明,Amh在红耳龟早期雄性性腺形成中是必需的关键基因, 其缺失会导致彻底的雄性向雌性性逆转。相反地, 为了确定Amh基因能否单独启动红耳龟早期雄性分化过程, 本研究向第14期FPT胚胎注射了携带LV-Amh-OE过表达片段的慢病毒液, 开展了Amh基因的功能获得研究。在注射后的第15期, FPT性腺中Amh表达明显上升, 至16期时表达水平甚至超过了对照组MPT性腺(图3)。
基于Amh过表达FPT胚胎模型的成功建立, 本研究同样通过观察性腺表型以及检测雌雄特异性基因和蛋白的表达分布变化, 从而判断性腺原先的雌性分化方向是否被阻断而转向雄性分化。结果显示,Amh过表达后的第25期FPT性腺变得粗短, 向雄性方向发育(图6B和6C); 大部分过表达Amh后的FPT性腺内部结构出现了显著变化, 髓质区分化出雄性性索结构, 同时检测到大量VASA蛋白表达信号, 此时性腺具有典型的雄性特征, 性逆转彻底(图6G、6G’和6K—K’’); 但在一部分性腺的髓质区, 尽管也存在少量性索, 但皮质区并未完全退化,且生殖细胞在皮质区和髓质区均有分布, 性逆转不彻底, 此时性腺成为卵睾丸(图6F、F’和6J—J’’)。分子水平的研究结果显示Amh过表达后, 第21期FPT性腺中的Sox9mRNA表达上升,Foxl2和Cyp19a1mRNA表达下降(图7A); 在Amh过表达后的FPT性腺中, SOX9蛋白被诱导大量表达, 甚至与对照组MPT性腺中的表达量相当, 而FOXL2和AROM蛋白表达量则显著下降, 在性逆转彻底的性腺中未见这两个蛋白的表达信号, 而在性逆转不彻底的卵睾丸中, 同时检测到了SOX9、FOXL2和AROM这三种蛋白的荧光信号, 但始终SOX9表达水平更高(图7B)。数据统计显示, 在LV-Amh-OE处理后的FPT胚胎中,66.67%(26/39)向雄性分化(图7C)。以上功能获得实验表明, 过表达Amh基因能够充分激活红耳龟早期雄性分化通路。
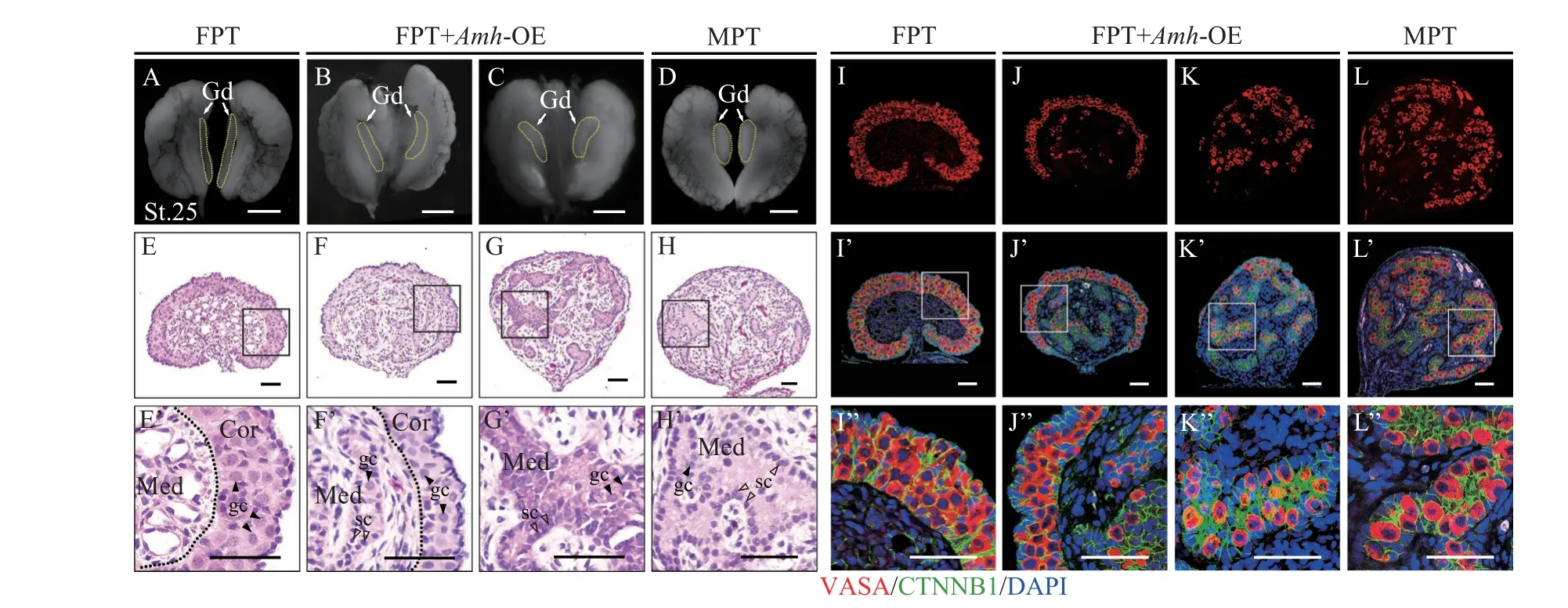
图6 过表达Amh后胚胎性腺的形态组织学变化Fig. 6 The morphological changes of embryonic gonads after Amh overexpression
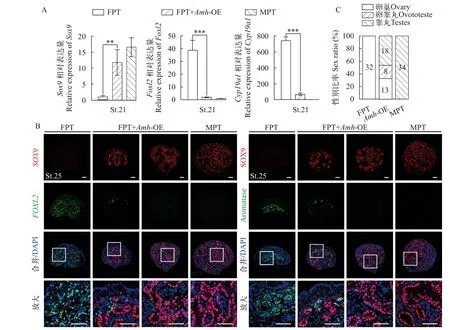
图7 过表达Amh后雌雄特异性基因和蛋白的表达分布变化及性逆转率Fig. 7 The expression and distribution changes of male- and female-specific genes and proteins after Amh overexpression and sex reversal rate
3 讨论
温度依赖型性别决定(TSD)自发现至今, 挖掘能够调控二态性(未分化)性腺向睾丸或卵巢分化的关键因子, 尤其是那些位于性别决定通路上游的调控基因, 一直是解析TSD分子机理的关键科学问题之一。越来越多的研究提示, 在TSD系统中可能存在与GSD类似的分子调控通路。聚焦GSD关键调控基因在TSD中的功能研究, 已成为破译上述科学问题的一个突破口。
本研究以脊椎动物雄性分化高度关联基因Amh为切入点, 以TSD动物红耳龟为实验对象, 成体(1龄)组织表达分布结果显示在被检组织中, 该基因仅在睾丸中高度表达, 提示Amh基因在红耳龟后期睾丸发育过程中可能仍发挥着重要的调控作用。Amh这种睾丸特异性高表达特征在GSD动物中华鳖中同样存在[38]。而在青鳉中,Amh基因仅呈现性腺(精巢和卵巢)组织特异性表达, 且在性别决定和分化阶段, 该基因自出现表达后始终在两性性腺中均存在丰富表达[15]。本研究发现,Amh基因在红耳龟胚胎早期就已在MPT性腺中高表达, 且这种雄性特异性分布贯穿了性别决定和性腺分化的关键时期; 此外, 当孵化温度由FPT置换为MPT时,Amh迅速上调表达量, 强烈提示Amh基因与红耳龟TSD雄性分化高度关联。类似地, 在另一个TSD爬行动物美洲短吻鳄中, 同样观察到了Amh这种温度依赖型表达模式(MPT性腺高表达)[13]。在人类、鸡、中华鳖、热带爪蟾及一些鱼类等GSD动物胚胎的不同发育阶段(性别决定和/或性别分化), 也分别检测到了Amh基因的性别二态性表达[18,20,26,27,34,39]。以上研究结果表明, 在不同进化地位和不同性别决定方式物种的性腺发育过程中,Amh基因的表达特征有所不同。
迄今,Amh基因在性别决定和性别分化中的功能鉴定研究主要集中在GSD动物上, 而在TSD系统中尚未见相关报道。为了明确Amh基因在TSD中的具体作用, 本研究在性别分化启动前将LV-AmhshRNA和LV-Amh-OE载体系统通过龟卵注射技术分别引入产雄温度(MPT)和产雌温度(FPT)下的红耳龟胚胎中, 成功获得了Amh敲低的MPT龟胚和Amh过表达的FPT龟胚模型。结果发现, 敲低Amh后的MPT性腺外形及内部组织结构明显雌性化, 生殖细胞呈现类雌性性腺的皮质区分布模式, 出现了雄性向雌性完全性逆转现象; 相反地, 过表达Amh后的FPT性腺则转向雄性方向分化。以上正反功能验证实验表明,Amh基因在红耳龟雄性性腺形成过程中是必需的, 且能够充分启动早期睾丸分化过程。在两种硬骨鱼(银汉鱼和尼罗罗非鱼)中, 通过敲低位于雄性性染色体(Y)上的Amhy基因证明了该基因在雄性决定和分化中是必需的, 被确定为这两个物种雄性性别决定的主控基因[26,27]。而研究发现小鼠的初级性别决定和睾丸发育并不需要Amh,但Amh通路的突变会导致雄性性别发育障碍[40,41];敲低鸡ZZ胚胎中的Amh后, 性腺的性别分化方向并没有发生改变[42]。在同属龟鳖目的GSD动物中华鳖上, 本团队前期通过相同的基因操纵方法同样验证了Amh在早期雄性分化中必要且充分的调控角色。此外, 本研究发现过表达Amh能显著上调Sox9的表达量, 同时抑制了Cyp19a1和Foxl2的表达, 提示在红耳龟雄性分化通路中Amh基因位于Sox9上游。在鸡和美洲短吻鳄中,Amh的表达早于Sox9,可能作用于Sox9上游[13,43]。而在哺乳动物中,Amh则位于Sox9下游,Sox9通过激活Amh表达, 诱导缪勒氏管退化, 同时抑制了Cyp19a1表达[44]。本团队之前研究发现, 过表达红耳龟Dmrt1后Amh基因表达上升, 提示Amh位于Dmrt1下游[37]。在中华鳖中, 同样发现Amh作用于Sox9上游, 且受到Dmrt1调控[34,45]。因此, 与Amh在一些鱼类中扮演性别决定基因的角色不同, 该基因在红耳龟中并不是性别决定和分化最上游的启动因子, 而是受到外界温度及生物体内一系列调控因子直接或间接的影响, 通过被动改变转录水平从而参与性别分化过程。与GSD动物中华鳖相似, 雄性分化级联通路“Dmrt1-Amh-Sox9”在红耳龟TSD系统中可能同样存在, 尽管它们最上游的调控者显然不同。上述研究表明, 在脊椎动物雄性分化分子调控通路上,Amh在不同进化地位动物中的具体作用和调控位置是不同的, 而在具有不同性别决定方式的龟鳖动物中, 该基因可能高度保守。
综上所述, 本研究利用团队前期在龟鳖动物上建立的基因功能鉴定技术, 首次对TSD体系中Amh的调控作用进行了功能验证。研究发现了Amh在红耳龟性别决定和分化的关键时期呈现雄性特异性高表达, 且能够快速响应温度变化; 明确了Amh基因是红耳龟早期雄性分化的必需且充分的调控因子, 位于TSD雄性发育级联通路的上游位置。为了彻底解释TSD的调控机制, 我们下一步关注重点是温度如何将信号传入胚胎, 即TSD机制研究的核心问题——温度感受机制, 进而转化为生物信号启动雌雄分化的?
