双三倍体银鲫超数微小染色体的基因组特征
2023-09-09王忠卫张晓娟李李熙银桂建芳
石 倩 丁 苗 汪 洋 周 莉 王忠卫 张晓娟李 志 李熙银 * 桂建芳 *
(1. 大连海洋大学水产与生命学院, 大连 116023; 2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,水产品种创制与高效养殖重点实验室, 湖北洪山实验室, 中国科学院种子创新研究院, 武汉 430072;3. 中国科学院大学, 北京 100049)
超数染色体(又叫超数B染色体、B染色体或者额外染色体), 是指除了常规染色体(又叫常规A染色体或A染色体: 包含常染色体和性染色体)之外的非必须染色体[1]。超数染色体最早于1907年在半翅目昆虫中被记载[2], 且预计存在于约15%的真核生物中[3]。由于超数染色体不遵循孟德尔遗传定律,所以其数量在同一群体不同个体之间也会存在差异[4]。超数染色体通常被认为起源于常规染色体,并且能够积累细胞器来源的DNA序列[4]。超数染色体发现之初, 被认为不含有关键基因且没有功能,然而, 随着测序技术和基因功能研究手段的迅速发展, 越来越多的证据显示超数染色体上的活性基因能够发挥重要的生物学功能[5,6], 且为物种的演化提供了额外的基因组材料[7], 例如: 在小麦病原真菌(Zymoseptoria tritici)中, 超数染色体能增强其对小麦的致病性[8]; 在黑麦(Secale cereale)中, 超数染色体能够增加常规染色体的重组率并增强其对逆境条件的适应性[9,10]; 在玉米(Zea maysL.)中, 超数染色体能够增强其对坏死病的抵抗能力[11]; 在洞穴鱼(Astyanax mexicanus)中, 超数染色体含有性别决定基因, 具有雄性决定作用[5]。
多倍体鲫复合种包括有性生殖四倍体鲫(Carassius auratus)和单性雌核生殖六倍体银鲫(Carassius gibelio), 广泛分布于亚欧大陆及邻近岛屿的淡水水系[12,13]。全基因组解析揭示四倍体鲫是双二倍体(AABB,n=100), 包含两套二倍体基因组, 每套二倍体基因组源于不同祖先; 六倍体银鲫是双三倍体(AAABBB,n≈150), 包含两套三倍体基因组, 每套三倍体基因组源自不同祖先[14—16]。约82—96万年前, 双三倍体银鲫由祖先双二倍体鲫经同源三倍化而形成, 多倍化后的双三倍体银鲫通过雌核生殖克服三个同源染色体不能正常配对和均等分离的生殖障碍[14]。雌核生殖是指母本产生不减数卵子, 不减数的卵子在同域有性生殖物种精子的刺激下进行胚胎发育, 最终产生与母本遗传背景一致的全雌子代[17,18]。双三倍体银鲫通过抑制减数第一次分裂, 从而产生不减数的卵子[14], 并利用同水域的双二倍体鲫或其他物种的精子进行雌核生殖[17,18]。有意思的是, 雌核生殖银鲫不同于其他单性脊椎动物, 在自然群体中含有少部分雄性个体[19]。
双二倍体鲫含有100条常规染色体, 不含有超数染色体; 而双三倍体银鲫含有约150条染色体,除了常规染色体之外还有一些超数染色体, 由于银鲫的超数染色体大小比常规染色体偏小, 我们将其称为超数微小染色体。银鲫雌性个体含有约9个超数微小染色体, 而雄性个体比雌性个体多出了额外的3—4个雄性特异超数微小染色体, 且这些雄性特异的超数微小染色体具有遗传雄性决定作用[20,21]。随后, 我们通过荧光显微切割、体外扩增和测序, 对这些雄性特异超数微小染色体进行了解析, 并筛选到具有雄性特异或者雄性偏向表达的基因片段[20]。然而, 银鲫雌性中超数微小染色体的基因组特征及其在单性雌核生殖方式演化中的作用仍不清楚。
在本研究中, 我们利用银鲫超数微小染色体富集的重复序列和染色体荧光原位杂交, 鉴定了银鲫雌性基因组中的潜在超数微小染色体序列。我们发现银鲫超数微小染色体含有所有常染色体的同源序列、大量重复序列以及完整活性基因。此外,大部分银鲫中扩张的减数分裂相关基因家族在超数微小染色体上存在扩增拷贝。这些结果不仅解析了双三倍体银鲫的超数微小染色体基因组特征,也为超数染色体在单性生殖演化中的作用提供了创新见解。
1 材料与方法
1.1 实验材料
本实验所使用的双二倍体鲫(C. auratus)和双三倍体银鲫(C. gibelio)来自于国家水生生物种质资源库(National Aquatic Biological Resource Center,NABRC), 中国科学院水生生物研究所。
1.2 中期染色体制备
双三倍体银鲫和双二倍体鲫有丝分裂中期染色体的制备采用植物血球凝集素体内诱导肾细胞制片技术, 具体参考朱华平等[22]描述的方法进行。
1.3 染色体荧光原位杂交(Fluorescence in situ hybridization, FISH)
FISH实验参照丁苗等[20]描述的方法进行, 但方法有略微改动。FISH探针为超数微小染色体探针[20]和酵母人工染色体(Bacterial artificial chromosome,BAC)质粒探针。BAC质粒的接种和提取参考彭金霞等[23]描述的方法进行。其中, BAC质粒探针的制备按照DIG-Nick Translation Mix试剂盒(Roche公司)的说明书进行。染色体玻片于65℃放置3h后,移至70℃变性液(35 mL去离子甲酰胺, 10 mL灭菌水和5 mL 2×SSC)中变性3min。将玻片放入预冷的70%、90%和100%的乙醇中依次脱水5min, 自然晾干玻片。与此同时, 将探针混合液(50%去离子甲酰胺, 20×SSC, 10% SDS, 0.25 mg/mL 鲑精子DNA,50%硫酸葡聚糖, 100 ng BAC质粒探针和5 ng超数微小染色体探针), 于100℃的水中变性10min, 而后将探针混合液立即置于冰上; 将探针变性混合液孵育染色体玻片, 37℃避光杂交24h。
在杂交完毕后, 玻片放置于20%去离子甲酰胺(35 mL灭菌水, 10 mL去离子甲酰胺和5 mL 20×SSC)中洗10min。随后于2×SSC(含1% Tween)中洗5min, 之后放于1×PBST中洗3次, 每次5min; 1×PBS中洗3次, 每次5min。接着于每张玻片中加200 μL羊抗Dig稀释液(羊抗Dig﹕1×PBS =1﹕100), 37℃湿盒中避光孵育1h。然后将玻片于1×PBS中洗3次, 每次5min, 自然晾干后, 在每张玻片用150 μL(2 μg/mL)的DAPI染色, 盖上盖玻片, 37℃湿盒避光染色1h。最后将玻片放于1×PBS中洗3次, 每次5min, 加30 μL的抗淬灭剂封片, 借助共聚焦显微镜镜检。
1.4 DNA提取和PCR
剪取适量大小的尾鳍, 用干净滤纸擦干鳍条表面黏液后, 将样品放于1.5 mL的EP管中, 然后加入500 μL 核酸裂解液和10 μL(10 mg/mL)蛋白酶K, 放于55℃水浴锅中1h; 待样品裂解充分后, 14000 r/min离心5min, 将上清液转入新的1.5 mL EP管中, 加入200 μL 蛋白沉淀剂, 上下颠倒混匀, 置于冰上10min;待样品充分沉淀后, 14000 r/min离心5min, 吸取上清液于新的1.5 mL EP管中, 加入500 μL预冷的异丙醇, 上下颠倒混匀(可见白色絮状物); 14000 r/min离心5min, 弃上清, 加入500 μL 80%乙醇混匀; 14000 r/min离心5min, 弃上清, 室温放置待白色沉淀变为透明物, 加入100 μL灭菌水, 混匀以便充分溶解DNA。采用NanoDrop测浓度, 将样品DNA浓度调为100 ng/μL,调整好浓度的样品存于4℃待用。
PCR模板为双三倍银鲫和双二倍体鲫基因组DNA, 反应体系为20 μL, 包括10 μL的Taqreaction Mix, 0.5 μL的上下游引物, 1 μL的模板和8 μL的灭菌水。扩增Cg-Ca-CL1、bmb-CgB、ccna2-CgB和nusap1-CgB,这些序列的引物在表1中, PCR反应程序为: 95℃ 3min; 95℃ 15s, 60℃ 20s, 72℃ 20s,35个循环; 72℃ 5min, 12℃ 5min。待PCR程序结束后, PCR产物用1.5%的琼脂糖凝胶检测, 检测时采用的Marker为TaKaRa DL2000。

表1 引物序列Tab. 1 Primer sequences
1.5 共线性分析
以已发表的银鲫基因组及基因组BAC序列为参考数据库,Cg-Ca-CL1为查询序列, 借助 BLAST软件[24], 使用默认参数比对, 获取超数微小染色体基因组序列, 再将鉴定到的超数微小染色体序列分别和已发表的双三倍体银鲫常规A染色体序列(GenBank ID: PRJNA546443)及双二倍体鲫基因组(GenBank ID: PRJNA546444)通过Minimap2[25]进行
基因组共线性分析, 结果借助Circos[26]展示。
1.6 重复序列注释和基因通路分析
使用Repeatmask[27]软件进行重复序列分析。对超数染色体序列上的注释基因进行KEGG通路分析和GO通路分析(https://david.ncifcrf.gov/)。
1.7 荧光定量PCR(Real-time fluorescence quantitative PCR, qPCR)
qPCR采用SYBR Green染料法根据操作说明进行基因表达量的检测。qPCR反应体系为20 μL, 包括10 μL的 SYBR Mix, 0.5 μL的上下游引物(表1),1 μL的模板和8 μL的灭菌水。反应程序为: 95℃预变性, 95℃ 15s, 60℃ 20s, 72℃ 20s, 40个循环。每个反应进行3次重复, 采用2-ΔΔCt计算获得基因的相对表达量。
2 结果
2.1 双三倍体银鲫超数微小染色体序列鉴定
在前期研究中筛选到双三倍体银鲫中含量最高的重复序列Cg-Ca-CL1, 利用该重复序列为探针,通过染色体FISH能够特异性标记银鲫的超数微小染色体[20]。双三倍体银鲫由祖先双二倍体鲫经同源三倍化而形成[14], 利用Cg-Ca-CL1探针在双二倍体鲫中进行染色体FISH分析, 发现双二倍体鲫不含有超数微小染色体, 且常染色体和性染色体上也没有明显荧光信号(图1A)。由于Cg-Ca-CL1在双二倍体鲫中的含量低, 通过FISH在双二倍体鲫中检测不到Cg-Ca-CL1信号, 但是利用PCR扩增及其产物序列测定, 能够在双二倍体鲫中检测到Cg-Ca-CL1(图1B)。在双二倍体鲫中,Cg-Ca-CL1扩增条带单一, 说明该序列不是以串联重复形式存在; 而在Cg-Ca-CL1在双三倍体银鲫中PCR扩增出不同长度条带, 说明Cg-Ca-CL1发生了扩增且以串联重复的形式存在(图1B)。这些结果揭示同源三倍化之后,Cg-Ca-CL1在双三倍体银鲫的超数微小染色体上发生了扩增和富集。因此, 我们拟通过该重复序列并结合染色体荧光原位杂交来筛选双三倍体银鲫超数微小染色体序列。

图1 重复序列Cg-Ca-CL1分析Fig. 1 Analysis of repetitive sequence Cg-Ca-CL1
对双三倍体银鲫雌性基因组(GenBank: PRJNA 546443)进行了重复序列Cg-Ca-CL1搜寻, 总共发现18个未组装的scaffold和12个组装好的染色体含有该重复序列, 包含Cg-Ca-CL1的拷贝数从5到3157不等(图1C)。这18个scaffold由于未能组装到染色体, 可能是潜在超数微小染色体序列。随后, 在这尾测序个体构建的酵母人工染色体文库中, 筛选到500个 BAC质粒含有Cg-Ca-CL1。拿这些BAC质粒序列与上述的18个scaffold进行序列比对, 最终鉴定出85个BAC质粒序列能比对上其中的15个scaffold(序列相似度大于95%)。在15个scaffold中, 分别选择一个能匹配的BAC质粒为探针(表2), 通过FISH进行染色体定位分析。FISH结果显示, 这15个BAC质粒的信号均位于超数微小染色体上, 而在常规染色体上没有明显信号, 因此, 可以推测这些BAC质粒所对应的scaffold序列是超数微小染色体序列(图2)。

图2 BAC质粒的染色体定位Fig. 2 Chromosomal localization of BAC plasmids

表2 超数微小染色体序列概况Tab. 2 Summary of sequences from supernumerary microchromosomes
2.2 超数微小染色体含有常规染色体同源序列
由于双三倍体银鲫由祖先双二倍体鲫经同源三倍化而形成[14], 同时选取了双三倍体银鲫及双二倍体鲫为对照, 通过序列比对来揭示双三倍体银鲫超数微小染色体的序列特征。双三倍体银鲫中未组装的序列不能确定是常规染色体还是超数微小染色体序列, 所以我们舍弃了这部分未组装的序列,只用组装到染色体的50条常规染色体序列来做超数微小染色体同源性分析。双二倍体鲫中由于不含有超数微小染色体(图1A), 其未组装的序列都是来源于常规染色体, 所以双二倍体鲫所有序列都用来做超数微小染色体同源性分析。我们发现银鲫5.48%的超数微小染色体序列与银鲫组装的常规染色体具有同源性, 且同源序列在每个常规染色体上都有分布, 其中含有超数微小染色体同源序列最多的常规染色体依次是chr1B、chr4A和chr16A(图3A)。同时, 与双二倍体鲫基因组进行比对时发现, 22.28%的超数微小染色体序列在双二倍体鲫基因组中能找到同源序列, 其中含有超数微小染色体同源序列最多的是未组装的序列及chr25B、chr21B和chr22B号染色体(图3B)。由于双三倍体银鲫中部分属于常规染色体但是又未能组装到染色体的序列没有用来做同源分析, 所以导致银鲫常规染色体上同源序列比例(5.48%)远低于鲫常规染色体(22.28%)。从上述的结果来看, 银鲫超数微小染色体含有常规染色体同源序列, 暗示着银鲫的超数微小染色体可能起源于常规染色体。

图3 超数微小染色体同源序列特征Fig. 3 Homologous sequence characterization of supernumerary microchromosomes
2.3 超数微小染色体重复序列扩增
双三倍体银鲫超数微小染色体、双三倍体银鲫组装的常规染色体及双二倍体鲫常规染色体的GC含量分别为38.06%、37.61%和37.63%, 三者没有显著差异(图4A)。随后通过重复序列鉴定发现超数微小染色体的重复序列占所有序列的比重为78.29%, 比双三倍体银鲫组装的常规染色体(47.93%)和双二倍体鲫常规染色体(47.56%)的重复序列占比明显偏高(图4A)。相比双三倍体银鲫组装的常规染色体(卫星序列: 8.20%; TE: 69.45%)及双二倍体鲫常规染色体(卫星序列: 7.59%; TE: 72.53%), 超数微小染色体重复序列中卫星序列(21.61%)的占比有所增加而TE的占比有所下降(50.67%; 图4B)。此外, 超数微小染色体卫星序列中Y染色体类型占比增加到52.05%(图4C), TE中DNA类型占比减少到42.20%(图4D)。 这些结果说明重复序列尤其是卫星序列在双三倍体银鲫超数微小染色体上发生了大量扩增。
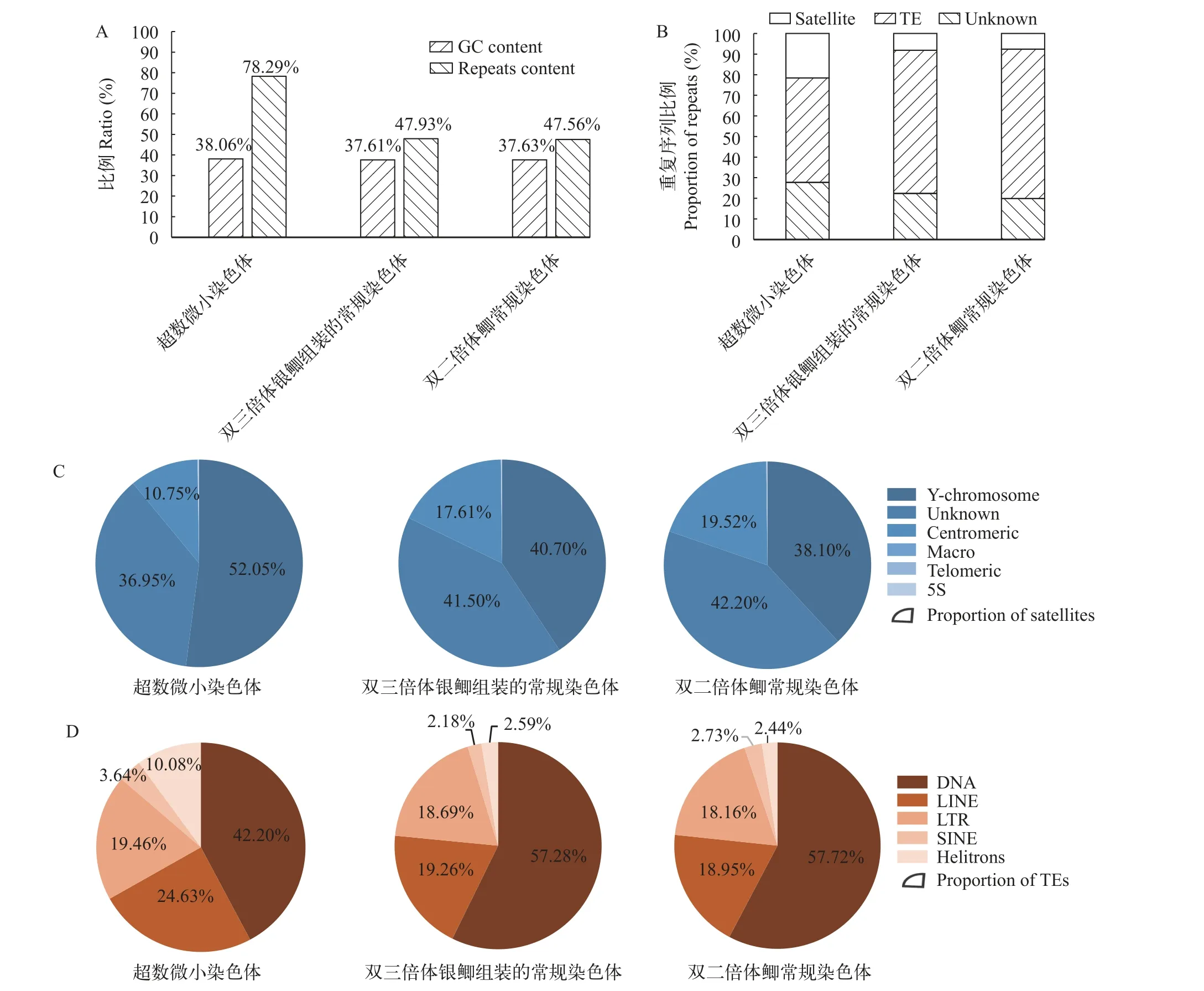
图4 重复序列分析Fig. 4 Analysis of repetitive elements
2.4 超数微小染色体注释基因通路分析
超数微小染色体序列上总共注释到了318个完整基因, 其中包含141个已知基因和177个未知基因(图5A)。本研究使用已知基因进行了KEGG(Kyoto Encyclopedia of Genes and Genomes)和GO(Gene Ontology)通路分析。在KEGG分析中, 213个基因能够匹配到6个主要类别中的31个通路。包含最多基因数的通路是癌症: 概述(16个基因); 膜运输(14个基因); 癌症: 特定类型以及全局和总览图(13个基因) (图5B)。此外, 在GO分析中, 分别有401个、266个和235个基因能够匹配到生物学过程、细胞学组分及分子生物学功能这3个主要类别中的47个通路。其中, 含有注释基因组最多的通路依次是结合通路(83个基因), 细胞通路(72个基因)和细胞部分通路(53个基因; 图5C)。
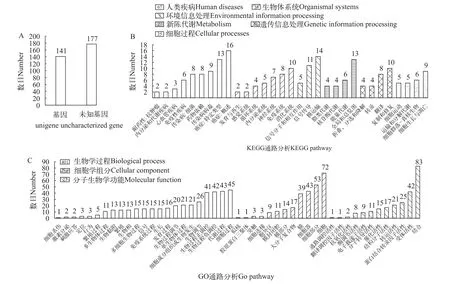
图5 超数微小染色体注释基因通路分析Fig. 5 Pathway analysis of annotated genes from supernumerary microchromosomes
2.5 超数微小染色体上减数分裂相关基因的鉴定及表达分析
前期的研究通过多个品系的比较基因组解析发现与双二倍体鲫相比, 双三倍体银鲫中有13个基因家族发生了扩张, 其中有8个是减数分裂相关基因家族, 这些基因的扩张可能与银鲫进行雌核生殖特殊的卵子发生方式有关[14]。本研究发现在这8个扩增的减数分裂相关基因家族中, 有6个在超数微小染色体序列中都能检测到扩增拷贝。纺锤体组成相关基因incenp在HiC_sacffold_51和HiC_sacffold_53分别有1个拷贝; 细胞周期相关基因fbxo5在HiC_sacffold_57上有2个拷贝; 核膜组装相关基因lap2在HiC_sacffold_56和HiC_sacffold_204上分别有1个拷贝;bmb在HiC_sacffold_64上有1个拷贝;ccna2在HiC_sacffold_53上有2个拷贝;nusap1在HiC_sacffold_166上有1个拷贝。其中,incenp、fbxo5和lap2这3个基因除了在双三倍体银鲫超数微小染色体序列上存在拷贝, 还分别在双三倍体银鲫的染色体chr3B、chr18B和chr9A上存在1个扩增拷贝; 而bmb、ccna2和nusap1这三个基因则只在双三倍体银鲫超数染色体序列上存在扩增拷贝。
本研究针对这6个基因在双三倍体银鲫中扩增的拷贝[incenp-Cg(B+chr3B)、fbxo5-Cg(B+chr18B)、lap2-Cg(B+chr9A)、bmb-CgB、ccna2-CgB和nusap1-CgB]设计了特异的PCR引物(表1), 分别在双三倍体银鲫出膜后30d、70d、160d、200d和1y(性成熟时期)的雌性性腺中进行了qPCR检测。我们发现这些基因拷贝在银鲫卵子发生过程中几乎均有转录表达(图6), 暗示着超数微小染色体上扩增的这些基因具有活性, 可能在银鲫特殊的卵子发生过程中发挥作用。

图6 双三倍体银鲫特异扩增减数分裂相关基因的转录活性检测Fig. 6 Transcriptional activity detection of meiosis-related genes that are specifically expanded in amphitriploid C. gibelio
2.6 超数微小染色体减数分裂相关基因SCAR标记开发
此外,bmb-CgB、ccna2-CgB和nusap1-CgB这些超数微小染色体特异拷贝引物还可以用来开发超数微小染色体特异的SCAR(sequence characterized amplified regions)标记。我们在不含超数微小染色体的双二倍体鲫和含有超数微小染色体的双三倍体银鲫中进行了PCR检测, 发现这3对引物在双三倍体银鲫雌性和雄性个体中均能扩增出特异条带, 而在双二倍体鲫雌性和雄性个体中均扩增不出条带(图7)。因此, 这些SCAR标记还可以作为区分双二倍体鲫和双三倍体银鲫的分子标记。
3 讨论
性别在自然界中普遍存在, 广义的有性生殖是指发生减数分裂以及随后核子融合[28]。越来越多的证据表明有性生殖是真核生物的共源性状[29,30]。然而在自然界中的确存在少数的生物类群进行单性生殖, 其中脊椎动物约有100种[31]。我们通常所说的单性生殖包括孤雌生殖、雌核生殖和杂种生殖[32]。孤雌生殖是雌性亲本产生未减数的卵子, 这些卵子独自发育成与母本遗传背景一致的个体, 不需要雄性[33]。雌核生殖同样也是雌性亲本产生不减数的卵子, 但是卵子须要外源精子刺激胚胎发育,形成与母本遗传背景一致的个体[17,18]。行杂种生殖的生物, 雌性产生减数的卵子, 但是卵子只含有母本的单倍体基因组, 父本的基因组在形成卵子的时候被排除[34]。单性生殖没有减数分裂同源重组,导致有害突变积累及阻碍遗传多样性产生, 通常被认为是演化的死胡同。值得注意的是, 有些单性生殖生物类群存在的时间已经远超出其预测的灭绝时间, 且展示出很高的遗传多样性和很强的环境适应性[13,35,36]。因此, 单性动物对于回答生态学和演化生物学领域的基础科学问题具有重要意义。
超数染色体由于其非必需的特质, 最初被认为是没有或者很少有生物学功能的。随着研究的拓展和深入, 逐渐发现超数染色体对于所在的生物类群能够发挥重要的生物学功能和演化适应性[37]: 比如在真菌中, 超数染色体发现与致病性有关[38]; 在植物中, 超数染色体能够增强植物的耐受性[39]; 在许多动物中, 超数染色体具有性别决定功能[40,41],近期在洞穴鱼的超数染色体上还鉴定了性别决定基因[5]。我们前期的研究也发现, 在银鲫雄性中, 雄性特异的超数微小染色体上含有在性别决定关键时期雄性特异或者雄性偏向表达的基因[20], 且与银鲫的雄性发生紧密相关[21]。在本文的研究中, 发现银鲫中扩张的8个减数分裂相关基因, 有6个在超数微小染色体上存在扩增拷贝。其中incenp、fbxo5和lap2这3个基因在常规染色体和超数微小染色体上都存在扩增拷贝, 且荧光定量检测引物没有办法区分常规染色体和超数微小染色体上的扩增拷贝,因此这3个基因在卵巢发育不同时期的转录表达是常规染色体和超数微小染色体扩增拷贝共同表达的结果。另外3个基因(bmb、ccna2和nusap1)则只在超数微小染色体上存在扩增拷贝, 且这3个基因在卵巢发育的不同阶段都具有转录表达。这些结果暗示着超数微小染色体在双三倍体银鲫特殊的单性雌核生殖过程中可能发挥作用。
此外, 双二倍体鲫和双三倍体银鲫共同组成了鲫复合种, 双三倍体银鲫是由祖先双二倍体鲫经同源三倍化而形成, 他们广泛的分布于亚欧大陆及附近岛屿的淡水水系, 有着部分重叠的生态分布[12,13]。双二倍体鲫和双三倍体银鲫是我国重要的大宗淡水养殖鱼类, 在外观和形态上没有明显差异, 通常我们是通过流式细胞仪对其血细胞的DNA含量进行测定来对二者进行区分[42]。通过流式细胞仪进行区分的流程比较繁琐, 样品处理不当还容易造成结果不准确。本研究中开发的超数微小染色体特异SCAR标记, 能够很好地区分双二倍体鲫和双三倍体银鲫, 为两者的快速鉴定提供了一条快捷和准确的途径。
总之, 本研究鉴定了双三倍体银鲫超数微小染色体序列, 揭示了银鲫超数微小染色体含有常规染色体同源序列且积累了大量重复序列, 发现超数微小染色体上含有活性基因, 证明减数分裂相关基因通过超数微小染色体发生扩张, 开发了超数微小染色体特异的SCAR标记。本研究不仅解析了银鲫超数微小染色体的基因组特征, 也为超数染色体在单性生物演化中的作用提供了创新见解。
