注射和口服GnRH对小黄鱼人工催产效果的评估
2023-09-09方馨正胡伟华陈睿毅曾延清柴学军徐冬冬
方馨正 胡伟华 陈睿毅 曾延清 柴学军 徐冬冬
(1. 浙江海洋大学水产学院, 舟山 316022; 2. 浙江省海洋水产研究所, 舟山 316021;3. 浙江省海水增养殖重点实验室, 舟山 316021)
在人工养殖条件下, 有些鱼类的亲体必须依赖催产素才能够排卵[1—3]。随着催产激素的研制和应用, 突破了多种淡、海水鱼类的人工繁殖技术, 结束了以捕捞天然苗种的时代[4]。目前, 常用的催产激素种类主要有人绒毛膜促性腺激素(Human Chorionic gonadotrophins, hCG)、地欧酮(Domperidone,DOM)、鲤鱼脑垂体(Carp pituitary extraction, CPE)和促黄体素释放激素类似物(Luteinizing hormone releasing hormone along, LHRH-A)和促性腺激素释放激素类似物(Gonadotrophin releasing hormone,GnRH)等[5—7]。虽然催产激素种类众多, 但不同的催产激素在不同鱼类中的给药方式、剂量及其效果差异很大, 如黄颡鱼[8](Pelteobagrus fulvidraco)、加州鲈[9](Micropterus salmoides)和泥鳅[10](Misgurnus anguillicaudatus)等常用LHRH-A2、DOM及HCG组合进行腹腔或肌肉注射催产; 大黄鱼[11](Larimichthys crocea)则常采用LHRH-A3注射催产; 金枪鱼[12](Thunnusthynnus)和虹鳟[13](Oncorhynchus mykiss)等采用GnRH肌肉注射埋植法。采用注射的方式催产是鱼类中最为常见的给药方式, 埋植和口服等给药方法的报道较少[14—16]。对于应激性强的鱼类, 如大黄鱼、金枪鱼等, 人工注射容易引发亲鱼损伤、引起炎症, 从而引发疾病甚至死亡。研发口服型的催产激素不仅能够降低催产对于亲本的损伤, 而且还能够提高产卵效率, 节省人力成本。
GnRH作为动物下丘脑-垂体-性腺(Hypothalamus-pituitary-gonad, HPG)轴中最先发现激素, 由10个氨基酸组成, 其在鱼类中的序列保守, 且易于人工合成, 是研发口服型催产激素的首选目标。研究发现在猪、马、牛和羊等畜禽类动物中, 通过投喂GnRH能提高发情频率和受精率, 提高产出的子代数量和质量[17,18]。但与注射或包埋给药方式相比, 口服激素由于合成价格高、催产效果不佳等原因, 所以尚未大规模投入使用。但近年来, 随着生物药物加工技术水平的飞速发展, 人工合成的多肽费用显著下降[19,20], 已有激素、单克隆抗体及多肽疫苗等超百种多肽药物问世[21,22], 这些为口服激素在水产中的研制和应用提供了良好基础。同时, 因口服激素无须注射或埋植等操作, 可有效避免麻醉和捕捞等人工处理给亲鱼带来的损伤, 其应用相关的探索越来越受到人们的关注。
小黄鱼(Larimichthys polyactis), 俗称黄花鱼,属鲈形目、石首鱼科、黄鱼属, 广泛分布于我国东海、黄海和渤海海域及朝鲜半岛附近海域, 因其肉质细腻鲜美, 营养丰富, 深受消费者喜爱, 是我国的“四大海产”之一[23—25]。随着渔业资源过度捕捞, 小黄鱼种群中呈现出个体性成熟提前、低龄化和小型化等资源衰退现象[26,27]。近年来, 浙江省海洋水产研究所等单位对小黄鱼人工繁育进行了系统研究, 突破了其全人工规模化繁殖技术[28]。小黄鱼的人工繁殖必须依靠催产激素才能排卵, 已有研究表明LHRH-A2能够有效诱导小黄鱼排卵, 但催产效果有待提高, 且因其应激性强, 采用注射的方式容易造成鱼体损伤, 亟须研发新型催产激素并改变催产方式。本研究旨在探索新型催产激素和给药方式, 采用注射和口服两种方式开展小黄鱼催产试验,以生理盐水注射为对照, 设置LHRH-A2注射组、GnRH注射组和GnRH口服组, 比较各实验处理组的产卵情况、血清激素水平及组织生理变化, 评价不同催产方法的繁殖性能, 综合评估GnRH的催产效果。研究结果为提高小黄鱼的人工繁育技术水平提供理论和技术参考。
1 材料与方法
1.1 亲鱼来源及强化培育
小黄鱼亲鱼来自2019—2020年人工培育的2—3龄无病无伤, 活力良好的性成熟个体, 雌雄鱼初始平均体重分别为(64.49±8.81)和(65.28±7.87) g。2021年2月从网箱移至室内50 m3水泥池强化培育,采用经沉淀砂滤而得的自然海水养殖, 每天吸污、换水, 保持溶氧6 mg/L以上, 日换水量100%以上, 每天投喂两次配合饲料和沙蚕进行营养强化。
1.2 试验方法
待自然水温上升至16℃, 挑选亲本120尾, 腹部柔软且生殖孔红肿的雌鱼72尾, 轻压腹部有精液流出的雄鱼48尾, 按雌雄比1.5﹕1随机分至1 m3玻璃钢试验桶中暂养, 每组30尾。暂养1周后, 将实验分为生理盐水注射组、LHRH-A2注射组、GnRH注射组和GnRH口服组, 共分为4组, 每组两个平行。根据文献报道设置A2注射组剂量为2.4 μg/kg, GnRH注射组剂量为75 μg/kg, 采用腹腔注射法进行催产[29,30];GnRH口服组剂量为6 mg/kg[31]。口服GnRH的制备方法是优化了激素饲料制备和包埋方式, 具体为将溶于无水乙醇的GnRH均匀喷洒在饲料上, 然后用海藻酸钠-壳聚糖凝胶进行药物包埋, 待晾干后投喂给药[31,32]。在试验开始后, GnRH口服组每天饱食投喂, 至亲鱼产卵停止激素处理, 转为正常饲料, 其他各组采用正常饲料饱食投喂。
1.3 受精卵收集及孵化
小黄鱼的卵属于浮性卵类型且为夜间产卵, 定期用80目的筛绢网在实验桶中收集鱼卵, 收集后的鱼卵静置15min后虹吸去除死卵, 将上浮卵置于孵化槽中孵化。统计产卵量(Egg production, EP)、上浮卵重(Buoyancy egg weight, BEW)、受精率(Fertilization rate, FR)及孵化率(Hatching rate, HR)。
受精率(FR, %)=受精卵总数/总产卵量×100
孵化率(HR, %)=出膜仔鱼数/受精卵总数×100
1.4 组织样品采集
在各组产卵前(实验处理前)、中(开始产卵后的第7天)、后(停止产卵后的第7天)进行取样, 每次取6尾, 用浓度为100 mg/L的MS-222(间氨基苯甲酸乙酯甲磺酸盐)对实验鱼进行快速麻醉, 测量其全长、体长和体重等数据后尾静脉采血, 离心后收集上层血清置于-20℃保存备用; 解剖取出完整的卵巢, 观察性腺发育情况, 判断卵巢分期, 称量性腺重(Gonadal weight, GW), 计算生殖腺指数(Gonad somatic index, GSI)。每尾鱼取左侧卵巢0.1—0.5 g,解剖镜下计数, 计算出卵巢中的总怀卵量, 即绝对繁殖力(Absolute fecundity, AF); 取右侧卵巢中部置于Bouin’s液中固定, 用于后续组织学切片。
生殖腺指数(GSI)=性腺重/体重×100
绝对繁殖力(AF)=每克卵数量×卵巢重量
1.5 血清激素测定
选用ELISA试剂盒检测血清中促黄体激素生成素(Luteinizing hormone, LH; 博深, BS-E17501O2)、卵泡刺激素(Follicle-stimulating hormone, FSH;博深, BS-E17362O2)和促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH; 博深, BS-E17365O2)水平。通过酶标仪(BioTek Synergy; 美国伯腾)在450 nm 处测定其吸光值 (Optical Density, OD), 根据标准曲线计算每个样品的LH、FSH和GnRH激素水平, 每个样品重复测定3次。
1.6 组织学切片及卵母细胞发育分期
Bouin’s固定液中卵巢经乙醇梯度脱水和二甲苯透明, 用石蜡包埋固定样品, 在切片机(RM 2245型; 德国莱卡)上连续切片(厚度5—6 μm), 经苏木精-伊红染色, 中性树脂封片, 用光学显微镜(AXIOCam 506型; 德国蔡司)拍照观察。卵母细胞发育分期的划分, 参照文献报道关于鱼类卵母细胞发育分期的标准[33—35], 根据测量的卵母细胞直径大小和核仁数目, 并结合卵黄物质的积累, 将其划分为3个时相: 第Ⅱ时相卵母细胞(初级生长期), 其直径为44—210 μm, 核仁数量3—8个; 第Ⅲ时相卵母细胞(皮质液泡阶段), 细胞核占卵母细胞大部分, 其直径为211—400 μm, 核仁数量明显增多; 第Ⅳ时相卵母细胞(卵黄蛋白原合成期), 大部分细胞核消融, 并出现大量油滴和卵黄颗粒, 其直径为401—697 μm, 核仁数量明显减少。利用ZEN Blue lite2测量卵母细胞直径, 并记录不同发育时相卵母细胞的数量。
1.7 数据统计
所有实验数据由Excel 2019软件统计, 表示为平均值±标准误(mean±SE), 用SPSS 25.0统计软件进行统计学分析, 采用T-test检验进行显著性检验,差异显著性水平为P<0.05, 利用GraphPad Prism 9.0软件进行制作图表。
2 结果
2.1 人工催产繁殖效果分析
实验期间注射生理盐水组的小黄鱼不会产卵,外源激素处理组均可诱导小黄鱼产卵。LHRH-A2注射组和GnRH注射组的效应时间为48h, 且LHRHA2组在注射后第2天达到产卵高峰, 其后开始下降;GnRH注射组的产卵量在注射后第3天达到高峰; 而GnRH口服组的效应时间为120h, 产卵期间的前3天产卵量较高, 之后呈现逐渐下降的趋势(图1)。
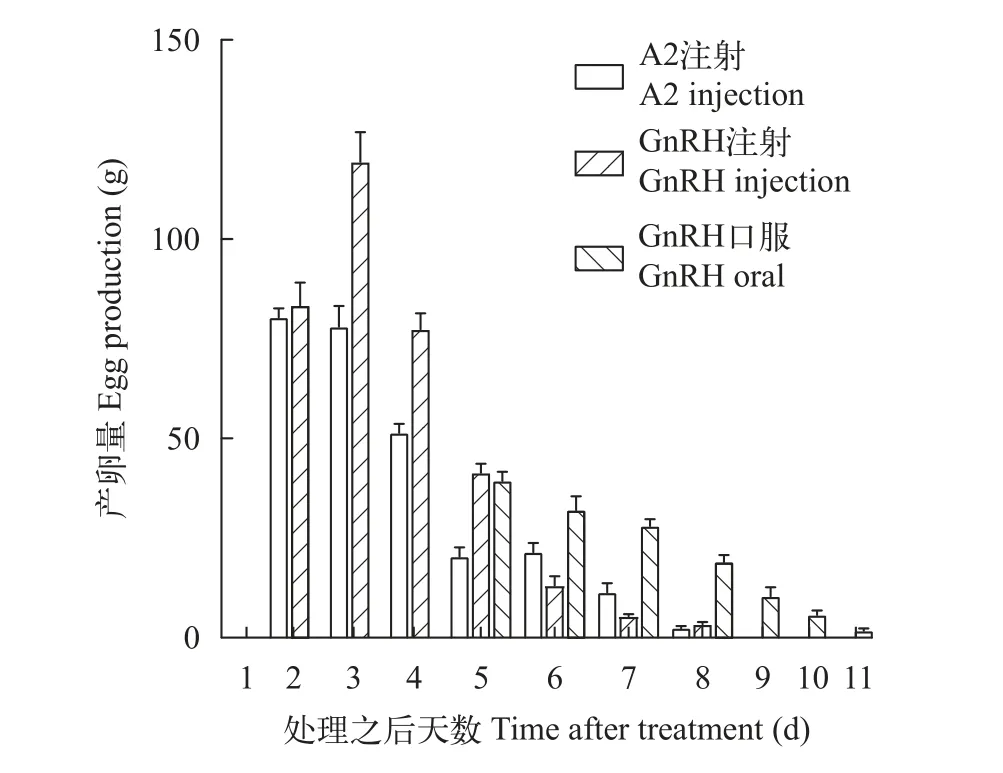
图1 LHRH-A2注射组、GnRH注射组和GnRH口服组每天的产卵量Fig. 1 Daily egg production of injection of LHRH-A2, injection of GnRH and oral administration of GnRH
在产卵量和上浮卵重方面, LHRH-A2注射组分别为(254.5±25.5)和(126.19±17.38) g; GnRH注射组最高, 分别为(354.5±23.5)和(152.68±18.72) g, 但与LHRH-A2注射组无明显差异(P>0.05); GnRH口服组最低, 为(140.2±6.04)和(49.61±3.66) g, 显著低于外源激素注射组(P<0.05)。但在受精率和孵化率方面, 各处理组间无明显差异(表1)。
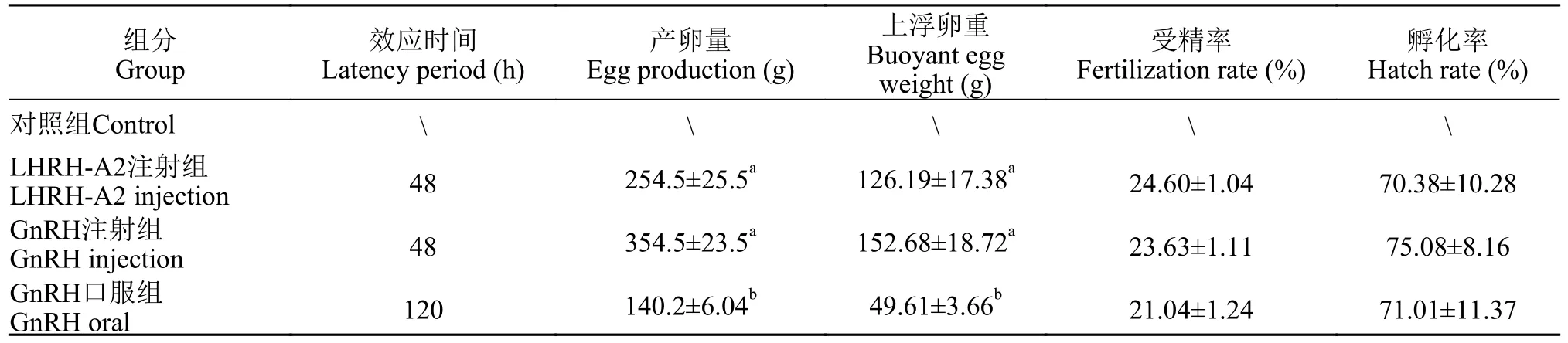
表1 各处理组的产卵情况比较Tab. 1 Comparison of effect time, egg production, floating egg weight, fertilization rate, and hatching rate
2.2 小黄鱼产卵过程的性腺发育分析
实验初始小黄鱼性腺发育良好, 雄鱼精巢呈乳白色、细线状, 轻挤压精巢有精液流出, 卵巢呈淡黄色的长囊状, 血管丰富, 两侧对称(图2)。
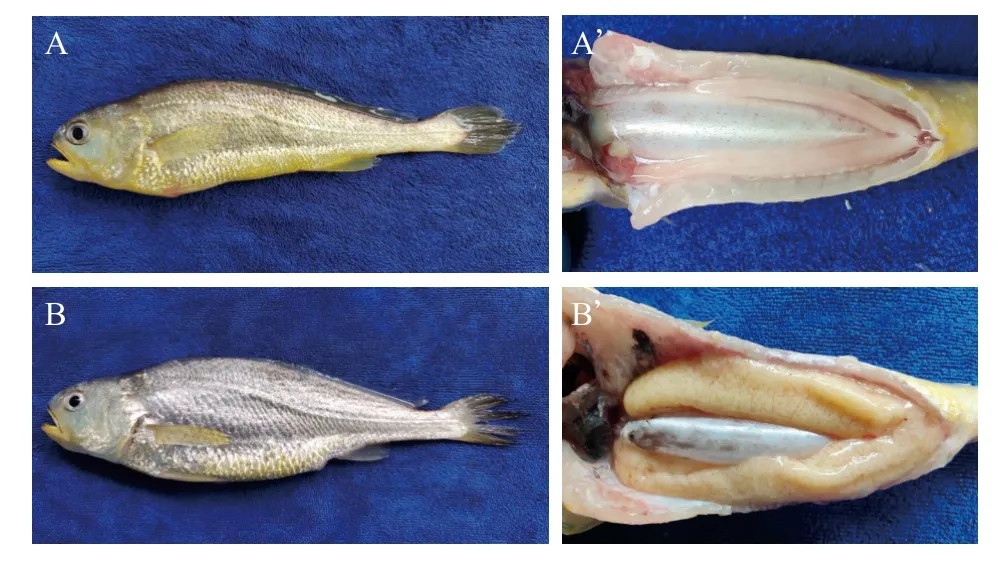
图2 实验初期小黄鱼的性腺发育情况Fig. 2 Gonadal development of small yellow croaker at the start of experiment
对小黄鱼产卵过程的性腺发育情况分析, 对照组的生殖腺指数(GSI)和绝对繁殖力(AF)在试验过程中无明显变化。各激素处理组的GSI在产卵中和产卵后均呈现显著下降的趋势, 显著低于同期的对照组(P<0.05)。而各激素处理组的AF在产卵中和产卵后均呈上升趋势, 显著高于同期对照组(P<0.05),且GnRH注射组高于LHRH-A2注射组(图3)。
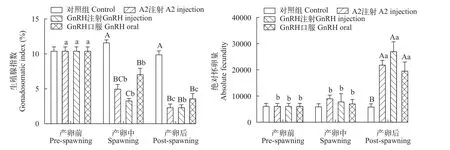
图3 小黄鱼生殖腺指数和绝对繁殖力Fig. 3 The gonadosomatic index of small yellow croaker and absolute fecundity in pre-spawning, spawning and post-spawning
进一步采用组织切片分析各组的卵巢组织结构, 在产卵前期各处理组卵巢均处于Ⅲ期, 可见大量第Ⅲ时相卵母细胞(图4A、4D、4G和4J)。产卵中期, 各激素处理组的卵巢均处于Ⅴ期(图4E、4H和4K), 但A2注射组的油滴和卵黄颗粒数量明显多于GnRH口服组(图4K), 且大量卵母细胞的细胞核已溶解, 放射带变厚。产卵后期, 外源激素处理组的卵巢发育相似, 可见大量空滤泡结构(图4F、4I和4L), 而对照组卵巢在产卵前、中、后无明显变化(图4A、4B和4C)。
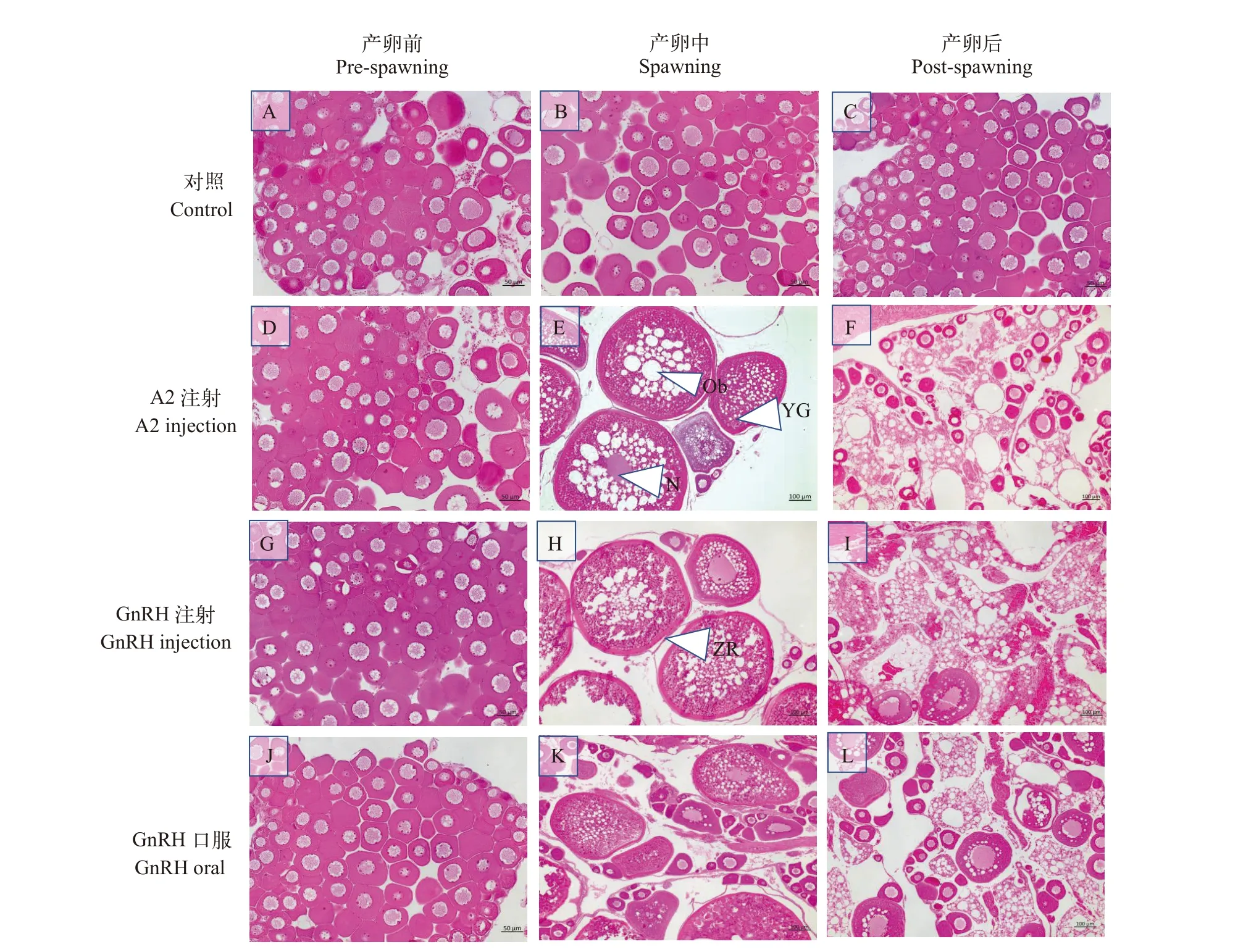
图4 不同催产激素处理组在产卵过程中卵巢发育的组织学比较Fig. 4 Histological comparison of ovarian development during the pre-spawning, spawning, and post-spawning periods in small yellow croaker treated with different oxytocic hormones
对小黄鱼产卵过程的卵母细胞时相占比进行分析, 在产卵前期各组初始的Ⅱ时相、Ⅲ时相和Ⅳ时相比例分别为40%—42%、29%—31%和27%—31%(图5)。在实验过程中, 对照组虽未产卵, 但卵母细胞各时相比例也有所变化, 表现为Ⅱ时相卵母细胞比例先下降后升高, Ⅳ时相卵母细胞先升高后下降的趋势。各激素处理组的卵母细胞时相占比则发生剧烈变化, 在产卵中期, LHRH-A2注射组和GnRH注射组以Ⅲ和Ⅳ时相卵母细胞为主, 总比例分别为74%和62%; 而GnRH口服组的Ⅱ时相卵母细胞占50%, Ⅲ和Ⅳ时相总比例为50%。在产卵后期, 各激素处理的卵母细胞以Ⅱ时相为主, 占比为68%—69%, 而此时对照组的Ⅱ时相比例仅为36%。
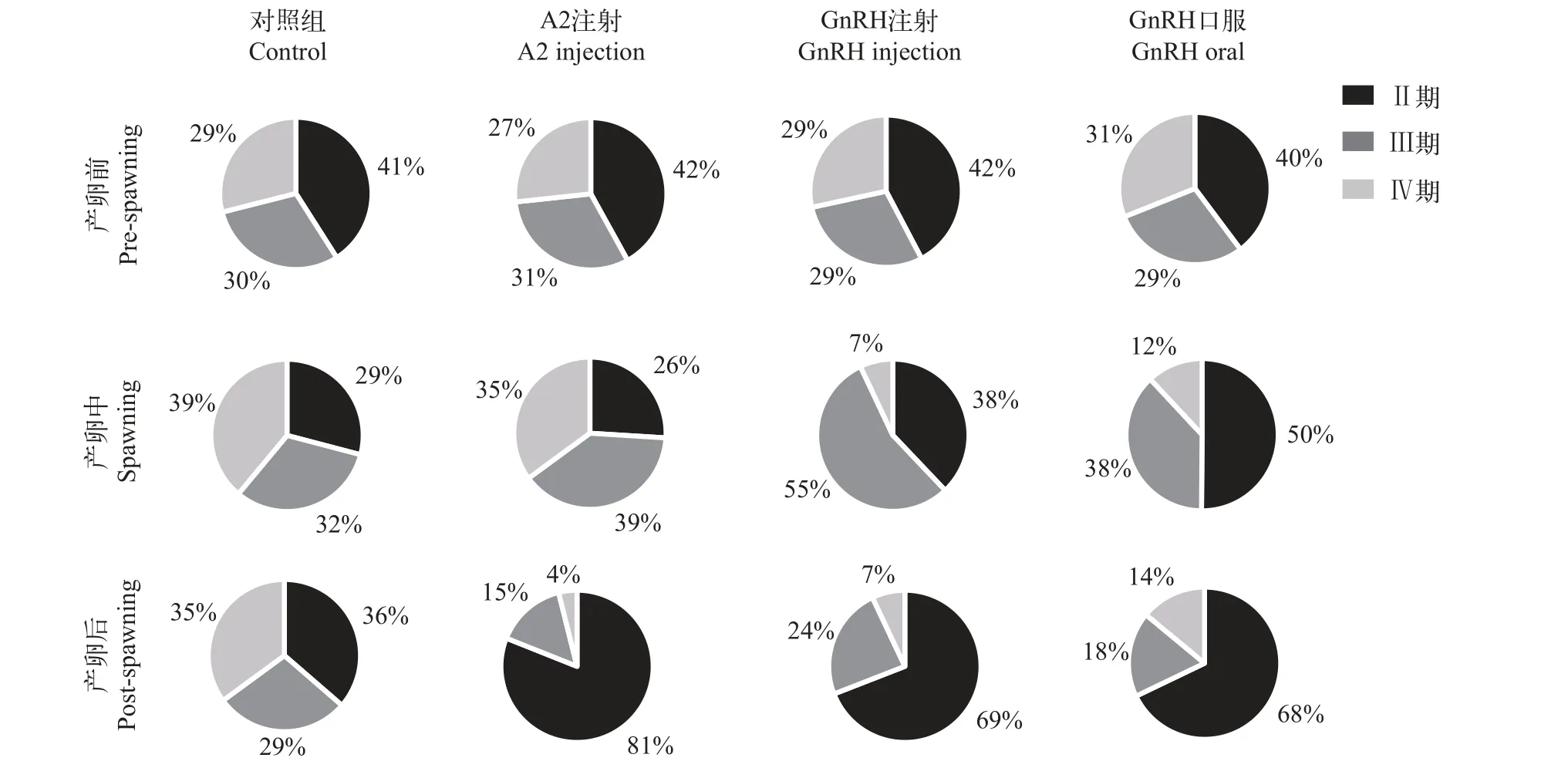
图5 小黄鱼产卵前、中、后期卵母细胞分期占比统计Fig. 5 Staging percentage of pre-spawning, spawning and post-spawning oocytes in small yellow croaker
2.3 小黄鱼产卵过程血清中LH、FSH和GnRH激素水平的分析
对小黄鱼产卵过程中血清HPG轴相关的类固醇激素进行分析, 结果显示, 与对照组相比, 各激素处理血清的LH、FSH和GnRH水平迅速升高, 均显著高于同期对照组(P<0.05), 产卵后期仍可维持在较高水平(图6)。其中, GnRH注射组的FSH、GnRH水平显著高于LHRH-A2注射组(P<0.05), LH无显著差异(P>0.05)。GnRH口服组的LH、FSH和GnRH水平显著高于其余激素处理组(P<0.05)。
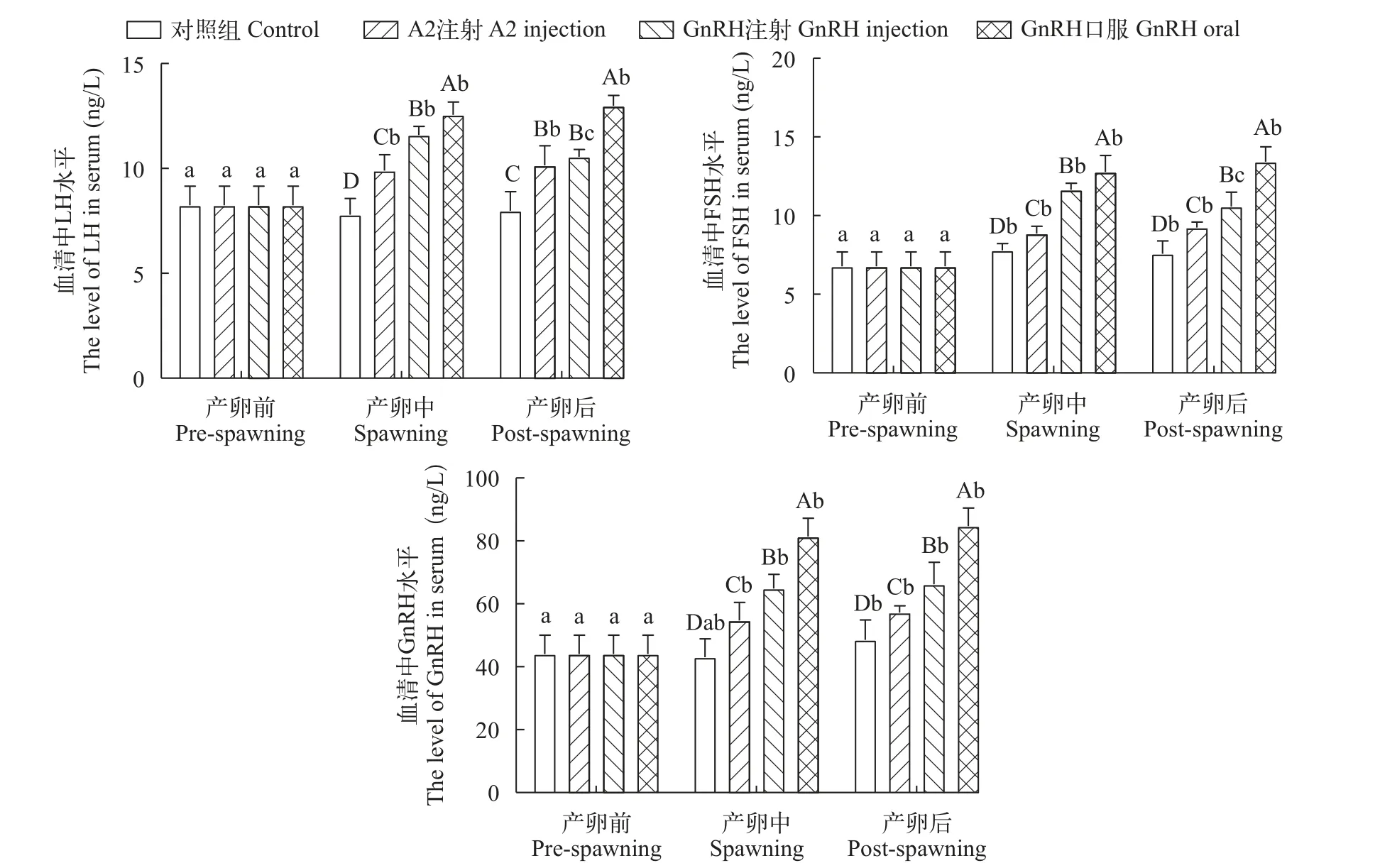
图6 小黄鱼产卵前、中、后的血清激素水平Fig. 6 Serum hormone levels of pre-spawning, spawning and post-spawning in small yellow croaker
3 讨论
催产激素的研发和应用对于鱼类繁殖至关重要。小黄鱼需要依靠激素催产才能完成排卵, 但其应激性较强, 注射和埋植均会不可避免地造成损伤,筛选新型催产激素并探索口服给药对于提高人工繁育技术水平具有重要意义。本研究初步评估了GnRH对小黄鱼的催产效果, 通过设置LHRH-A2注射、GnRH注射和口服等不同处理, 分析其在小黄鱼产卵中的催产作用, 结果表明GnRH注射与LHRH-A2注射相比在效应时间、受精率和孵化率基本相当, 但产卵量和上浮卵量显著高于LHRHA2注射组。口服GnRH也能够诱导小黄鱼产卵, 与注射组相比, 受精率和孵化率无差异, 但效应时间长、产卵量显著低。因此, 上述结果表明GnRH是小黄鱼人工催产激素的潜在选择。GnRH注射能显著提高小黄鱼人工繁殖效果, 与条纹狼鲈(Morone saxatilis)[3]、白卜鲔(Euthynnus affinis)[36]和金头鲷(Sparus aurata)[37]等鱼类中的GnRH催产效果相一致。然而, 口服GnRH组的产卵量低于注射组, 这可能由于口服激素需要经过吸收、代谢等过程, 导致效应时间较注射组长, 且此过程会导致药物损耗,到达靶器官时其有效剂量减少, 故而可能导致产卵量减少。
安全有效的催产激素和科学的催产方案越来越受到关注[38]。良好的产卵效果往往既能获得优质受精卵又可以提高亲本产后存活率[37,39,40], Donaldson和Hunter等[41]发现养殖鱼类会因卵母细胞不能达到成熟排卵阶段(Final Ooctye maturation, FOM)而引起雌鱼死亡。卵巢中卵母细胞发育成熟及排卵情况与人工繁殖效果紧密相关, 通过解剖学和组织学分析可以明确卵巢中卵母细胞的成熟情况, 很好地评估外源激素处理对繁殖性能的影响。本研究通过解剖学和组织学分析表明经外源催产激素处理后, 各处理组的卵巢均可以发育至Ⅳ期并排卵,产卵中期的卵母细胞以Ⅳ时相为主, 而对照组卵巢则停留在Ⅲ期且卵子不会排出, 进一步证明小黄鱼在室内培育条件下需要依靠外源激素促熟排卵。
HPG轴在性腺发育成熟中起着关键性的作用,相关激素如GnRH、FSH、LH等类固醇激素都在鱼类繁殖中扮演着重要的角色, GnRH由下丘脑分泌, 可通过垂体门脉系统来调控FSH和LH的合成和分泌。FSH与LH协同作用促进卵泡分泌甾体激素,从而触发排卵[42,43]。在产卵障碍的哺乳动物中, 均发现LH和FSH激素水平显著低于正常个体[44,45]。在本研究中, 经过激素处理后鱼体血清中GnRH、FSH和LH的激素水平显著上升, 表明GnRH和LHRHA2均能够有效促进FSH和LH的合成与释放[46—48],从而诱导小黄鱼产卵。口服GnRH组的相关激素水平也能够迅速升高, 但产卵量显著低于注射组, 表明口服GnRH可以通过肠道吸收、循环转运至垂体发挥生理功能, 但其口服的药代动力学还需要深入研究。
口服给药能够减少人工操作, 可以有效降低人工成本, 在鱼类繁殖实践中应用潜力巨大。尤其在一些应激性强的鱼类中, 口服激素的研发应用非常重要。研究学者已经进行了相关的试验尝试, 如蓝鳍金枪鱼通过投喂抗原级GnRH, 其催产效果与激素埋植的效果相当, 可以在繁殖期进行多次安全有效的催产[36]; 云纹犬牙石首鱼(Cynoscion nebulosus)和点带石斑鱼(Epinephelus coioides)等通过口服GnRH类似物, 能成功诱导产卵并使其血液中激素水平升高并诱导其排卵[16,49]。本研究首次在石首鱼类中尝试采用口服GnRH的方式催产, 虽然催产效果不及人工注射的效果, 但通过进一步优化包埋方式、给药剂量等方法有望提升口服的催产效果, 建立安全高效的催产繁殖操作流程。相关技术不仅有利于提高小黄鱼的人工繁殖技术水平, 也可以在大黄鱼等海水鱼类中应用, 为其繁育水平的提升提供技术支撑。
致谢:
感谢浙江省海洋水产研究所的王跃斌、张鼎元、安从军等在试验期间对小黄鱼养殖管理方面给予的帮助。
