柚皮苷对更年期抑郁症模型小鼠绝望行为的影响及神经保护机制研究
2023-09-09王丽红赵德萍徐红丹
苏 婷,王丽红,于 浩,崔 悦,张 宁,赵德萍,徐红丹,雷 霞,2
(1.佳木斯大学药学院,黑龙江 佳木斯 154007;2.无锡市中医医院,江苏 无锡 214071;3.黑龙江中医药大学,黑龙江 哈尔滨150040;4.无锡卫生高等职业技术学校,江苏 无锡 214071)
更年期抑郁症是一种以情绪低落、绝望、焦虑为主要临床特征的精神疾病,海马神经元损伤是其主要病理特征之一[1]。绝经后女性脑内的海马神经元细胞缺乏雌激素的保护作用,更加难以应对压力事件,是导致女性绝经后易感抑郁的重要原因[2]。研究表明,压力刺激会造成前额叶皮层谷氨酸大量释放,引起神经元兴奋毒损伤,造成海马神经元细胞过度凋亡,细胞数量减少[3]。
柚皮苷(4,5,7-三羟基黄烷酮-7-鼠李糖苷),是一种分布较广的黄酮类化合物,其在骨碎补中含量较高,具有植物雌激素样结构[4]。Jung 等[5]研究表明,柚皮苷易通过血脑屏障,并具有较强的抗细胞凋亡作用。进一步研究发现,柚皮苷对神经元细胞的抗凋亡作用依赖于激活雌激素受体(estrogen receptor,ER)[6,7]。柚皮苷是否 通过促进更 年期抑郁症(OVX+CUMS)模型小鼠脑内的ER 受体表达而发挥抗细胞凋亡作用?本文主要探究柚皮苷对OVX+CUMS 模型小鼠海马雌激素受体及神经元细胞凋亡的影响。
1 资料与方法
1.1 资料
1.1.1 动物 SPF 级昆明小鼠,雌性,体重(23±2)g,购自昌盛生物科技有限公司,合格证号:SCXK(辽)2019-0001。所有方案均经黑龙江中医药大学动物伦理委员会批准(许可证号:NO.2019-002)。每只鼠笼(42 cm×30 cm×27 cm)饲养和驯化5 只小鼠,并将其饲养于温度为(21±2)℃、相对湿度为(62±2)%、光照12 h 昼夜交替环境下。实验期间自由饮食、饮水。
1.1.2 药品和主要试剂 柚皮苷(纯度≥98%,货号:B21594),购自上海源叶生物科技有限公司;ICI182780,(货号:531042),购自Sigma;雌二醇(纯度98%,S30633),购于源叶生物;BCA 蛋白定量试剂盒(货号:20201ES76),购自翌圣生物科技(上海)股份有限公司;PVDF 膜和 Immobilon Western HRP 底 物(货 号:10600023,WBKLS0100),购 自Whatman 公司;ERα、ERβ、GluR2、CAMK Ⅱ、NMDAR1、β-actin、山羊抗兔IgG H&L(HRP)(货号:ab22595,ab22595,ab52180,ab181052,ab17345,ab8227,ab6721),购自Abcam 公司;Bad、Bcl-2、Caspase3(货号:BM4241,BA0412,BA2142),购自博士德生物;抗体稀释液(货号:E-IR-R106),购自Elabscience。
1.1.3 主要仪器 光学显微镜(型号:BX41,奥林巴斯);化学成像系统(型号:A44116,Thermo);酶标仪(型号:5187149,Thermo);水平摇床(型号:WD9405B,北京市六一仪器厂);电泳仪(型号:MiniPROTEANTetra Cell,BIO-RAD 公 司);半 干转 膜 仪(型 号:Trans-Blot SD Cell,BIO-RAD 公司);超纯水制备系统(型号:RsearchUV UF,上海和泰公司)。
1.2 方法
1.2.1 动物分组
54 只小鼠随机分为6 组(n=9),即空白组、模型(OVX+CUMS)组、假手术组(SHAM 组)、雌二醇组(E2组)、柚 皮 苷 组 和 柚 皮 苷+ER 阻 断 剂(ICI182780)组。
1.2.2 OVX+CUMS 模型复制及给药
适应性饲养7 d 后,按冯钰[8]手术操作方法对空白组外其他各组小鼠进行双侧卵巢摘除手术。每只雌性小鼠均用2%异氟烷后,在其背部区域做一个切口,找到卵巢周围的脂肪,拉出卵巢,切除卵巢并剪去余线,随后将子宫角送回原位。假手术按上述操作进行,但只剪去等体积脂肪块。
手术结束14 d 后,对除空白组和SHAM 组外其余各组小鼠按吴熠等[9]应激方式进行刺激。每天随机进行一种应激刺激,但不连续使用同一种应激方式,连续刺激21 d。
21 d 刺激结束后,空白组、SHAM 组和OVX+CUMS 组每天灌胃0.2 mL 蒸馏水,E2组、柚皮苷组每天分别灌胃等体积E(220.090 mg·kg-1·d-1)、柚皮苷(100 mg·kg-1·d-1),柚皮苷+ICI182780 组先腹腔注 射ICI182780(0.075 mg·kg-1·d-1),15 min 后 灌 胃等体积柚皮苷(100 mg·kg-1·d-1),柚皮苷给药剂量基于实验室前期研究结果确定最佳给药剂量[10]。连续给药21 d 后,第22 天进行悬尾实验,第23 天进行强迫游泳实验。
1.2.3 行为学实验
1.2.3.1 悬尾实验 将每只小鼠用胶带使其悬浮在桌面上方58 cm 处的架子边缘,并将其放置在离尾巴尖端大约1 cm 的地方,悬挂保持6 min,并在测试的最后4 min 记录静止时间。静止时间判定标准为小鼠被动地且完全静止不动时,即视为静止。
1.2.3.2 强迫游泳实验 将每只小鼠单独放置在一个玻璃聚碳酸酯圆柱体中(高度:25 cm;直径:10 cm),深度为10 cm,水温保持恒温,保持6 min,并在测试的最后4 min 记录静止时间。静止时间判定标准如“1.2.3.1”。
1.2.4 脑组织收集
行为学结束后,戊巴比妥(80 mg/kg)麻醉后,经心脏灌注适量生理盐水,其中各组3 只小鼠继续经心脏灌注4%多聚甲醛,立即摘除脑组织,并沿中缝分为半脑,随后用生理盐水冲洗表面,用滤纸吸干体表水份,称重。随后将3 只灌注多聚甲醛的小鼠脑组织放入4%多聚甲醛固定24 h,其余小鼠脑组织分离海马后,于-80℃保存备用。
1.2.5 HE 染色观察小鼠海马神经元形态变化
将“1.2.4”小鼠脑组织经脱水、包埋、切片(厚度为4 μm)、烘片后,对切片进行HE 染色,并于显微镜下观察。
1.2.6 免疫组化检测海马区ERα 和ERβ 的阳性细胞表达
按云海龙等[11]步骤进行免疫组化实验操作,一抗ERα(1∶200)、ERβ(1∶200)和 二抗HRP(1∶500)按相应比例用抗体稀释液稀释后进行孵育,最后采用Image J 软件对每个切片5 个不同视野中的阳性细胞进行分析计算。
1.2.7 蛋白免疫印迹(WB)法检测海马中ERβ、GluR2、CAMKⅡ、NMDAR1、Bad、Bcl-2、Caspase3蛋白表达
取出海马,按耿娜[12]方法进行提蛋白、上样、蛋白含量检测等操作,经上样、电泳、转膜、抗体孵育等操作后,使用成像系统通过ECL 化学发光检测信号显影成像,最后应用Image J 软件对清晰条带进行分析。各抗体用抗体稀释液按ERβ(1∶200)、GluR2(1∶500)、CAMK Ⅱ(1∶200)、NMDAR1(1∶500)、Bad(1∶500)、Bcl-2(1∶500)、Caspase3(1∶500)、β-actin(1∶1 000)比例对抗体进行稀释。
1.2.8 统计学分析
2 结果
2.1 行为学实验结果
2.1.1 悬尾实验结果 与空白组相比,OVX+CUMS 组小鼠静止时间显著增加(P<0.01);与OVX+CUMS 组相比,SHAM 组、E2组和柚皮苷组小鼠静止时间显著减少(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠静止时间明显增加(P<0.05)。结果见图1。

图1 各组小鼠对悬尾实验的影响(n=9,)Fig 1 Effect of each group of mice on the suspended tailexperiment(n=9,)
2.1.2 强迫游泳实验结果 与空白组相比,OVX+CUMS 组小鼠静止时间显著增加(P<0.01);与OVX+CUMS 组相比,SHAM 组、E2组和柚皮苷组小鼠静止时间显著减少(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠静止时间明显增加(P<0.05)。结果见图2。

图2 各组小鼠对强迫游泳实验的影响(n=9,)Fig 2 Effect of each group of mice on the forced swim experiment (n=9,)
2.2 HE 染色观察各组小鼠海马神经元形态变化结果
如图3 所示,空白组小鼠海马神经元细胞正常,排列紧密;模型组小鼠海马神经元细胞排列稀疏,细胞固缩,胞体减小;与模型组相比,SHAM 组、E2组及柚皮苷组小鼠海马神经元细胞完整,排列相对紧密;柚皮苷+ICI182780 组神经元细胞与模型组细胞变化相似,胞体减小,细胞排列松散。

图3 各组小鼠海马神经元细胞形态变化(n=9,)Fig 3 Cell morphological changes of hippocampal neurons in each mouse group (n=9,)
2.3 免疫组化检测海马区ERa 和ERβ 的阳性细胞表达结果
与空白组相比,OVX+CUMS 组小鼠ERa 表达降低,但无统计学意义(P>0.05),ERβ 表达显著降低(P<0.01);与OVX+CUMS 组相比,SHAM组、E2组和柚皮苷组小鼠ERa 表达升高,但无统计学意义(P>0.05),ERβ 表达显著升高(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠ERa 和ERβ 表达显著降低(P<0.01)。结果见图4。

图4 各组小鼠海马中ERα 和ERβ 的阳性细胞表达的影响(n=9,)Fig 4 Effect of positive cell expression of ERα and ERβ in the hippocampus of each mouse group(n=9,)
如图5 所示,空白组小鼠海马区ERα 蛋白表达细胞排列紧密;模型组小鼠海马区ERα 蛋白表达细胞减少,核固缩;SHAM 组、E2组及柚皮苷组小鼠较模型组小鼠海马区细胞增多,细胞排列稍整齐;柚皮苷+ICI182780 组较柚皮苷组海马区细胞减少,且与模型组小鼠细胞形态相似。

图5 各组小鼠ERα 蛋白表达(免疫组化,×200)Fig 5 Expression of ERα protein in each group of mice (immunohistochemical,×200)
如图6 所示,空白组小鼠海马区ERβ 蛋白表达细胞正常、排列紧密;模型组小鼠海马区ERβ 蛋白表达细胞减少,排列松散;SHAM 组、E2组及柚皮苷组较模型组小鼠海马区细胞增多;柚皮苷+ICI182780 组较柚皮苷组海马区细胞减少,且与模型组小鼠细胞形态相似。

图6 各组小鼠ERβ 蛋白表达(免疫组化,×200)Fig 6 Expression of ERβ protein in each group of mice (immunohistochemical,×200)
2.4 WB 检 测 海 马 中ERβ、GluR2、NMDAR1、CAMKⅡ及凋亡因子Bad、Bcl-2 和Caspase3 的表达结果
2.4.1 WB 检测海马中ERβ 表达结果 与空白组相比,OVX+CUMS 组小鼠ERβ 表达显著降低(P<0.01);与OVX+CUMS 组相比,SHAM 组、E2组和柚皮苷组小鼠ERβ 表达显著升高(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠ERβ 表达显著降低(P<0.01)。结果见图7。
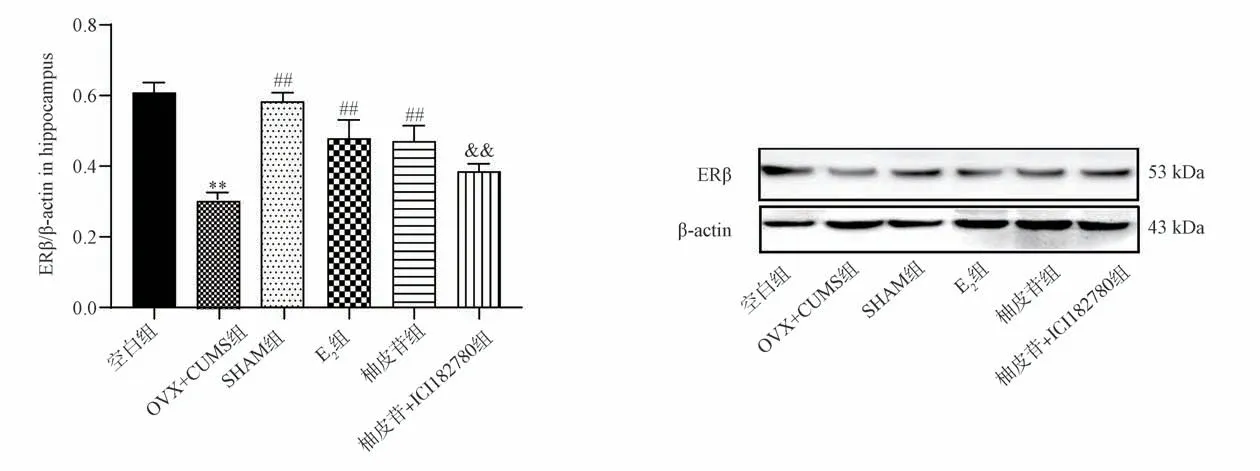
图7 各组小鼠海马中ERβ 表达结果(n=3,)Fig 7 Results of ERβ expression in the hippocampus of each mouse group (n=3,)
2.4.2 WB 检 测 海 马 中NMDAR1、GluR2、CAMKⅡ表达结果 与空白组相比,OVX+CUMS 组小鼠CAMKⅡ表达显著升高(P<0.01)、NMDAR1 表达明显升高(P<0.05)、GluR2 表达显著降低(P<0.01);与OVX+CUMS 组 相 比,SHAM 组 小 鼠GluR2、CAMKⅡ表达明显升高(P<0.05),E2组小鼠CAMKⅡ表达显著下降(P<0.01)、NMDAR1 表达明显下降(P<0.05)、GluR2 表达显著升高(P<0.01),柚皮苷组小鼠CAMKⅡ表达明显下降(P<0.05)、NMDAR1 表达显著下降(P<0.01)、GluR2表达显著升高(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠CAMKⅡ、NMDAR1 表达明显升高(P<0.05),GluR2 表达降低(P>0.05)。结果见图8。
2.4.3 WB 检测海马中凋亡因子Bad、Bcl-2 和Caspase3 的表达结果 与空白组相比,OVX+CUMS组 小 鼠Bad、Caspase3 表 达 显 著 升 高(P<0.01),Bcl-2 表 达 极 显 著 降 低(P<0.001);与OVX+CUMS 组 相 比,SHAM 组、E2组 和 柚 皮 苷 组 小 鼠Bad 和Caspase3 表达显著降低(P<0.01),Bcl-2 表达显著升高(P<0.01);与柚皮苷组相比,柚皮苷+ICI182780 组小鼠Bad、Caspase3 表达升高(P<0.01,P<0.05),Bcl-2 表达明显降低(P<0.05)。结果见图9。

图9 各组小鼠海马中凋亡因子Bad、Bcl-2 和Caspase3 的表达结果(n=3,)Fig 9 Results of expression of apoptotic factors Bad,Bcl-2 and Caspase3 in the hippocampus of mice in each group(n=3,)
3 讨论
采用OVX 联合CUMS 的抑郁症模型,能合理地模拟雌激素撤退和遭受压力性刺激的双重致病因素[13]。OVX+CUMS 模型可以诱导出抑郁样行为以及典型的海马神经元过度凋亡,在更年期抑郁症的机制研究中是较为理想的模型[14,15]。本实验结果表明,模型小鼠悬尾不动时间与游泳静止时间均显著增加,小鼠产生绝望行为,说明OVX+CUMS方法复制的更年期抑郁症模型小鼠表现人类抑郁的核心症状,出现了意志力减弱或情绪低落[1,9]。经E2或柚皮苷给药干预后,小鼠静止时间均有不同程度的减短,说明柚皮苷能够减轻小鼠绝望行为。在ER 阻断剂的作用下,柚皮苷对模型小鼠行为的恢复作用被逆转,说明ER 可能是介导柚皮苷发挥作用的重要靶点。
谷氨酸受体分为离子型受体(NMDAR)和代谢型 受 体(mGLuRs)[16]。研 究 表 明,抑 郁 状 态 下,NMDA 受体主要调控钙调蛋白/钙调蛋白依赖的蛋白激酶(CaM/CaMKⅡ)通路,GluR2 亚基的高表达会促进Ca2+内流,大量内流的Ca2+会在线粒体内快速沉积,造成线粒体功能丧失,进一步增加一氧化氮合酶的活性,从而增加NO 的合成[17-19]。因此,当神经元含有大量的离子型NMDA 受体时,细胞内Ca2+超载,会导致大量神经元因兴奋性毒性而过度凋亡[20]。海马神经元细胞突触结构、数量和功能的缺失正是造成抑郁样行为的重要原因。本研究发现,模型小鼠海马神经元细胞会出现胞体减小、核固缩等变化,柚皮苷给药可改善海马区病理变化,且能够上调GluR2 蛋白表达,抑制海马区NMDA 受体蛋白表达,下调CAMKⅡ表达,从而减轻细胞因兴奋毒而死亡。在ER 阻断剂干预下,也反向验证了柚皮苷抑制谷氨酸受体调节的钙超载作用依赖于ER 受体。
本文通过对海马区ERα 和ERβ 蛋白表达进行半定量,结果发现柚皮苷上调了模型小鼠海马ERβ蛋白的表达,但对ERα 无明显影响,与文献结论一致[21],提示柚皮苷主要激活海马区ERβ,而非ERα(主要调节外周激素分泌水平)。张阳等[22]证实了ERβ 对海马神经元细胞有保护作用。ERβ 激活下游信号,主要通过调节核移位发挥基因组效应,促进 抗 凋 亡 因 子Bcl-2 的 合 成[7]。Bcl-2 家 族 和Caspase3 家族不断激活可发挥抗细胞凋亡作用[6],但是动物在遭受反复刺激后,往往出现Bcl-2/Bad 比值极显著降低,预示着大脑相应区域的细胞过度凋亡。柚皮苷具有抗细胞凋亡作用,但在ICI182780作用下其抗凋亡作用明显降低,说明柚皮苷可能通过激活海马区ERβ 减少神经元细胞过度凋亡。
4 结论
柚皮苷可能通过激活更年期抑郁症模型小鼠海马区ERβ,抑制谷氨酸受体激活引起的神经元兴奋毒,减少海马神经元细胞凋亡,改善绝望行为。
作者贡献度说明:
苏婷、于浩、崔悦、赵德萍:建立模型、指标检测、数据整理与分析、撰写论文;王丽红、张宁、徐红丹:指导实验、修改论文;雷霞:基金支持、论文审阅。
所有作者不存在利益冲突关系。
