骨肉瘤铜死亡相关LncRNA 预后模型构建与验证
2023-09-09范以东苏国威肖世富刘俊良李威材吴广涛
范以东,秦 刚,苏国威,肖世富,刘俊良,李威材,吴广涛
(1.广西中医药大学,广西 南宁 530022;2.广西中医药大学第一附属医院,广西 南宁530022)
骨肉瘤(osteosarcoma,OS)是起源于原始间充质细胞的最常见的原发性骨肿瘤[1]。在儿童和青少年中最常见,是继软骨肉瘤和脊索瘤之后的成人第3 大常见骨癌。全球总发病率为每年3.4/100 万[2]。当前,OS 患者的治疗通常包括手术联合新辅助化疗药物,且估计转移性OS 患者的5 年生存率不足20%[3]。在过去的20 年中,尽管有许多化疗方案,但生存率没有显著改善。对OS 预后生物标志物的预测,能够辅助判断患者接受治疗后可能发生的临床转归、提高OS 的治疗效果、降低治疗相关毒性并为将来的临床试验设计提供方案[4]。因此,确定OS的预后生物标志物至关重要。
铜是所有生物体内不可缺少一种微量元素,主要参与真核生物的能量代谢、活性氧积累、铁摄取和信号传导,细胞中铜对细胞增殖、分化或细胞死亡有直接影响[5]。当细胞内铜离子浓度超过了维持稳态的阈值时,将导致细胞毒性的出现。涉及的机制包括活性氧的积累、抗血管生成和蛋白酶体抑制等[6]。最近的研究表明,铜参与调节细胞死亡的模式与已知的死亡机制(如:铁死亡、细胞凋亡、坏死性凋亡、自噬)不同,且与线粒体呼吸关系更为密切[7]。铜离子直接结合三羧酸循环(TCA)中的脂酰化成分,导致这些蛋白聚集、失调,随后铁-硫簇蛋白丢失,进而引发蛋白质毒性应激,并最终致使细胞 死 亡,Tsvetkov 等[8]将 这 一 过 程 命 名 为 铜 死 亡(cuproptosis)。
长链非编码RNA(lncRNA)是长度超过200 个核苷酸的转录本,参与许多生物过程,包括细胞分化、发育和凋亡[9]。重要的是,lncRNA 已被证明是基因表达的重要调节因子,它们可以在包括癌症在内的各种生物学功能和疾病过程中发挥关键作用[10]。研究发现lncRNA 与多种癌症相关,包括乳腺癌[11]、结直肠癌[12]、肝癌[13]等。当前,铜死亡相关LncRNA 在OS 中的作用尚不清楚,因此,我们的研究旨在利用生物信息学探索铜死亡相关lncRNA 在OS 预后中的作用。
1 材料与方法
1.1 铜死亡相关lncRNA 的筛选
2022 年10 月19 日 从UCSC Xena 数 据 库(http://xena.ucsc.edu/)下载88 例骨肉瘤样本的基因表达谱与相应的临床数据(包括生存时间、生存状态、年龄、性别、是否转移)。2022 年10 月20 日从GTEx 数据库(https://www.gtexportal.org/home/)获得396 例正常样品的基因表达谱,对所有基因表达数据进行log2(x+1)转换。从已发表的文章中提取 了19 个 铜 死 亡 相 关 基 因[8,14]。R 软 件”sva“包Combat 函数对UCSC 和GTEx 的合并数据进行归一化处理。根据合并数据中基因的注释信息来区分mRNA 与LncRNA。为了筛选潜在与铜死亡相关的LncRNA,使用R 软件“limma”包以|R|>0.4 和P<0.05(R 为相关系数)作为筛选条件对19 个铜死亡基因与lncRNA 进行共表达分析。最后,对符合要求的lncRNA 按|log2FC|≥1,FDR<0.05 条件进行差异分析,得到差异的铜死亡相关lncRNA 进行后续分析。
1.2 铜死亡相关lncRNA 预后模型构建与验证
对85 例患者(其中2 名患者没有生存状态,1 名患者没有总生存时间,故未纳入研究)按1∶1 随机分成训练组与验证组。训练组用于构建预后模型,验证组和总样本组进行模型验证(表1)。单因素Cox回归筛选铜死亡相关差异lncRNA 中预后相关的lncRNA。然后,对训练组采用最小绝对收缩和选择算子(LASSO)Cox 回归和多元Cox 回归模型来创建预后模型。计算每个患者的风险值公式为:,其 中xi和Coefi代 表 每 个lncRNA 的表达量和风险系数。根据训练组中风险评分的中位数将OS 患者分成高、低风险两组。Kaplan-Meier(K-M)生存分析比较了两个不同风险组之间的总生存期。进一步绘制预测1 年、3 年、5 年总生存期及临床特征的受试者工作特征(ROC)曲线以评估模型的预测价值。验证组和总样本组中每个OS 患者的风险评分根据相同的公式计算。
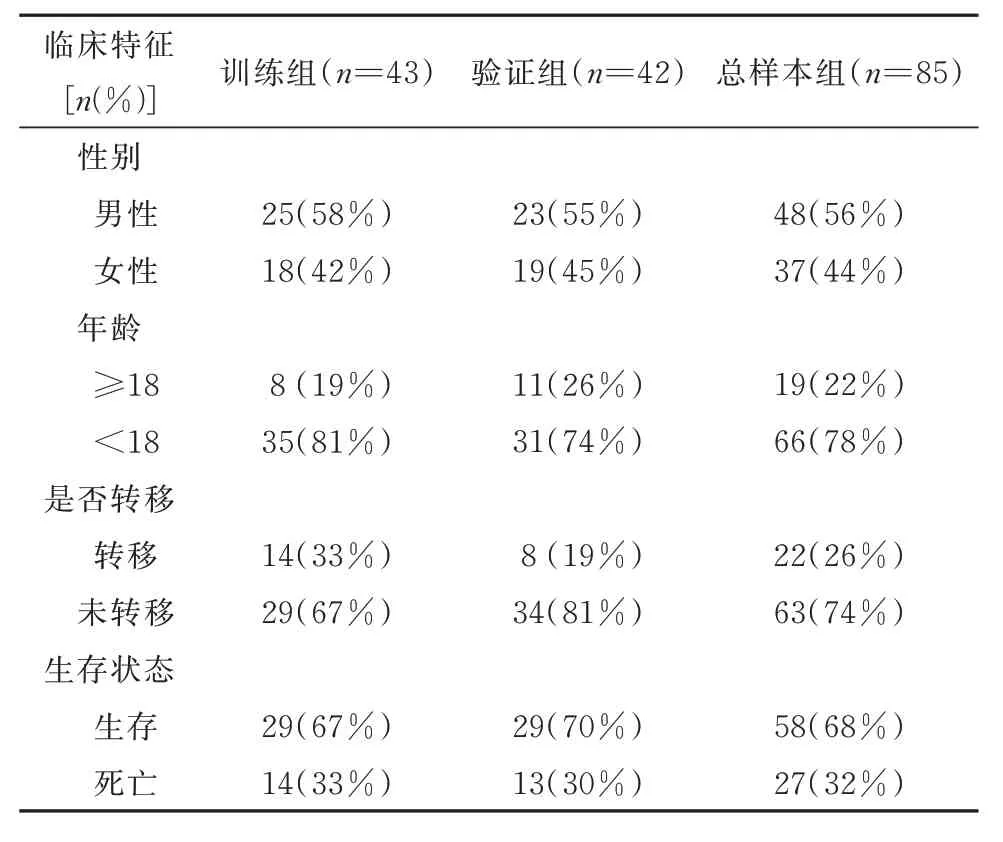
表1 分组的临床信息Tab 1 Grouped clinical information
1.3 独立预后分析
将风险打分与OS 患者的临床信息结合,包括年龄、性别、转移。采用单因素与多因素Cox 分析确定风险评分是否可以作为独立的预后因素。
1.4 列线图的构建
为了更好的使预后模型应用于临床,使用R 软件的“rms”与“survival”包构建预后列线图模型,以评估OS 患者的1 年、3 年和5 年的生存期。校准曲线可视化实际结果与列线图预测结果间的一致性。
1.5 不同风险组的免疫细胞和功能差异分析
采用R 软件“GSVA”包中的单样本基因集富集分析(ssGSEA)分析16 种免疫细胞浸润和13 种免疫功能在高、低风险组的差异。
1.6 统计学处理
本研究所有的统计分析与绘图均在R(64x 4.1.2)软件上进行。Pearson 相关分析得到基因共表达的相关性。采用Wilcox test 比较肿瘤组织与正常组织的差异基因表达。Mann-Whitney 检验来比较高、低风险组之间免疫细胞含量或功能的ssGSEA 评分。采用Kaplan-Meier 生存分析和对数秩检验来比较高低风险组之间的生存差异。单因素和多因素Cox 回归分析用于确定独立的预后因素。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 确定预后模型构建相关的铜死亡lncRNA
提取UCSC+GTEx 合并数据中19 个铜死亡基因与13 425 个lncRNA 的表达量进行共表达分析,共得到符合条件的181 个lncRNA(|R|>0.4 和P<0.05),其中PDHA1 未发现有相关lncRNA。进行差异分析,得到108 个差异铜死亡相关lncRNA(|log2FC|≥1,FDR<0.05),其中33 个下调,75 个上调。桑基图可视化铜死亡基因与其相关lncRNA 共表达关系(图1A)。共有85 位OS 患者被随机分为训练组(n=43)和验证组(n=42)。对于训练组,将筛选得到的108 个铜死亡相关lncRNA 进行单因素Cox 分析,确定了10 个预后相关的铜死亡lncRNA,其 中 有 5 个 高 风 险 lncRNA(AC124798.1、AC005277.2、LINC01549、LINC01060、AP00085 1.2)和5 个低风险lncRNA(PCOLCE-AS1、AC090 152.1、NKILA、AC090559.1、AL136162.1)(图1B)。随后,采用Lasso 回归与多因素Cox 回归分析最终确定了参与模型构建的最优的3 个lncRNA(AC124798.1、AC090152.1、AC090559.1)(图1C、D、E)。

图1 鉴定OS 中具有预后意义的铜死亡相关lncRNAFig 1 Identification of cuproptosis -associated lncRNAs with prognostic significance in OS
2.2 预后模型的构建与验证
采用筛选得到的3 个lncRNA 对训练组、验证组及总样本组中的每位患者计算风险评分,风险评分= AC124798.1×(1.14553168738236)+AC09015 2.1×(-1.13701301122647)+AC090559.1*(-1.8 3119937382105)。根据风险评分的中位值将训练组患者分为高、低风险组。生存分析显示低风险组的总生存期明显优于高风险组。风险热图显示从低风险组到高风险组AC124798.1 表达逐渐升高,AC090152.1 与AC090559.1 表达逐渐降低。生存状态图显示,低危组到高危组患者死亡数逐渐增加。不仅如此,我们还在验证组和总样本组进行了验证。结果显示,验证组与总样本组均具有与训练组相似的趋势(图2A-L)。ROC 曲线显示,1 年、3 年和5 年的AUC 值分别为0.799、0.786、0.827(图3A)。风险评分与转移的AUC 值分别为0.799 和0.905,高于年龄(0.461)与性别(0.467)(图3B)。总之,以上结果说明我们构建的预后模型具有较好的预后价值。
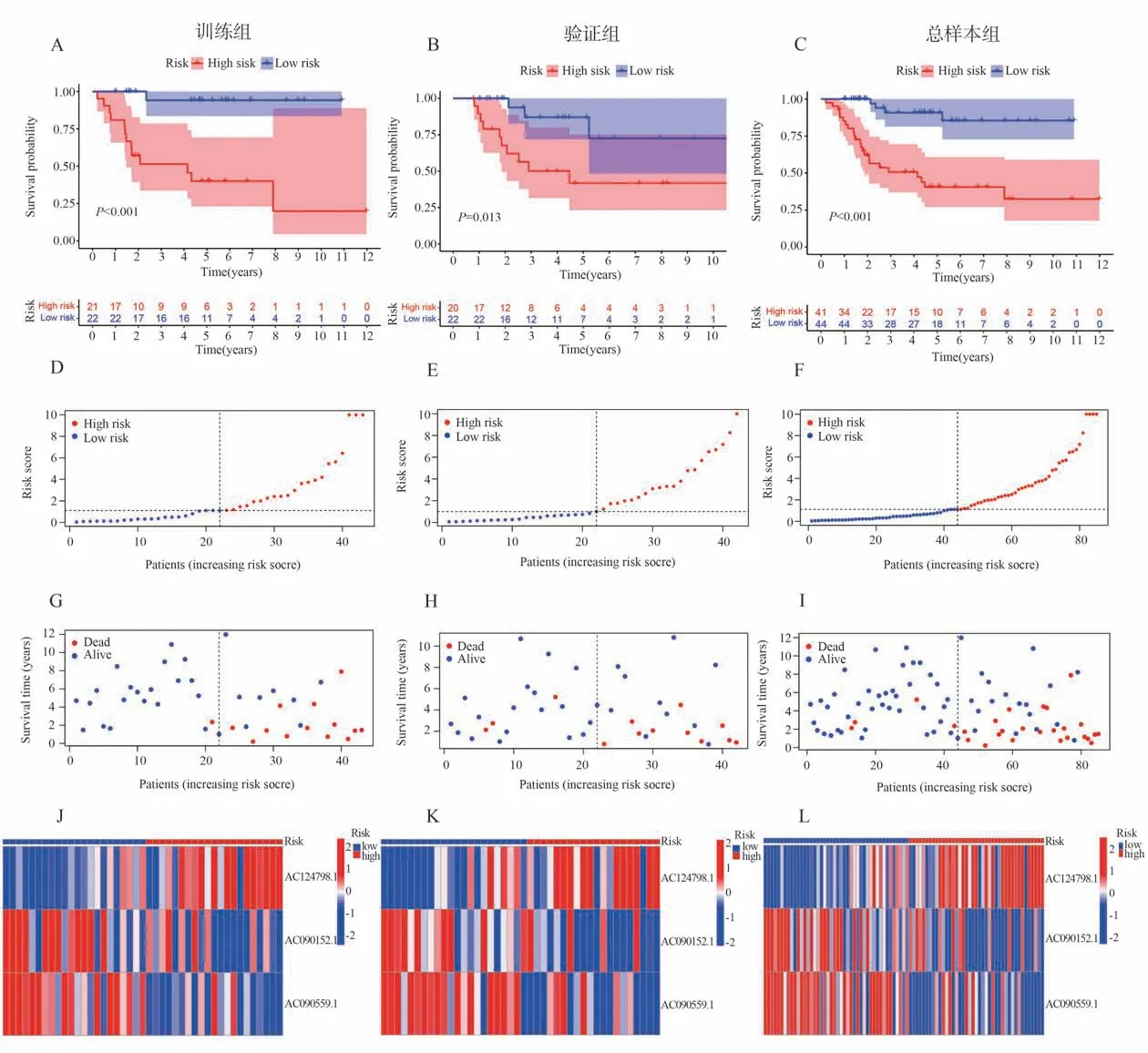
图2 不同分组中OS 患者铜死亡相关lncRNA 的预后价值Fig 2 Prognostic value of cuproptosis -related lncRNAs in different groups of patients with OS

图3 预后模型的临床相关ROC 曲线Fig 3 ROC curve of clinical relevance of prognostic model

图4 OS 患者临床性状与风险评分的独立预后分析Fig 4 Independent prognostic analysis of clinical traits and risk score in patients with OS
2.3 独立预后分析
采用单因素和多因素Cox 分析,以判断风险打分是否是可以独立于其他临床特征的预后因素。结果显示,在单因素和多因素Cox 分析中风险评分和转移可以作为独立的预后因素,且都为高危因素。
2.4 列线图模型的构建与验证
根据临床特征(包括风险评分、年龄、性别、转移),构建预测OS 患者1 年、3 年和5 年生存期的列线图模型(图5A)。校准曲线表明,列线图预测的总生存期与实际的总生存期具有较好的一致性(图5B)。我们还将列线图加入进来,绘制了预测5 年生存期的ROC 曲线,结果显示,列线图的AUC 值(AUC=0.852)最高,具有一定的临床应用价值(图5C)。
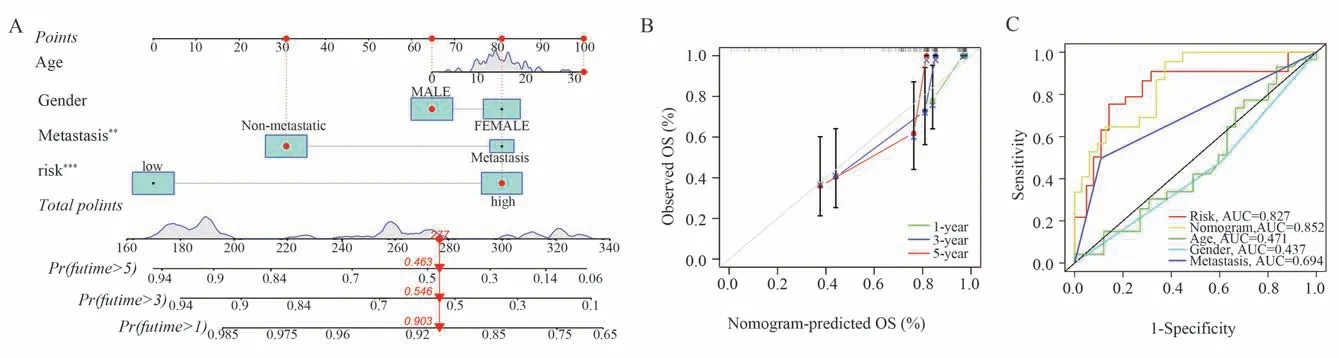
图5 列线图的构建与验证Fig 5 Construction and validation of nomograms
2.5 高、低风险组ssGSEA 结果
通过ssGSEA 研究了不同风险组与浸润肿瘤免疫细胞和免疫功能之间的关系。发现绝大多数免疫细胞和免疫功能在高低风险组之间有差异,且低风险组的免疫细胞和免疫功能打分均比高风险组的高。低风险组中免疫细胞(包括B cells、CD8+T cells、DCs、Macrophages、Neutrophils、NK cells、pDCs、T helper cells、Tfh、Th1 cells、Th2 cells、TIL、Treg)(图6A)及免疫功能(包括APC co inhibition、APC co stimulation、CCR、Check-point、Cytolytic activity、HLA、inflammation-promoting、MHC class I、Parainflammation、T Cell co-inhibition、T Cell costimulation、Type_I_IFN_Reponse)(图6B)显 著 上调(P<0.05)。说明铜死亡与肿瘤免疫关系密切,高风险组中免疫细胞及功能可能受到抑制。

图6 高低风险组中免疫细胞与免疫功能的差异分析Fig 6 Analysis of differences between immune cells and immune function in high and low risk groups
3 讨论
铜死亡是新发现的一种铜依赖性调节细胞死亡形式。细胞内铜稳态的失衡可以影响癌细胞的生长及增殖的速度[15]。以往的研究表明,细胞的程序性细胞死亡与肿瘤密切相关,如细胞凋亡、自噬、坏死性凋亡等[16]。所以,对铜死亡的深入研究可能会为癌症的治疗带来新的解决方案。
LncRNA 一类是非蛋白质编码RNA 分子,能够在各种水平上调节基因表达,包括组蛋白修饰,转录和转录后调节[17]。据估计,人类中有超过60 000个lncRNA,并且lncRNA 的数量仍在快速增长[18]。到目前为止,只有极少数lncRNA 的功能被注释[19]。失调的lncRNA 广泛参与肿瘤的发病机制,包括细胞增殖、迁移、侵袭、细胞凋亡和抗肿瘤耐药性[20]。不仅如此,一部分LncRNA 还被确定为肿瘤诊断和预 后 的 生 物 标 志 物。Deng 等[21]证 实LncRNA RBM5-AS1 在OS 组织和细胞系中显着增加,此外,在体外实验中敲低RBM5-AS1 显著抑制OS 细胞的增 殖,迁 移 和 侵 袭。Huang 等[22]发 现LncRNA BE503655 在人OS 组织和OS 细胞系中过表达,敲低lncRNA BE503655 可以抑制OS 细胞增殖和侵袭,且其发挥功能依赖于OS 细胞中Wnt/β-catenin信号通路传导的调节。LncRNA CBR3-AS1 被发现在调节OS 细胞增殖、迁移、侵袭方面具有致癌作用,并且还是OS 患者的独立不良预后因素[23]。以上研究说明在OS 中,LncRNA 不仅可以充当OS 的生物标志物,且与其预后密切相关。
本研究通过Pearson 相关系数与差异分析共得到108 个差异铜死亡相关lncRNA。随后对85 例骨肉瘤患者按1∶1 分为训练组和验证组,在训练组中使用单因素Cox、Lasso 回归及多因素Cox 构建了包含3 个LncRNA 的预后模型,并在验证组和总样本组中得到了验证。利用生存分析、ROC、独立预后分析、校准曲线验证评估了此模型的预测性能。
预后模型是由3 个LncRNA 构成,包括AC124798.1、AC090152.1、AC090559.1。其 中,AC124798.1 是骨肉瘤预后不良的危险因素,AC090152.1 和AC090559.1 则是保护因素。本研究发现这3 个LncRNA 与多种肿瘤预后相关,在一定程度上反映了本研究结果的可靠性。AC124798.1与乳腺癌和胰腺癌患者的生存相关,是两者重要的预后保护因素[24][25]。AC090152.1 被认为是肝癌预后 生 物 标 志 物[26]。Wang 等[27]发 现AC090152.1 不仅是肾细胞癌的预后不良因素,而且与T 细胞等免疫细胞群之间存在正相关关系,与中性粒细胞和内皮细胞呈负相关。AC090559.1 与铁死亡、自噬、坏死性凋亡、焦亡密切相关,可以用作肺腺癌与骨肉瘤预后的生物标志物[28-31]。目前这些LncRNA 在OS 中的相关研究甚少,与OS 的关系仍不清楚。
肿瘤微环境中浸润的免疫细胞和免疫功能在肿瘤发生和肿瘤进展中起着至关重要的作用[32]。我们对不同风险组进行了16 种免疫细胞浸润和13种免疫功能的差异分析,结果显示有13 种免疫细胞和12 种免疫功能在高风险组都受到抑制。OS 的免疫微环境主要是由T 淋巴细胞和巨噬细胞组成,此外还有B 淋巴细 胞和肥大细胞[33]。CD8+T 细胞被认为是抗肿瘤免疫的主要驱动因素之一[34],可以直接裂解和清除癌细胞[35]。有研究表明,在三阴性乳腺癌中,CD8+T 细胞的高水平与患者的预后良好有关[36]。Tfh(滤泡辅助性T 细胞)与抗肿瘤免疫也密切相关,乳腺癌患者中Tfh 细胞浸润较高的患者生存率也较高[37]。深入研究肿瘤微环境中的各种免疫细胞及功能的内在机制,并从中寻找有利于提高免疫系统抗肿瘤能力的研究具有十分重要的意义。
这项研究也存在着许多不足,首先,尽管构建的预后模型在内部数据中得到了证实,但是,还是需要更多的临床数据进行进一步验证。其次,本研究的预后模型是通过公共数据库建立和验证的,除了本研究的数据分析外,仍要进行实验验证。
作者贡献度说明:
秦刚:文章构思;范以东:数据分析、研究设计及手稿撰写;苏国威、肖世富:文章芯片筛选;刘俊良、李威材和吴广涛:负责数据整理及文献查阅。
所有作者声明不存在利益冲突关系。
