基于谷氨酰胺代谢相关基因构建肝细胞癌预后模型及治疗方案分析
2023-09-09王豪杰任铭心刘高峰刘长青
梁 宇,陈 颖,王豪杰,任铭心,刘高峰,刘长青
(1.蚌埠医学院临床医学院,安徽 蚌埠 233000;2.蚌埠医学院生命科学学院,安徽 蚌埠 233000)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,其发病率呈不断上升趋势,根据世界卫生组织国际癌症研究机构发布的2020 年最新癌症负担数据。HCC 是世界范围内第六大癌症,且死亡率居世界第三[1]。HCC 具有起病隐匿、恶性度高、进展快、预后差和死亡率高等特点。使得HCC 患者的5 年生存率仅为10.1%,但患者若早期及时发现且经手术治疗,5 年生存率可提高至50%左右[2]。然而,绝大多数HCC 患者就诊时已处于晚期,此时手术治疗的效果不好[3]。因此,探索新的预后预测和个体化治疗的潜在标志物具有重要的临床意义。
谷氨酰胺在细胞存活和生长中具有关键作用。谷氨酰胺可通过不同酶和基因通过不同细胞信号通路的多种作用机制来合成细胞生长所需的核酸、脂质和蛋白质[4]。谷氨酰胺不是必需氨基酸,但却被认为是条件必需氨基酸,尤其是在分解代谢应激条件下,如手术后和创伤等,胃肠道、肾脏和免疫系统等对谷氨酰胺的需求急剧增加[4]。此外,谷氨酰胺与肿瘤恶性进展亦密切相关[5]。由于肿瘤细胞快速增殖,谷氨酰胺作为肿瘤细胞供能的养料,以及合成核苷酸、蛋白质和GSH 合成等重要前体,致使谷氨酰胺的合成不能满足肿瘤增殖的需求,此时谷氨酰胺转变为条件性必需氨基酸[6]。有研究表明,肿瘤细胞通过谷氨酰胺转运蛋白摄取利用谷氨酰胺,为肿瘤细胞提供能量和生物合成,从而促进肿瘤的恶性进展[7]。近期研究表面,谷氨酰胺代谢广泛参与肝癌的增殖和侵袭转移等环节,表明谷氨酰胺代谢是肝癌的潜在预后和治疗靶标。
免疫疗法与手术、化疗和放疗一起成为癌症治疗的新的可选方案[8]。谷氨酰胺代谢通过影响肿瘤微环境(TME),来调控肿瘤的发生发展[9]。在三阴性乳腺癌中,肿瘤细胞会竞争性地捕食TME 中的谷氨酰胺,导致谷氨酰胺对肿瘤浸润性T 淋巴细胞的可用性有限,从而影响其抗肿瘤免疫反应[10]。在谷氨酰胺成瘾的透明细胞肾细胞癌中,肿瘤细胞对谷氨酰胺的竞争性消耗导致细胞外谷氨酰胺的局部剥夺,导致Treg 细胞的增殖和活化,从而抑制Teff 细胞的抗肿瘤活性[11]。因此,免疫细胞和癌细胞中的谷氨酰胺代谢基因组特征是免疫疗法和临床结果有希望的预测指标。
本研究系统分析了GMRGs 的表达及其对HCC 患者临床特征、预后和治疗反应的影响。对TCGA 数据库进行差异分析,筛选出23 个差异表达的GMRGs 基因,并表明其具有较强的相关性。然后通过单因素cox 筛选出与患者生存状态相关的14个基因。进而通过lasso 回归和step 多因素cox 筛选出4 个基因构建评分模型,准确预测HCC 患者的临床结果和免疫和药物治疗效果。本研究以期开发可行的HCC 免疫和药物治疗方法提供参考。
1 资料与方法
1.1 数据选择和获取
从TCGA-LIHC 数 据 库(https://portal.gdc.cancer.gov/)中检索HCC 的RNA 表达数据、体细胞突变数据、CNV 文件和相应的临床病理信息,并利用GEO 数 据 库 (https://www.ncbi.nlm.nih.gov/geo/)获取GSE14520 临床参数和标准化基因表达数据[12]。从MSigDB 数据库(Hallmark 基因集)获得了6 个谷氨酰胺代谢相关的基因集,去除重复后共80 个GMRGs。
1.2 基于GMRG 的预后特征的开发和验证
在单变量Cox 回归分析中发现的与HCC 相关的14 个GMRGs,随后使用R 包“glmnet”进行最小绝对收缩和选择运算符(LASSO)回归分析。为了防止模型的过拟合效应,通过十倍交叉验证确定了惩罚参数λ,最终筛出7 个基因进行下一步使用“rms”包的Step 多因素cox。最后选择4 个GMRGs基于相应系数和基因表达量构建风险评分模型。每位患者的GMRGs 特征风险评分计算如下:
Coef(i)和 X(i)表示 GMRGs 相关的回归系数和基因表达值。采用R 编程语言的套索回归算法计算风险评分。通过多个基因的线性组合计算的回归系数按中位风险评分将受试者分为高风险和低风险两组。使用“time-ROC”(0.4 版)R 包进行1年、3 年和5 年的ROC 曲线分析。
1.3 列线图的构建
列线图旨在为肝癌患者提供有价值的临床预测,包括其风险评分和其他临床病理学特征,特别是关于1 年、3 年和5 年的OS。使用“rms”和“regplot”R 包开发了GMRGs 相关的临床病理学列线图。然后进行了校准曲线分析和决策曲线分析(DCA),以验证已建立的列线图的临床可靠性。
1.4 免疫治疗分析
肿瘤免疫功能障碍和排斥(TIDE)算法用于推断患者对免疫治疗的临床反应[13]。IMvigor210 队列联合抗PD-L1 治疗在GMRGs 评分模型与免疫治疗反应的相关性研究中进行了分析[14]。Mvigor210队列的完整数据集,包括基因表达数据和临床信息,均 来 自http://research-pub.gene.com/IMvigor210CoreBiologies。
1.5 药物治疗分析
使用癌症药物敏感性基因组学(GDSC)数据集(https://www.cancerrxgene.org/)来评估每个样本的化疗反应。根据GDSC 数据,采用半最大抑制浓度(IC50)来估计药物反应。预测程序由R 语言中的 "pRRophetic "包承担[15]。
1.6 统计学处理
与预后相关的临床病理学因素由单因素cox 和Step Cox 分析确定。分类数P<0.05 为差异具有统计学意义。所有统计分析均由R(版本4.2.1)执行。
2 结果
2.1 HCC 中GMRG 的基因突变和互作关系
首先使用TCGA-LIHC 数据集鉴定了肿瘤标本和正常标本中80 个GMRGs 的表达水平。共发现23 个差异基因(DEGs)(均|logFC|>1,adjustedPvalue<0.05),大部分DEGs 在肿瘤样本中含量丰富。除了AADAT、GLYATL1、ASS1 和UROC1表达低于正常组织外,其余基因在HCC 中的表达均高于正常组织 (图1A)。同样,基于TCGA-LIHC中mRNA 表达水平构建的相关网络在这些DEGs之间可以观察到很强的正相关(图1B)。通过String网站建立蛋白质-蛋白质相互作用(PPI)分析,揭示DEGs 具有很强的交互性(图1C)。下一步确定了HCC 中23 个GMRGs 的拷贝数变异(CNV)和体细胞突变的发生率。371 个HCC 样本中有40 个(10.78%)出现了基因突变,SLC25A12 基因突变率最高为2%,其余9 个基因的突变率均为1%(图1D)。图1E 显示染色体上23 个GMRGs 的CNV 改变位点。上述分析表明,GMRGs 在HCC 中的遗传和表达变化具有高度异质性,揭示了GMRGs 表达的不平衡在HCC 的发生发展中起着关键作用。
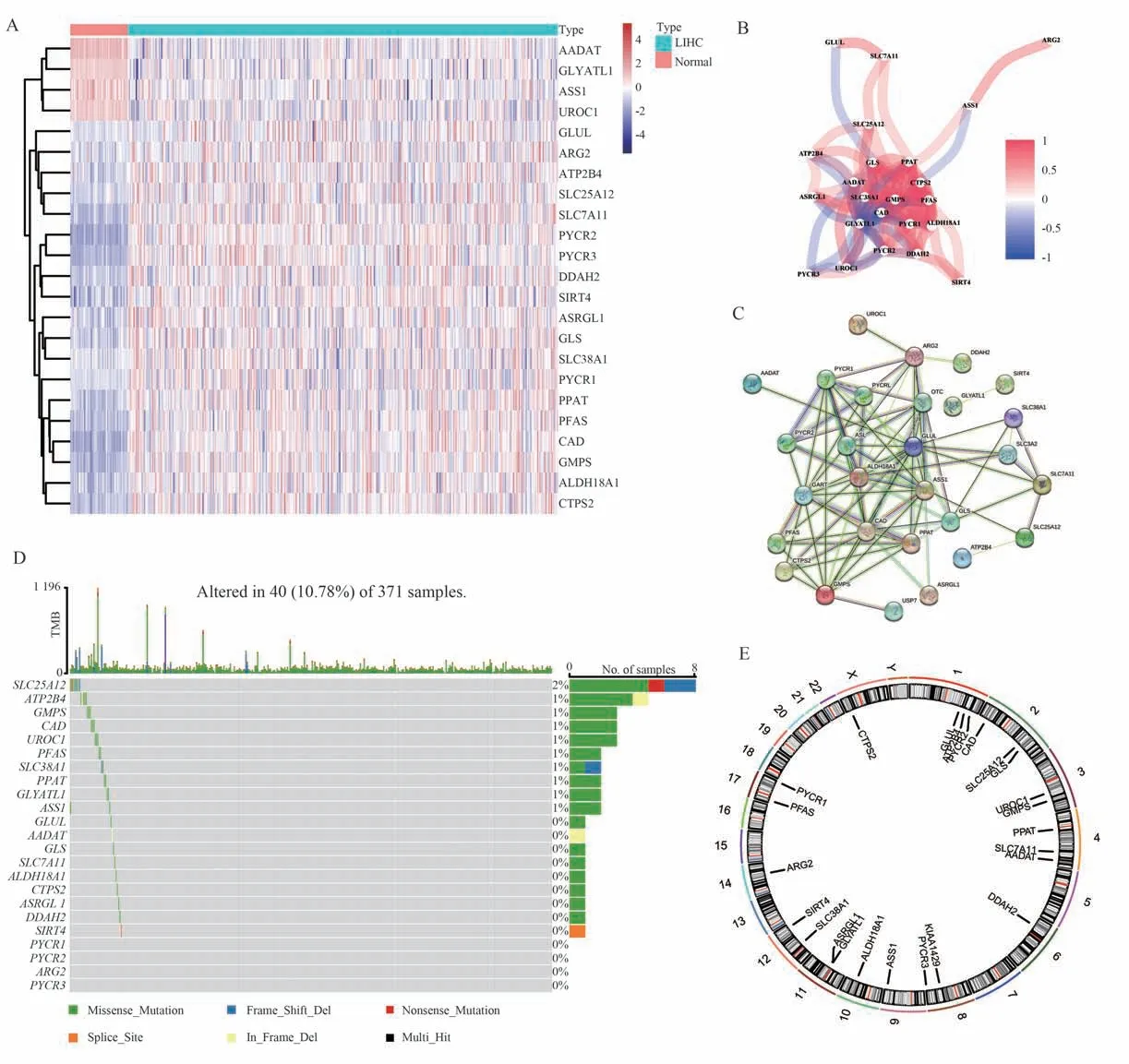
图1 HCC 中GMRGs 的基因突变和互作情况Fig 1 Mutations and interactions of GMRGs in HCC
2.2 基于GMRGs 构建HCC 的预后风险模型
基于GMRGs 构建了风险预后模型。单因素COX 分析发 现,在23 个DEGs 中,只有14 个预后相关基因与患者的OS 相关(P<0.05)(图2A)。接下来,将14 个GMRGs 纳入下面的lasso 回归分析。图2B-C 进行了lasso 回归和lasso 回归的十倍交叉验证,结果保留了7 个基因进行下一步step cox 回归分析,最终结果保留4 个基因用于最终的预后模型的构建。风险评分计算如下:风险评分=(0.3530 *CAD 表达)+(0.5985 * PPAT 表达)+(0.1797 *PYCR3 表达)+(0.2609 * SLC7A11 表达)。

图2 风险模型的构建Fig 2 Construction of the risk model
2.3 风险预后模型的分布特征
进一步分析了风险特征的整体分布情况。图3A、B 表明风险相关的4 个基因在训练集和验证集中具有一致的表达趋势,即都在高风险组中高表达。对两个样本患者的风险评分从低到高排序,结果显示在图3C、D。患者高低组评分和总生存时间的分布表现在图3E、F 图,结果表明高风险评分的患者生存时间更短。然后比较了不同临床信息(生存状态、肿瘤临床分期,肿瘤组织学分期)中风险评分,可以看出,死亡状态、3-4 期的分期都具有更高的风险评分,证明预后风险模型对临床信息也有一定的指导作用。

图3 TCGA 队列和GEO 队列中风险分数的生存分析Fig 3 Survival analysis of risk scores in the TCGA cohort and GEO cohort
2.4 构建预测HCC 患者预后的列线图
由于风险评分与患者预后之间的高度相关性,我们纳入了临床参数(年龄、性别和肿瘤临床分期)来建立列线图。列线图用于估计HCC 患者的1 年、3 年和5 年 OS(图4A)。该已建立的列线图的校准曲线在实际观测值和预测值之间表现出很高的准确性(图4C)。此外,估计了这些临床因素的AUC值,分别用于预测1 年,3 年和5 年的OS。如图D,AUC 值符合预期,这意味着该列线图对预后具有出色的预测能力。Kaplan-Meier 生存分析显示,高危组患者的总生存期显着缩短(图4B)。同时,在GEO 队列中的分析结果与TCGA 队列一致,表面构建的列线图具有较高的准确性。(图4E-G)。

图4 列线图的构建和验证Fig 4 Construction and validation of column line diagrams
2.5 免疫治疗效果分析
低风险组具有较高的TIDE 评分,证明其对免疫治疗更不敏感(图5A)。Dysfunction 评分和Exclusion 评分可以用来解释这种现象。低风险组具有较高的Dysfunction 评分(图5B),证明其免疫细胞功能低下;高风险组Exclusion 评分更高(图5C),证明其免疫细胞遭到排斥。然后,为了进一步探索GMRGs 在预测免疫治疗反应方面的价值,我们IMvigor210 队列分析高危组和低危组接受抗PD-L1 免疫治疗效果的差异。免疫治疗完全缓解和部分缓解的患者比疾病稳定和疾病进展的患者风险评分更高(图5D),意味着高风险人群更可能获益于免疫治疗。E 图说明了再高风险组患者中,完全缓解和部分缓解的患者占比更高,卡方检验表明这种差异具有显著性(P=0.01)。然后比较了高低风险组中肿瘤突变负荷的差异,结果不具有显著性,表明基于GMRGs 的风险模型中TMB 预测免疫治疗不合适。最后比较了免疫检查点分子在高低风险组中的表达差异(图5G),可见大部分免疫检查点分子都在高风险组高表达,表明高风险组更可能获益于免疫检查点抑制剂。
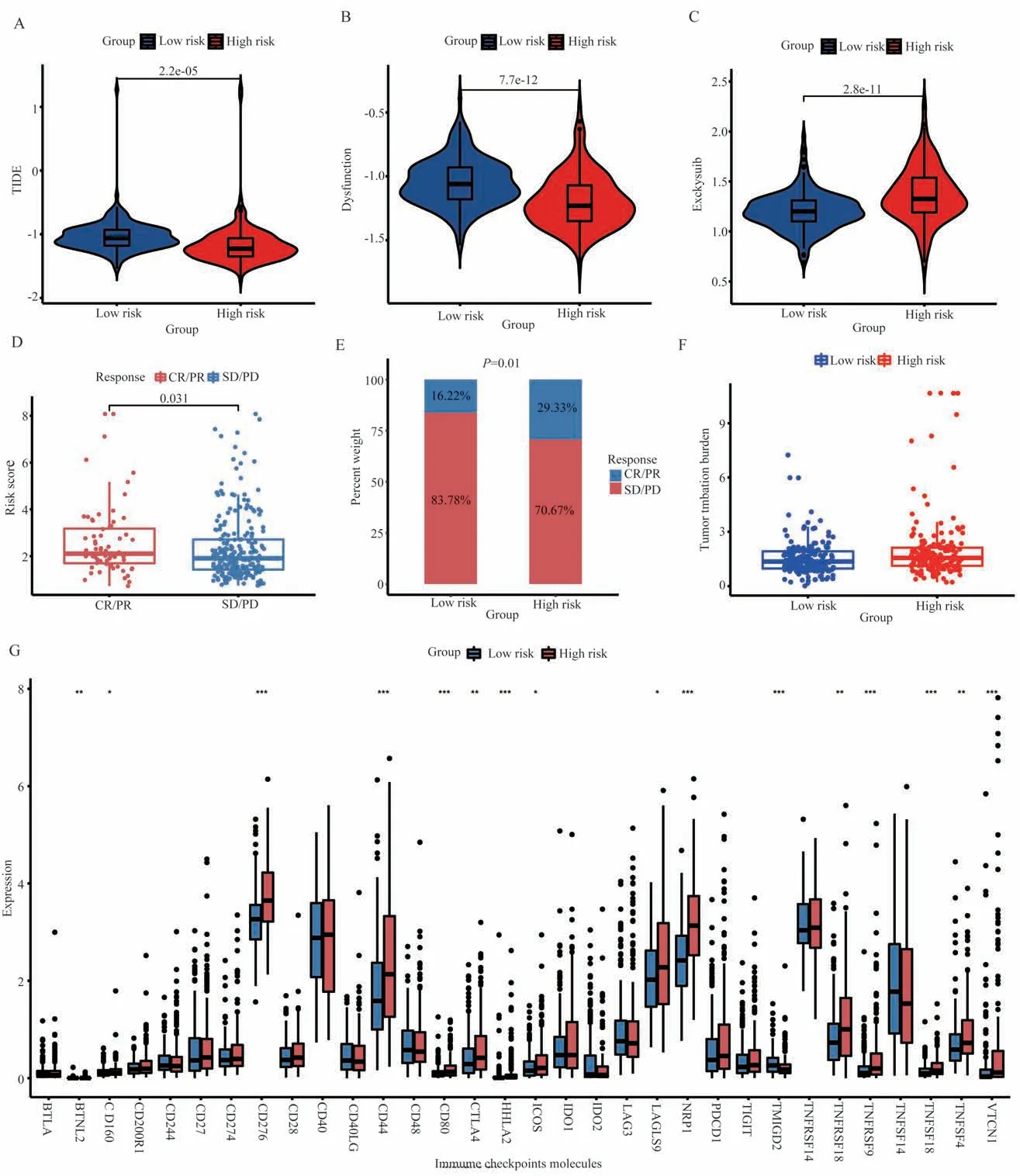
图5 GMRGs 风险评分模型的免疫治疗效果和免疫检查点差异Fig 5 Immunotherapy effects and immune checkpoint differences in the GMRGs risk score model
2.6 药物敏感度分析
使用pRRophetic 算法探讨了HCC 患者基于GMRGs 的风险评分与他们对6 种常见抗癌药物(顺铂、甲胺喋呤、多柔比星、拉帕替尼、尼罗替尼、帕唑帕尼、雷帕霉素、索拉非尼和替吡法尼)的反应之间的关联(图6)。可以看出,除了高风险组拉帕替尼治疗效果比较好外,低风险组的化疗药和靶向药治疗情况都要优于高危组。
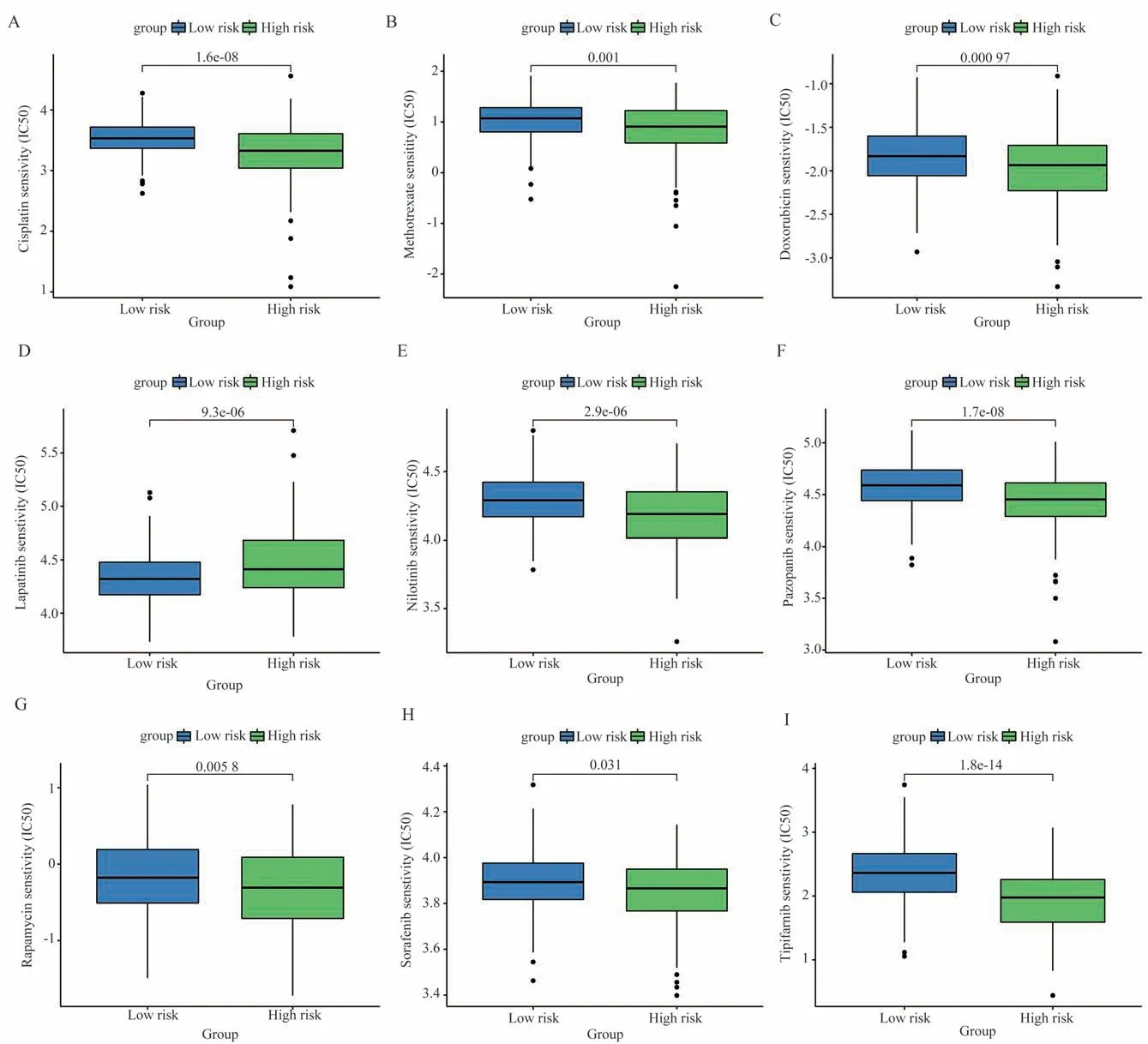
图6 通过GMRGs 风险模型评估治疗反应Fig 6 Assessing treatment response through the GMRGs risk model
3 讨论
谷氨酰胺是肿瘤增殖侵袭的重要支撑原料。早有研究表明,肝癌细胞在缺乏谷氨酰胺的培养基中不能生长,培养基中加入谷氨酰胺越多,细胞增殖越快,侵袭迁移能力越强[16]。肿瘤细胞可以通过特异性转运蛋白(如溶质载体家族1 中性氨基酸转运体成员5,SLC1A5)将谷氨酰胺转运到细胞中,然后在谷氨酰胺酶的作用下转化为谷氨酸,再转化为α-酮戊二酸,进入三羧酸循环,参与肿瘤的发生、发展和迁移[17,18]。例如,肿瘤细胞中的谷氨酰胺代谢产物在进入三羧酸循环后为肿瘤进展提供能量[19]。谷氨酰胺分解作用产生合成大分子物质的原料,如肿瘤细胞所需的氨基酸、核苷酸、脂肪酸和己糖胺[20]。
免疫细胞想要增殖并发挥功能,谷氨酰胺必不可少[21]。如T 细胞在激活状态下需要增加谷氨酰胺的摄入,从而快速增殖,同时促进细胞因子的分泌[22];谷氨酰胺也可以B 细胞的增殖和存活[23],并且还促进B 细胞分化为浆细胞和淋巴细胞[24]。中性粒细胞相对于其他白细胞(如巨噬细胞和淋巴细胞)消耗谷氨酰胺的速率最高[25,26]。并且谷氨酰胺通过产生ATP 增强中性粒细胞中超氧化物的产生,并调节NADPH 氧化酶复合物成分的表达[27]。
然而TME 中肿瘤细胞和免疫细胞对谷氨酰胺的竞争摄取导致谷氨酰胺缺乏,而且肿瘤细胞对谷氨酰胺的消耗最高,从而影响免疫细胞的功能[9]。选择性地阻断肿瘤细胞中的谷氨酰胺代谢可以消除TME 中对谷氨酰胺的代谢竞争,同时释放谷氨酰胺供免疫细胞使用,从而增强抗肿瘤免疫反应[10,28]。因此谷氨酰胺代谢在肿瘤发生发展和免疫功能是否良好,起着重要的调节和预示功能,也是选用免疫治疗的一个可行指标。
在本研究中,首先根据TCGA-LIHC 队列确定了差异表达GMRGs 的转录改变和表达水平,并检测了这些GMRGs 的基因突变情况。尽管这些基因的突变强度较低,但其中大多数在HCC 患者中上调并与预后有关。然后进一步筛选了与HCC 生存有关的23 个GMRGs,最后通过lasso 回归和step cox分 析 保 留4 个 基 因(CAD、PPAT、PYCR3 和SLC7A11),建立了能够量化个体患者特征的评分机制。不仅有助于建立准确的预后模型,而且通过GMRGs 评分分析了免疫和药物治疗效果,能帮助临床医生有效地评估免疫和药物治疗作为治疗方案的合理性。
本文筛选出的4 个GMRGs 差异表达基因(CAD、PPAT、PYCR3 和SLC7A11)与肝癌的预后有关。CAD 是氨甲酰磷酸合成酶2,催化新生嘧啶合成[9]。肝癌中CAD 的酶活性比在正常肝组织中增加了1.3~5.9 倍,与肿瘤生长速率呈正相关[29]。另有研究表明,精氨酸琥珀酸合酶在癌症中的活性降低通过激活CAD 和促进嘧啶合成来支持增殖[30]。PPAT 是磷酰焦磷酸酰胺转移酶,催化辅酶A 的生物合成[31]。PPAT 在肺腺癌中的表达被证明增加,并且与患者的疾病预后有关[32]。PPAT 抑制表达影响了神经内分泌癌3 种细胞系的生长,与患者的预后不良有强相关性[33]。PYCR3 是吡咯啉-5-甲酸酯还原酶3,它是一种参与从鸟氨酸生物合成脯氨酸的细胞质酶,在结直肠癌中表达上调,是癌细胞存活和增殖所必须的[34]。溶质载体家族7 成员11(SLC7A11)是一种氨基酸转运蛋白,经常在人恶性肿瘤中过度表达[35]。SLC7A11 的表达和活性通过多种机制受到肿瘤细胞中癌基因和肿瘤抑制因子的精细调控,对胱氨酸和谷氨酸具有高度特异性[36]。在胰腺导管腺癌中,敲低SLC7A11 会抑制肿瘤生长和转移扩散[37]。上述4 个基因高表达均会提高肿瘤的增殖速率,与肝癌高危组中风险四基因高表达相关,提示患者的不良预后。
然后根据筛选出的4 个GMRGs 构建肝癌风险评分模型,并将患者群体分成高危和低危两个亚群。KM 曲线表明两组具有显著的生存差异,并通过ROC 曲线验证其对1 年、3 年和5 年OS 的预测稳健性。因此GMRGs 评分模型对患者的预后具有可靠的预测能力。最后发现,与风险评分相关的4 个基因在高风险组中均高表达,与高风险组的预后较差有关。同时比较了不同临床信息的风险评分,结果表明生存状态、临床分期和组织学分级都具有更高的风险评分,说明构建的风险预后模型其对临床信息仍有一定的指导作用。通过TIDE 算法和IMvigor210 队列评估了高低危险组的免疫治疗情况差异。发现低风险组的免疫治疗没有高风险组效果好,低风险组的免疫细胞功能低下,高风险组的免疫细胞遭到排斥。笔者猜测功能低下的免疫细胞常常很难逆转为功能正常,所以免疫治疗效果常不好,免疫排斥的肿瘤只要解除了排斥状态,细胞功能正常即可发挥免疫作用,所以常对免疫治疗效果更好,这需要后续进一步的实验验证。IMvigor210队列分析同样表明高危组的免疫治疗效果要好于低危组。同时,对两组的免疫检查点表达情况做了比较,发现高危组表达大部分的免疫检查点分子,表明高风险组更能获益于免疫检查点抑制剂。最后,比较了高低危两组的抗癌药物治疗情况,结果表明低危组可能更适宜药物治疗。因此,高危组更适合免疫疗法,而低危组更适合药物治疗。
总之,研究表明了谷氨酰胺代谢对HCC 的影响和GMRGs 相关疗法的新见解,但还有很多局限性。这些数据是从公共数据库获得的回顾性数据,开展前瞻性研究和完整的体内体外实验以验证和优化GMRGs 相关的风险评分模型非常重要。研究结果为HCC 患者选择合适的治疗方法和预后预测提供新的思路和方向。
作者贡献度说明:
梁宇:文章设计、数据分析及手稿撰写;陈颖、王豪杰和任铭心:相关文献搜集与整理,数据分析;刘长青、刘高峰:提供整体思路和修改意见。
所有作者声明不存在利益冲突关系。
