甘草次酸对咳嗽变异性哮喘小鼠Th1/Th2 平衡影响的研究
2023-09-09陈秋玲李燕玲吴燕春
陈秋玲,周 蓓,李燕玲,林 惠,吴燕春,刘 含
(广西中医药大学,广西 南宁 530000)
咳嗽变异性哮喘(cough variant asthma,CVA)是一种特殊类型哮喘,无喘息、气急及哮鸣音等典型哮喘的症状和体征[1],通常以刺激性干咳作为唯一或主要临床表现,是中国儿童慢性咳嗽的最常见病因之一[2]。本病迁延难愈、容易复发,患儿发展成典型哮喘的概率高[3]。目前CVA 发病机理尚不明确,大部分学者认为CVA 存在气道平滑肌的异常收缩、支气管痉挛和黏液腺体分泌亢进,其病理改变以气道高反应性、持续的气道炎症反应以及气道重塑为特点[4],涉及多种炎症细胞、炎症介质和细胞因子共同参与和相互作用,主要以T 辅助细胞2(Th2)效应细胞活化、免疫球蛋白E(IgE)的生成和嗜酸性粒细胞(Eos)增多为特征[5,6]。治疗上国内外现有诊疗指南强调确诊后即按经典哮喘长期规范治疗[7,8]。临床治疗主要以糖皮质激素联合β2受体激动剂为主,可达到预期治疗效果,但长期使用也存在副作用和局限性。
甘草(glycyrrhiza uralensis)是世界上最古老和最常用的药物之一,在中外古籍中均有记载[9]。在中国,甘草作为药物最早收录于汉《神农本草经》,被列为上品,有“国老”的美誉,具有补脾益气、清热解毒、祛痰止咳、缓急止痛及调和诸药等广泛且良好的药效作用,因此在神经、消化、呼吸、心血管等系统疾病中均有应用。在CVA 的中医治疗方面,有研究显示甘草是处方中词频最高的药物[10],有其不可或缺的药理作用。
甘草次酸(glycyrrhetinic acid,Cas 号471-53-4,分子式C30H46O4,图1),是甘草的主要活性成分,已被证明具有减轻气道炎症、改善气道重塑、镇咳等作用[11-13]。本研究通过建立咳嗽变异性哮喘小鼠模型,通过给药后观察甘草次酸对Th1/Th2 平衡的影响,为其临床治疗咳嗽变异性哮喘提供实验依据。
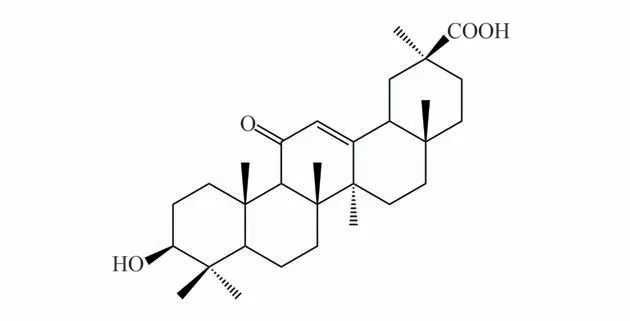
图1 甘草次酸Fig 1 Glycyrrhetinic acid
1 材料
1.1 动物
48 只幼龄BALB/c 雌性小鼠(4~6 周龄,14~16 g),购自湖南斯莱克景达实验动物有限公司(许可证号:SCXK(湘)2019-0004),饲养于广西中医药大学动物实验中心SPF 级屏障系统环境内,昼夜节律12 h,温度20~26 ℃,湿度40%~70%,自由摄食、饮水。本研究方案经广西中医药大学动物伦理与福利委员会批准(动物实验伦理号:DW20220422-160)。
1.2 药物与试剂
甘草次酸(中国食品药品检定研究院,纯度99.6%,批 号:110723-201715);卵 蛋 白(美 国Sigma-Aldrich,SLCB8249);氢氧化铝(天津市大茂化学试剂厂,20170523);醋酸泼尼松片(浙江仙琚制药股份有限公司,批号201215);小鼠OVA-sIgE ELISA 试剂盒(上海江莱实业股份有限公司,货号:032210ZF234050324);T-bet(武汉三鹰生物技术有限公司,货号:13700-1-AP);IFN-γ(Abcam,货号:ab171081);Gata3(武汉三鹰生物技术有限公司,货号:66400-1-Ig);IL-4(武汉三鹰生物技术有限公司,货号:66142-1-Ig);IL-13(碧云天生物技术有限公司,货 号:AF7254);β-actin(Bioworld,货 号:BS6007M);二抗-羊抗鼠辣根过氧化物酶(Bioworld,货号:BS12478);二抗-羊抗兔辣根过氧化物酶(Bioworld,货号:BS13278)。
1.3 主要仪器
压缩雾化机(百瑞医疗科技(常州)有限公司,型号:BRM-085Ⅱ);通用电泳仪(BIO-RAD,型号:PowerPac);超灵敏多功能成像仪(GE,型号:Amersham Imager 800 Fluor system);全波长酶标仪(BioTek Instruments,Inc.,型 号:Biotek Epoch 2);荧光正置显微镜(Olympus Corporation,型号:BX53)。
2 方法
2.1 建立小鼠咳嗽变异性哮喘模型
将小鼠随机分为空白对照组、模型对照组、醋酸泼尼松组、甘草次酸高剂量组、甘草次酸中剂量组和甘草次酸低剂量组,每组8 只。配制致敏剂:取适量生理盐水,加入氢氧化铝,充分混匀后得到氢氧化铝凝胶;在上述凝胶中加入OVA,获得致敏剂(OVA:1 mg/mL,氢氧化铝:20 mg/mL)。
小鼠适应性饲养后,除空白对照组外,其余各组于第1、8、15 天腹腔注射0.2 mL 致敏剂,空白对照组给予等量生理盐水。第22 天开始,除空白对照组外,其余小鼠置于自制的透明雾化箱,通入3%OVA 溶液进行雾化激发。该操作每天实施1 次,每次30 min,持续14 d[14-16]。
2.2 给药
各组小鼠在雾化激发阶段给予药物干预,按0.2 mL/10 g 灌胃给药。甘草次酸高、中、低剂量组的各相应浓度分别设为:20 mg/kg,10 mg/kg 及5 mg/kg,醋酸泼尼松组的药物浓度为:5 mg/kg,空白对照组和模型对照组给予等量生理盐水。所有给药均在雾化前30 min 进行,1 次/d,持续14 d。
2.3 小鼠哮喘行为学观察
末次雾化30 min 后,观察各组小鼠的哮喘行为并评分[17,18]。小鼠哮喘发作可表现为:精神异常(易惊、烦躁不安或反应迟钝、精神萎靡)、呼吸急促、口唇紫绀、腹肌抽搐、呼吸困难(弓背、腹式呼吸)、抓鼻等,评分表见表1。

表1 小鼠哮喘行为学评分表Tab 1 Mouse asthma behavioral scoring table
2.4 计算肺脏指数
记录小鼠体质量。结扎小鼠肺右主支气管,分离小鼠右肺,记录小鼠右肺质量,计算肺脏指数。小鼠肺脏指数=右肺质量(mg)/体质量(g)
2.5 ELISA 法检测肺泡灌洗液中OVA-sIgE 的含量
小鼠左肺注入0.1 mL 生理盐水,收集支气管肺泡灌洗液(BALF),重复 2 次。将所得支气管肺泡灌洗液于4 ℃、2 000 r/min 离心5 min,取上清液保存于-80℃,待进一步检测。严格按照ELISA 试剂盒进行BALF 中OVA 特异性免疫球蛋白E(OVAsIgE)的检测。
2.6 HE 染色观察肺组织病理学改变
切除右肺下叶,将其固定在4%多聚甲醛溶液小瓶中。苏木素-伊红(HE)染色观察肺组织病理学改变。
将固定好的右肺组织进行石蜡包埋、切片。二甲苯溶液和无水乙醇溶液进行脱蜡,用乙醇进行梯度洗脱,操作重复两遍。入蒸馏水中5 min 后取出。苏木素染液中浸润20 min,流水冲洗15 min,放入1%盐酸乙醇溶液浸泡至肺组织切片变红。伊红染液中浸润5 min,流水冲洗,用低到高浓度乙醇脱水,二甲苯溶液至透明,中性树胶封片。
2.7 Western Blot 检测肺组织中T-bet、IFN-γ、Gata3、IL-4 及IL-13 的蛋白表达
将适量蛋白酶抑制剂和磷酸酶抑制剂加入组织裂解液中,混匀后即得裂解缓冲液。取适量右肺上叶,冰上匀浆后加入上述裂解缓冲液中,于冰上裂解30 min 提取总蛋白,随后于4 ℃、12 000 r/min离心10 min,收集离心后的上清液,并加入适量上样缓冲液,并在100 ℃下加热10 min。取约10 μg 经降解的样品进行凝胶电泳、湿法转印后,将膜取出,于无蛋白快速封闭液中封闭10 min,后分别加入T-bet(1∶500 v/v)、IFN-γ(1∶2 000 v/v)、Gata3(1∶5 000 v/v)、IL-4(1∶1 000 v/v)、IL-13(1∶1 000 v/v)或β-actin(1∶10 000 v/v 的初级抗体中4℃孵育8~10 h。经TBST 洗涤后,用二抗(抗鼠或抗兔,1∶20 000 v/v)常温孵育膜1 h。采用化学发光试剂盒浸泡蛋白条带,置于超灵敏成像系统中进行化学发光检测。采用Image J 软件进行条带密度计算。
2.8 数据处理
采用Prism 8.0(GraphPad,USA)软件进行单因素方差分析或非参数检验。数据以从至少三次独立测试获得的或median(IQR)表示。P<0.05 为差异有统计学意义。
3 实验结果
3.1 实验动物行为学表现
末次雾化30 min 后观察小鼠哮喘行为,结果显示,空白对照组小鼠毛发柔顺光泽,精神状态较好,活动次数频繁,呼吸节律均匀平稳,几乎无哮喘行为学表现。模型对照组小鼠则出现毛发杂乱、呼吸急促、频繁抓鼻的情况及急躁不安、精神萎靡、反应迟钝等精神异常行为,哮喘行为学评分与空白对照组相比显著升高(P< 0.01)。醋酸泼尼松组小鼠与模型对照组相比,哮喘行为有所缓解(P< 0.01),精神状态稍好,毛发杂乱程度缓和,活动较频繁,抓鼻频次降低,呼吸节律缓和。甘草次酸各给药组与模型对照组相比,哮喘行为均有所缓解,精神状态稍好,抓鼻频次降低,呼吸节律缓和。其中甘草次酸高剂量组哮喘行为学评分与模型对照组相比显著降低(P< 0.05)。各组间小鼠哮喘行为学评分统计见表2。
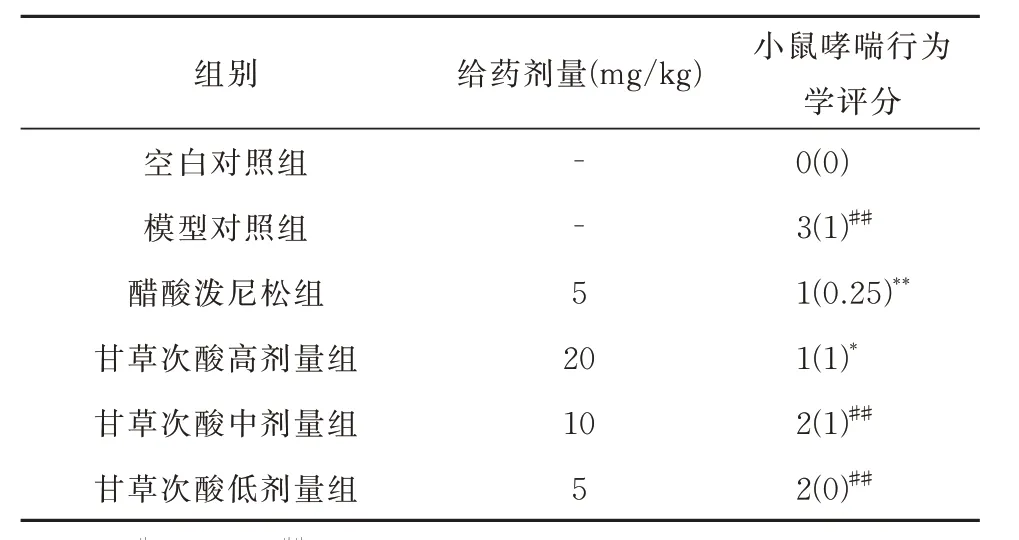
表2 小鼠哮喘行为学评分统计图[n=8,median(IQR)]Tab 2 Asthma behavioral scores in mice[n=8,median(IQR)]
3.2 小鼠肺脏指数
与空白对照组相比,模型对照组小鼠肺脏指数明显增加(P<0.01)。给予甘草次酸后,甘草次酸高剂量组和中剂量组的小鼠肺脏指数明显降低(P<0.01),见表3。
表3 小鼠肺脏指数统计图(n=8,)Tab 3 Index of lung(n=8,)

表3 小鼠肺脏指数统计图(n=8,)Tab 3 Index of lung(n=8,)
注:#P<0.05;##P<0.01;*P<0.05;**P<0.01。
肺脏指数5.75±0.89 10.63±0.72##6.97±0.73**8.60±0.76##**8.67±1.06##**9.22±1.85##17.85组别空白对照组模型对照组醋酸泼尼松组甘草次酸高剂量组甘草次酸中剂量组甘草次酸低剂量组F给药剂量(mg/kg)-- 5 2 0 10 5
3.3 肺泡灌洗液中OVA-sIgE 的水平
ELISA 结果显示,空白对照组OVA-sIgE 的水平低,经OVA 致敏和雾化激发后,各组的OVA-sIgE 水平均显著高于空白对照组(P<0.01)。药物干预后,与模型对照组相比,OVA-sIgE 表达水平均有所下降,其中甘草次酸高剂量组下降明显,差异有显著性意义(P<0.01),见表4。
表4 小鼠肺泡灌洗液中OVA-sIgE 水平(n=8,)Tab 4 OVA-sIgE level in BALF(n=8,)

表4 小鼠肺泡灌洗液中OVA-sIgE 水平(n=8,)Tab 4 OVA-sIgE level in BALF(n=8,)
注:#P<0.05;##P<0.01;*P<0.05;**P<0.01。
OVA-sIgE 水平0.25±0.03 3.18±0.40##2.14±0.65##**2.14±0.72##**2.65±0.42##2.47±0.61##25.59组别空白对照组模型对照组醋酸泼尼松组甘草次酸高剂量组甘草次酸中剂量组甘草次酸低剂量组F给药剂量(mg/kg)-- 5 2 0 10 5
3.4 小鼠肺组织病理结果
HE 染色结果显示,空白对照组小鼠肺组织结构清晰,肺泡上皮光滑,肺内几乎未见炎症细胞浸润。经OVA 致敏激发后,模型对照组小鼠肺组织结构不规则,肺泡腔内可见炎性分泌物,部分区域炎症灶合并成块。给药后,甘草次酸各组肺组织结构均有所改善,炎症细胞浸润情况减轻,见图2。
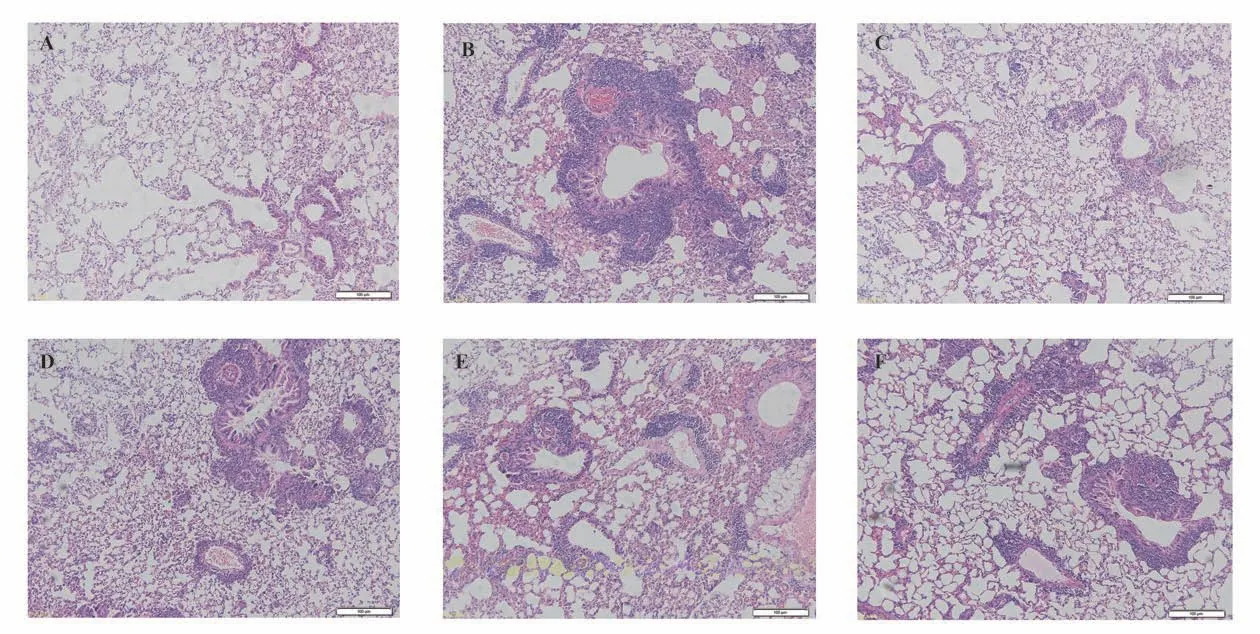
图2 各组小鼠肺组织HE 染色结果(100 ×)Fig 2 HE staining results in each group (100 × )
3.5 小鼠肺组织中T-bet、IFN-γ、Gata3、IL-4、IL-13的蛋白表达情况
经OVA 诱导,与空白对照组相比,模型对照组Th2 相关蛋白Gata3、IL-4、IL-13 的表达均显著升高(P< 0.05 或P<0.01)。给药后,Th2 相关细胞因子蛋白表达均降低,其中Gata3 在甘草次酸低剂量组下降明显(P<0.01),IL-4 在甘草次酸高剂量组下降明显(P<0.05),IL-13 在甘草次酸中剂量组和甘草次酸低剂量组均显著降低(P<0.05)。
经OVA 诱导,与空白对照组相比,模型对照组的Th1 相 关 因 子IFN-γ 的 表 达 显 著 降 低(P<0.01)。给药后,甘草次酸组的IFN-γ 蛋白表达均升高,其中甘草次酸高剂量组显著升高(P< 0.05)。而另一相关因子T-bet 没有出现对等趋势,见图3,表5。
表5 Th1/Th2 相关因子在肺组织中的蛋白表达情况()Tab 5 Protein expressions of Th1/Th2 related factors()

表5 Th1/Th2 相关因子在肺组织中的蛋白表达情况()Tab 5 Protein expressions of Th1/Th2 related factors()
注:#P<0.05;##P<0.01;*P<0.05;**P<0.01。
组别空白对照组模型对照组醋酸泼尼松组甘草次酸高剂量组甘草次酸中剂量组甘草次酸低剂量组F给药剂量(mg/kg)IL-13 0.36±0.20 0.96±0.03#0.66±0.11 0.75±0.14 0.45±0.18*0.37±0.28*3.902-- 5 2 0 10 5 T-bet 0.20±0.07 0.86±0.10##0.57±0.06 0.57±0.18 0.65±0.16 0.61±0.29 3.434 IFN-γ 1.54±0.45 0.58±0.11##1.74±0.70**1.32±0.30*0.95±0.31 0.81±0.10 5.454 Gata3 0.45±0.09 1.25±0.11##0.74±0.13*1.13±0.15##0.89±0.13#0.56±0.24**9.020 IL-4 0.48±0.09 1.27±0.08#0.56±0.18*0.56±0.26*0.68±0.31 0.69±0.22 3.733

图3 肺组织中WB 条带Fig 3 WB bands of lung tissue
4 讨论
CVA 是一种特殊类型的哮喘,刺激性干咳是其唯一或主要的临床表现。目前,CVA 的发病机制尚不清楚,由于其病理变化与经典哮喘相似,CVA 被认为是哮喘的不同阶段或进展之一,建议按照经典哮喘方法进行长期规范治疗。由于CVA 患者多为儿童和青少年,处于身体生长发育的黄金阶段,其独特的生理和病理特征给诊断、治疗、用药安全以及维持正常肺功能和发育带来了挑战。目前,许多化学药物在治疗哮喘方面均有较好的疗效,但仍存在全身性副作用过大、费用高昂等缺点。
在传统医学体系中,天然药物和天然成分在疾病的预防和治疗中发挥着重要作用,其中一些药物可能具有良好的抗哮喘作用,且副作用小。本实验从甘草次酸调节Th1/Th2 平衡的角度出发,对甘草次酸的免疫调节作用及相关作用机制进行研究。
因OVA 诱导的模型以Th2 响应为特征[19],可提供Th2 细胞效应功能,以探索可能的Th1/Th2 失衡机制。因此本研究建立了OVA 诱导的CVA 小鼠模型,研究Th1/Th2 在肺组织中的表达,探讨其机制。结果显示,经OVA 致敏激发后,与空白对照组相比,模型对照组哮喘行为学评分显著升高,肺脏指数明显升高,炎症细胞浸润明显,BALF 中OVA-sIgE 表达显著升高,肺组织中Th2 相关因子Gata3、IL-4 和IL-13 表达显著升高,同时肺组织中Th1 相关因子IFN-γ 表达降低。给予甘草次酸后,与模型对照组相比,甘草次酸各剂量组哮喘行为学评分降低,肺脏指数降低,OVA-sIgE 表达水平下降,炎症细胞浸润减少;肺Th2 相关细胞因子蛋白表达均降低,肺组织Th1 相关细胞因子IFN-γ 蛋白表达显著升高。临床研究表示,哮喘患儿存在明显的Th1/Th2 细胞因子失衡情况,患者不仅体内的IFN-γ 水 平 降 低,IL-4 水 平 较 高[20],且 外 周 血 中Th1/Th2 细 胞 比 值 降 低[21]。有 研 究 表 示 当Th1/Th2 型免疫应答失衡,可分泌大量的细胞因子,引起异常的免疫反应,Th1 细胞在呼吸系统的功能低下及Th2 细胞优势分化是哮喘发病的基础。Th2 分泌的特征性细胞因子IL-4 可诱导IgE 产生嗜酸性粒细胞并在气管内聚集,导致慢性气道炎症反应[22];其分泌的另一细胞因子IL-13 能通过促进黏液分泌和加重气道高反应性而加重哮喘[23],二者皆可反应Th2 的免疫应答情况。IFN-γ 则是Th1 特征性细胞因子,能加强Th1 细胞的应答,降低气道阻力,从而减轻慢性炎症,当Th2 功能亢进时,Th1 被抑制,IFN-γ 因此分泌减少,一定程度上可反应Th1 的免疫应答情况[24]。
综上所述,甘草次酸能通过调节CVA 小鼠的Th1/Th2 的失衡从而减轻气道炎症,这可能是甘草次酸治疗CVA 的机制之一,为开发基于甘草次酸治疗CVA 的免疫调节疗法提供了依据。
