扩张的血管周围腔隙在阿尔茨海默病海马萎缩中的作用*
2023-09-08邵元伟
邵元伟 朱 彦 周 群
江苏大学附属医院影像科,江苏省镇江市 212001
阿尔茨海默病是目前为止全世界范围发病最为广泛的一种脑退行性病变,其导致的严重记忆力衰退、认知障碍以及语言功能损害的一系列临床症状给家庭及社会带来了沉重负担。阿尔茨海默病的一个重要表现就是海马萎缩,海马是中枢神经系统中负责学习记忆及情感调控的重要核团,国内外诸多研究均表明阿尔茨海默病的严重程度与海马萎缩程度强烈相关。扩张的血管周围腔隙(dVRS)以往被认为是无功能的一种正常结构,但近期有一系列研究表明dVRS的成分十分复杂,其内含有的多种细胞因子起到炎症损伤、阻碍递质传递以及血脑屏障破坏等神经有害作用,其存在状态与多种神经退行性疾病及精神疾病相关[1-2]。阿尔茨海默病中dVRS介导的海马萎缩可能是疾病发生发展的关键,这种变化能够利用高场MRI准确检测并重建分析,通过基于dVRS存在状态评估的海马萎缩预测分析能够客观指导阿尔茨海默病的干预方案,并有助于研究阿尔茨海默病发病机制。
1 资料与方法
1.1 一般资料 收集2022年1—12月就诊于我院神经内科及老年科并诊断为阿尔茨海默病的患者共125例,诊断依据美国精神疾病诊断及统计学手册第4版中阿尔茨海默病的诊断标准。初步收集的患者通过以下条件进一步筛选:(1)本人或监督人同意接受研究组研究方案;(2)无磁共振检查禁忌证;(3)磁共振检查排除颅脑器质性病变;(4)排除其他脑退行性病变或精神疾病;(5)无药物、酒精或毒品依赖。再次筛选后,最终入组77例阿尔茨海默病患者为病例组,其中男56例,女21例,平均年龄(75±3.1)岁,平均受教育年限(10.4±2.3)年,平均身高(160±10.4)cm,平均体重(63.2±8.7)kg,均为右利手。同时收集正常受试者30例,受试者均来自江苏大学附属医院退休职工,筛选标准同病例组,其中男20例,女10例,平均年龄(73±2.9)岁,平均受教育年限(11.4±2.4)年,平均身高(161±9.6)cm,平均体重(65.1±7.7)kg,均为右利手。本研究经江苏大学附属医院伦理委员会批准,所有受试者均知情同意并签署知情同意书。
1.2 方法
1.2.1 磁共振图像数据采集。数据采集设备使用SIMENS公司3.0 T Magneton Trio型号MRI 仪配以8通道头颅专用线圈;受试者进行数据采集前由研究组成员进行相关注意事项告知以及情绪安抚工作,静坐15~20min后以仰卧位、头先进方式进床以及定位。头颅常规扫描序列及参数如下:T1加权成像(T1WI),重复时间(Repetition time,TR)= 450ms,回波时间(Echo time,TE)=10ms;T2加权成像(T2WI),TR=4 350ms,TE=95ms;液体衰减反转恢复序列(FLAIR),TR=8 200ms,TE=113ms;弥散加权成像(DWI),TR=4 000ms,TE=97ms。海马扫描:采用平行于脑干的斜冠状位T1WI-3D结构扫描序列,TR=450ms,TE=10ms。所采集的数据统一光盘储存以便后续进行数据处理。
1.2.2 海马及dVRS的识别、重建与分析。海马及dVRS的MRI结构重建通过mimics17.0软件进行,分别由三名高年资主治医师单独进行,见图1。
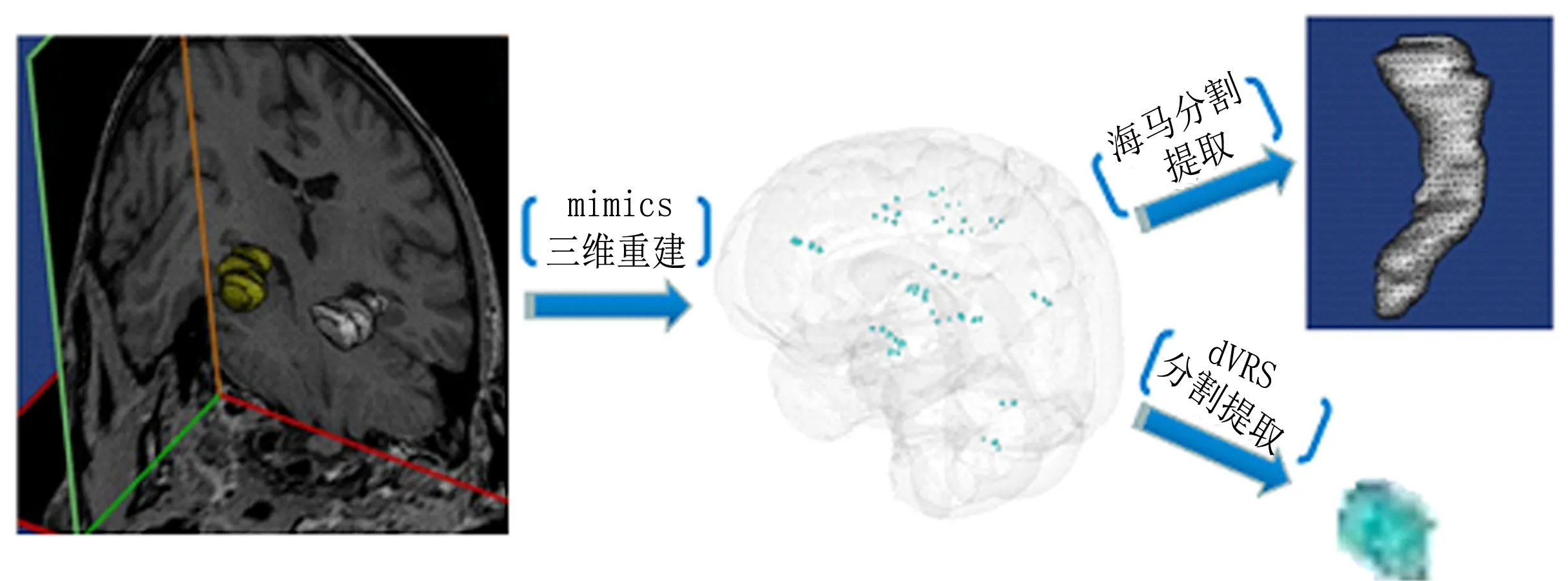
图1 基于mimics软件的海马及dVRS的重建、分割及提取
海马重建及体积计算:(1)参照国内学者Wang发布的磁共振中人类海马结构解剖标志点及边缘识别标准在斜冠状位T1WI-3D图像中进行逐层海马的勾勒[3];(2)同样参照上述办法对海马头部、体部以及尾部进行边界勾勒;(3)利用mimics17.0软件对勾勒的海马进行重建,同时对海马不同部位的重建掩模进行赋色以便区别;(4)利用mimics17.0软件中的自动计算功能对重建的海马总体及不同部位进行体积计算。
dVRS重建及体积计算:(1)参照Martinez-Ramirez在Stroke杂志发布的dVRS识别标准进行dVRS的识别及边缘勾勒[4],识别标准如下:形态规则、边缘光整,分布与穿支血管伴行,所有序列信号与脑脊液信号一致,无占位效应及周围胶质增生信号;(2)利用mimics17.0软件对勾勒出的dVRS进行三维重建并赋色;(3)对dVRS重建结构进行体积计算并统计总体积。

2 结果
2.1 病例组与正常组双侧海马体积及dVRS形态学指标对比分析 对比正常组,病例组双侧海马体积下降明显,双侧海马中dVRS数目及总体积增加明显,见表1。

表1 病例组与正常组双侧海马体积及dVRS形态学指标对比
2.2 病例组双侧海马dVRS分布及形态学情况分析 病例组中,双侧海马头部dVRS的分布较其他部位更为广泛,dVRS的总体积更大,见表2。

表2 病例组双侧海马dVRS分布及形态学情况(%)
2.3 病例组双侧海马dVRS形态学指标与海马体积相关性分析 病例组中,双侧海马体积与海马内dVRS的数目和总体积均呈负相关(左侧海马dVRS数目与左侧海马体积相关系数:r=-0.486,P<0.05,左侧海马dVRS总体积与左侧海马体积相关系数:r=-0.572,P<0.05;右侧海马dVRS数目与右侧海马体积相关系数:r=-0.421,P<0.05,右侧海马dVRS总体积与右侧海马体积相关系数:r=-0.465,P<0.05),见图2。
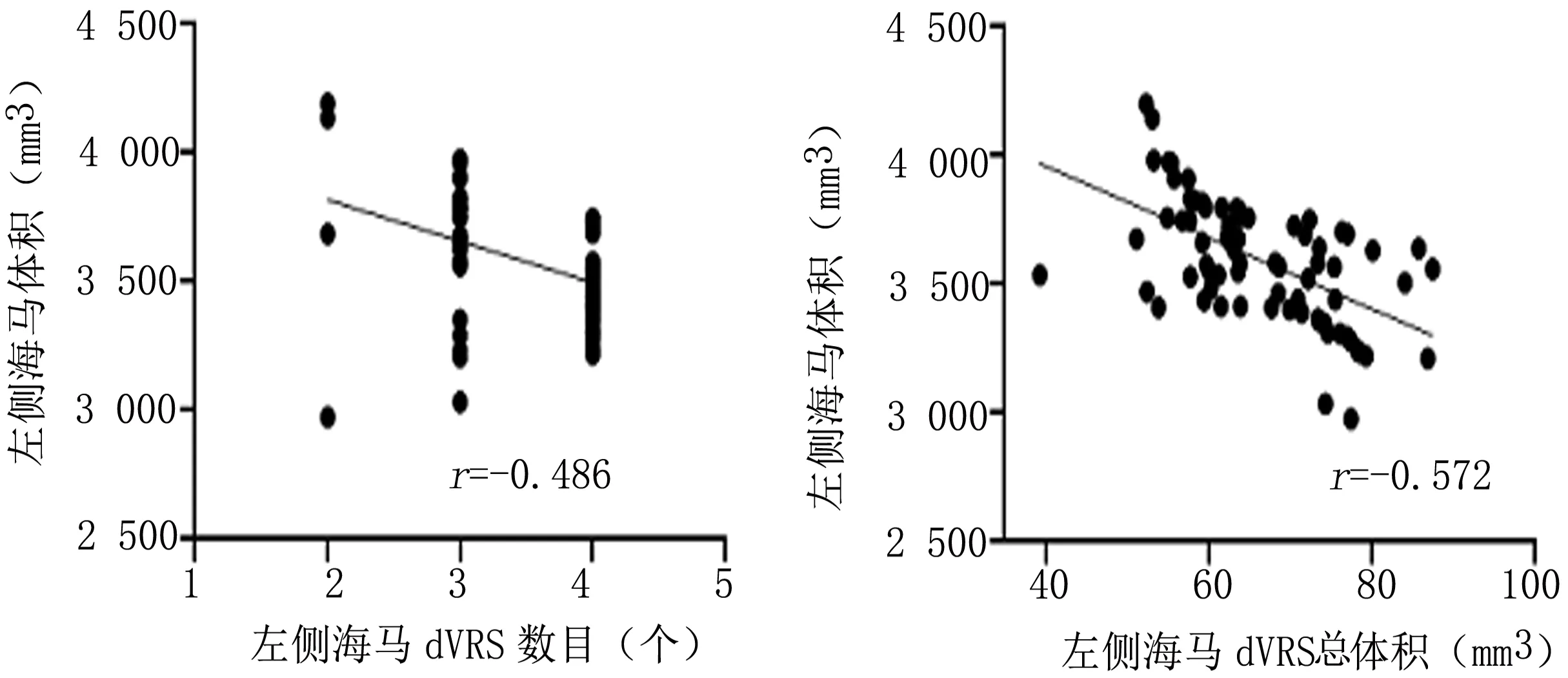
图2 病例组双侧海马dVRS形态学指标与海马体积相关图
2.4 病例组双侧海马dVRS存在状态对海马体积萎缩预测价值的ROC曲线分析 病例组中,左侧海马dVRS数目AUC=0.845,灵敏度66.76%,特异度94.81%;左侧海马dVRS总体积AUC=0.920,灵敏度76.67%,特异度98.70%;右侧海马dVRS数目AUC=0.722,灵敏度60.00%,特异度83.12%;右侧海马dVRS总体积AUC=0.872,灵敏度80.00%,特异度81.82%。见图3。
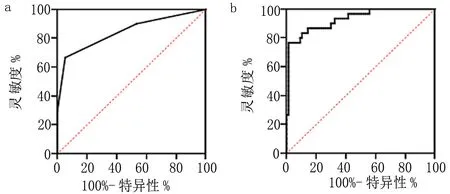
图3 病例组双侧海马dVRS存在状态对海马体积萎缩预测价值的ROC图
3 讨论
阿尔茨海默病是一种严重影响人类认知、记忆以及学习能力的退行性脑病,近几年呈逐年上升的发病趋势,不仅影响患者自身的生活质量,也给家庭以及社会带来不小的经济负担。目前阿尔茨海默病的发病机制仍在不断探索之中,主要集中在脑内β淀粉样蛋白异常沉积、脑内Tau蛋白过度磷酸化以及神经纤维缠结等研究热点之中[5-6]。近期有国外报道长期的神经慢性炎症在阿尔茨海默病中扮演了重要角色,而过往被人忽视的dVRS可能是神经慢性炎症的一种重要表现形式,同时也可能是促进病情发展的一种重要病理因素[7]。准确理解阿尔茨海默病中dVRS对于脑结构的损伤模式成为探索阿尔茨海默病发生发展机制的重要切入口,同时也为临床干预手段的制定及预后评估提供数据支持。
阿尔茨海默病最重要的变化是负责学习记忆的海马核团不可逆性萎缩,这种萎缩的微观体现的是大量神经元的凋亡及功能丧失[8]。基于现代MRI成像技术的进步,对于海马结构体积计算及分析的准确性及可靠性逐步上升,现已成为无创性评估阿尔茨海默病脑结构变化及病情评估的一项重要客观手段[9]。依据之前dVRS产生对脑结构损伤的潜在理论性基础,采用高场MRI成像手段评估阿尔茨海默病患者海马结构中dVRS存在状态对海马萎缩影响的作用成为本研究的一个重要目的,旨在形成基于海马结构dVRS存在状态的疾病发展预测模型。
本研究通过对比发现,相较于正常组,病例组双侧海马中dVRS分布更为明显、数目更多且总体积更为庞大,同步的,病例组海马体积出现了明显的缩小;在dVRS形态学指标与海马体积的相关性分析中发现dVRS数目越多、总体积越大,所在海马体积就萎缩得更为明显。提示dVRS介导了海马萎缩的发生发展;近年国外Jokinen通过大鼠模型的研究发现dVRS里填充的并非单纯脑脊液[10],其内液体中的炎症因子含量很丰富,尤其是对神经细胞毒性较大的IL-1β、IL-6和TNF-α[11],这些毒性炎症因子一方面促进dVRS邻近的海马神经细胞凋亡,另一方面能够损害该区域血管内皮细胞功能,促使更多炎症因子的渗入,加重该区域神经细胞凋亡速度和程度[12]。在dVRS分布研究中,发现双侧海马头部dVRS的分布较其他海马部分更为明显,提示海马头部更为明显的受损敏感性,海马头部被认为是与记忆功能最为密切相关的亚结构,阿尔茨海默病出现了海马头部严重损害也高度符合其核心症状的解释。通过对海马中dVRS分布、数目、体积的研究以及相关性分析,证明了dVRS存在状态越明显,该区域脑结构萎缩亦会随之加重。
基于以上研究结果,本研究小组通过对dVRS多种形态学指标的分析以及海马萎缩程度的观察,建立了基于MRI图像分析技术的阿尔茨海默病海马萎缩预测的模型。依据本实验模型预测结果来看,影像科医生能够通过观察dVRS的存在状态预测阿尔茨海默病对象的海马是否存在萎缩以及萎缩程度,为阿尔茨海默病患者的临床干预方案以及预后评估起到充分的数据模型支撑。同时,本研究结果在一定程度上辅证了阿尔茨海默病中由dVRS介导的海马神经细胞炎症毒性凋亡作用。
