miR-381-3p在宫颈癌中靶基因及信号通路的分析*
2023-09-08魏林珍马晓梅秦天生
魏林珍 马晓梅 张 郎 陈 凡 秦天生
1 甘肃省人民医院妇产科,甘肃省兰州市 730000; 2 兰州大学基础医学院; 3 甘肃中医药大学
宫颈癌是女性癌症死亡第二大原因,宫颈癌的复发和转移仍旧是诊治的难题[1],开发敏感的诊断方法并找到新的治疗策略是研究的热点。miRNA是小单链非编码RNA,它的过表达或下调可引起抑制基因或癌基因的激活,从而参与分化、增殖和存活等生物学过程。本研究利用TCGA数据库研究宫颈癌组织中miR-381-3p的表达水平,并探索其可能的靶基因及分子调控机制,为宫颈癌的防治提供思路。
1 材料与方法
1.1 miR-381-3p基本资料 通过PubMed数据库查询miR-381-3p相关的文献,并用miRBase和UCSC等查找miR-381-3p 的物种保守性、染色体定位等基本资料。见表1。

表1 在线数据库名称及网址
1.2 miR-381-3p在宫颈癌中的表达 通过TCGA网站获取人肿瘤组织与肿瘤旁正常组织的miR-381-3p表达水平。利用UALCAN数据库比较 miR-381-3p在宫颈癌中的差异表达水平。
1.3 miR-381-3p靶基因预测 使用miRWalk数据库进行预测。为了提高准确性,设定预测结点为3’UTR,预测评分0.95,且同时能在TargetScan和miRDB数据库被预测。
1.4 miR-381-3p靶基因的生物信息学分析 利用DAVID对miR-381-3p的靶基因实行GO功能注释,设定条件是基因数目>10且得满足P<0.05。对靶基因探究KEGG通路,设定条件是P<0.05。
1.5 蛋白与蛋白相互作用(PPI) 利用STRING数据库构建 PPI网络,利用 Cytohubba插件依EPC筛选前10位关键基因。
1.6 分析关键基因 利用GEPIA分析关键基因在子宫颈癌组织中和正常组织的表达,以P<0.05为有统计学差异。
2 结果
2.1 miR-381-3p基本信息 通过检索得到 hsa-miR-210-3p定位在14q32.31染色体区域中,且在人、大鼠、猕猴、小鼠等多种物种之间维系高度保守性。见表2。
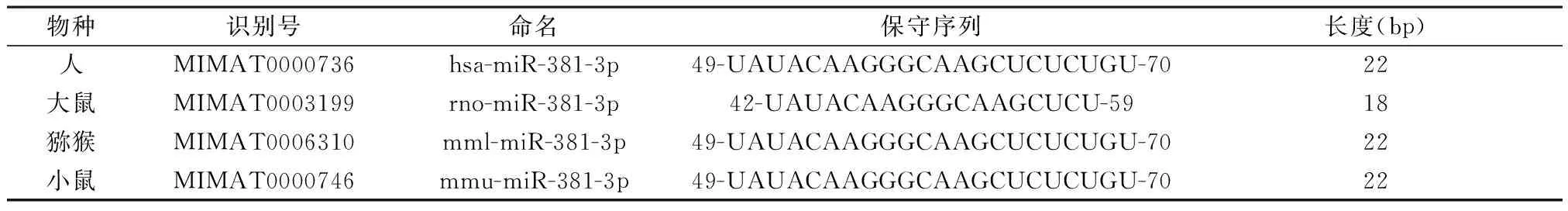
表2 miR-381-3p在不同物种中的基本信息
2.2 miR-381-3p在人各肿瘤组织和其在相应正常组织的表达差异 通过数据库分析:miR-381-3p在多种肿瘤及其邻近正常组织中都存在着差异表达。在肾上腺皮质癌、结肠癌、睾丸癌、子宫肉瘤等肿瘤中miR-381-3p呈显著高表达,可能在这些肿瘤里充当癌基因角色。而在宫颈癌、头颈鳞状细胞癌、多形性胶质细胞瘤等肿瘤中的表达显著降低,miR-381-3p在这些肿瘤中可能发挥抑癌基因角色。见图1。
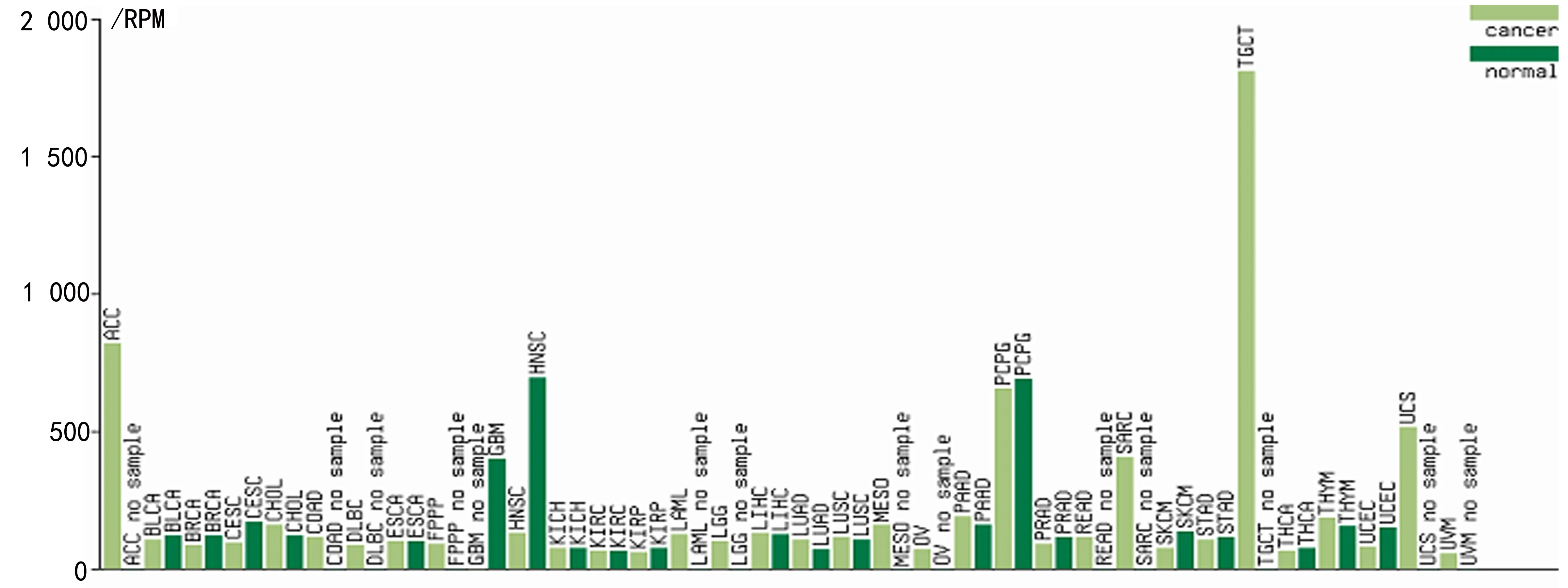
图1 miR-381-3p在不同的肿瘤组织中和肿瘤旁正常组织之间的表达
依据UALCAN平台数据分析,miR-381-3p在宫颈癌患者组织中呈现显著的低表达(见图2a)。依据宫颈癌分期的资料与数据,与宫颈正常组织比较,S2、S3与S4的miR-381-3p表达水平均显著性降低,且从其表达量数据分析发现,与宫颈癌分期呈负相关关系,但只有S1与S3之间有统计学差异(见图2b)。依据宫颈癌分级的相应资料展现,与宫颈正常组织比较,G2和G3级的宫颈癌组织的hsa-miR-381-3p表达量均显著降低,但宫颈癌分级之间并未见数据上的统计学差异(见图2c)。 依据宫颈癌分期的相应资料显示,正常宫颈组与宫颈癌淋巴结有无转移组无统计学差异,宫颈癌组中有无淋巴结转移间也未见统计学差异(见图2d)。
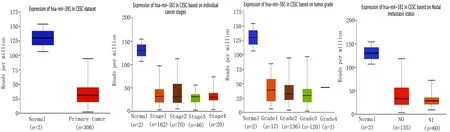
a b c d
2.3 筛选miR-381-3p下游靶基因预测 通用miRWalk数据库对miR-381-3p行靶基因预测,剔除重复,预测得到1 606个基因。进一步筛查,能被 miRTarBase和miRDB同时预测到,最终得到84个靶基因。
2.4 miR-381-3p靶基因GO与KEGG信号通路富集分析 对筛选出的84个靶基因实行GO注释显示:miR-381-3p的靶基因富集在对RNA聚合酶Ⅱ启动子转录进行正向调节和信号转导的生物学过程,富集在细胞核、细胞质、胞浆、核质体、细胞膜、核体等细胞组分,富集在蛋白质结合和RNA聚合酶Ⅱ的转录因子活性序列特异性DNA结合等分子功能,结果见图3。KEGG表明,靶基因富集于癌症通路、乳腺癌、胃癌、Hippo、MAPK、肌动蛋白细胞骨架的调节等信号通路,见图4。
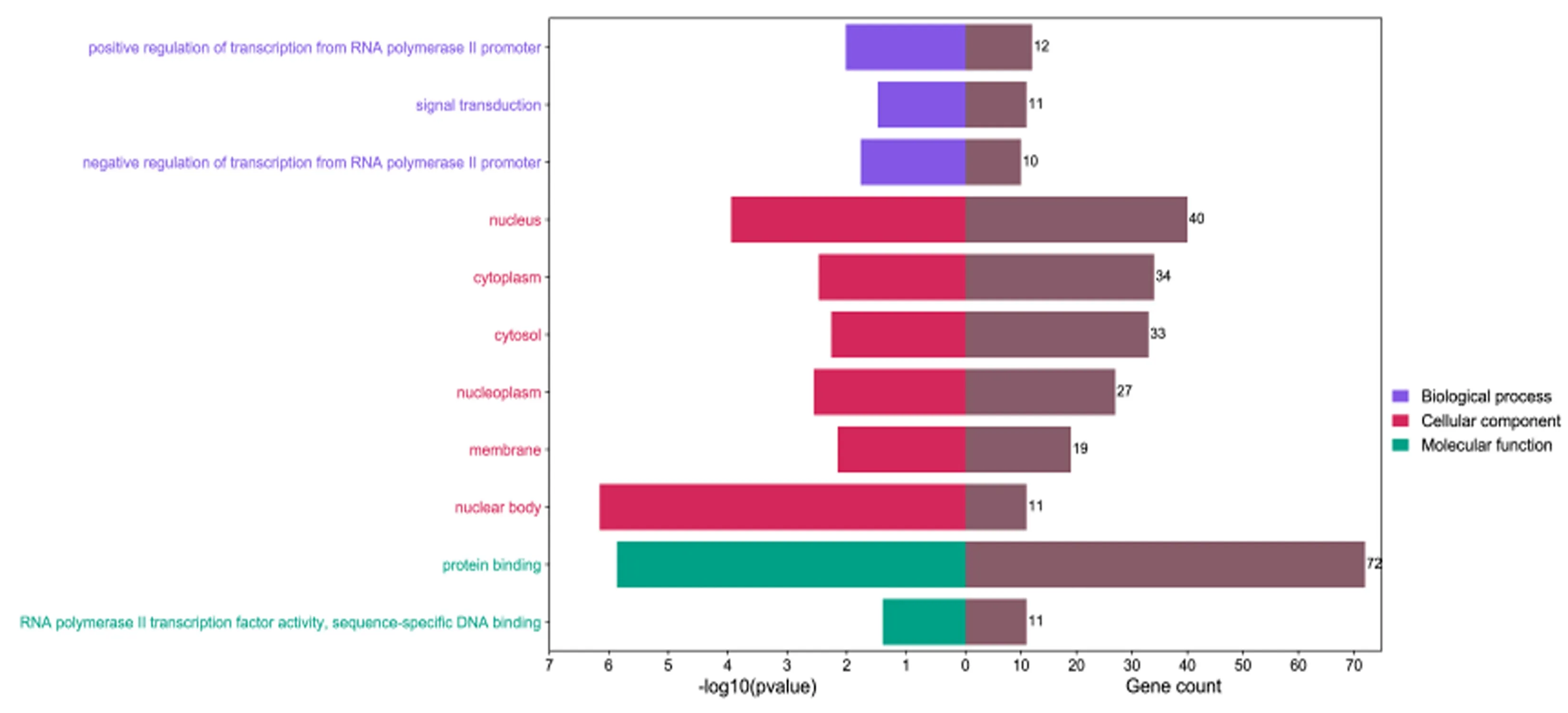
图3 miR-381-3p预测靶基因生物学过程、细胞组成、分子功能
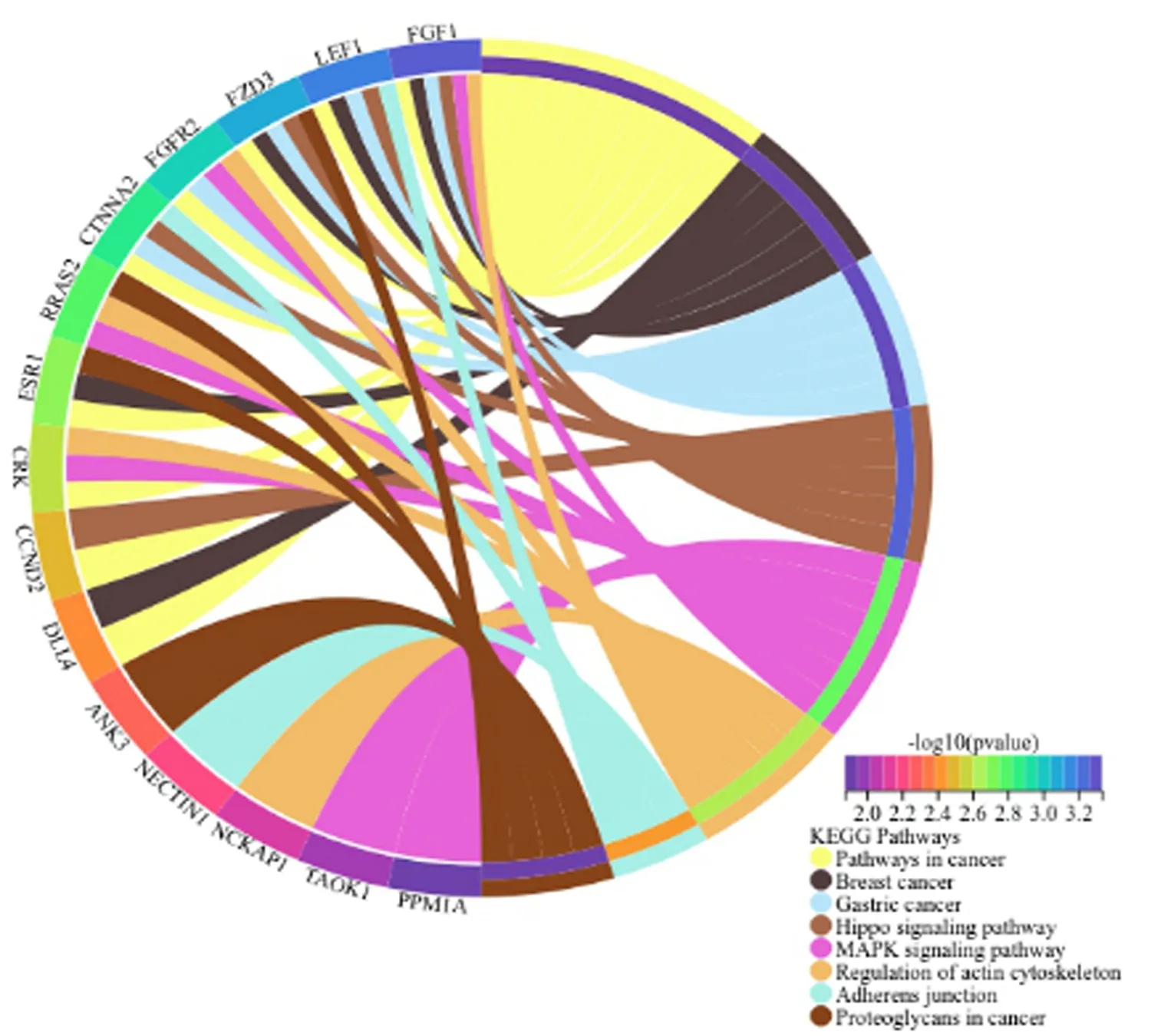
图4 miR-381-3p靶基因 KEGG信号通路富集分析
2.5 靶基因 PPI网络构建及关键基因 基于STRING数据库建靶基因蛋白与蛋白的网络图(见图5),并根据EPC在CytoHubba插件筛选出网络图中前 10的关键基因,分别是 ESR1、LEF1、PBX1、CCND2、FGFR2、CADM1、TCF3、MPP6、PVRL1、UBE3A(见图6)。

图5 miR-381-3p靶基因蛋白与蛋白网络图
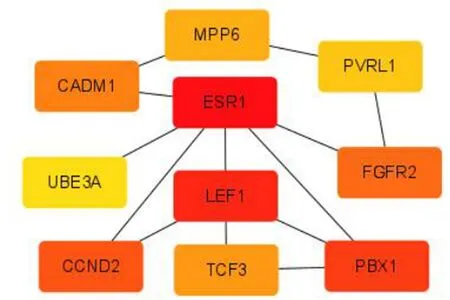
图6 网络图中前 10的关键基因
2.6 验证核心基因 利用 GEPIA在线分析网站,比较核心基因在宫颈癌和正常对照中的表达,结果显示:与正常组织相比,宫颈癌组织中ESR1、PBX1、CCND2在表达水平较低(P<0.05)。见图7。
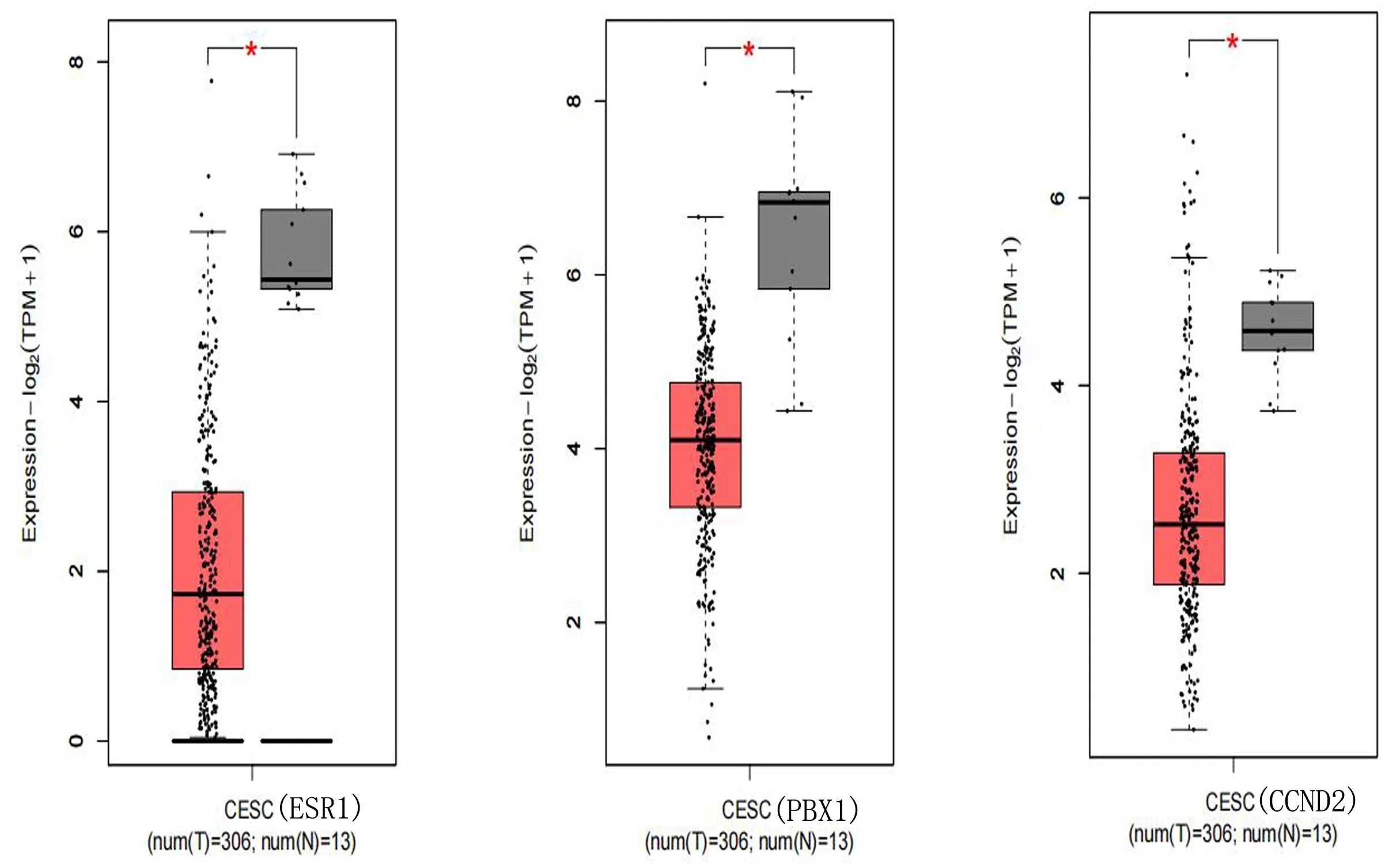
图7 宫颈癌组织(T)与正常宫颈组织(N)中ESR1、PBX1、 CCND2的表达
3 讨论
宫颈癌不仅影响女性的生殖健康,而且对心理健康也造成一定的影响。因此,研究宫颈癌早期的诊治标记物显得尤为重要。现有研究发现,miRNA与宫颈癌有着一定的关系,可作为宫颈癌早期诊治的标记物,也可以作为生物治疗的靶点[2]。
前期研究发现,miR-381-3p与多种肿瘤关系密切,且在不同肿瘤中表现为抑癌基因或癌基因[3]。本研究通过TCGA数据库发现miR-381-3p在宫颈癌组织中表达降低,这与Shang等[4]的研究相符。同时,根据UALCAN在线分析,miR-381-3p在宫颈癌患者的组织中出现显著低表达,且与肿瘤分期、分级间有一定的关系,与有无淋巴结转移无统计学差异。上述结果表明miR-381-3p在宫颈癌疾病中可作为抑癌基因,可能与宫颈癌发生有一定联系。
为进一步探讨miR-381-3p表达异常与宫颈癌的相互关系,需要预测靶基因及靶基因的功能。本研究利用miRWalk获取 miR-381-3p的靶基因,为了增加准确性,且靶基因能在miRDB和miRTarBase中被预测到,共获得84个miR-381-3p的靶基因。GO注释表明,靶基因主要富集于信号转导和RNA聚合酶Ⅱ启动子对转录的负向调节等生物学过程,富集在细胞核、细胞质等细胞组分,富集在蛋白质结合等分子功能。
KEGG结果表明,癌症通路、乳腺癌、胃癌、Hippo、MAPK、肌动蛋白细胞的骨架调节等关键信号通路被富集。已有研究表明[5]MAPK途径是从细胞外信号转换为细胞内反应的重要桥梁。由于遗传和表观遗传学的变化,在包括癌症内的各种疾病中发现了信号级联的改变。MAPK对癌症治疗的反应具有影响,特别是对实验性MAPK抑制的反应中的补偿途径的激活。Hippo信号通路受到广泛的细胞内和细胞外信号的调控,在许多癌症类型中都观察到了Hippo信号的失调, Hippo途径的核心成分可能通过诱导肿瘤干细胞和增殖而启动肿瘤发生,最终导致转移和耐药性,广泛发生于宫颈癌[6]。
进一步证实miR-381-3p异常表达与宫颈癌关系,对miR-381-3p的核心基因进行验证,结果显示ESR1、PBX1、CCND2水平在CESC组织中低于正常组织。ESR1是编码雌激素受体α的基因,是乳腺癌中最常见的核转录因子。激活ESR1配体结合结构域突变产生组成/配体非依赖性转录活性,并在延长一线激素治疗方案后出现,这些突变对ER转录、转移倾向和肿瘤微环境的多模式影响[7]。Hu等[8]研究发现ESR1通过与HS1BP3启动子融合抑制肝癌的增殖并改善其预后。CCND2是细胞增殖的关键调节因子,在恶性肿瘤中起重要作用。最近研究表明,CCND2的功能异常会加速肿瘤进展。例如,CCND2调节并促进结直肠癌干细胞的细胞周期进展,抑制骨肉瘤细胞增殖和生长[9-10]。PBX1与重要的发育程序有关,其表达失调与癌症在内的多因素疾病有关。相关研究表明 PBX1 可能参与避免免疫破坏和促进肿瘤的炎性标志物[11]。此外,本研究通过数据库预测miR-381-3p与ESR1、PBX1、CCND2存在靶向调控关系,结合靶基因的表达水平,推测miR-381-3p参与宫颈癌的疾病进程可能与ESR1、PBX1、CCND2靶基因相关。后期,笔者结合临床宫颈癌组织标本进一步验证miR-381-3p与靶基因关系。
本研究发现miR-381-3p可作为宫颈癌的抑癌基因,并可能靶向ESR1、PBX1和CCND2影响宫颈癌的进展。由于ESR1、PBX1和CCND2表达与宫颈癌相关,提示它们可能为宫颈癌诊断和治疗的靶点,但是仍需进一步证实miR-381-3p与宫颈癌,miR-381-3p与ESR1、PBX1和CCND2复杂作用机制。
