BCR-ABL 融合基因定性检测试剂盒的性能评价
2023-09-07李丽莉黄杰张文新孙楠黄传峰曲守方
李丽莉 黄杰 张文新 孙楠 黄传峰 曲守方
白血病是我国高发的恶性肿瘤之一,存在某些染色体畸变,如易位、缺失、插入等。染色体易位时形成相关的融合基因,可以作为某种白血病的特异性分子诊断标志,用于白血病的分子生物学分型、预后观察及微小残留病(minimal residual disease,MRD)的诊断。白血病融合基因主要有BCR-ABL、PML-RARA、AMLl-ETO、CBβl3-MYH11、TEL/AMLl、E2A/PBXl以及MLL融合基因等[1]。其中BCR-ABL融合基因最早在慢性髓系白血病细胞的费城染色体(Philadelphia Chromosome,Ph)中发现,由原癌基因ABL 与BCR 基因融合形成,编码的P210、P230 和P190 融合蛋白,具有酪氨酸激酶活性,通过激活下游多条信号通路使细胞显著转化[2-3]。BCR-ABL融合基因在约95%以上的慢性粒细胞白血病患者(chronic myelogenous leukemia,CML)和20%的急性淋巴细胞白血病患者(acute lymphoblastic leukemia,ALL)的白血病细胞中表达。BCR-ABL 融合蛋白的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)药物,如甲磺酸伊马替尼等,改善了慢性粒细胞白血病患者的生存期[4],因此BCR-ABL融合基因的检测具有重要的临床意义。
BCR-ABL融合基因的方法主要包括荧光原位杂交法、免疫印迹法、实时荧光定量PCR(realtime fluorescence quantitative PCR,RT-qPCR)法和测序法[5-7]等。本研究使用BCR-ABL 参考品,评价国内的BCR-ABL融合基因定性检测试剂盒(荧光PCR 法)的阳性参考品符合率、阴性参考品符合率、检出限和重复性项目,为该类试剂盒的性能评价提供技术基础。
1 材料与方法
1.1 研究对象
阳性参考品P1、P2 和P3 分别为P210、P230和P190 的BCR-ABL融合基因型样本,阴性参考品N1~N5 分别为HL-60、PML-RARa、MLL-AF9、TEL-AML 和E2A-PBX1 样本,重复性参考品WS1 和WS3 分别为高、低融合比例的P210 型样本,由中国食品药品检定研究院提供。
1.2 试剂
白血病融合基因检测试剂盒(荧光PCR 法)和高效血液总RNA 提取试剂盒(离心柱型),厦门致善生物科技股份有限公司;白血病相关15 种融合基因检测试剂盒(荧光RT-PCR 法)和TRIzol Reagent,苏州云泰生物医药科技有限公司;白血病相关融合基因检测试剂盒(RT-PCR 法)和TRIzol Reagent,上海源奇生物医药科技有限公司。
1.3 仪器
全自动医用PCR 分析系统,型号:SLAN-96S(上海宏石医疗科技有限公司);荧光定量PCR仪,型号:Bio-Rad CFX96(美国伯乐公司);荧光定量PCR 仪,型号:ABI 7500(美国赛默飞世尔科技公司)。
1.4 方法
使用试剂盒说明书中指定的RNA 提取试剂盒,提取参考品的RNA,并对RNA 的浓度和纯度进行测定。将阳性参考品P1、P2、P3 和阴性参考品N1 使用数字PCR 平台进行浓度标定,获得相应的拷贝数,用N1 将P1、P2、P3 分别稀释至融合基因为100 copies/反应的检测限参考品L1、L2、L3。使用白血病融合基因检测试剂盒对阳性参考品、阴性参考品、检测限参考品和重复性参考品进行PCR 扩增。使用不同平台的荧光定量PCR 仪进行检测,并使用仪器软件进行分析,获得样本的BCR-ABL融合基因的结果。对国内常见BCR-ABL融合基因型别的阳性参考品检测1次,行业标准中“阳性参考品符合率”要求结果应为阳性。对不含被测物和不在试剂盒宣称检测范围内融合基因型别的阴性参考品检测1 次,行业标准中“阴性参考品符合率”要求结果应为阴性。对于拷贝数不高于100 copies/反应的BCR-ABL融合基因检测限标准品检测1 次,行业标准中“检出限”要求结果应为阳性。对重复性参考品重复检测10 次,行业标准中“重复性”要求BCR-ABL 反应通道Ct 值的变异系数(CV,%)应≤5.0%或结果应为阳性。
2 结果
2.1 阳性参考品符合率
研究结果显示在三个试剂盒中,阳性参考品P1~P3 在BCR-ABL 反应通道扩增曲线有明显对数增长期且Ct 值<试剂盒的阳性Ct 界值,为BCR-ABL融合突变阳性。见图1。

图1 阳性参考品的BCR-ABL 融合基因结果Figure 1 Results of BCR-ABL fusion gene mutation for positive reference
2.2 阴性参考品符合率
本研究提供的阴性参考品包括BCR-ABL融合阴性的样本(N1)和其他白血病融合基因型别的样本(N2~N5)。结果显示阴性参考品N1~N5 在BCR-ABL 反应通道均没有扩增曲线,为BCR-ABL融合突变阴性,其中试剂盒B 的结果。见图2。
图2 阴性参考品的BCR-ABL 融合基因结果Figure 2 Results of BCR-ABL fusion gene mutation for negative reference
2.3 检出限
将阳性参考品P1~P3 稀释至融合基因为100 copies/反应的检测限参考品L1、L2、L3。结果显示检测限参考品L1、L2、L3 在BCR-ABL 反应通道扩增曲线有明显对数增长期且Ct 值<阳性Ct 界值,为BCR-ABL融合突变阳性,见图3。

图3 检测限参考品的BCR-ABL 融合基因结果Figure 3 Results of BCR-ABL fusion gene mutation for detection limit reference
2.4 重复性
统计结果显示重复性参考品WS1 在三个试剂盒的BCR-ABL 反应通道的Ct 值的变异系数(CV,%)分别为0.4%、0.5%和0.4%且为BCR-ABL融合突变阳性,WS3 在BCR-ABL 反应通道的Ct值的变异系数(CV,%)分别为1.8%、0.7%和0.4%且为BCR-ABL融合突变阳性,其中试剂盒B 的结果见图4。
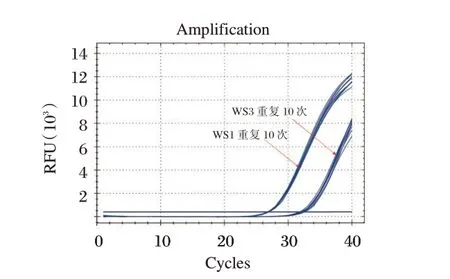
图4 重复性参考品的BCR-ABL 融合基因结果Figure 4 Results of BCR-ABL fusion gene mutation for reproducibility reference
3 讨论
白血病融合基因的检测,对白血病的正确分型、临床治疗指导和判断预后具有重要意义。其中BCR-ABL融合基因已成为白血病早期诊断、常规分子检测和药物监测的重要生物标志物[7-8]。微小残留病(MRD)是指白血病诱导化疗完全缓解后仍然残留在血液中的少量白血病细胞的状态,MRD 的监测对于预测白血病的复发和治疗方案的选择具有一定的指导意义。检测MRD 的方法包括多色流式细胞术、实时荧光定量PCR(RT-qPCR)和高通量测序法[9-10]。美国综合癌症网(National Comprehensive Cancer Network,NCCN)指南推荐采用实时荧光定量PCR 检测BCR-ABL融合基因评估Ph+ALL 患者的微小残留病[11],北美专家共识中优先推荐在骨髓标本中使用RT-qPCR 检测BCR-ABL融合基因作为监测MRD 的方法[12]。我国中国成人急性淋巴细胞白血病诊断与治疗指南(2016 年版)推荐MRD 的监测方法包括融合基因转录本的实时定量PCR 的检测,如BCR-ABL融合基因[13]。国家药品监督管理局批准的3 个白血病融合基因检测试剂盒(荧光PCR 法),定性检测人骨髓样本中白血病融合基因。目前我国尚无相关的标准对断裂点簇集区-艾贝尔逊白血病病毒(BCRABL)融合基因检测试剂盒的质量要求进行规范,对临床使用上的风险不易把控。为了提高产品的标准,本院负责《断裂点簇集区-艾贝尔逊白血病病毒(BCR-ABL)融合基因检测试剂盒》标准的制定工作。
本研究使用统一的参考品对白血病融合基因检测试剂盒(荧光PCR 法)的阳性参考品符合率、阴性参考品符合率、检出限和重复性项目进行评价。阳性参考品包含BCR-ABL融合基因主要型(p210)、次要型(p190)和微小型(p230),阴性参考品包括BCR-ABL融合阴性和其他白血病融合基因型别(PML-RARa、MLL-AF9、TEL-AML 和E2APBX1)的样本。BCR-ABL融合基因定性检测试剂盒用于检测CML 或ALL 患者中外周全血或骨髓样本中的BCR-ABL融合基因的转录水平。因为外周全血或骨髓样本需要经过RNA 提取,而且不同试剂盒的提取效率会有差异,不能对检出限进行绝对定量。我们根据目前国家药品监督管理局批准的白血病融合基因检测试剂盒的检测限要求,在标准中规定了定性试剂盒的检出限是拷贝数不高于100 拷贝/反应能检测出BCR-ABL融合基因突变阳性。本研究结果表明阳性参考品均检出BCR-ABL融合基因突变阳性,不高于100 拷贝/反应的检测限参考品均能检出BCR-ABL融合基因突变阳性,BCR-ABL融合基因突变阴性和其他白血病融合基因突变的阴性参考品均未检出BCR-ABL融合基因突变阳性,高和低融合比例的重复性参考品的BCR-ABL 反应通道Ct 值的变异系数(CV,%)均不高于5.0%且为BCR-ABL融合阳性。验证结果符合行业标准《断裂点簇集区-艾贝尔逊白血病病毒(BCR-ABL)融合基因检测试剂盒》中定性试剂盒的阳性参考品符合率、阴性参考品符合率、检出限和重复性要求,为该类试剂盒的技术指标设置的合理性和科学性提供了技术基础。本研究为行业标准的颁布实施,试剂盒的注册工作和上市后的监管工作提供了技术指导。
