基于红外光谱研究重离子辐射对牡丹幼苗生长的诱变效应
2023-09-07李秀丽陈法志阳永学陈志伟翟敬华戢小梅
李秀丽 陈法志 阳永学 陈志伟 陈 镇 翟敬华 刘 忠 戢小梅
(武汉市农业科学院林业果树研究所,湖北 武汉 430075)
牡丹(Paeonia suffruticosaAndr.)原产于中国,为芍药科芍药属多年生落叶灌木,极具观赏、药用和油用价值[1]。目前我国用于种植推广的油用牡丹是在产籽量和含油率上具有显著优势的凤丹牡丹(Paeonia ostiiFengdan)和紫斑牡丹(Paeonia rockii)2 个品种群[1],主要在我国安徽、河南、山东、湖北等地区种植,表现出极广泛的生态适应性[2]。但油用牡丹存在低产和花色花型单调等产业问题,限制了其应用推广。因此,培育优质高产的品种是油用牡丹产业持续发展的关键。
当前牡丹育种方式主要为自然杂交实生选种[3]、人工杂交育种[4]和诱变育种[5]。通过以上育种方式获得牡丹新品种周期较长且变异类型有限,需要进一步探索深化。重离子是一种新兴辐射诱变源,具有传能线密度高、辐射穿透力强等特点,其单位剂量诱变效率较X 射线和γ 射线的诱变效率高出10 倍,是一种有效的植物种质创新和品种改良途径[6-7]。目前,我国重离子辐射诱变育种主要集中在粮油作物及经济作物上[8-9],但在牡丹育种领域还鲜有研究,本研究将利用中能重离子对凤丹牡丹种子进行辐射,以期获得性状改良的突变体,为牡丹育种开辟新的途径。
研究表明,不同的重离子种类及其辐射剂量产生的诱变效应也不同[10],重离子可诱导基因位点变异[11]、关键靶分子DNA 链发生断裂及交联[12-13]。傅里叶变换红外光谱(fourier transformation infrared spectroscopy,FTIR)技术广泛应用于植物材料,如种子、花粉、叶片等[14-15]。多数有机物和无机物的基频吸收带都出现在中红外区(4 000~400 cm-1),FTIR 技术的优势在于利用中红外区不同基团的特征振动峰鉴定物质归属,包括碳水化合物、脂肪酸、氨基酸等生化物质。同时,可进一步进行分子构象分析,如蛋白质二级结构,从而详细分析不同条件下植物的生化组分变化规律[14-15]。此外,结合主成分分析(principal component analysis,PCA),将FTIR 复杂的数据集进行转换和可视化,得到相应的载荷图,同时借助聚类分析获得更多更直接的相关信息[16]。鉴于此,本试验以凤丹牡丹为研究对象,借助FTIR 技术分析重离子辐射对种子幼苗叶片生化组分的调控规律,并通过PCA 探索重离子辐射剂量效应,以期从光谱学角度解析重离子辐射对凤丹牡丹种子的诱变机制,为进一步探索油用牡丹的资源创制提供理论基础。
1 材料与方法
1.1 材料与试剂
本试验所用的凤丹牡丹种子为当年采收于武汉市农科院林业果树研究所种质资源圃,自然阴干后,存放于室内阴凉干燥处,种子含水量8.92%,含油率22.73%,千粒重223.50 g,试验中所用叶片源自种子辐射后形成的一年生辐射苗。溴化钾(分析纯),购于国药集团化学试剂有限公司。
1.2 仪器与设备
PGJ-10/20-AS 品冠(超)纯水机,武汉品冠仪器设备有限公司;DW-86L626(2013 款)超低温保存箱,青岛海尔集团;DHG-9148A 电热恒温鼓风干燥箱,上海精宏实验设备有限公司;SCIENTZ-10N 冷冻干燥机,宁波新芝生物科技有限公司;VERTEX 70 红外光谱仪,德国布鲁克公司。
1.3 试验方法
1.3.1 辐射处理 借助中科院近代物理研究所的兰州重离子加速器装置(heavy ion research facility in Lanzhou,HIRFL),利用中能重离子束12C 对凤丹牡丹(Paeonia ostiiFengdan)种子进行辐射诱变处理,辐射剂量率20 Gy·min-1,根据处理的时间长短来固定累积剂量:10、20、40、60、80、100、120、150、200 和300 Gy,共计10个剂量组和1个对照组(0 Gy)。
1.3.2 出苗率 取不同辐照剂量牡丹种子各100 粒,10月中旬沙藏后,每组选取30粒种子,每处理3组重复,播种于穴盘中,置于避雨棚,日温14~16 ℃,夜温5~7 ℃,湿度60%~70%,光照强度8 000~12 000 Lux,光照时间12 h·d-1,每4~5 d 用喷壶淋水,保证基质湿润,培养至2 月下旬,统计出苗率。将芽苗移栽至圆筒状生物降解性无纺布袋中,袋高16 cm,直径12 cm,培养基质泥炭、珍珠岩、蛭石、鸡粪体积比为6∶1∶1∶2,日温23~25 ℃,夜温12~14 ℃,湿度60%~70%,光照强度8 000~12 000 Lux,光照时间12 h·d-1,并根据幼苗生长情况统一进行浇水、施肥、除草以及病虫害防治管理。
1.3.3 形态指标测量 在5 月份牡丹生长期,利用直尺测定不同12C重离子辐射剂量的一年生实生苗株高、叶片长度、宽度,每处理测定3 株,每株测定3 次,取其平均值,并计算叶片长宽比。
1.3.4 傅里叶变换红外光谱(FTIR)表征 分别取不同12C重离子辐射剂量的凤丹牡丹叶片,每处理3 个重复,将叶片先后用清水和去离子水(>18 MΩ)清洗,用液氮研磨成粉末后,真空冷冻干燥12 h。取1~2 mg干燥的样品与200 mg干燥的溴化钾置于玛瑙研钵中,研成均一细粉,并取少量压片,利用红外光谱仪,以空气为参比,选用4 cm-1的分辨率,扫描128次;波数范围为400~4 000 cm-1[15,17]。
1.4 数据处理
利用Origin 8.0 统计软件对FTIR 原始数据作图,计算峰值强度比值:RⅠ(A 2 951 cm-1/A 2 858 cm-1),RⅡ(A 1 547 cm-1/A 1 656 cm-1),RⅢ(A 1 547 cm-1/A 3 296 cm-1),RⅣ(A 1 083 cm-1/A 1 547 cm-1),RⅤ(A 1 741 cm-1/A 1 458 cm-1),RⅥ(A 1 741 cm-1/A 1 547 cm-1),R Ⅶ(A 1 458 cm-1/A 1 547 cm-1)。并对氨基I 区域(1 700~1 600 cm-1)的曲线进行高斯单峰正态分布的曲线拟合,再依据不同蛋白质二级结构的特征峰位,对拟合曲线进行高斯多峰拟合,从分峰拟合结果中得到每种蛋白质二级结构所对应的峰面积,依据各峰峰面积借助Excel 2010 计算蛋白质二级结构所占的比例,利用Origin 8.0 统计软件作图。借助SPSS 22对FTIR 图谱进行主成分和载荷图分析,并进一步使用SPSS 22 对不同12C 重离子辐射剂量下的牡丹叶片FTIR 图谱进行聚类分析,聚类方法选择组间连接法,区间选择欧式距离(euclidean distance)。此外,研究中所需要的其他数据借助Excel 2010 和Origin 8.0 统计软件进行分析。
2 结果与分析
2.1 重离子辐射对凤丹牡丹出苗率及一年生苗主要农艺性状的影响
与对照相比,经12C6+重离子辐射后,凤丹牡丹的出苗率显著降低,当辐射剂量为10 Gy 时,出苗率从90.00%下降至57.78%,当辐射剂量增大至20 Gy 时,出苗率下降至34.44%,当辐射剂量大于20 Gy 时,出苗率仅为10.00%左右,但40~300 Gy 剂量下的出苗率并无显著性差异(表1)。进一步借助SPSS 22 对12C6+重离子辐射剂量和种子出苗率进行Probit回归分析,发现牡丹种子的半致死剂量为14.47 Gy,介于10~20 Gy之间。不同12C6+重离子辐射剂量对株高的影响也不同(表1),与对照相比,重离子辐射抑制了牡丹生长,尤其当辐射剂量为80 和100 Gy 时,株高显著下降,分别从11.10 cm 下降至6.68 和5.20 cm。此外,重离子辐射诱导叶片产生畸形(图1),如叶裂数增多、叶裂深度增加、叶片颜色变浅、厚度变薄、发生皱缩等现象,尤其是当辐射剂量在80 和120 Gy 时,叶片皱缩现象明显。对于与叶片形状相关的叶长、叶宽而言,辐射抑制了叶片长和宽的正常生长,对叶片长宽比的诱导效果不显著(表1)。当辐射剂量为80 Gy 时,重离子辐射显著抑制了叶宽的形成;当辐射剂量为100 Gy 时,叶片的长度和宽度均受到显著抑制。
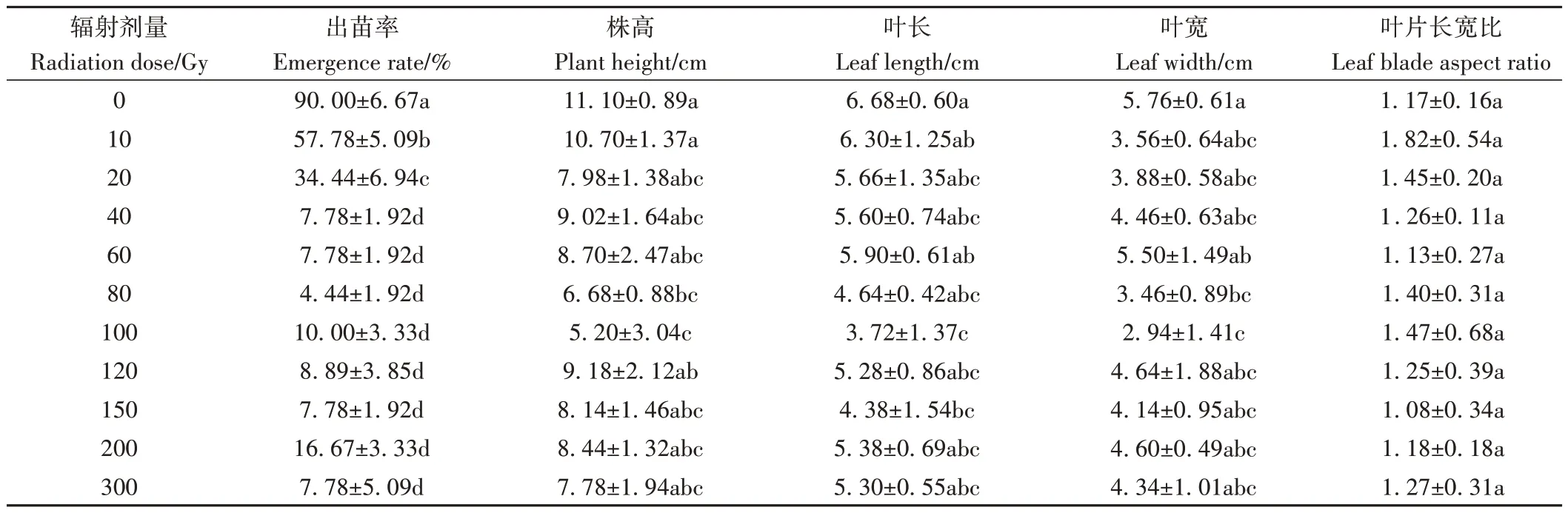
表1 不同12C6+重离子辐射剂量对凤丹牡丹表型的影响Table 1 Effects of different doses of 12C6+ heavy ion radiation on the phenotype of Fengdan peony

图1 不同12C6+重离子辐射剂量对叶片畸形程度的影响Fig.1 The degree of leaf deformity induced by different doses of 12C6+ heavy ion radiation
2.2 FTIR光谱特征
图2为不同12C6+重离子辐射剂量处理后凤丹牡丹叶片的FTIR 图谱。结果发现,不同辐射剂量的叶片存在12 个典型的共有峰,具体如下:在3 428 cm-1处存在强且宽的振动峰,该峰峰形不对称,表明该区域存在O—H或N—H伸缩振动的重叠,说明叶片中含有类胡萝卜素、酰胺和碳水化合物等物质[18]。2 921和2 846 cm-1分别为CH2反对称和对称伸缩振动,主要来源于脂质、蛋白质、碳水化合物等生化物质的CH2基团[18]。1 720 cm-1处为酯类物质的C=O 伸缩振动,与对照相比,当辐射剂量在40~80 Gy之间时,峰强明显减弱,其他辐射剂量时,峰强变化不明显,甚至在10 Gy时,峰强出现增强趋势。与辐射对1 720 cm-1处振动峰峰强影响规律相似的是位于1 212 cm-1处的振动峰,该峰主要源于木质素中芳香C—H面内变形振动[19]。1 629 cm-1处的强振动峰来源于氨基Ⅰ中C=O和C—N 伸缩振动[20],该峰峰位和峰强在重离子辐射下发生了较大变化,当辐射剂量为10和60 Gy时,峰位向低波数移动至1 617 cm-1,当辐射剂量为80 Gy时,峰位向高波数移动至1 645 cm-1,辐射剂量为10和200 Gy时,峰强明显变弱。在1 636 cm-1附近的1 545 cm-1处存在一个振动强度较弱的肩峰,主要是由氨基Ⅱ中C—N伸缩振动引起的[21],在10、200和300 Gy时峰强增强,在40~60 Gy时峰强减弱,几近消失。1 453 cm-1为CH3和CH2反对称变形弯曲振动,主要来源于蛋白质、脂类、木质素等物质[22]。1 395 cm-1为脂肪和氨基酸中COO-对称伸缩振动[23],1 320 cm-1为氨基Ⅲ中C—N伸缩振动和C—N—H面内弯曲振动[24],当辐射剂量为10、200 Gy时,1 395 cm-1处的尖峰变成了1 320 cm-1处的肩峰。1 052 cm-1处振动峰分别由C—O伸缩振动,C—O—C对称伸缩振动,C—H变形振动引起,主要来源于纤维素、无定形纤维素、半纤维素[19],当辐射剂量为20~60 Gy 时,该峰峰强减弱。这些特征峰的波数、振动模式和归属详见表2。
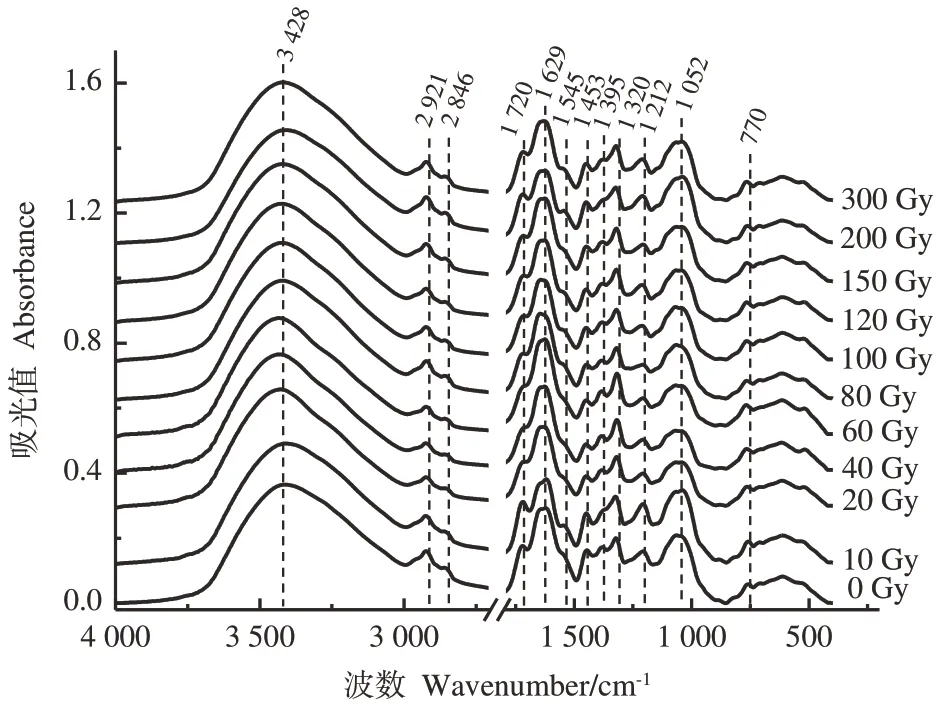
图2 不同12C重离子辐射剂量下叶片FTIR图谱的比较Fig.2 Comparative FTIR spectra of leaves induced by different 12C heavy ion radiation doses

表2 FTIR图谱的主要峰位及其归属Table 2 Wavenumber and assignment of the main peaks in the FTIR spectrum
2.3 FTIR的峰值强度比值变化规律
为了深入分析不同12C6+重离子辐射剂量处理后叶片生化组分的变化趋势,进一步对FTIR 图谱中7 种峰值强度的比值进行了分析(图3)。RⅠ表示蛋白质甲基与亚甲基吸收强度之比,与对照相比,12C6+重离子辐射使凤丹牡丹叶片RⅠ比值升高,表明重离子辐射促进了叶片蛋白质甲基的形成。RⅡ值的变化由总蛋白含量的变化引起,RⅢ通常用来指示叶片中氨基Ⅱ和氨基A蛋白的含量。12C6+重离子辐射后,凤丹牡丹叶片中RⅡ和RⅢ呈现相同的变化趋势:与对照相比,辐射降低了RⅡ和RⅢ值,当辐射剂量介于0~40 Gy 之间时,RⅡ和RⅢ随辐射剂量的增加迅速降低,辐射剂量持续增加至300 Gy时,RⅡ和RⅢ出现短暂升高后缓慢下降并逐渐平稳的趋势。结果表明:重离子辐射抑制了叶片中氨基Ⅱ和氨基A 蛋白的形成,并抑制了总蛋白的合成。RⅣ表示糖蛋白的变异性,从结果可以看出重离子辐射使叶片中糖蛋白的变异度增加,即当辐射剂量为10 Gy时,RⅣ显著增加,随后出现急剧下降和缓慢下降趋势,当辐射剂量为80~200 Gy时,RⅣ呈现逐渐增加趋势,并在200 Gy 时达到最高值,300 Gy 时,RⅣ有所下降,但也显著高于其他的辐射剂量。RⅤ的变化归因于脂类的氧化程度,当辐射剂量为0~40 Gy 时,RⅤ值随辐射剂量的增加而增加,之后逐渐下降并趋于平缓,总体而言,重离子辐射促进了脂类氧化程度的增加。RⅥ和RⅦ的变化趋势相同,呈现出先增加后减少再缓慢增加直至平稳的趋势,表明凤丹牡丹受重离子辐射后,尤其在10 和200 Gy 时,叶片出现脂类降解现象,该现象由羰基形成所致。
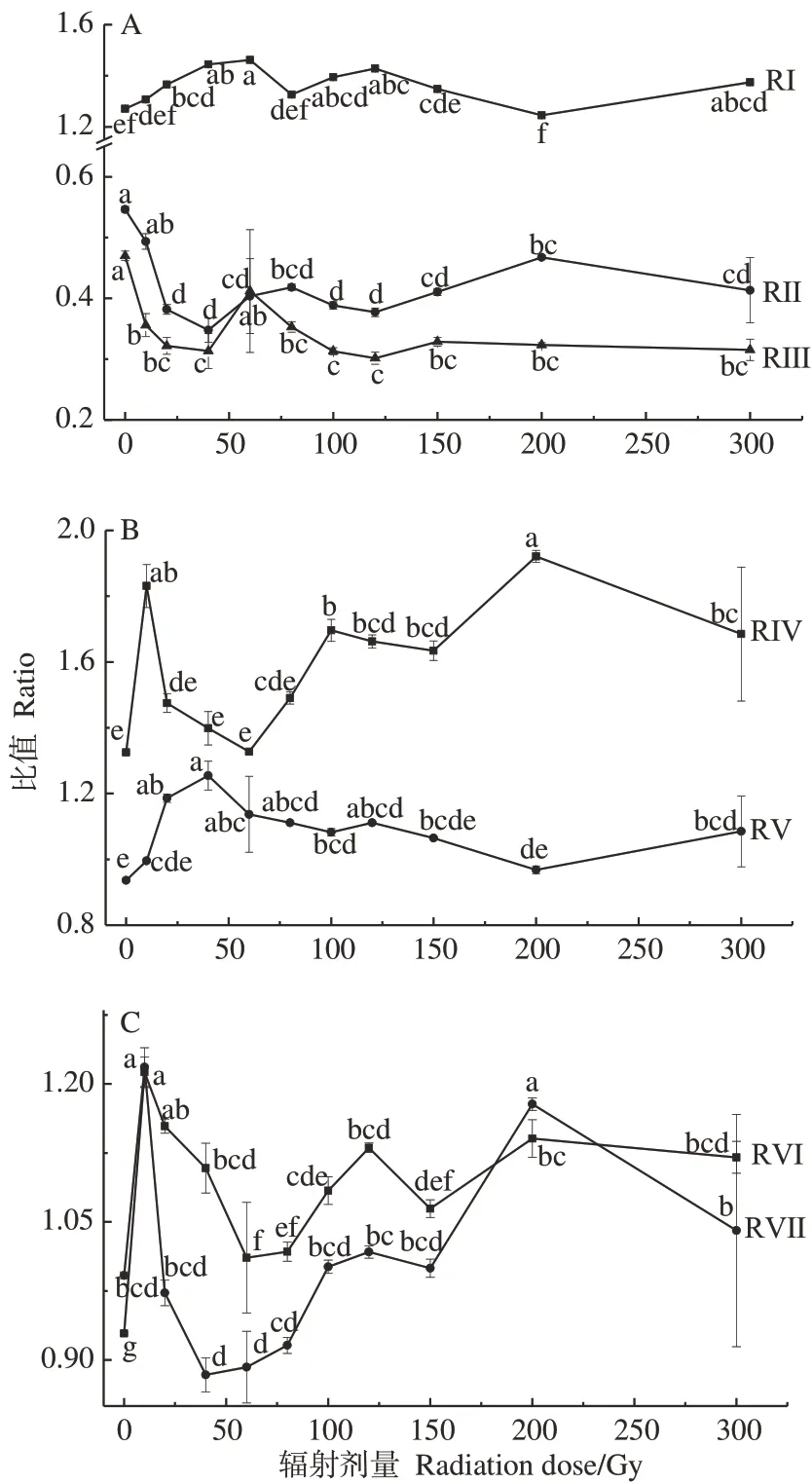
图3 不同波数峰值强度的比值Fig.3 Ratio of peak intensities of the bands at different wavenumbers
2.4 FTIR的蛋白质二级结构分析
蛋白质的二级结构主要影响FTIR 中氨基Ⅰ区域(1 700~1 600 cm-1)图谱的形貌,每种二级结构分别对应不同的FTIR 峰位:β-折叠(β-sheet,β)+侧链(side chain,S)+果胶(pectin,P)为1 615 cm-1,β 为1 635 cm-1,无规卷曲(random coil,R)为1 648 cm-1,α-螺旋(α-helix,α)为1 654 cm-1,环(loop,L)+转角(T,turn)为1 670 cm-1[14-15]。根据上述蛋白质二级结构的峰位对1 600~1 700 cm-1范围的FTIR 图谱进行高斯多峰拟合,结果如图4 所示。重离子辐射后的β+S+P 含量小于对照组,呈现先下降后上升再逐渐平稳的变化规律。其他4 种蛋白质二级结构的含量均表现为剂量组高于对照组。与对照相比,当辐射剂量为100 和200 Gy 时,显著促进了蛋白二级结构β 的形成(图4-A);当辐射剂量为10 Gy时,R含量显著增加(图4-A);当辐射剂量为10、20、120 和200 Gy 时,α 结构均显著增加(图4-B);重离子辐射显著提高了L+T 的形成,但不同重离子辐射剂量下L+T 含量无显著性差异(图4-B)。
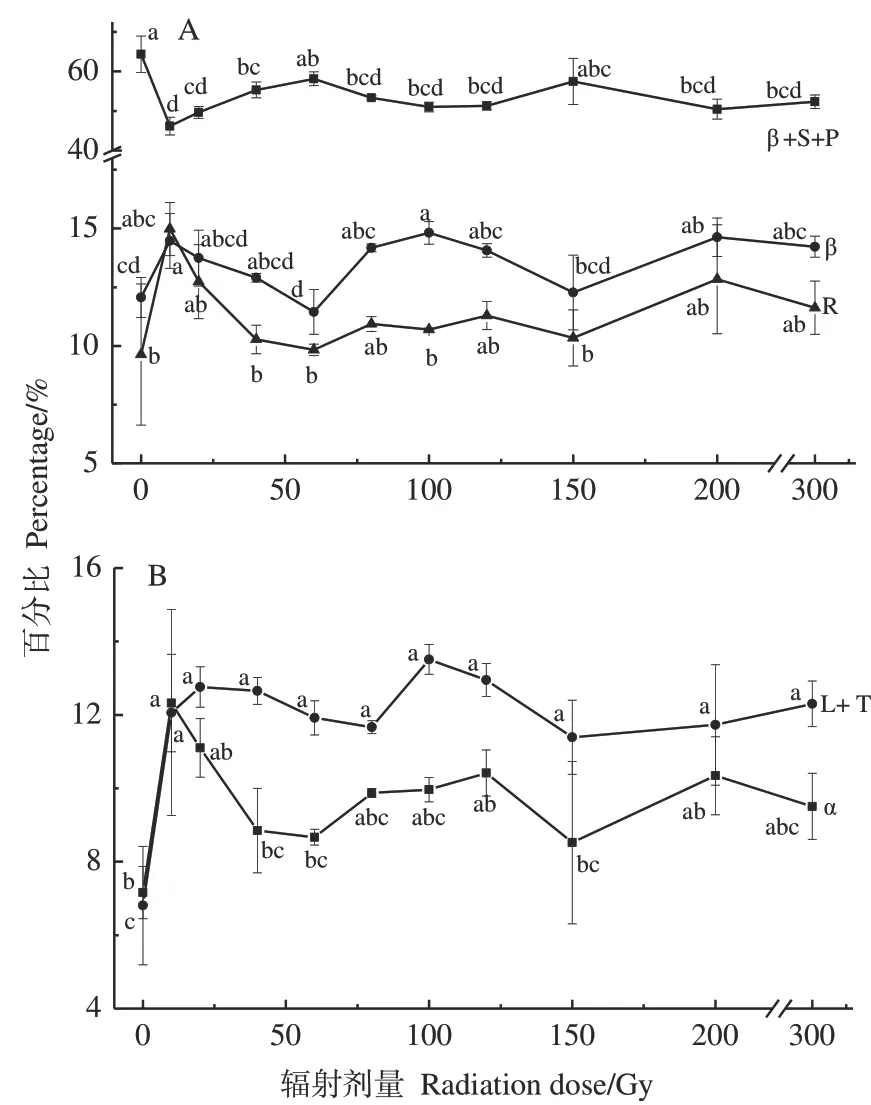
图4 基于高斯多峰拟合分析不同12C6+重离子辐射剂量下叶片蛋白质二级结构的百分比Fig.4 The percentage of protein secondary structure of leaves induced by different doses of 12C6+ heavy ion radiation based on multi-peaks Guassian fitting
2.5 FTIR的PCA分析
进一步将FTIR 谱图分为4 个波束范围,分别以降维方式对其进行主成分分析,结果如图5所示。在4个波数范围内,提取的两个主成分均包含了总方差99%以上的光谱信息,且第1主成分占总方差的99%左右,同一处理的3 个重复在第一组成分中能够较好地归类在一起,不同处理间存在分离和聚集现象。因此,本研究重点关注处理组和对照组在第1 主成分中的信息。主成分载荷图能够显示不同变量对主成分的贡献大小,从而获取更多样品的差异信息(图6)。结合图5和图6可以看出,在3 050~2 800 cm-1波数范围内,200 Gy辐射剂量处理的叶片得分较高;20、40 和60 Gy 处理的叶片得分较低,其他辐射剂量与对照组的得分相似,均得分居中(图5-A)。第1 主成分主要捕获了2 923 cm-1处峰值信息,表明该波数范围内样品间的差异主要来自于脂质、蛋白质和碳水化合物等含量的差异(图6-A)。在其他3 个波数范围1 700~1 600 cm-1(氨基Ⅰ区域)、1 600~1 300 cm-1和1 250~750 cm-1,对照组与剂量组之间也存在样品的聚集与分离现象,20、40 和60 Gy 辐射后的样品得分较高,200 Gy辐射后的样品得分较低;其他辐射剂量与对照组的样品得分居中(图6-B~D)。氨基Ⅰ区域中,1 649 cm-1附近的吸收峰对第1 主成分的贡献较大,氨基Ⅰ区域的差异主要来源于蛋白质二级结构α-螺旋和无规卷曲。1 600~1 300 cm-1波束范围内,1 488、1 362 和1 315 cm-1附近的吸收峰对第1 主成分的贡献较大,主要是来自蛋白质、脂肪酸和氨基Ⅲ等化合物。1 250~750 cm-1波数范围内,第1 主成分主要包含了1 203、1 019和777 cm-1附近的吸收峰,其化学成分主要为纤维素、半纤维素、木质素等碳水化合物。综上所述,样品间第1主成分的差异性主要源于碳水化合物、蛋白质和脂肪等物质成分的含量和结构,能反映凤丹牡丹红外光谱的主要信息。
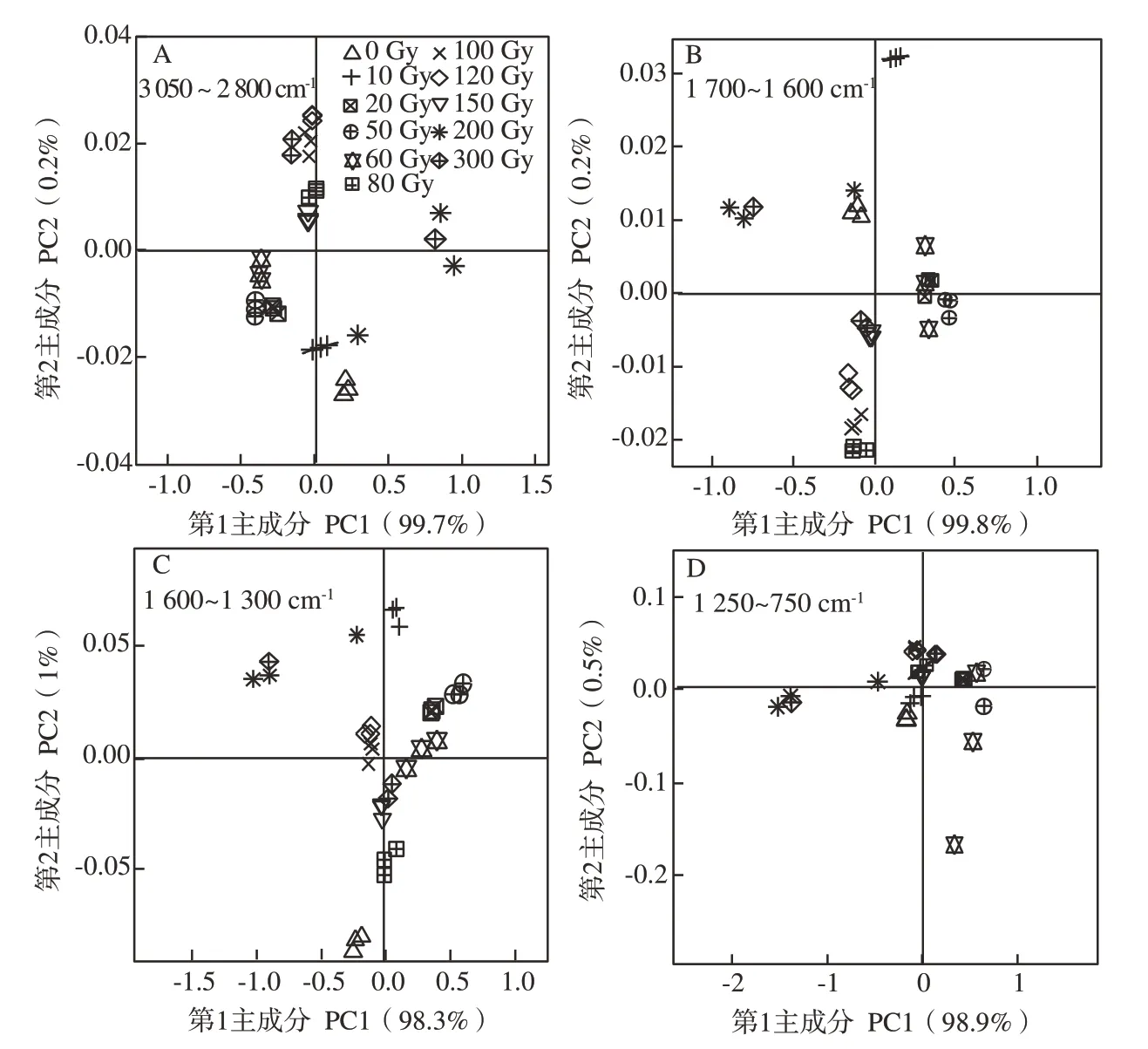
图5 不同12C6+ 重离子辐射剂量下叶片FTIR图谱的主成分分析Fig.5 PCA analysis of FTIR spectra of leaves induced by different doses of 12C6+ heavy ion radiation

图6 PC1(实线)和PC2(虚线)载荷图Fig.6 Plot of loadings corresponding to PC1 (solid line) and PC2 (dotted line)
2.6 FTIR的聚类分析
对凤丹牡丹叶片4 个波数范围的光谱进行聚类分析,将样品进行有效分离,并用树形图直观显示样品间的聚类情况(图7)。当距离为5 时,在3 050~2 800 cm-1(脂质区域)、1 600~1 300 cm-1和1 250~750 cm-1(多糖区域)波数范围内,不同12C6+重离子辐射剂量的叶片可以分为3个表征群:0、10、80、100、120、150、300 Gy聚为一类,20、40、60 Gy 聚为一类,200 Gy 单独聚为一类(图7-A、C、D);在1 700~1 600 cm-1(氨基Ⅰ区域)波数范围,不同辐射剂量的叶片可聚为3 类:0、80、100、120、150、300 Gy聚为一类,10、20、40、60 Gy聚为一类,200 Gy 单独聚为一类(图7-B),聚类结果与主成分分析结果相符。可见,与对照相比,80、100、120、150、300 Gy辐射下凤丹牡丹叶片的化学成分变化不大,10、20、40、60 Gy 辐射剂量下叶片的化学成分相似但明显不同于对照组,而200 Gy 辐射剂量下叶片的化学物质的变化较大,出现单独聚类现象。

图7 不同12C6+重离子辐射剂量下叶片FTIR图谱的聚类分析Fig.7 Cluster analysis of FTIR spectra of leaves induced by different doses of 12C6+ heavy ion radiation
3 讨论
3.1 重离子辐射对凤丹牡丹表型的诱变效应
前人研究表明,诱变效应存在物种特异性[9,27],重离子辐射可抑制黄花蒿和玉米的出苗率[6,10],有助于培育矮化、耐密型品种[6]。而本研究发现12C6+重离子对凤丹牡丹的辐射效应较为复杂,主要表现为损伤和抑制效应:重离子辐射能显著抑制出苗率,抑制株高和叶片的正常生长,造成叶片皱缩畸形。当辐射剂量介于10~20 Gy之间时,对牡丹幼苗的抑制效应较小。
3.2 重离子辐射对叶片生化组分及其形成机制的影响
重离子辐射也影响着植物体内主要生化成分的组成与含量[28-29]。FTIR 技术能克服传统化学测试的复杂性,检测不同环境下植物叶片生化组分的结构和组成,明确样品间生物大分子的差异[15-16]。本研究首次借助FTIR 技术,分析了重离子辐射对凤丹牡丹叶片主要化学成分的影响规律。
首先,重离子辐射对叶片细胞壁多糖和木质素存在正、负双重诱导效应。1 052 cm-1代表纤维素、无定形纤维素和半纤维素的振动[19],1 212 cm-1为木质素的振动峰[19]。当辐射剂量为10 Gy 时,这两处峰峰强均增强,40~150 Gy 时,峰强均减弱。研究表明重离子辐射会破坏纤维素Ⅰ的非结晶区及结晶区Ⅰα到Ⅰβ晶相转变时的超微结构,从而抑制纤维素的有序组装[30]。重离子辐射促进了糖蛋白变异(RⅣ),糖蛋白能够调控细胞壁多糖的有序沉积,从而调控细胞的生长与分化,影响叶片形态[31]。当辐射剂量为40~200 Gy 时,叶片出现不同程度的畸形,极有可能由于重离子辐射诱导糖蛋白发生变异,抑制了细胞壁多糖的有序沉积,从而调控牡丹幼苗叶片的形态特征。
其次,重离子辐射调控了叶片上蛋白质及其二级结构的形成。1 395 cm-1处为氨基酸的振动峰[23],该峰对低高剂量辐射较为敏感。氨基Ⅰ的振动峰在1 629 cm-1附近[20],常用来预测蛋白质二级结构[17]。该峰在10、80 和100 Gy 时,峰位移动,峰型发生变化,且在10 和200 Gy 时,峰强减弱。1 545 cm-1处为氨基Ⅱ的振动峰[21-22],该峰在40、60和200 Gy时峰强减弱,在低剂量10 Gy 和高剂量200 Gy 时峰强增强,表明重离子辐射对氨基Ⅱ存在正、负双重诱导效应。氨基Ⅱ与氨基Ⅰ类似,其振动峰的峰型和强度取决于蛋白质的骨架结构。1 320 cm-1为氨基Ⅲ的振动峰[32],可用于蛋白质二级结构分析[24]。当辐射剂量为10、200 Gy 时,该峰峰强变弱。由此推测,重离子辐射能改变凤丹牡丹幼苗叶片上蛋白质主链分子构象,从而调控蛋白质二级结构。有研究发现蛋白质二级结构中α-螺旋与蛋白质-水之间氢键的多少有关,β-折叠与植物体内ATP 的存在形式有关,当ATP 为游离状态时,β-折叠含量较高,当ATP被修饰后,使β-折叠含量降低[14]。本研究发现重离子辐射促进了蛋白质二级结构中α-螺旋和β-折叠的形成,可见重离子辐射能增加蛋白质与水的结合力,促进ATP以游离态存在,可为植物生长发育提供动力。有研究表明蛋白质的生物活性往往由氨基酸侧链所决定[33],氨基Ⅲ振动峰除与蛋白质骨架结构存在相关性外,与侧链结构也存在相关性[34]。本研究发现重离子辐射促进了蛋白质侧链上甲基的形成(RⅠ)。蛋白质侧链的甲基化与蛋白质-蛋白质、蛋白质-DNA 或蛋白质-RNA的相互作用相关,影响着蛋白质的结构稳定性及亚细胞定位[35]。由此可见,重离子辐射对牡丹幼苗叶片上蛋白质的结构和功能具有重要调控作用。
此外,1 395 cm-1处也代表脂肪酸中COO-对称伸缩振动[23],结合吸光度比值分析发现,重离子辐射促进了代表脂质氧化程度的RⅤ、RⅥ和RⅦ值的增加。由此推测,重离子辐射通过促进牡丹幼苗叶片脂肪的氧化降解,从而抑制叶片上脂肪的积累,调控脂肪酸代谢。本研究主要探讨了重离子辐射对牡丹M1 代幼苗的诱变效应,下一步将继续研究重离子辐射对M1 代植株开花结果特性的影响,同时对M2 代植株的相关性状进行测定,从可遗传变异角度深入分析重离子辐射对牡丹的诱变效应及其作用机制。
4 结论
12C6+重离子辐射对凤丹牡丹幼苗生长和生化组分特性有重要影响,主要表现为损伤和抑制效应。半致死剂量介于10~20 Gy,该剂量范围对叶片形态的影响相对较小;能促进细胞壁多糖的有序组装,调控蛋白质的骨架结构及侧链结构,有助于维持细胞结构和功能;并且样品能与对照组进行有效分离。因此,推荐10~20 Gy作为牡丹12C6+重离子辐射育种的适宜诱变剂量区间。
