黔中黄壤溶磷细菌溶磷特性及对土壤微生物碳循环基因的影响
2023-09-04乔志伟张永杰谢梅芳
乔志伟,张永杰,谢梅芳
(1.安顺学院农学院,贵州 安顺 561000;2.安顺学院资源与环境工程学院,贵州 安顺 561000;3.贵州省高校乡村振兴研究中心,贵州 安顺 561000)
磷是植物生长最重要的营养元素之一[1],由于在土壤中易累积导致其利用率较低。溶磷细菌在促进土壤磷有效化过程中具有重要作用[2-4],因此,关于溶磷微生物的研究是土壤磷研究的热点方向。碳是微生物有机体的能源物质,也是重要的结构物质,微生物介导的碳循环是地球物质循环的重要组成部分,其微生物驱动机制和关键功能基因是重要研究内容[5]。在不同碳源条件下,微生物溶磷能力差异较大[6-7],因此,研究不同碳源条件下溶磷细菌的溶磷特性具有重要意义。
外源磷添加可以通过改变木质素和微生物残体分解[8]、土壤呼吸[9]、团聚体稳定性[10]等影响土壤有机碳的转化。土壤微生物碳循环基因丰度与碳合成、分解等有密切关系[11],宏基因组学及碳水化合物活性酶(CAZY)数据库的不断完善为全面研究微生物碳循环基因提供了前提条件。溶磷细菌可以增加土壤有效磷含量[12-14],在溶磷微生物作用下导致的土壤有效磷增加对碳循环基因的影响需要进一步探讨。然而,通过宏基因组学探讨溶磷细菌对微生物碳循环基因影响的研究尚未见报道。鉴于此,拟以从贵州省安顺市农田土壤中筛选到的伯克霍尔德菌(Burkholderiasp.)QZW-3、假单胞菌(Pseudomonassp.)QZY-5、中 华 根 瘤 菌(Sinorhizobiumsp.)QZY-6共3株溶磷细菌为试验菌株,研究菌株在不同碳源、氮源条件下的溶磷特性,分析菌株对土壤养分和微生物碳循环基因的影响,以期为探究溶磷细菌对土壤微生物碳循环的影响及加强溶磷细菌的应用提供参考。
1 材料和方法
1.1 试验菌株
黔中黄壤溶磷细菌QZW-3、QZY-5、QZY-6 保存于安顺学院微生物实验室,分离自贵州省安顺市农田土壤中,经初步试验发现,其有较强的溶磷能力,分别属于伯克氏菌属(Burkholderia)、假单胞菌属(Pseudomonas)和根瘤菌属(Sinorhizobium)。
1.2 室内培养试验
1.2.1 菌株活化培养基 菌株活化培养基(牛肉膏蛋白胨培养基):牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g、蒸馏水1 000 mL,调节pH 值使其介于6.5~7.5。
1.2.2 溶磷能力测定培养基 溶磷能力测定培养基(NBRIP):葡萄糖10.0 g、磷酸三钙5.0 g、氯化镁5.0 g、硫酸镁0.25 g、硫酸铵0.1 g、氯化钾0.2 g、磷酸三钙(磷矿粉或磷酸铝)5.0 g,蒸馏水1 000 mL,调节pH值使其介于6.5~7.5。
1.2.3 菌株活化 将保存于4 ℃冰箱中的菌株取出,接种在灭菌冷却后的活化培养基上培养24 h,备用。
1.2.4 菌株对磷酸三钙、磷酸铝、磷矿粉的溶解能力测定 选择磷酸三钙、磷酸铝、磷矿粉等作为难溶态磷酸盐模拟土壤中的主要难溶态磷(三钙磷、铝磷、十钙磷),评价菌株对难溶态磷酸盐的溶磷能力。将配制好的NBRIP 培养液分装在250 mL 三角瓶中,每瓶装培养液100 mL,灭菌后冷却,将活化好的菌液1 mL接种于冷却后的NBRIP培养液中,振荡培养7 d。离心后取上清液测定培养液中有效磷含量,并设置不接菌的灭菌培养液作为空白对照,根据接种菌株培养液有效磷含量和空白培养液有效磷含量的差值计算菌株对难溶态磷酸盐(磷酸三钙、磷酸铝、磷矿粉)的溶解能力。每个处理(包含空白对照)设置3次重复。
1.2.5 不同碳源条件下菌株溶磷能力测定 在NBRIP 培养基(难溶态磷酸盐为磷酸三钙)中,分别以淀粉、乳糖、木糖、甘露醇、麦芽糖、蔗糖、纤维二糖、鼠李糖、葡聚糖等9 种糖类等质量替换葡萄糖。以上述10 种糖类(9 种糖类+葡萄糖)物质组合作为碳源,各糖类质量之比为1∶1,组合碳源加入量为10 g∕L,接菌(菌液与培养液体积比为1∶100)振荡培养7 d,并设置不接菌的空白对照,每个处理重复3次。培养结束后测定培养液有效磷含量,分析不同碳源对菌株溶磷能力的影响。
1.2.6 不同氮源条件下菌株溶磷能力测定 在NBRIP 培养基(难溶态磷酸盐为磷酸三钙)中,以葡萄糖为碳源,以硝酸钾、氯化铵、硝酸铵、硝酸钠为氮源替换硫酸铵(氮的物质的量相同),接菌(菌液与培养液体积比为1∶100)振荡培养7 d,并设置不接菌的空白对照,每个处理重复3 次。培养结束后测定培养液有效磷含量,分析不同氮源对菌株溶磷能力的影响。
1.2.7 培养液有效磷含量测定 取培养液,离心后取上清液1 mL,通过碳酸氢钠浸提-钼锑抗比色法测定培养液有效磷含量。
1.3 盆栽试验
1.3.1 试验土壤 将采集于贵州省安顺市西秀区的农田土壤风干后过2 cm 筛备用。土壤基本性质:pH 值4.23、碱解氮含量137.12 mg∕kg、有效磷含量79.65 mg∕kg、速效钾含量318.10 mg∕kg、全氮含量2.45 g∕kg、全磷含量0.91 g∕kg、全钾含量28.02 g∕kg、有机质含量39.03 g∕kg。
1.3.2 试验设计 将过筛后的土壤装盆,每盆装5 kg,共设置6 个处理:CK(不添加任何物质)、基质(M)、QZW-3、QZY-5、QZY-6、QZW-3+QZY-5+QZY-6(COM),每个处理重复3 次。其中,M 处理为施用腐熟好的鸡粪有机肥,含N 1.95%、P2O51.01%、K2O 2.31%;QZW-3、QZY-5、QZY-6这3个处理为菌株活化后菌液与基质按照1∶9(菌液体积与基质质量比为1∶9)混匀而配制成对应的菌肥;QZW-3+QZY-5+QZY-6(组合菌株)为3 株菌株混合后菌液与基质按照1∶9(菌液体积与基质质量比为1∶9)混匀而配制成的组合菌肥。除CK 外,其余各处理按试验设计加入对应的肥料,加入量为每盆20 g。
将肥料与土壤充分混匀,每盆移栽3株油菜(品种为上海青),放置在实验室内60 d,定期管理。油菜成熟后采摘测定油菜鲜质量,并采集表层新鲜土样100 g 左右,除去杂草等杂质放置于塑封袋中。部分样品放在干冰中寄送至上海生工生物工程有限公司,进行土壤宏基因组测序;剩余的土样风干后过筛,进行土壤养分的测定。
1.3.3 土壤养分测定 土壤有效磷含量采用0.5 mol∕L 碳酸氢钠溶液浸提、钼锑抗比色法测定[15];pH值通过pH 计直接测定(采用水土比为1∶1)[15];土壤有机质含量采用重铬酸钾容量法测定[15]。
1.3.4 土壤微生物碳循环基因分析
1.3.4.1 土壤DNA 提取和宏基因组测序 称取土样0.5 g,使用E.Z.N.A Mag-Bind Soil DNA Kit 试剂盒(Omega,M5635-02,USA),按照说明提取微生物总群落基因组DNA,使用Qubit 4.0(Thermo,USA)测量DNA 质量浓度。取500 ng DNA 样品进行宏基因组测序,采用Illumina NovaSeq 6000 高通量测序平台完成。
从春天查到冬天,半年多的时间过去了,案子再次搁浅。王敬凯不得不从另一角度对破案工作作出安排:对匿名信及3张纸条纸的来源和玻璃药瓶的来源进行调查。
1.3.4.2 宏基因组序列分析 测得的原始数据使用Trimmonmatic 进行过滤处理,默认参数值Q20(质量值≥20 的碱基),去除得分低于20 的低质量序列,得到Clean 数据;使用基于De Bruijn graph 原理的拼接软件IDBA_UD 对优质的read 进行拼接组装,获得contig;选择100 bp 以上的基因,翻译出蛋白质序列。将所有预测出来的基因序列,用CD-HIT 软件进行聚类(设置参数为95%相似度、90%覆盖度),构建非冗余基因集[16]。
1.3.4.3 碳水化合物活性酶注释分析 通过HMMER3 将翻译出的蛋白质序列与CAZY 数据库比对,得到其相应的碳水化合物活性酶注释,筛选条件E-value<1e-5,并统计CAZY 各功能层级的丰度。
1.4 数据处理
数据处理和作图采用Excel 2016,显著性分析采用SPSS 20.0。
2 结果与分析
2.1 黔中黄壤溶磷细菌菌株对难溶态磷酸盐的溶解能力
菌株QZW-3、QZY-5、QZY-6对磷酸三钙、磷酸铝、磷矿粉的溶解能力见表1。由表1可知,3株菌株对难溶态磷酸盐都具有较强的溶解能力。QZW-3、QZY-5、QZY-6 对磷酸三钙的溶解能力分别为603.13、645.82、672.21 mg∕L,对磷酸铝的溶解能力分别为293.56、269.17、359.02 mg∕L,对磷矿粉的溶解能力分别为197.63、272.45、286.65 mg∕L。3 株菌株对磷酸三钙的溶解能力均大于600 mg∕L,对磷酸铝的溶解能力均大于250 mg∕L,对磷矿粉的溶解能力均大于190 mg∕L,3株菌株对各类无机难溶态磷酸盐都具有较强的溶解能力。
2.2 不同碳源对黔中黄壤溶磷细菌菌株溶磷能力的影响
菌株QZW-3、QZY-5、QZY-6 在不同碳源条件下对磷酸三钙的溶解能力见表2。由表2 可知,各菌株在不同碳源条件下其溶磷能力差异较大。QZW-3 以葡萄糖为碳源时,其溶磷能力最强,表明其对葡萄糖的利用率最高,并显著高于其他糖类;以纤维二糖、乳糖、蔗糖为碳源时,其溶磷能力分别为372.44、350.85、280.73 mg∕L,表明QZW-3 对这3种糖的利用率也较高,以淀粉、麦芽糖、木糖、鼠李糖、葡聚糖等为碳源时,其溶磷能力均在100 mg∕L以下,表明其对这些糖类的利用率较低。QZY-5 以葡萄糖为碳源时,其溶磷能力显著高于其他糖类;以乳糖为碳源溶磷能力次之;以淀粉、蔗糖、麦芽糖、甘露醇、木糖、鼠李糖、纤维二糖、葡聚糖及组合碳源为碳源时,其溶磷能力均在100 mg∕L 以下,表明其对这些糖类的利用率较低。QZY-6 同样以葡萄糖为碳源时,其溶磷能力显著高于其他糖类;以蔗糖和麦芽糖为碳源时,其溶磷能力在300 mg∕L 以上;以乳糖和纤维二糖为碳源时,其溶磷能力分别为284.87、238.67 mg∕L;以淀粉、木糖、鼠李糖、葡聚糖等为碳源时,其溶磷能力均低于100 mg∕L。
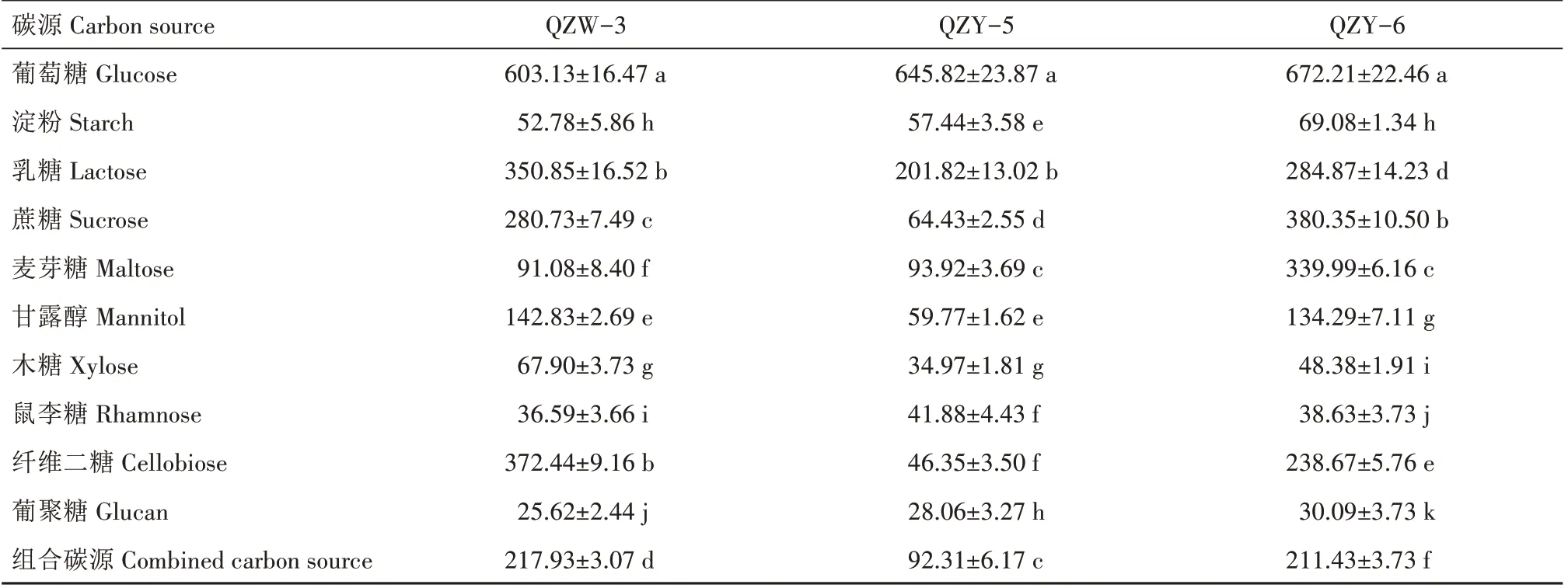
表2 QZW-3、QZY-5、QZY-6在不同碳源条件下的溶磷能力Tab.2 Phosphorus solubility of QZW-3,QZY-5,and QZY-6 under different carbon source conditionsmg∕L
QZW-3、QZY-5、QZY-6 三株菌株均以葡萄糖为碳源时溶磷能力最强,表明葡萄糖为溶磷细菌利用率最高的碳源;3株菌株以淀粉、木糖、鼠李糖、葡聚糖为碳源时溶磷能力均在100 mg∕L 以下,表明其对这些糖类的利用率均较低;3株菌株对蔗糖、麦芽糖、纤维二糖的利用率差异较大。QZW-3、QZY-5、QZY-6 在10 种碳源条件下溶磷能力分别介于25.62~603.13、28.06~645.82、30.09~672.21 mg∕L,极差分别为577.51、617.76、642.12 mg∕L。
QZW-3、QZY-5、QZY-6 在组合碳源条件下对磷酸三钙的溶解能力分别为217.93、92.31、211.43 mg∕L,QZW-3 和QZY-6 在组合碳源条件下的溶磷能力远远高于QZY-5,但2 株菌株之间的溶磷能力差异不显著;QZW-3、QZY-5、QZY-6 在组合碳源条件下对磷酸三钙的溶解能力比以葡萄糖为碳源的溶解能力分别降低了385.20、553.51、460.78 mg∕L。
2.3 不同氮源对黔中黄壤溶磷细菌菌株溶磷能力的影响
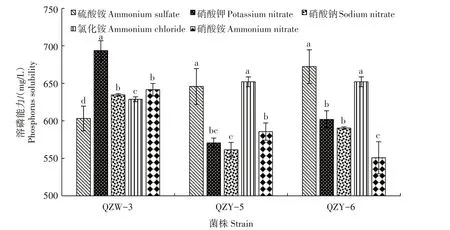
图1 QZW-3、QZY-5、QZY-6在不同氮源条件下的溶磷能力Tab.1 Phosphorus solubility of QZW-3,QZY-5,and QZY-6 under different nitrogen source conditions
2.4 不同黔中黄壤溶磷细菌菌株对油菜鲜质量及土壤养分的影响
不同处理油菜鲜质量及土壤pH 值、有效磷和有机质含量见表3。由表3 可知,QZW-3、QZY-6 处理油菜鲜质量均显著高于M 处理,分别比M 处理增加了44.06%、59.59%;QZY-5 处理油菜鲜质量与M处理差异不显著;COM 处理油菜鲜质量最高,为37.89 g∕盆,分别比CK、M、QZW-3、QZY-5、QZY-6处理显著增加了222.74%、100.16%、38.94%、90.21%、25.42%。M 处理土壤pH 值与QZW-3、QZY-5、QZY-6、COM处理相比差异不显著。QZW-3、QZY-5、QZY-6、COM 处理土壤有效磷含量均显著高于M 处理,分别比M 处理增加了11.75%、6.55%、11.93%、11.46%,但是溶磷细菌各处理之间差异不显著。QZW-3、QZY-5、QZY-6 和COM 处理土壤有机质含量均高于M 处理,分别比M 处理增加了1.31%、5.06%、1.39%、4.88%。
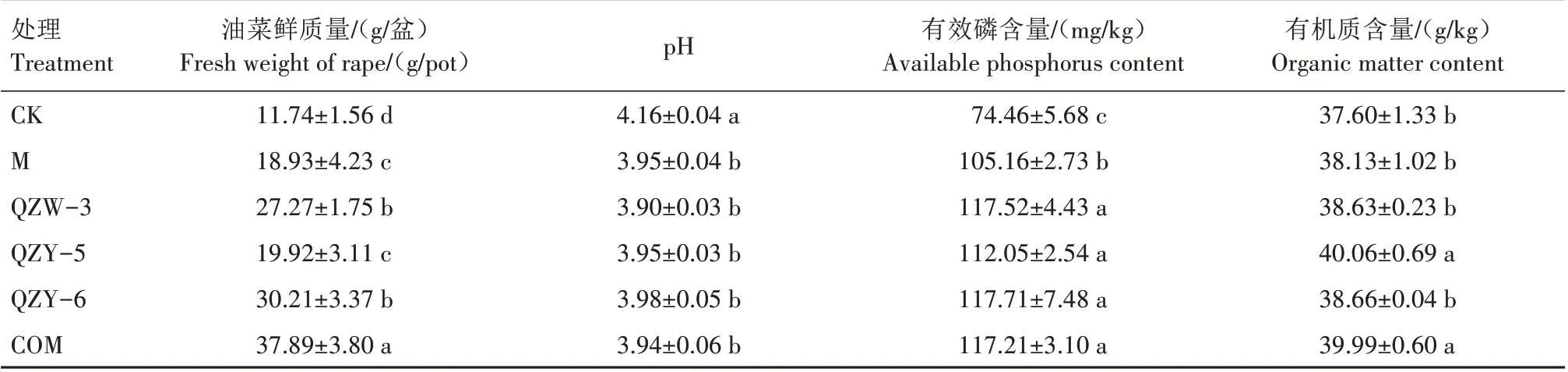
表3 QZW-3、QZY-5、QZY-6对油菜鲜质量及土壤养分含量的影响Tab.3 Effect of QZW-3,QZY-5,QZY-6 on fresh weight of rape and soil nutrient content
2.5 不同菌株处理对微生物碳循环基因相对丰度的影响
碳循环基因包括糖苷水解酶类(GHs)、碳水化合物酯酶类(CEs)、多糖裂解酶类(PLs)、糖基转移酶类(GTs)、辅助活性酶类(AAs)等五大类基因。不同菌株对微生物碳循环基因(GHs、CEs、PLs、GTs、AAs)相对丰度的影响见图2。由图2A 可知,M 处理GHs基因相对丰度显著高于CK 处理。QZW-3、QZY-5、QZY-6、COM 等处理GHs基因相对丰度均高于M 处理,但差异不显著。溶磷细菌各处理GHs基因相对丰度差异也不显著。由图2B可知,M处理和各溶磷细菌处理CEs基因相对丰度均高于CK 处理,但是M 处理与各溶磷细菌处理以及溶磷细菌各处理之间差异均不显著。由图2C 可知,与CK 处理相比,其余处理PLs基因相对丰度均呈下降趋势,M处理PLs基因相对丰度与溶磷细菌各处理相比,差异不显著。由图2D 可知,M 处理GTs相对丰度比CK 处理减少了0.81%,QZW-3、QZY-5、QZY-6、COM 等处理GTs相对丰度分别比M 处理增加了0.44%、0.13%、4.28%、2.14%,溶磷细菌可以增加土壤GTs相对丰度。由图2E 可知,各处理土壤AAs相对丰度差异不显著。
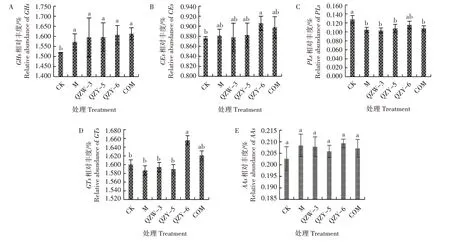
图2 不同处理土壤微生物碳循环基因相对丰度差异Fig.2 Relative abundance differences of soil microbial carbon cycling genes under different treatments
2.6 土壤养分指标与微生物碳循环基因的相关性分析
土壤养分与微生物碳循环基因相对丰度相关性见表4。由表4 可知,土壤pH 值与微生物碳循环基因AAs、CEs、GHs相对丰度呈负相关关系,其中与AAs相对丰度呈极显著负相关关系(P<0.01);与GTs、PLs相对丰度呈正相关关系,其中与PLs相对丰度呈极显著正相关关系(P<0.01)。土壤有效磷含量与GHs相对丰度呈显著正相关关系,与PLs相对丰度呈极显著负相关关系。土壤有机质含量与微生物碳循环各基因相对丰度相关性不显著。

表4 土壤养分与微生物碳循环基因相对丰度相关系数Tab.4 Correlation coefficients between soil nutrients and microbial carbon cycling genes
3 结论与讨论
3.1 不同碳源和氮源对溶磷细菌溶磷能力的影响
微生物对难溶态磷酸盐的溶解能力是评价其溶磷能力大小的重要指标[17-18]。李慧萍等[19]对祁连山云杉林土壤溶磷细菌进行研究后,筛选出5 株对磷酸三钙溶解能力在387.41~479.87 mg∕L 的菌株;朱芙蓉等[20]在滇重楼根际土壤分离出42 株无机磷细菌,溶磷能力在66.68~104.10 mg∕L;刘萍等[21]研究发现,溶磷细菌RPB03 在较高的温度、盐度和碱性条件下溶磷能力均在300 mg∕L以上;吕俊等[22]、刘春菊等[23]筛选的溶磷菌株溶磷能力在200 mg∕L 以上。本研究中,QZW-3、QZY-5、QZY-6 对磷酸三钙的溶解能力均大于600 mg∕L,分别为603.13、645.82、672.21 mg∕L,对磷酸铝的溶解能力分别为293.56、269.17、359.02 mg∕L,对磷矿粉的溶解能力分别为197.63、272.45、286.65 mg∕L,3 株菌株对各种难溶态磷酸盐都具有较强的溶解能力,可以作为黔中黄壤区农田土壤磷研究的溶磷细菌资源。
培养基碳源和氮源种类对溶磷微生物溶磷能力影响较大[24]。相关研究表明,不同碳源通过影响产生有机酸的种类和含量进而影响溶磷微生物溶磷能力[25],产生有机酸是微生物溶磷的重要机制之一[26-27]。宋小双等[28]从樟子松根际土壤中分离出溶磷细菌A43 和A54,其中A43 以葡萄糖为碳源、硫酸铵为氮源时溶磷能力最强,A54以蔗糖为碳源、硝酸钠为氮源时溶磷能力最强;吕俊等[22]的研究结果表明,溶磷菌株WJ2 对乳糖和葡萄糖的利用率较高。本研究结果也表明,不同碳源和氮源条件下,不同菌株的溶磷能力差别较大。QZW-3、QZY-5、QZY-6均以葡萄糖为碳源时,对磷酸三钙溶解能力最强;以淀粉、木糖、鼠李糖、葡聚糖为碳源溶磷能力均在100 mg∕L 以下,对这些糖类的利用率均较低;对蔗糖、麦芽糖、纤维二糖的利用率差异较大。QZW-3、QZY-5、QZY-6在10种碳源条件下溶磷能力极差分别为577.51、617.76、642.12 mg∕L,QZW-3、QZY-5、QZY-6在5种不同氮源条件下其溶磷能力极差分别为90.52、84.48、121.48 mg∕L,碳源对菌株溶磷能力的影响远远大于氮源。
溶磷细菌研究的关键在于应用,土壤中的碳源种类繁多,含量也不尽相同,因此,研究不同碳源条件对溶磷细菌溶磷能力的影响,不仅要分析单一碳源的影响,更要分析组合碳源的影响。本研究中,QZW-3、QZY-5、QZY-6 在组合碳源条件下的溶磷能力分别为217.93、92.31、211.43 mg∕L,比以葡萄糖为碳源溶磷能力分别减少了385.23、553.51、460.78 mg∕L,所以土壤复杂的环境条件对溶磷微生物能力的发挥具有很强的限制作用。QZW-3对葡萄糖、乳糖、蔗糖、纤维二糖等4种糖的利用效率较高,QZY-6对葡萄糖、蔗糖、麦芽糖、乳糖、纤维二糖等5种糖的利用效率较高,QZY-5仅对葡萄糖、乳糖等2种糖的利用率较高。在组合碳源条件下,QZW-3、QZY-6对组合碳源的溶磷能力远远高于QZY-5。
3.2 溶磷细菌对作物生长、土壤养分及微生物碳循环基因的影响
本研究中,QZW-3、QZY-5、QZY-6 及组合菌株处理土壤有效磷含量显著高于基质处理,这与BARRA 等[29]的研究结果相同,溶磷细菌在促进有效磷转化和提升土壤磷有效性方面发挥积极的作用。此外,溶磷细菌还可以分泌生长素等物质,促进作物生长和实现作物增产[13]。本研究中,QZW-3、QZY-5、QZY-6 及组合菌株处理油菜鲜质量均高于基质处理,组合菌株处理油菜鲜质量最高,显著高于其他单菌株处理。组合菌株与单菌株相比,在适应环境、克服土著微生物的影响等方面具有一定的优势,因此,在促进作物生长方面,作用也最强。
土壤微生物碳循环基因中,GHs参与土壤有机碳的分解,CEs、PLs、AAs分别参与多糖、碳水化合物酯和木质素的分解[30]。本研究中,基质处理GHs相对丰度显著高于空白处理,基质为腐熟好的有机肥,外加碳源会产生正激发效应[31],导致参与有机碳分解的基因GHs相对丰度增加,溶磷细菌各处理GHs相对丰度均高于基质处理,这可能是因为溶磷细菌需要利用土壤中的碳源作为生长的碳骨架和能源物质,维持自身生长和溶磷能力发挥,促进了土壤碳的分解,土壤有机碳分解基因GHs丰度增加。溶磷细菌各处理AAs、CEs、PLs相对丰度之间整体上差异不显著,这与土壤微生物系统的复杂性相关,外源溶磷细菌的添加对上述3类微生物碳循环基因影响较小。
