猪流行性腹泻疫苗研究进展
2023-09-04梁雨萱庞胜美王龙龙段强德
梁雨萱,庞胜美,刘 梅,王龙龙,段强德
(1.扬州大学兽医学院,江苏 扬州 225009;2.扬州大学江苏省动物重要疫病与人兽共患病防控协同创新中心∕教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;3.扬州大学江苏省动物重要疫病和重要人兽共患病防控技术国际合作联合实验室,江苏 扬州 225009)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种猪的高传染性、急性的肠道疾病。该病多发生于春冬季节,可感染各年龄段和各品种的猪,但哺乳期的仔猪最易感,故又称仔猪流行性腹泻。在仔猪中,PED 具有发病率高和死亡率高的特征,临床上主要表现为呕吐、水样腹泻和严重脱水,并且常与猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)、轮状病毒(Porcine rotavirus,PRV)和产肠毒素大肠杆菌(EnterotoxigenicEscherichia coli,ETEC)混合感染,死亡率高达100%[1-2]。因此,PED 已成为危害仔猪生产和影响养猪经济效益的重要疾病,防治PED是养猪业的重中之重。
PEDV 于1971 年首次在欧洲发现,随后传入其他大洲,并引起多次地方性和全球性流行。PEDV于20世纪80年代传入我国,特别是自2010年以来,该病毒的高致病性变异毒株在我国生猪产业中广泛暴发,并呈现发病率高、死亡率高和流行广的新态势,造成了大量仔猪死亡,给我国养猪业带来了巨大的经济损失[3]。目前,临床上主要通过对症治疗、生物安全措施和疫苗免疫等手段进行防控,其中疫苗接种是最经济和有效的手段。尽管在养猪业中已经广泛接种PEDV 灭活疫苗和弱毒疫苗,但是由于病毒的不断变异和进化,疫苗提供的免疫保护效果欠佳,该病在我国的发病率仍居高不下[4]。近年来,病毒样颗粒(Virus-like particles,VLPs)疫苗、亚单位疫苗、重组活载体疫苗、转基因植物和核酸疫苗等新型疫苗的研究得到广泛关注,但是它们临床上对PEDV 的预防效果还有待评估。因此,进一步深入阐明PEDV 的进化规律和致病机制,研究广谱、高效、长效疫苗的任务迫在眉睫。综述了PEDV的病原学特性、致病机制及PEDV疫苗的最新研究进展,旨在为临床上有效防控PED提供参考。
1 PEDV的基因组学
冠状病毒属于套式病毒目、冠状病毒科、冠状病毒亚科,该亚科根据其亲缘关系和基因组结构可分为α、β、γ 和δ 4 个属,可感染猪的冠状病毒包括TGEV、猪急性腹泻综合征冠状病毒(Novel emerging swine acute diarrhea syndrome coronavirus,SADSCoV)、猪德尔塔冠状病毒(Porcine delta coronavirus,PDCoV)和PEDV。其中,PEDV 属于α 冠状病毒属(Coronavirus)的成员,是一种有囊膜的单股正链的RNA 病毒。PEDV 病毒基因组全长约28 kb,包含7个开放性阅读框(ORF1a、OR1b、ORF2—6),共编码4种结构蛋白和16种非结构蛋白(NSP1—16)(图1A)[5-6]。其中,PEDV ORF3 区域第40—91 位氨基酸是其细胞质定位的关键结构域,为进一步研究细胞内转运和生物功能提供了参考[7]。4 种结构蛋白包含纤突(Spike,S)蛋白、包膜(Envelope,E)蛋白、膜(Membrane,M)蛋白和核(Nucleocapsid,N)蛋白(图1B)[8]。其中,E 蛋白和M 蛋白主要参与病毒的装配和出芽过程,M 蛋白也能诱导机体干扰素的产生[9-10]。N 蛋白是一种核衣壳蛋白,主要参与病毒RNA 的包裹和病毒颗粒的释放。S蛋白是一种位于病毒表面的糖蛋白,通过与宿主细胞上的特异性受体结合,介导病毒的入侵,并与病毒的组织或宿主嗜性相关。S蛋白由S1和S2两个功能性亚基组成,其中S1 亚基介导病毒与宿主细胞上特异性受体结合,S2 亚基介导病毒和细胞膜的融合(图2)。S1 亚基的第1—18 位氨基酸残基是其信号肽,第19—233 位氨基酸残基是其唾液酸结合区,第499—638位氨基酸残基区域是S 蛋白的核心中和表位区域(COE)。S2 亚基的第938—1117 位和第1 274—1 313 位分别含有2 个七肽重复区,第1 351—1 386位氨基酸残基为其胞浆区。根据S蛋白中是否包含INDEL氨基酸序列,可将PEDV分为GⅠ型和GⅡ型2 个基因型,其中GⅠ型包括GⅠ-a 和GⅠ-b 2 个亚型,GⅡ型包括GⅡ-a 和GⅡ-b 2 个亚型[11]。我国主要流行的为GⅡ变异型。鉴于S 蛋白在PEDV 致病机制中的至关重要作用,其成为各种类型PEDV 疫苗研究的主要靶标蛋白。
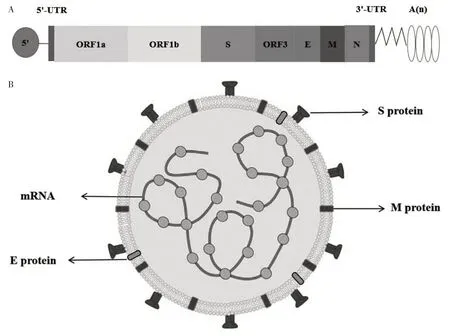
图1 PEDV基因组(A)和病毒粒子(B)结构Fig.1 The structure of PEDV genome(A)and virion(B)
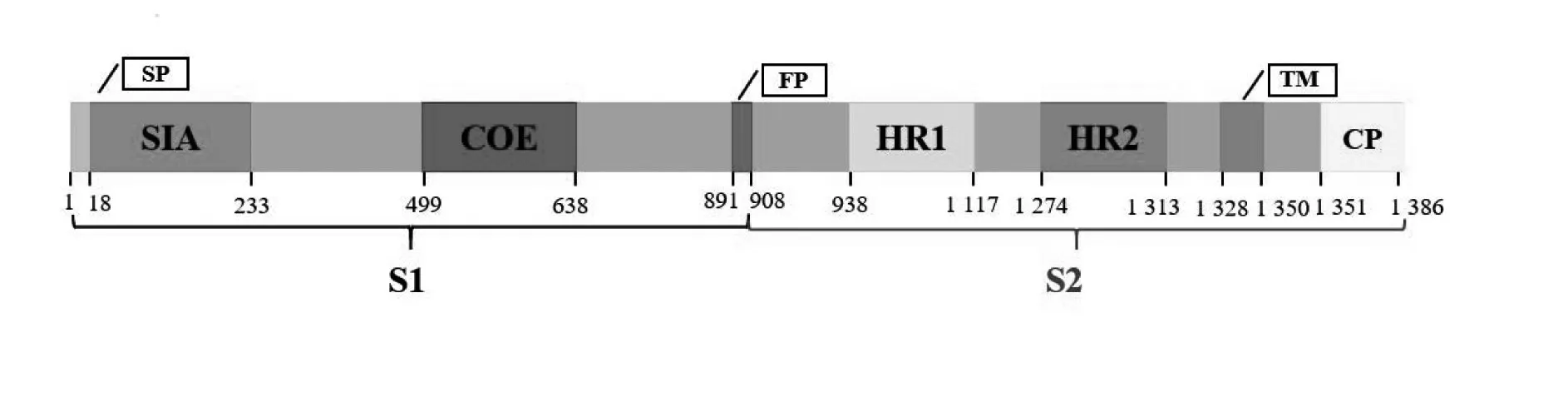
图2 PEDV的S蛋白结构Fig.2 The structure of PEDV S protein
2 PEDV的致病机制
口粪传播是PEDV 的主要传播途径,易感仔猪通过直接接触感染猪的粪便和∕或呕吐物,或者间接接触它们污染的器具、饲料等而感染[12]。有研究发现,PEDV 也可通过气溶胶进行传播,通过呼吸道途径感染,这使得PEDV 的防控更加困难[13]。PEDV 进入机体后,主要感染猪的空肠和回肠,其次为空肠近段和十二指肠。PEDV 在仔猪小肠上皮细胞中的增殖过程包括吸附、入侵、脱壳、合成、装配、释放等环节。PEDV 通过消化道进入小肠后,病毒表面的S蛋白与小肠细胞上的特异性受体结合,从而介导病毒的吸附和入侵[14]。猪氨肽酶N(Porcine aminopeptidase N,pAPN)被鉴定为PEDV 的功能性受体,但敲除pAPN 受体的猪仍对PEDV 易感,表明PEDV 可能还存在其他功能性受体[15]。在S 蛋白的S2亚基介导下,附着于小肠上皮细胞的病毒与宿主细胞膜融合侵入细胞,然后将病毒基因组释放到细胞质中,引起感染。随后,猪的小肠绒毛上皮细胞急性坏死剥落,小肠绒毛萎缩融合,患病猪出现食欲不振、呕吐、腹泻乃至于脱水等临床症状,严重的最终引起死亡[16]。
3 PEDV疫苗的研究现状
疫苗接种是当前预防PED 的最经济和有效的措施。PED 疫苗主要包括传统疫苗和新型基因工程疫苗。目前,商用PED 疫苗仍以传统疫苗为主,但是随着病毒基因组的高度变异,传统疫苗已不足以抵御PEDV感染和传播。
3.1 传统疫苗
PEDV 的传统疫苗主要包括全病毒灭活疫苗和弱毒活疫苗两类(表1)。传统疫苗由于安全性好、免疫效果良好,目前应用广泛。临床上常用的有PEDV 和TGEV 二联灭活苗或者弱毒苗,以及PEDV、TGEV和RV三联灭活苗或者弱毒苗。
3.1.1 全病毒灭活疫苗 PEDV 全病毒灭活疫苗是指将病猪的小肠组织(组织灭活苗)或者病毒的细胞培养物(细胞灭活苗)灭活后,加入佐剂增强其免疫原性而制成的疫苗。郭子仪[17]以基于河南分离的PEDV CH-HNKF-03 株制备的灭活疫苗免疫妊娠母猪,发现在母猪乳汁可产生较高的中和抗体,对4日龄仔猪的保护率可达80%。PEDV 组织灭活苗通常采用的是疫病流行地区的强毒株,免疫效果良好,但是成本相对较高,而且存在一定的生物安全风险。徐宏军等[18]研究表明,经产母猪产前30 d 免疫PEDV CV777株Vero E6细胞悬浮灭活苗,对仔猪的免疫保护效果为80%。SONG 等[19]研究也表明,妊娠母猪免疫PEDV DR13毒株细胞灭活苗,在体内可诱导强劲的免疫反应。常小云等[20]将PEDVGF10 变异株的Vero 细胞灭活苗免疫妊娠母猪并对其所产3 日龄仔猪进行攻毒,结果表明该疫苗对于仔猪的保护率可达90%,且仔猪通过母乳获得的母源抗体可持续至35 日龄左右。郭振刚[21]同样利用悬浮培养技术将分离的PEDV-GS10 毒株制备成灭活疫苗且免疫妊娠母猪,28日龄仔猪的母源抗体效价不低于1∶32,说明该疫苗对妊娠母猪的免疫是有效的,其仔猪获得的母源抗体至少可持续28 d。目前,国内商品化的PEDV 灭活苗还以联苗为主,主要包括PEDV-TGEV 二联苗和PEDV-TGEV-PoRV 三联苗。二联苗中多用的PEDV 毒株为AJ1102 株和SCSZ-1株,三联苗一般用CV777毒株[22]。灭活疫苗虽然具有安全性高、生产工艺成熟、便于运输等优点,但由于不能有效刺激机体的黏膜免疫反应,且存在免疫保护期短、免疫原性弱、需要多次接种等问题,使得灭活疫苗的免疫保护效果并不佳。
3.1.2 弱毒活疫苗 PEDV 弱毒活疫苗是指将PEDV 强毒株通过细胞连续传代或者缺失某些关键毒力基因而使其毒力和致病性降低,并基于该弱毒株制备而成的疫苗。PEDV 弱毒活疫苗无论是免疫妊娠母猪还是仔猪,都具有良好的免疫保护效果。佟有恩等[23]将PDEV CV777 强毒株在Vero 细胞和PK细胞连续传代并克隆纯化,获得了免疫原性良好而毒力致弱的PDEV CV777 弱毒株,将基于该弱毒株制备成的疫苗免疫妊娠母猪或者仔猪,免疫保护效果分别为96.20%和95.92%。PARK 等[24]将在韩国分离的PED-CUP-B2014强毒株在Vero细胞上连续传代致弱后,通过口服途径免疫妊娠母猪,仔猪攻毒试验表明,该弱毒疫苗株对仔猪PEDV 感染具有良好的免疫保护效果。HOU 等[25]将PC21A 强毒株在Vero 细胞上连续传代获得的PC177 弱毒株(S蛋白N端197 aa缺失)口服免疫仔猪,对仔猪具有较好的免疫保护效果。S基因的缺失或者插入PEDV 毒株,虽然使得致病性减弱,但是同时也会导致中和抗体表位的减少,免疫保护效果降低。SCHUMACHER 等[26]研究表明,在母猪妊娠后79 d和100 d 分别口服S-INDEL PEDV 重组毒株,对仔猪NON-S-INDEL PEDV 强毒株感染的免疫保护率为63.6%。PEDV 弱毒株也常与TGEV 弱毒株制备成二联活疫苗,或者与TGEV和PoRV弱毒株制备成三联活疫苗,免疫母猪后能预防仔猪的PEDV、TGEV 和PoRV 混合感染。此外,利用反向遗传学技术对PEDV 结构蛋白和非结构蛋白(NSP1、NSP3、NSP5、NSP7、NSP14、NSP15、NSP16、RF3、E 蛋白、M蛋白和N 蛋白)的编码基因进行改造,使其毒力和致病性减弱,也可用于开发PED 减毒活疫苗的候选毒株[27]。
PEDV 弱毒活疫苗相较于灭活疫苗,病毒在体内可以自我复制,从而实现一次免疫终身保护,免疫保护期更长,也可以避免多次注射给母猪或者仔猪造成的应激反应。此外,弱毒活疫苗还可以刺激肠道黏膜免疫反应,诱导sIgA 抗体的产生,从而发挥更好的免疫保护效果。但是弱毒疫苗的免疫保护效果与毒株的匹配度相关,基于经典毒株制备的弱毒疫苗对现流行的PEDV 新变异株的保护效果呈现逐年下降趋势。因此,如何平衡好毒株致弱和保持疫苗免疫原性是值得探究的要点。此外,弱毒疫苗存在的毒力返强以及疫苗株与野毒株重组等潜在的生物安全问题也同样不容忽视。
3.2 基因工程疫苗
PEDV 基因工程疫苗是指利用基因工程技术将编码PEDV 保护性抗原的基因片段(常为S基因)克隆至表达载体,再利用真核细胞、细菌、病毒、植物等重组表达目的抗原蛋白或重组体本身而制成的疫苗。目前,PEDV 的基因工程疫苗有亚单位疫苗、VLPs 疫苗、转基因植物疫苗、重组活载体疫苗和核酸疫苗。
3.2.1 亚单位疫苗 PEDV 亚单位疫苗是指以体外高效表达和纯化的PEDV 结构∕非结构蛋白为抗原制备而成的疫苗。鉴于S 蛋白在PEDV 致病过程中的关键作用,以及其本身良好的免疫原性和包含多个中和B 淋巴细胞抗原表位的特性,其是开发PEDV 亚单位疫苗的主要靶标。LI 等[28]研究表明,将PEDV S 蛋白的COE 结构域替换成沙门氏菌鞭毛蛋白的D3 结构域,用体外表达的重组蛋白(rSFCOE-3D)免疫4 周龄的仔猪2 次(间隔14 d),该重组蛋白在猪体内能诱导产生针对S 蛋白的特异性IgG、IgA抗体和中和抗体,减轻PEDV 感染所致的腹泻症状和肠道绒毛的病理变化。CHANG 等[29]利用重组表达的S 蛋白的三聚体为抗原,热敏肠毒素B亚单位为佐剂,肌肉注射免疫5周龄的仔猪,研究结果表明,仔猪体内诱导产生了高水平的抗S 蛋白的IgG 和中和抗体,但不足以保护仔猪免受PEDV 感染。刘家兴等[30]利用大肠杆菌制备的PEDV S1CD-铁蛋白Ferritin 纳米颗粒免疫小鼠,重组蛋白免疫小鼠后诱导产生的IgG 和IgA 抗体水平均显著高于S1CD 蛋白单独免疫组,这表明铁蛋白Ferritin为载体制备的纳米颗粒疫苗可诱导机体产生高水平的免疫应答反应,为PEDV 亚单位疫苗的研究拓展了思路。
相对于传统疫苗,PEDV 亚单位疫苗由于不携带病毒基因组,安全性更高;并且能同时诱导体液免疫反应和细胞免疫反应,有利于清除体内的病毒。但是表达的重组蛋白难以维持其自身的天然构象表位,这导致虽然基于S 蛋白或者其部分结构域的亚单位疫苗能够诱导针对S 蛋白的特异性IgG抗体,但是对PEDV 感染的保护效果未达预期。因此,将来针对PEDV 亚单位疫苗应该在保证其免疫原性的同时,通过改进蛋白质表达系统、优化免疫方式等措施来进一步提高其免疫保护效果。
3.2.2 病毒样颗粒疫苗 PEDV VLPs 疫苗是基于PEDV 的一种或多种结构蛋白(不含核酸)组装而成的具有病毒结构,但是无复制能力的病毒颗粒为抗原的疫苗。WANG等[31]利用昆虫杆状病毒表达系统在Sf9 细胞表达了PEDV VLPs(包含S、M 和E 蛋白),并证明了该PEDV VLPs 具有良好的免疫原性,可以在小鼠体内诱导高水平的特异性中和抗体,表明其将来可能作为预防PEDV 感染的候选疫苗。此外,利用杆状病毒表达系统表达的PEDV CV777 S1蛋白具有良好的免疫原性,可以诱导小鼠体内针对PEDV 的特异性抗体[32]。HSU 等[33]研究表明,以PEDV VLPs(包含S、M 和E 蛋白)为抗原,辅以CCL25 和CCL28 作为佐剂,不仅能诱导高水平的抗S 蛋白的IgG 抗体,还能诱导IgA 抗体的产生和细胞免疫反应,有效保护断奶仔猪的PEDV 感染。GUO等[34]利用噬菌体Qβ 外壳蛋白展呈冠状病毒通用中和表位,构建了嵌合型VLPs 疫苗,研究结果表明,该嵌合型VLPs 疫苗具有良好的免疫原性,在小鼠体内能诱导针对PEDV 和PDCoV 的中和抗体,为研发PEDV 以及冠状病毒通用型VLPs 疫苗提供了新的思路。
VLPs具有与天然病毒颗粒相似的结构,从而可以有效模拟病毒颗粒的自然感染过程,诱导免疫保护作用。同时,由于VLPs 不含有病毒核酸,本身不具有感染和自主复制能力,因此较弱毒活疫苗和以病毒为载体的载体疫苗具有更高的安全性。当前基于VLPs 为抗原的PEDV 疫苗研究主要是在小鼠模型中评估其免疫原性,但是小鼠并不是PEDV 的易感动物,中和抗体水平也不能完全代表体内的免疫保护效果,所以PEDV VLPs 疫苗的免疫保护效果有待在临床上的进一步验证。
3.2.3 转基因植物疫苗 利用基因工程技术在植物中表达PEDV 的免疫保护性抗原,基于此表达的保护性抗原为免疫原的疫苗即PEDV 转基因植物疫苗。目前,已经在烟草、水稻、莴苣等多种植物中成功表达PEDV 的保护性抗原[35-37]。将表达PEDV S蛋白COE 结构域的转基因烟草饲喂小鼠,可以同时刺激机体的系统免疫和黏膜免疫反应,表明该转基因烟草植物疫苗具有良好的免疫原性[38]。尹国友[39]利用番茄成功表达了PEDV 的S1 蛋白,对仔猪饲喂该转基因番茄能够刺激仔猪的主动免疫反应,从而有效保护仔猪免受PEDV 的感染。另一项研究也表明,对母猪饲喂表达PEDV S 蛋白COE 结构域的本氏猪笼草,仔猪可以通过母乳被动获得高水平的抗PEDV 的IgG 抗体和抗COE 的IgA 抗体,从而有效保护高致病性PEDV(GⅡa型)对仔猪的感染[40]。
相对于灭活疫苗,转基因植物疫苗不仅能够诱导机体的系统免疫反应,同时还能够诱导黏膜免疫反应,对肠道病原感染具有更好的免疫保护效果。此外,转基因植物疫苗可以通过注射提取转基因植物蛋白原液、口服以及添加在饲料中喂食等多种途径免疫,减少了免疫的工作量和成本,适用于大规模免疫应用。但是目的抗原蛋白在转基因中常表达量较低,口服免疫的情况下大量的抗原容易被胃液消化,导致到达肠道的有效抗原量较少,从而刺激的免疫反应较弱。此外,目前转基因疫苗的研发很多都基于模式植物,不利于直接口服给药,需要开发更多可以直接作为青饲料饲喂猪的果蔬模式植物。
3.2.4 重组活载体疫苗 PEDV 重组活载体疫苗包括重组病毒活载体疫苗和细菌活载体疫苗两类。已有基于水疱口炎病毒、痘病毒、牛病毒性腹泻病毒等病毒载体构建PEDV 重组病毒活载体疫苗研究的报道[41-43]。HAIN 等[42]利用猪痘病毒为载体表达PEDV S 蛋白构建了重组猪痘病毒活载体疫苗,将其肌肉注射免疫3 周龄仔猪,可以在仔猪体内诱导针对PEDV S 蛋白的高水平的IgG 和IgA 抗体,表明该PEDV 重组猪痘病毒活载体疫苗具有良好的免疫原性,可以同时刺激仔猪的体液和黏膜免疫反应。YUAN 等[44]同样利用猪痘病毒为载体构建了PEDV重组猪痘病毒活载体疫苗,动物试验表明,该疫苗虽然对同源PEDV 毒株感染具有良好的保护作用,但是对异源PEDV 毒株感染的交叉保护效力较弱。QIU 等[45]以高致病性猪繁殖与呼吸综合征病毒(PRRSV)2型感染性克隆rJSTZ1712-12为载体构建了PEDV-PRRSV 活载体疫苗,动物试验表明,虽然该疫苗能够诱导针对PEDV和PRRSV 2种病毒的中和抗体,但是对2种病毒的感染无免疫保护作用,感染仔猪全部死亡。
目前,已研发了以减毒沙门氏菌、枯草芽孢杆菌、乳酸杆菌为载体的PEDV 重组细菌活载体疫苗[46-50]。以减毒沙门氏菌、枯草芽孢杆菌、乳酸杆菌为载体,表达PEDV 的S 蛋白或者S 蛋白的S1 或者COE 结构域的重组细菌活载体疫苗均具有良好的免疫原性,能够同时诱导产生针对PEDV S 蛋白的IgG和IgA抗体,但是它们免疫后对仔猪的免疫保护效果还需要进一步的研究和评估。白伟琴等[51]利用乳酸杆菌活菌载体成功表达了PEDV S2蛋白的B细胞抗原表位,但是其免疫原性和免疫后对仔猪的免疫保护效果还有待进一步的验证。
PEDV 重组活载体疫苗诱导的免疫反应广泛,能够同时诱导仔猪的体液免疫、细胞免疫和黏膜免疫反应,并且只需免疫一次即可诱导持久的免疫保护效果。但作为活载体疫苗,其仍存在基因重组产生新病毒的生物安全风险。此外,基于载体的预存抗体也可能影响再次免疫的效果。未来PEDV 活载体疫苗的研制在聚焦增强其免疫原性的同时,也要注意进一步地提高其安全性和免疫保护效力。
4 小结和展望
PEDV 在我国持续流行,严重威胁我国养猪业的健康、持续发展。在当前没有特效治疗药物的情况下,疫苗仍是防治PEDV 最有效的措施。传统的灭活疫苗由于其有效抗原含量较低,以及很少诱导局部黏膜免疫反应和细胞免疫反应,疫苗的免疫效果欠佳。弱毒疫苗虽然对疫区流行的PEDV 毒株具有良好的保护效果,但是不能有效提供针对不同的毒株以及出现的新变异株的交叉保护,免疫效果较差。随着高致病性PEDV 新变异株的不断出现,传统疫苗已不堪其重,提高灭活疫苗的有效抗原含量,平衡好弱毒疫苗的有效性与安全性是增强传统疫苗免疫保护效力的突破口;另一种应对策略就是应用人参茎叶皂苷-聚乳酸-聚羟基乙酸(GSLSPLGA)纳米颗粒、层状双氢氧化物(LDH)等新型佐剂或者采用皮内注射途径等方法来提高现有疫苗的免疫原性和免疫保护效果[52-54]。随着基因工程技术的发展,全球多个实验室开展了多种新型PEDV疫苗的研发,但是受制于安全性、生产成本、免疫保护效果等因素,PEDV 基因工程疫苗从实验室走向临床应用还需要一段时间。纳米技术在疫苗制备方面的运用也为PEDV 疫苗载体设计提供了更大平台[55]。mRNA 疫苗作为新冠暴发以来备受瞩目的疫苗,为今后同样作为冠状病毒的PEDV 疫苗的研发提供了新平台和思路。
PEDV 作为一种肠道病原,仔猪的黏膜免疫反应在预防PEDV 感染中发挥至关重要的作用。因此,今后PEDV 疫苗的研究重点应在于如何刺激仔猪肠道免疫,诱导sIgA 抗体的产生。进一步深入研究PEDV 的致病机制、揭示病原与宿主相互作用机制,有利于为PEDV 疫苗和特效药物的研发提供新的靶点,以及为通用性冠状病毒疫苗的研发提供新的策略。此外,不同类型疫苗的优化组合使用,以及创新免疫接种方式均有利于提高现有疫苗的免疫效果,从而提高仔猪的存活率。
此外,木兰醇MAG、臭柏叶、芦荟提取物、双苄基异喹啉生物碱、姜黄素等药物被发现对PEDV 有较好的防治作用。因此,疫苗免疫结合高效药物的防治可能会起到比单一防治措施更好的效果[56-60]。
