溶磷细菌筛选及对复垦土壤磷素有效性的评价
2019-06-01乔志伟腾飞龙邵晓贵
乔志伟,腾飞龙,邵晓贵
(1.安顺学院资源环境与工程学院,贵州 安顺 561000;2.安顺学院农学院,贵州 安顺 561000)
井工开采是煤炭开采的最主要方式,目前我国90%以上的煤碳都是井工开采[1],这种方式必然会造成地表沉陷,山西约有一半的地下采空区发生了地面塌陷[2], 地面塌陷导致耕地被大面积的破坏,作物产量减少,对人类的居住和生产活动都有一定程度的危害,土地复垦迫在眉睫.研究表明,提高复垦土壤肥力是采煤塌陷地土地复垦成功与否的关键[3-4],其中最主要的限制因子是复垦土壤中的磷素养分[5],溶磷微生物参与土壤中难溶态磷素有效性的转化[6-9],因此在复垦土壤上研究溶磷微生物具有重要的意义.
目前关于溶磷细菌在复垦土壤上应用研究较多[10-14],其基本方法是将溶磷细菌通过合适的基质吸附后,单独或者配合无机、有机肥施入复垦土壤中,研究其对土壤磷素的影响,试验结果都表明溶磷细菌可以提高复垦土壤磷素有效性,这些研究为溶磷细菌在复垦土壤上的应用提供了定性的方法.但是土壤磷素有效性受植物根际[15]、土壤微生物[16]、环境[17]等多方面因素影响,在提高复垦土壤磷素有效性中土壤溶磷微生物的作用有多少,目前国内外相关研究都未明确指出.本试验从土壤中分离筛选溶磷细菌,采用室内培养的方法,通过在复垦土壤上接种菌株,并设置灭菌菌株的对照处理,单独研究溶磷细菌对复垦土壤有效磷、磷酸酶、各无机磷形态含量的影响,为评价溶磷细菌在提高复垦土壤有效性的作用提供理论依据.
1 材料与方法
1.1 溶磷细菌的筛选
1.1.1 土样采集 土样采自于山西农业大学农学院实验基地,采样地种植作物为玉米,蔬菜等,采样深度0~20 cm,土壤为石灰性褐土,将采集的土样除去植物根系和杂草,保存于4 ℃冰箱,24 h内用于溶磷细菌的分离和筛选.
1.1.2 培养基 (1)溶磷细菌分离培养基(改良后的PVK培养基):葡萄糖10 g,Ca2(PO4)35 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,MgSO40.1 g,FeSO4·7H2O 0.002 g,MnSO4·4H2O 0.002 g,0.4%溴酚蓝(pH6.7)10 mL,酵母浸膏0.5 g,蒸馏水1 000 mL,固体培养基20 g琼脂,pH自然;(2)溶磷细菌筛选培养基(NBRIP培养基):葡萄糖10 g,Ca2(PO4)35 g,MgCl 5 g,(NH4)2SO40.1 g,KCl 0.2 g,MgSO40.25 g,蒸馏水1 000 mL,固体培养基20 g琼脂,pH自然;(3)溶磷细菌保存和活化培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,固体培养基20 g琼脂,pH自然.
1.1.3 溶磷细菌的分离筛选 称取10 g新鲜土样放在有90 mL无菌水的250 mL三角瓶中,在摇床上振荡30 min,用10倍稀释法分别稀配至10-7的土壤悬浊液,将10-5、10-6、10-7的土壤悬浊液分别涂布在PVK培养基平板上,倒置于培养箱中,28 ℃培养3~5 d,待菌落长出后,观察在平板上是否产生溶磷圈对菌株进行初步的筛选;在平板培养基上多次划线纯化后,对在平板上仍产生透明圈层的菌株,将其保存于置于4 ℃冰箱.
1.1.4 溶磷细菌溶磷能力的测定 将培养7 d的磷细菌培养液于4 ℃,6 000 r/min的条件下离心8 min,取上清液2 mL 于250 mL三角瓶中,加入0.5 mol/L NaHCO350 mL,在180 r/min的振荡机上振荡30 min后过滤后,用钼锑抗比色法测定.
1.1.5 溶磷细菌16sRNA序列的测定 采用引物7f (5′-CAGAGTTTGATCCTGGCT-3′),1540r (5′-AGGAGGTGATCCAGCCGCA-3′) 建立扩增反应体系并测序,将获得的DNA序列输入GenBank,用Blast 程序与数据库中的所有序列进行比较分析,确定其属种.
1.2 溶磷细菌对复垦土壤有效磷及不同形态无机磷含量的影响
1.2.1 试验菌株 从1.1中筛选鉴定出的菌株中选择不同种属的溶磷细菌作为试验菌株,同一种属的选择溶磷能力强的菌株.
1.2.2 种子培养基 葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO40.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,KH2PO42.0 g,蒸馏水1 000 mL,pH自然.
1.2.3 试验土样 土样采自于山西省长治市襄垣县潞安集团采煤塌陷区复垦第4年耕层土壤,有效磷为8.37 mg/kg,有机质为10.01 g/kg,全氮0.41 g/kg,全钾20.4 g/kg,全磷0.71 g/kg,碱解氮为25.33 mg/kg,土壤pH为8.01.
1.2.4 试验设计 将土样风干且过2mm的筛后做灭菌处理备用,在250 mL三角瓶中装灭菌土壤,每瓶装土50 g.按照种子培养基的配方配制液体培养基并分装在250 mL三角瓶中,每瓶装液100 mL后灭菌;将在固体斜面保存好的试验菌株分别接种在灭菌冷却后的种子培养基中,每一菌株接种两瓶,28 ℃培养24 h后测定菌数,将每种菌株菌数稀释至108CFU/mL;每一菌株接种稀释后的两瓶中,将其中一瓶继续灭菌,做为未灭菌的对照处理.分别将各株菌株稀释后未灭菌的菌液5 mL加入到装有灭菌土壤的三角瓶中,每一菌株重复3次,并将各株菌株稀释后灭菌的菌液5 mL加入到装有灭菌土壤的三角瓶中,每一菌株重复3次,在另外3个装有灭菌土壤的三角瓶中分别装入5 mL无菌水,做为空白对照,每个三角瓶充分振荡均匀后放置在28 ℃恒温培养箱中,定期管理.
1.2.5 测定指标及方法 在培养箱培养60 d后取出三角瓶,采集土样待风干后过1 mm筛,测定土壤有效磷、pH、碱性(酸性)磷酸酶、无机磷形态等指标.土壤有效磷测定采用钼锑抗比色法测定[18];pH采用pH计直接测定[18];碱性(酸性)磷酸酶测定采用关松荫磷酸苯二钠比色法[19];无机磷分级采用蒋-顾的石灰性土壤无机磷分级的测定方法[20].
1.3 数据处理
本文数据采用方差分析和Duncan新负极差法(a=0.05)等数学统计方法,分析软件为Excel 2003、SAS V8.1.
2 结果与分析
2.1 溶磷细菌的筛选
经过初步筛选、分离和纯化,得到具有明显溶磷圈的菌株7株,并对7株溶磷细菌溶解磷酸三钙的能力进行测定,7株溶磷细菌菌落直径、溶磷圈直径及溶磷能力如表1所示.由表1可知7株磷细菌在磷酸三钙培养液中有效磷含量都高于300 mg/L,7株溶磷细菌对磷酸三钙都具有较强的溶解能力,其溶解能力大小依次为W7>W3> W5>W4>W2>W1=W6;其中W7在培养液中得有效磷含量最高,为594.9 mg/L,溶磷能力最强,为563.5 mg/L,显著高于其他菌株(P<0.05).
7株菌株的溶磷圈直径在1.20~2.55 cm,W6溶磷圈直径最小,为1.20,W4溶磷圈直径最大,为2.55;各菌株溶磷圈直径与菌落直径的比值在1.20~2.79之间;W6D/d值最小,为1.20, W7D/d值最大,为2.79;7株菌株溶磷能力与其溶磷圈大小的线性相关系数为R2为0.21,相关性不显著,而7株菌株溶磷能力与菌株D/d大小的线性相关系数为R2为0.88,呈极限著正相关(P<0.01),因此可以根据溶磷圈直径与菌落直径的比值,在一定程度上反应菌株溶磷能力的大小.
2.2 溶磷细菌的鉴定
以各菌株的总DNA为模板,利用细菌16S rRNA引物进行PCR扩增,得到扩增产物,将7株菌测序结果采用BLAST软件与Genbank中的序列比较.7株菌株鉴定结果如表2所列:
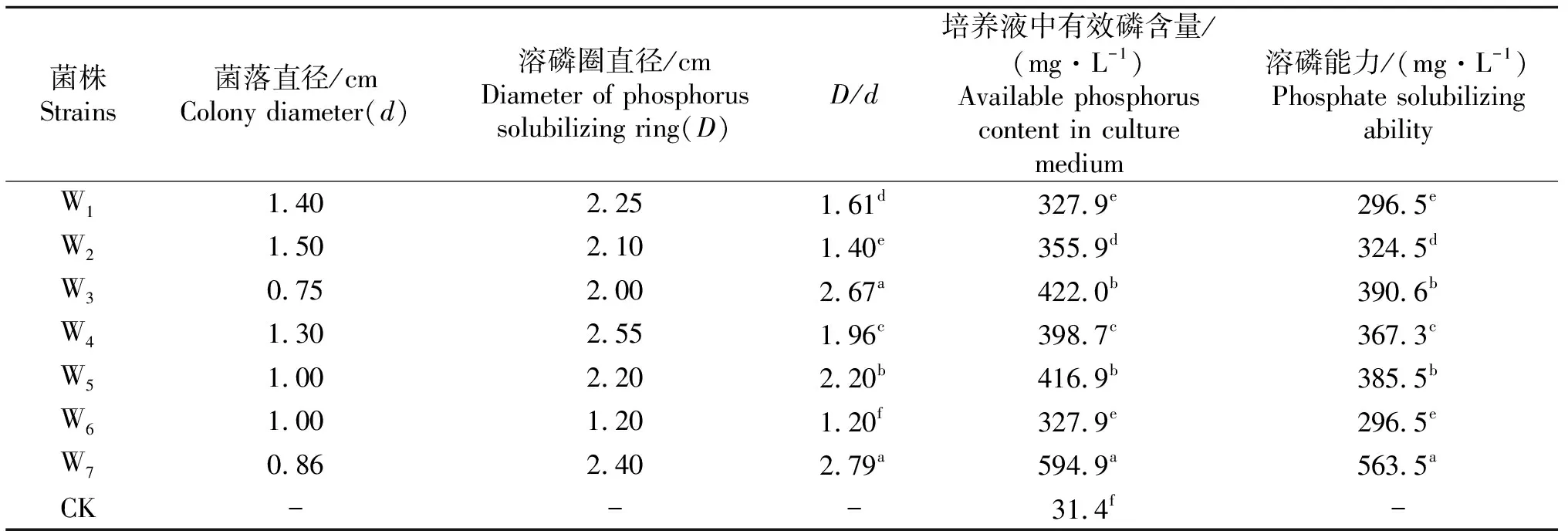
表1 7株磷细菌溶磷圈及溶磷能力
表中同列不同小写字母表示差异显著(P<0.05).
Different lowercase letters in the same table indicate significant difference (P<0.05).
2.3 溶磷细菌对复垦土壤有效磷及pH的影响
选择W1(Enterobactersp.)、W3(Rahnellasp.)、W4(Burkholderiasp.)和W7(Fluorescentpseudomonas)作为试验菌株,通过在复垦土壤上添加溶磷细菌菌液和对应菌株的灭菌菌液,研究溶磷细菌对复垦土壤有效磷、磷酸酶及各形态无机磷含量的影响.接种溶磷细菌及其灭菌菌液处理复垦土壤有效磷含量及pH见表3.由表3可知,溶磷细菌可以增加复垦土壤有效磷含量和降低土壤pH,与加灭菌菌液相比,接种W1、W3、W4、W7菌液处理复垦土壤有效磷含量分别增加了0.30~3.72 mg/kg,菌株W3对复垦土壤有效磷含量的增加量最多,为3.72 mg/kg;四株菌株对复垦土壤pH的降低值在0.03~0.09之间.

表2 解磷菌株鉴定结果
2.4 溶磷细菌对复垦土壤磷酸酶含量的影响
接种溶磷细菌及其灭菌菌液处理复垦土壤碱性磷酸酶及酸性磷酸酶含量见表4.由表4可知,溶磷细菌可以增加复垦土壤碱性磷酸酶的含量,与接种灭菌菌液相比,接种W1、W3、W4、W7菌株菌液处理复垦土壤碱性磷酸酶含量分别显著增加13.18、15.12、34.22、9.68 mg/kg, 接种W4菌液处理复垦土壤碱性磷酸酶含量增加量最大,为34.22 mg/kg,比添加W4灭菌菌液处理显著增加了112.6%;接种W7菌液处理复垦土壤碱性磷酸酶含量增加量最小,为9.68 mg/kg,比添加W7灭菌菌液处理显著增加了20.5%.溶磷细菌同时可以增加复垦土壤酸性磷酸酶的含量,与接种灭菌菌液相比,接种W1、W3、W4、W7菌液处理复垦土壤酸性磷酸酶含量增加范围在0.21~47.66 mg/kg,菌株W7对复垦土壤酸性磷酸酶含量的增加效果最显著.
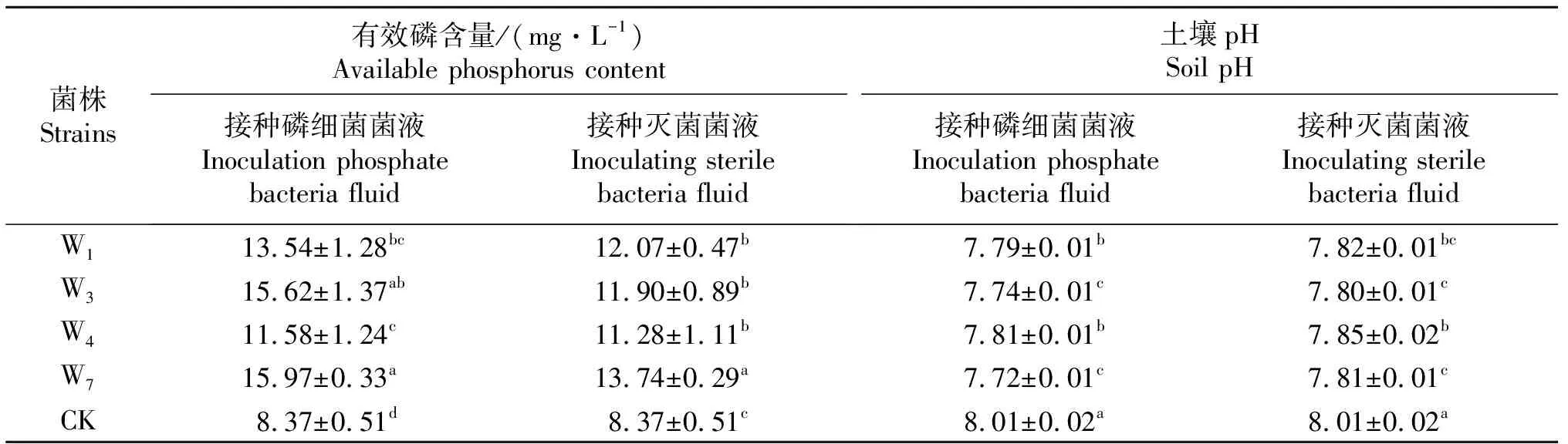
表3 不同种溶磷细菌复垦土壤有效磷含量及pH值
表中同列不同小写字母表示差异显著(P<0.05).
Different lowercase letters in the same column indicate significant difference (P<0.05).
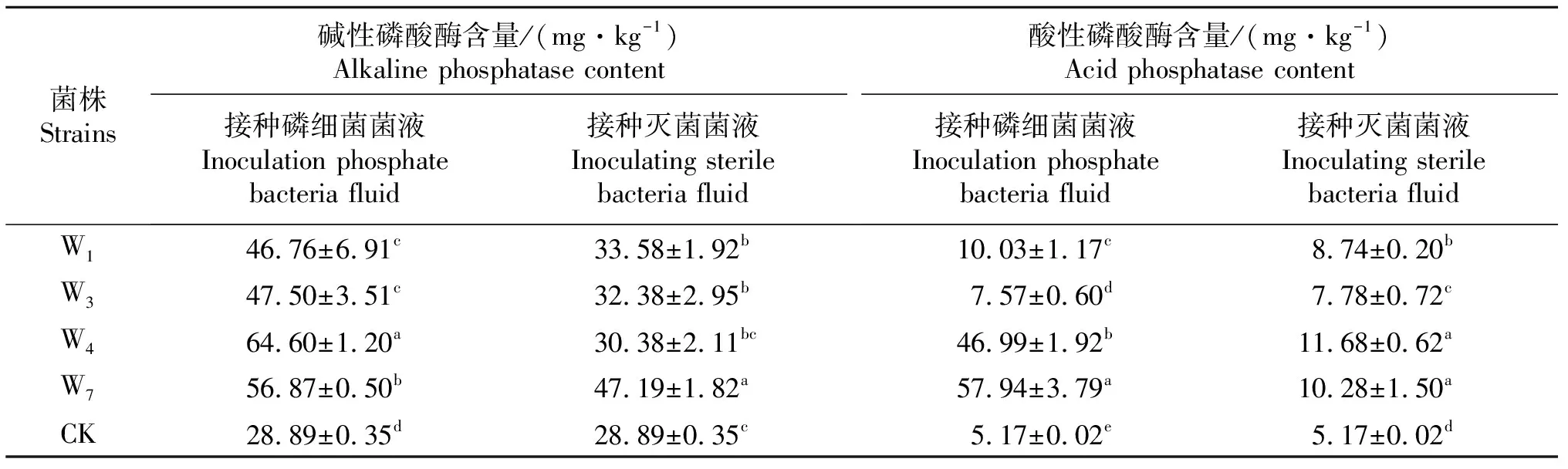
表4 不同种溶磷细菌复垦土壤碱性和酸性磷酸酶含量
表中同列不同小写字母表示差异显著(P<0.05).
Different lowercase letters in the same table indicate significant difference (P<0.05).
2.5 溶磷细菌对复垦土壤各形态无机磷含量的影响
根据蒋-顾的石灰性土壤无机磷分级测定方法,将土壤中的无机磷形态分为二钙磷(Ca2-P)、八钙磷(Ca8-P)、十钙磷(Ca10-P)、铁磷(Fe-P)、铝磷(Al-P)、闭蓄态磷(O-P)等6种形态,本试验中无机磷形态按照上述方法测定.
2.5.1 溶磷细菌对复垦土壤Ca2-P、Ca8-P、Ca10-P含量的影响 接种溶磷细菌及其灭菌菌液处理复垦土壤Ca2-P、Ca8-P、Ca10-P含量见表5.由表5可知,溶磷细菌可以增加复垦土壤Ca2-P、Ca8-P含量,显著减少Ca10-P含量.与接种灭菌菌液相比,接种W1、W3、W4、W7菌液处理复垦土壤Ca2-P、Ca8-P含量分别增加4.7%~33.8%和11.1%~26.0%,Ca10-P含量减少12.9%~14.9%.4株菌株中W1和W7对复垦土壤Ca2-P的增加效果显著,W1、W4、W7对复垦土壤Ca8-P的增加效果显著,W1、W3、W4、W7可以显著减少复垦土壤Ca10-P的含量,溶磷细菌对各形态钙磷影响较大,尤其是可以显著减少土壤中Ca10-P的含量.

表5 不同种溶磷细菌复垦土壤Ca2-P、Ca8-P、Ca10-P含量
表中同列不同小写字母表示差异显著(P<0.05).
Different lowercase letters in the same column indicate significant difference (P<0.05).
空白处理土壤Ca10-P含量为456.28 mg/kg,接种W1、W3、W4、W7灭菌菌液处理复垦土壤Ca10-P含量分别比空白增加97.46、103.38、99.45、95.73 mg/kg,接种W1、W3、W4、W7菌液处理复垦土壤Ca10-P含量分别比空白增加24.71、28.25、16.42、14.92 mg/kg,因此溶磷细菌可以抑制复垦土壤中有效磷向Ca10-P的转化.
2.5.2 溶磷细菌对复垦土壤Fe-P、Al-P、O-P含量的影响 接种溶磷细菌及其灭菌菌液处理复垦土壤Fe-P、Al-P、O-P含量见表6.由表6可知,溶磷细菌可以增加复垦土壤Fe-P、Al-P含量,对O-P影响不显著.与接种灭菌菌液相比,接种W1、W3、W4、W7菌液处理复垦土壤Fe-P、Al-P含量分别增加5.3%~24.1%和4.8%~30.0%.四株菌株中W3、W4、W7对复垦土壤Fe-P和Al-P增加效果显著,溶磷细菌对Fe-P和Al-P的影响也较大.
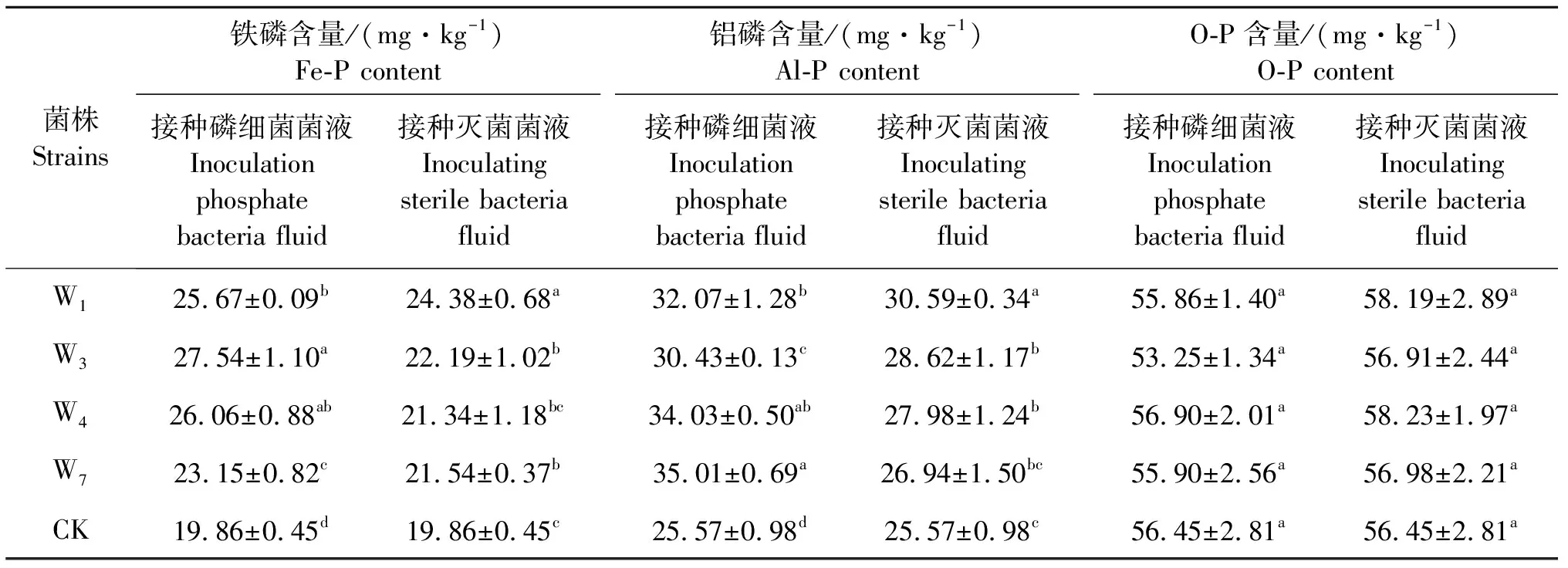
表6 不同种溶磷细菌复垦土壤Fe-P、Al-P、O-P含量
表中同列不同小写字母表示差异显著(P<0.05).
Different lowercase letters in the same table indicate significant difference (P<0.05).
3 讨论
溶磷微生物最明显的标志是可以在PVK固体培养基平板上产生溶磷圈,这也是目前筛选溶磷微生物最常用的方法之一,但是在试验筛选过程中,由于在平板上长出的菌落较多且相互之间的竞争关系,大多数菌株的溶磷能力受到抑制,并不是所有的菌株都会出现溶磷圈在平板上,且溶磷圈大小与溶磷能力之间是否存在相关性还有待研究,Nautial[21]、冯哲叶[22]、马骢毓等[23]研究表明,溶磷圈的大小不能代表其溶磷能力的大小,本试验中7株菌株溶磷能力与溶磷圈大小之间的关系并不显著,而与溶磷圈直径/菌落直径的比值呈显著正相关,因此溶磷圈仅是作为识别溶磷微生物的标志之一,在筛选强溶磷能力菌株时,应综合考虑其磷圈直径/菌落直径的比值和对其溶磷能力进行培养测定.
溶磷微生物可以溶解难溶态磷[24],其溶磷机理具有多样性,产生低分子量有机酸是主要的溶磷途径[25],本试验中接种溶磷细菌菌液与对应的灭菌菌液相比,复垦土壤有效磷含量增加,pH减小,这与孟会生[10]、李娜[26]等在复垦土壤上施用溶磷细菌后土壤磷素指标的变化一致;溶磷细菌还可以分泌磷酸酶促进土壤磷素转化[25],本试验中,接种磷细菌菌液的处理复垦土壤磷酸酶含量都增加,但是试验结果表明接种4株菌株土壤磷酸酶含量的增加量与复垦土壤有效磷的变化无显著关系,W4菌株碱性磷酸酶比灭菌菌液处理增加了112.6%,增加量显著高于其他菌株,接种W4有效磷含量仅增加了0.3 mg/kg,出现这一结果的原因可能是磷酸酶主要作用于土壤有机磷,土壤有机磷的转化是一个长期的过程并需要大量的微生物参与,本试验时间周期为60 d且土壤是经过灭菌的复垦土壤,复垦土壤养分含量极低,灭菌的土壤中土著微生物基本上被杀灭,微生物参与这一过程的作用也大大减弱,不同溶磷细菌在土壤中的生长繁殖情况各不相同以及不同菌株在土壤磷素活化方面的作用机理不同,这些方面都会影响菌株对土壤磷素的作用.溶磷微生物由于其特定的溶磷特性,必须会对土壤磷素形态产生影响,范丙全等[27]研究表明,施用溶磷草酸青霉菌的土壤Ca2-32P、Ca8-32P比例增加,Ca10-32P比例降低;Gong等[28]研究表明,溶磷微生物可以促进难溶态Ca10-P和缓效态Ca8-P向有效态磷的转化,土壤中有效态磷Ca2-P和Al-P含量增加;刘玲利等[11]在复垦土壤上研究溶磷细菌对磷素形态的影响,结果表明溶磷细菌处理增加了易溶态磷含量,难溶态磷含量减少;本试验中溶磷细菌可以增加Ca2-P、Ca8-P、Fe-P、Al-P含量,并且可以显著抑制土壤中有效磷向Ca10-P的转化,溶磷细菌可以对各形态无机磷含量产生影响.本试验中各处理间6种形态的无机磷含量在总量上没有呈现出一致性的规律,主要原因是不同菌株在生长过程中对土壤磷素的需求不相同,生长活动旺盛的菌株从土壤中吸收的磷就多,以此来维持自身生长的需要,有部分无机磷转换成微生物磷.
本次试验排除了植物根际、土壤微生物、环境因素等对土壤磷素有效性的影响,单独研究了溶磷细菌对提高复垦土壤磷素有效性中作用,试验结果证明溶磷细菌在复垦土壤上对磷素有效性有重要的作用.因此在复垦土壤上施用溶磷细菌,应构造适合其生长的土壤、作物、微生物等环境条件,使其在提高化学磷肥利用率、减少土壤磷素累积和流失方面发挥更重要的作用.
4 结论
1) 7株菌株的溶磷能力在296.5~563.5 mg/L之间,菌株的溶磷能力与溶磷圈直径(D)/菌落直径(d)的比值呈显著正相关;通过16sRNA序列分析鉴定,W1、W6属于Enterobactersp.,W2、W4属于Burkholderiasp.,W3、W5属于Rahnellasp.,W7属于Fluorescentpseudomonas.
2) 溶磷细菌可以提高复垦土壤有效磷含量、降低pH、增加磷酸酶含量,与接种灭菌菌液处理相比,4株溶磷细菌对复垦土壤有效磷增加在0.30~3.72 mg/kg之间,降低pH 0.03~0.09之间,土壤碱性和酸性磷酸酶提高幅度在9.68~34.22 mg/kg和0.21~47.66 mg/kg.
3) 溶磷细菌可以增加复垦土壤Ca2-P、Ca8-P、Fe-P、Al-P的含量,显著减少复垦土壤Ca10-P,对O-P影响不显著.与接种灭菌菌液处理相比,接种W1、W3、W4、W7菌液复垦土壤Ca2-P、Ca8-P、Fe-P、Al-P的增加范围分别在4.7%~33.8%、11.1%~26.0%、5.3%~24.1%、4.8%~30.0%,Ca10-P的减少幅度在12.9%~14.9%.
